요오드 헵타플루오리드
Iodine heptafluoride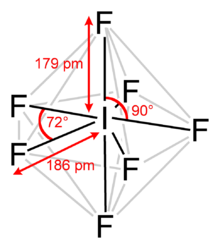 | |||
| | |||
| 이름 | |||
|---|---|---|---|
| 기타 이름 요오드(VII) 플루오르화 헵타플루오로오딘 | |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 켐스파이더 | |||
| ECHA InfoCard | 100.037.241 | ||
펍켐 CID | |||
| 유니 | |||
CompTox 대시보드 (EPA) | |||
| |||
| |||
| 특성. | |||
| IF7 | |||
| 어금질량 | 259.90 g/190 g/190 | ||
| 외관 | 무색 기체 | ||
| 밀도 | 2.6 g/cm3(6°C) 2.7 g/cm3(25°C) | ||
| 녹는점 | 4.5°C(40.1°F, 277.6K) (트리플 포인트) | ||
| 비등점 | 4.8 °C(40.6 °F; 277.9 K)(1 atm에서 서브라임) | ||
| 용해성성의 | |||
| 관련 화합물 | |||
관련 화합물 | 오타플루오린화 요오드 | ||
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |||
| Infobox 참조 자료 | |||
요오드 헵타플루오리드는 요오드(VII) 플루오르화 또는 요오드 플루오르화물로도 알려져 있으며 화학적 공식 IF를7 가진 할로겐 간 화합물이다.[2][3] VSEPR 이론에 의해 예측된 것과 같이, 특이한 오각형 두피라미드 구조를 가지고 있다.[4] 이 분자는 Bartell 메커니즘이라고 불리는 유사 재배열을 겪을 수 있는데, 이것은 Berry 메커니즘과 같지만 헵타코오더링 시스템을 위한 것이다.[5] 무색 결정체를 형성하며, 4.5°C에서 녹는다: 액체 범위는 극히 좁고 비등점은 4.77°C이다. 그 짙은 증기는 곰팡이가 피며 매캐한 냄새가 난다. 그5h 분자는 D 대칭을 가지고 있다.
준비
만일7 90°C에서 F를2 액체 IF로5 통과시켜 준비되면 증기를 270°C까지 가열한다. 대신, 이 화합물은 불소와 건조 팔라듐 또는 요오드화칼륨으로 조제하여 가수 분해에 의해 발생하는 불순물인 IOF의5 형성을 최소화할 수 있다.[6][7] 요오드 헵타플루오르화산은 다음과 같은 요오드 펜타플루오르화 용액에 불소화칼륨을 사용하여 헥사플루오르화산칼륨(V)[8]과 같은 다른 백금(V) 화합물을 준비하는 데 사용될 때 부산물로도 생산된다.
- OPtF26 + 2 KF + IF5 → 2 KPtF6 + 22 O + IF7
안전 고려 사항
IF는7 피부와 점막 모두에 매우 자극적이다. 또한 강한 산화제로 유기물질과의 접촉 시 화재를 일으킬 수 있다.
참조
- ^ 프라디오트 파트나이크. 무기 화학 약품 안내서. 맥그로힐, 2002년 ISBN0-07-049439-8
- ^ 맥킨타이어, J. E. (Ed.) (1992년). 무기 화합물 사전 (Vol. 3) 런던: 채프먼 & 홀.
- ^ 오닐, 메리델 J. (에드). (2001). 머크 지수 (13번째 에디션) 화이트하우스 역, 뉴저지 주: 머크.
- ^ K. O. Christe; E. C. Curtis; D. A. Dixon (1993). "On the problem of heptacoordination: vibrational spectra, structure, and fluxionality of iodine heptafluoride". Journal of the American Chemical Society. 115 (4): 1520–1526. doi:10.1021/ja00057a044.
- ^ W. J. Adams; H. Bradford Thompson; L. S. Bartell (1970). "Structure, Pseudorotation, and Vibrational Mode Coupling in IF7: An Electron Diffraction Study" (PDF). Journal of Chemical Physics. 53 (10): 4040–4046. Bibcode:1970JChPh..53.4040A. doi:10.1063/1.1673876. hdl:2027.42/71219.
- ^ Schumb, W. C.; Lynch, M. A. (1950). "Iodine Heptafluoride". Industrial & Engineering Chemistry. 42 (7): 1383–1386. doi:10.1021/ie50487a035.
- ^ Ruff, O.; Keim, R. (1930). ""Das Jod-7-fluorid" (The iodine-7-fluoride)". Zeitschrift für Anorganische und Allgemeine Chemie (in German). 193 (1/2): 176–186. doi:10.1002/zaac.19301930117.
- ^ Beveridge, A. D.; Clark, H. C. (1967). "Pentahalides of the Transition Metals". In Gutmann, Viktor (ed.). Halogen Chemistry. Vol. 3. Academic Press. pp. 179–226. ISBN 9780323148474.