샤르코트-마리-치아병
Charcot–Marie–| 샤르코트-마리-치아병 | |
|---|---|
| 기타이름 | 샤르코트-마리-치아 신경병증, 비골근위축, Dejerine-Sottas 증후군 |
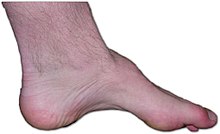 | |
| 샤르코와 함께 있는 사람의 발 – 마리 –치아 질환: 근육의 부족, 높은 아치, 발톱의 부족은 이 유전병의 징후입니다. | |
| 발음 | |
| 전문 | 신경과, 족부과, 정형외과, 물리의학과, 재활의학과 |
| 증상 | 다리 아래쪽과 팔/손 아래쪽의 발 아래쪽, 망치, 주변 근육 소모 |
| 보통발병 | 아동기 – 성인기 초기 |
| 지속 | 평생 |
| 원인들 | 가족력(유전학) |
| 위험요소 | 가족력(유전학), 높은 아치형 발, 평평한 아치형 발 |
| 진단방법 | 유전자 검사, 신경전도 검사 또는 근전도(EMG) |
| 감별진단 | 근위축증 |
| 치료 | 기능유지관리 |
| 예후 | 진보적인 |
| 빈도수. | 유병률: 2,500명[1][2] 중 1명 |
샤르코트-마리-치아 질환(CMT)은 말초신경계의 유전성 운동 및 감각 신경병증으로, 신체의 여러 부분에 걸쳐 근육 조직의 점진적인 손실과 촉각을 특징으로 합니다. 이 질환은 가장 흔하게 유전되는 신경 질환으로 약 2,500명 중 1명꼴로 발병합니다.[3][4] 그것은 고전적으로 그것을 묘사한 사람들의 이름을 따서 지어졌습니다: 프랑스인 장 마르탱 샤르코 (1825–1893), 그의 제자 피에르 마리 (1853–1940),[5] 그리고 영국인 하워드 헨리 투스 (1856–1925).[6]
알려진 치료법이 없습니다. 케어는 기능 유지에 중점을 둡니다. CMT는 이전에 근위축증의 아형으로 분류되었습니다.[3]
징후 및 증상
CMT의 증상은 보통 유아기나 성인 초기에 시작되지만 나중에 시작될 수 있습니다. 어떤 사람들은 30대 초반이나 40대까지 증상을 겪지 않습니다. 일반적으로 초기 증상은 질병의 진행 초기에 발이 떨어지거나 높은 아치형입니다. 이것은 발가락이 항상 말려있는 해머토를 동반할 수 있습니다. 다리 아래 부분의 근육 조직이 낭비되면 "황새 다리" 또는 "뒤집힌 샴페인 병"이 나타날 수 있습니다. 질병이 진행됨에 따라 손과 팔뚝의 쇠약은 많은 사람들에게 발생합니다.[7]
발, 발목, 다리는 물론 손, 손목, 팔 등 다양한 형태의 질환으로 촉각이 떨어집니다. 초기 및 후기 발병 형태는 질병이 활성화될 때 무력화될 수 있는 고통스러운 경련성 근육 수축과 함께 발생합니다. 높은 아치형 발(pescavus) 또는 평평한 아치형 발(pesplanus)은 고전적으로 장애와 관련이 있습니다.[8] 손과 발의 감각신경과 고유수용신경은 손상되는 경우가 많은 반면, 수막되지 않은 통증신경은 그대로 방치됩니다. 환부의 손이나 팔다리를 과도하게 사용하면 저림, 경련, 고통스러운 경련을 포함한 증상이 활성화될 수 있습니다.[7]
질병의 증상과 진행은 다양할 수 있습니다. 무의식적으로 이를 갈고, 눈을 가늘게 뜨게 하는 것은 널리 퍼져 있으며, 종종 영향을 받는 사람에 의해 눈에 띄지 않습니다. 호흡은 청각, 시각, 목과 어깨 근육과 같이 일부 영향을 받을 수 있습니다. 척추측만증은 흔히 발생하며, 촉지와 키의 손실을 유발합니다. 힙 소켓이 잘못 형성될 수 있습니다. 위장 문제는 CMT의 일부가 될 수 있으며,[9][10] 씹고 삼키거나 말하기가 어려울 수 있습니다.[11] 근육이 소모되면서 떨림이 생길 수 있습니다. 임신은 심각한 정서적 스트레스뿐만 아니라 CMT를 악화시키는 것으로 알려져 있습니다. CMT 환자는 2차 부상에서 회복될 때와 같이 장기간 움직이지 않으면 CMT의 증상이 급격히 가속화될 수 있으므로 장기적인 움직이지 않는 기간을 피해야 합니다.[12]
자세 변화, 골격 변형, 근육 피로, 경련으로 인한 통증은 CMT를 가진 사람들에게 상당히 흔합니다. 신체 치료, 수술, 교정 또는 보조 장치에 의해 완화되거나 치료될 수 있습니다. 다른 치료법이 통증 완화를 제공하지 않는 경우 진통제도 필요할 수 있습니다.[13] 신경병증성 통증은 종종 CMT의 증상이지만 CMT의 다른 증상과 마찬가지로 그 존재와 심각성은 경우에 따라 다릅니다. 어떤 사람들에게는 통증이 상당하거나 심할 수 있고 일상 생활 활동을 방해할 수 있습니다. 그러나 CMT를 가진 모든 사람이 통증을 경험하는 것은 아닙니다. CMT의 증상으로 신경병증성 통증이 나타나는 경우는 다른 말초신경병증, 대상포진 후 신경통, 복합부위통증증후군과 유사합니다.[14]
원인들
샤르코트-마리-치아 질환은 신경 단백질에 결함을 일으키는 유전자 돌연변이로 인해 발생합니다. 신경 신호는 미엘린 칼집을 감싼 축삭에 의해 수행됩니다. CMT의 대부분의 돌연변이는 수초피에 영향을 미치지만 일부는 축삭에 영향을 미칩니다.[15]
분류
CMT는 이질적인 질병이며 이와 관련된 돌연변이는 여러 다른 유전자에서 발생할 수 있습니다.[16] CMT는 영향을 받는 유전자에 따라 여러 종류와 아형으로 분류됩니다.[17]
17번 염색체
CMT의 가장 흔한 원인(70-80%)은 17번 염색체의 짧은 팔에 유전자 PMP22를 포함하는 넓은 영역이 중복되는 것입니다.[18]
염색체1
일부 돌연변이는 미토콘드리아 단백질을 암호화하는 1번 염색체의 유전자 MFN2에 영향을 미칩니다. 돌연변이 MFN2는 미토콘드리아가 큰 클러스터, 즉 응혈을 형성하게 하는데, 이들은 축삭을 타고 시냅스 쪽으로 이동할 수 없습니다. 이것은 시냅스가 작동하는 것을 방지합니다.[19]
X-연결된 CMT 및 Schwann 세포
CMT는 또한 X-linked 돌연변이에 의해 생성될 수 있으며, X-linked CMT(CMTX)로 명명됩니다. CMTX에서 돌연변이된 커넥션은 분자 교환 및 신호 전달을 방해하는 비기능적 갭 접합부를 생성합니다.[20][21][22]
돌연변이는 슈반 세포에서 발현되는 갭 접합 단백질인 코넥신 32 단백질을 코딩하는 GJB1 유전자에 나타날 수 있습니다. 이 단백질은 과립선세포에도 존재하기 때문에 중추신경계에서 탈수초화가 나타날 수 있습니다.[23]
슈반 세포는 축삭 주위에 원형질막을 둘러싸서 미엘린 외피를 만듭니다.[20]
신경세포, 슈반 세포, 섬유아세포가 함께 작용하여 기능성 신경을 만듭니다. 슈반 세포와 뉴런은 생존과 분화를 조절하는 갭 접합에 의해 분자 신호를 교환합니다.[citation needed]
슈반 세포가 탈수초화되면 축삭 구조와 기능에 이상이 생깁니다. 축삭의 퇴화를 유발하거나 단순히 축삭의 오작동을 유발할 수 있습니다.[3]
미엘린 외피는 신경 세포가 신호를 더 빠르게 전달할 수 있게 해줍니다. 수초가 손상되면 신경 신호가 느려지는데, 이는 일반적인 신경학적 검사인 근전도 검사로 측정할 수 있습니다. 그러나 축삭이 손상되면 복합 근육 작용 잠재력이 감소합니다.[24]
GARS1 관련 축삭신경병증
CMT2형은 일반적으로 축삭성 신경병증으로 불리는데, 이는 축삭성 변성이 관찰되기 때문입니다. CMT2 유형은 수초의 손상보다는 신경 축삭의 손상으로 인한 결과입니다(CMT1의 경우와 마찬가지). 손상된 축삭은 근육과 뇌에 신호 전달이 느려져 근육 위축, 약화, 민감도 저하, 발 기형 등의 증상을 유발합니다. CMT2형의 증상은 일반적으로 5세에서 25세 사이에 나타납니다.[25] CMT2D는 31명의 샤르코 마리 중 한 명입니다.치아 2형은 1형을 형성하며 운동결손과 함께 감각결손(감각축의 저하로 인한 감각상실 등)이 관찰되는 경우에만 진단되며, 그렇지 않은 경우에는 원위부 유전성 운동신경병증 5형이 진단됩니다. GARS1 신경병증 환자들 사이에 감각 관여가 왜 그렇게 다양한지는 알려지지 않았습니다.[26] CMT2D의 증상은 발 기형, 근육 약화 및 경련, 반사 저하, 감각 상실 및 근육 위축을 포함하며 다른 CMT1 및 CMT2 유형의 증상과 유사합니다. 증상과 중증도는 환자마다 다릅니다.[27]
마우스는 종종 CMT2D를 모델링하는 데 사용되며 일반적으로 신경근육 접합부(NMJ)에서 비정상적인 신경근육 기능을 보여줍니다.[28][29][30] CMT2D 마우스에서 신경근 접합부는 비정상적이며, 피험자는 뒷근육에서 신경근 접합부 퇴화를 보입니다. 등뿌리신경절(DRG)은 또한 감각신경세포 운명이 비정상적으로 결정된다는 것을 의미하는 비정상적인 감각신경절을 통해 영향을 받습니다. CMT2D 마우스는 고유수용성 및 기계감응성 뉴런이 적지만 더 많은 통각성 뉴런을 가지고 있는데, 이는 돌연변이 GlyRS가 트로포미오신 수용체 키나제(Trk) 수용체의 세포외 영역과 비정상적으로 상호작용하기 때문일 수 있습니다.[31] Trk 수용체는 감각신경세포의 생존과 발달에 매우 중요합니다. 신경 발달과 생존이 방해되면 CMT2D 마우스에서 관찰되는 비정상적인 감각신경세포 수를 초래할 수 있습니다.[26]
CMT2D는 7p14.3에 위치한 인간 GARS1 유전자의 상염색체 우성 돌연변이의 결과이며, 비정상적인 기능 획득 미스센스 돌연변이에 의해 발생하는 것으로 생각됩니다.[26] GARS1 유전자는 글리실-tRNA 합성효소(GlyRS)의 암호화를 담당하는 단백질 코딩 유전자입니다. 글리실-tRNA 합성효소는 II급 아미노아실-tRNA 합성효소로 단백질 번역을 위해 아미노산을 상응하는 동족 tRNA와 공유 결합함으로써 글리실-tRNA 합성의 촉매 역할을 합니다. 글리실-tRNA 합성효소는 단백질 번역에 필수적이며, 글리신을 동족 tRNA에 붙입니다.[33]
CMT2D 환자에서 많은 다른 돌연변이가 발견되었으며 GARS1의 돌연변이가 CMT2D를 어떻게 유발하는지는 여전히 불분명합니다. 그러나 돌연변이 글리실-tRNA 합성효소(GlyRS)는 막횡단 수용체를 방해하여 운동질환을[34][35] 유발하고 유전자의 돌연변이는 GlyRS가 동족 RNA와 상호작용하는 능력을 방해하여 단백질 생산을 방해할 수 있다고 생각됩니다. CMT2D에 존재하는 GARS1 돌연변이는 세포 내 부족한 양의 글리실-tRNA를 유발하여 단백질 합성의 신장 단계를 막습니다. 신장은 단백질 생산의 핵심 단계이기 때문에 리보솜은 글리신 부위에서 단백질 합성을 계속할 수 없습니다. GARS1 돌연변이는 또한 번역 개시를 지연시킵니다. 글리신 첨가 실패는 단백질 생산을 더욱 중단시키는 스트레스 반응을 일으켜 번역 개시를 막습니다. 신장 및 번역 개시를 지연시킴으로써 GARS1 유전자의 CMT2D 돌연변이는 번역 억제를 유발하여 전체 번역이 억제됨을 의미합니다.[36]
GARS1 관련 축삭신경병증은 진행성으로 시간이 지남에 따라 악화됩니다. 알려지지 않은 메커니즘이 비정상적인 GlyRS로 인한 만성 신경퇴행을 유발하는 것으로 생각되지만 질병에 대한 한 가지 이론은 VEGF-결핍입니다. 돌연변이 GlysRS는 신경필린 1(Nrp1) 및 혈관내피성장인자(VEGF)를 포함한 신경막횡단 수용체를 방해하여 신경병증을 유발합니다.[35] GARS-CMT2D 돌연변이는 GlyRS를 변화시키고 Nrp1 수용체에 결합하도록 하여 Nrp1과 VEGF의 정상적인 결합을 방해합니다. VEGF의 향상된 발현은 운동 기능을 향상시키는 반면, Nrp1의 감소된 발현은 CMT2D를 악화시킵니다; Nrp1은 돌연변이 GARS1-CMT2D 개체에서 돌연변이 GlyRS에 결합하기 때문에 Nrp1 발현은 감소되어 운동 기능을 악화시킵니다. VEGF가 결핍된 쥐는 시간이 지남에 따라 운동 신경 질환을 보여줍니다. 따라서 VEGF/Nrp1 경로는 CMT2D 치료에 표적이 될 수 있는 것으로 간주됩니다.[25]
진단.
CMT는 신경 자극의 속도 측정(신경 전도 연구), 신경 조직 검사, DNA 검사 등 세 가지 다른 형태의 검사를 통해 진단할 수 있습니다. DNA 검사를 통해 확실한 진단을 내릴 수 있지만 CMT에 대한 유전자 표지가 모두 알려진 것은 아닙니다. CMT는 누군가가 발이 떨어지거나 망치와 높은 아치를 포함한 발 기형과 같은 하퇴부 약화가 발생할 때 가장 먼저 발견되지만 징후만으로 진단으로 이어지지는 않습니다. 환자는 신경과나 재활의학과 전문의에게 의뢰해야 합니다. 근육 약화의 징후를 보기 위해, 신경과 의사는 환자들에게 발뒤꿈치로 걷거나 반대하는 힘에 맞서 다리의 일부를 움직이도록 요청할 수 있습니다. 감각 손실을 확인하기 위해 신경과 의사는 CMT에서 감소되거나 없는 무릎 저크와 같은 깊은 힘의 반사를 검사합니다. CMT는 유전되기 때문에 의사는 환자의 가족력을 물어볼 수도 있습니다. 가족력이 없다는 것이 CMT를 배제하는 것은 아니지만, 당뇨병이나 특정 화학물질이나 약물에 노출되는 것과 같은 다른 신경병증의 원인을 배제하는 데 도움이 됩니다.[37]
2010년 CMT는 영향을 받은 개인의 전체 유전체 염기서열을 분석해 특정 환자의 질병의 유전적 원인을 정확히 규명한 최초의 질병 중 하나였습니다. 이것은 샤르코 마리 치아 협회(CMTA)에 의해 고용된 과학자들에 의해 수행되었습니다.[38][17] CMT를 일으키는 것으로 알려진 유전자 SH3TC2에서 두 개의 돌연변이가 확인되었습니다. 그리고 나서 연구자들은 영향을 받은 환자의 유전체를 그 질병이 있거나 없는 환자의 어머니, 아버지, 그리고 일곱 형제자매의 유전체와 비교했습니다. 어머니와 아버지는 각각 이 유전자의 정상적인 사본과 돌연변이 사본을 하나씩 가지고 있었고, 증상이 경미하거나 전혀 없었습니다. 두 개의 돌연변이 유전자를 물려받은 자손들은 그 병을 완전히 보여주었습니다.[17]
역사학

CMT에서 발생하는 탈수초화와 재수초화의 일정한 주기는 일부 신경 주위에 "양파 구근"이라고 하는 수초층의 형성으로 이어질 수 있습니다. 이것들은 만성 염증성 탈수초성 다발성 신경병증에서도 볼 수 있습니다.[39] 근육은 섬유형 그룹화를 보여주는데, 이와 유사하게 비특이적인 소견으로 탈신경/신경의 주기를 나타냅니다. 일반적으로 I형과 II형 근섬유는 바둑판 모양의 무작위 분포를 보입니다. 그러나 재신경이 발생하면 하나의 신경과 연관된 섬유군은 같은 종류입니다. 섬유의 종류를 나타내는 기준은 histoenzymatic adenosine triphatase (pH 9.4에서의 ATPase)입니다.[40]
관리
종종 CMT 환자의 가장 중요한 목표는 움직임, 근력 및 유연성을 유지하는 것입니다. 따라서 작업 요법(OT), 물리 요법(PT), 정형외과 의사, 소아과 의사 또는 정형외과 의사와 함께하는 전문가 간 팀 접근 방식이 권장됩니다.[7] PT는 일반적으로 근력 운동, 근육 스트레칭, 유산소 운동에 중점을 두고 있으며, OT는 에너지 절약 전략과 일상 생활 활동에 대한 교육을 제공할 수 있습니다. 물리치료는 개인의 강점과 유연성에 맞는 운동 프로그램을 설계하는 데 참여해야 합니다. 브레이싱은 또한 CMT로 인한 문제를 교정하는 데 사용될 수 있습니다. 정형외과 의사는 정형외과 의사의 사용을 처방함으로써 보행 이상을 해결할 수 있습니다.[citation needed]
CMT를 가진 사람들에게도 적절한 신발은 매우 중요하지만, 높은 아치형 발과 해머토 때문에 잘 맞는 신발을 찾는데 어려움을 겪는 경우가 많습니다. CMT 환자는 발에 감각 수신이 잘 되지 않기 때문에 발 패드에 발생하는 손톱을 다듬거나 굳은살을 제거하는 데 도움을 받기 위해 소아과 의사를 만나야 할 수도 있습니다. 마지막으로, 환자는 소아과 의사나 정형외과 의사의 수술을 결정할 수도 있습니다. 수술은 환자의 발을 안정시키거나 진행성 문제를 교정하는 데 도움이 될 수 있습니다. 이러한 시술에는 발가락을 곧게 펴서 고정하고, 아치를 내리고, 때로는 발목 관절을 융합하여 안정성을 제공하는 것이 포함됩니다.[12] CMT 환자는 골절이 기저 질환이 있는 사람의 경우 치유되는 데 더 오랜 시간이 걸리기 때문에 넘어지지 않도록 각별히 주의해야 합니다. 또한, 결과적으로 활동하지 않을 경우 CMT가 악화될 수 있습니다.[12] 샤르코-마리-치아 협회는 화학 요법 약물 빈크리스틴을 "확실히 높은 위험"으로 분류하고 "빈크리스틴은 위험성이 입증되었으며 증상이 없는 환자를 포함한 모든 CMT 환자가 피해야 합니다."[41]라고 말합니다. 영향을 받는 사람들의 신체 상태를 개선하기 위해 몇 가지 교정 수술 절차를 수행할 수 있습니다.[42]
오르토틱스

하지의 근육이 약하다면 맞춤 제작된 정형외과를 처방하는 것이 타당합니다. 어떤 근육군이 영향을 받는지에 따라 올바른 근육 또는 적절한 기능적 요소를 가진 근육군을 처방해야 합니다. 발을 들어 올리는 경골(Musculus tibialis) 전방의 약점은 일반적으로 경골(Musculus gastrocnemius)의 위축을 동반하며, 경골(Musculus soleus)과 함께 경골(Musculus triceps surae, 종아리 원위부 근육)을 형성하여 알려진 "황새 다리 기형"을 유발합니다.[43] 대부분의 경우 발을 들어 올리는 기능적 요소와 앞발을 내리는 것을 조절할 수 있는 조절이 가능한 발목-발 오쏘스는 말이 됩니다. 종아리 근육이 약하면 앞발 레버가 충분히 활성화되지 않습니다. 이로 인해 서서 걸을 때 불확실성이 추가적으로 증가합니다. 따라서 종아리 근육이 약하다면, 앞발 레버를 활성화하기 위한 기능적 요소를 갖춘 것이 필요합니다. 이를 위해 정강이 앞에 있는 아래쪽 다리 껍질과 결합된 강력한 스프링과 함께 조절 가능한 동적 배굴곡 스톱이 있는 정형 관절을 권장합니다. 이러한 오르토는 발 낙하, 발과 발목의 불안정성을 제어하고 환자가 이동성과 발목 관절의 역동성을 제한하지 않고 서서 걸을 때 더 나은 균형 감각을 제공하는 데 도움이 됩니다. 연구들은 이러한 근육군의 마비가 있는 환자들에게 기능적 요소가 조절 가능한 정형외과의 긍정적인 효과를 확인합니다.[44][45][46][47] 등굴곡과 족저굴곡의 두 이동 방향에서 두 기능 요소의 저항을 서로 분리하여 설정할 수 있다면 큰 이점이 있습니다.[48]
예후
같은 종류의 CMT라도 증상의 중증도는 매우 다양합니다. 질병의 중증도가 다른 단형 접합성 쌍둥이의 사례가 보고되었으며, 이는 동일한 유전자형이 다른 중증도와 관련이 있음을 보여줍니다(침투 참조). 일부 환자는 정상적인 삶을 살 수 있으며 거의 또는 완전히 무증상입니다.[49] 2007년 보고서는 "대부분의 경우 기대 수명은 변경되지 않는 것으로 알려져 있습니다."[50]라고 밝혔습니다.
역사
이 병은 고전적으로 이 병을 기술한 사람들의 이름을 따서 지어졌습니다: 프랑스인 장 마르탱 샤르코 (1825–1893), 그의 제자 피에르 마리 (1853–1940),[5] 그리고 영국인 하워드 헨리 투스 (1856–1925).[6]
참고 항목
참고문헌
- ^ Cornett KM, Menezes MP, Bray P, Halaki M, Shy RR, Yum SW, et al. (June 2016). "Phenotypic Variability of Childhood Charcot-Marie-Tooth Disease". JAMA Neurology. 73 (6): 645–651. doi:10.1001/jamaneurol.2016.0171. PMC 4916861. PMID 27043305.
- ^ Skre H (2008-04-23). "Genetic and clinical aspects of Charcot-Marie-Tooth's disease". Clinical Genetics. 6 (2): 98–118. doi:10.1111/j.1399-0004.1974.tb00638.x. PMID 4430158. S2CID 45225191.
- ^ a b c Krajewski KM, Lewis RA, Fuerst DR, Turansky C, Hinderer SR, Garbern J, et al. (July 2000). "Neurological dysfunction and axonal degeneration in Charcot-Marie-Tooth disease type 1A". Brain. 123 (7): 1516–1527. doi:10.1093/brain/123.7.1516. PMID 10869062.
- ^ "Physical Medicine and Rehabilitation for Charcot–Marie–Tooth Disease: Background, Pathophysiology, Epidemiology". Emedicine.medscape.com. Retrieved 2016-11-13.
- ^ a b Charcot JM (1886). "Sur une forme particulière d'atrophie musculaire progressive, souvent familiale débutant par les pieds et les jambes et atteignant plus tard les mains" [On a particular form of progressive muscular atrophy, often familial, beginning with the feet and legs and later reaching the hands]. Revue Médicale (in French). 6: 97–138.
- ^ a b Tooth HH (1886). The peroneal type of progressive muscular atrophy (MD thesis). London.
- ^ a b c "Charcot-Marie-Tooth Disease Fact Sheet". National Institute of Neurological Disorders and Stroke. Retrieved 2022-04-23.
- ^ Le T, Bhushan V (6 January 2014). First Aid for the USMLE Step 1 2014. McGraw-Hill Education. ISBN 978-0-07-183142-0. Retrieved 4 September 2014.
Typically autosomal dominant inheritance pattern associated with scoliosis and foot deformities (high or flat arches).
- ^ "CMT News". Lindacrabtree.com. Archived from the original on 2016-08-05. Retrieved 2016-11-13.
- ^ Soykan I, McCallum RW (January 1997). "Gastrointestinal involvement in neurologic disorders: Stiff-man and Charcot-Marie-Tooth syndromes". The American Journal of the Medical Sciences. 313 (1): 70–73. doi:10.1097/00000441-199701000-00012. PMID 9001170.
- ^ "Charcot-Marie-Tooth Disease Fact Sheet". National Institute of Neurological Disorders and Stroke. 2016-01-14. Archived from the original on 2016-11-19. Retrieved 2016-11-13.
- ^ a b c "Treatment and Management of CMT" (Press release). Charcot-Marie-Tooth Association. October 6, 2010. Retrieved August 26, 2011.
- ^ "Charcot-Marie-Tooth Syndrome. CMT information". Patient. 20 August 2021.
- ^ Carter GT, Jensen MP, Galer BS, Kraft GH, Crabtree LD, Beardsley RM, et al. (December 1998). "Neuropathic pain in Charcot-Marie-Tooth disease". Archives of Physical Medicine and Rehabilitation. 79 (12): 1560–1564. doi:10.1016/S0003-9993(98)90421-X. PMID 9862301.
- ^ Niemann, Axel; Berger, Philipp; Suter, Ueli (March 2006). "Pathomechanisms of mutant proteins in Charcot-Marie-Tooth disease". NeuroMolecular Medicine. 8 (1–2): 217–241. doi:10.1385/NMM:8:1-2:217. ISSN 1535-1084. PMID 16775378. S2CID 17130051.[영구적 데드링크]
- ^ Hoyle JC, Isfort MC, Roggenbuck J, Arnold WD (2015). "The genetics of Charcot-Marie-Tooth disease: current trends and future implications for diagnosis and management". The Application of Clinical Genetics. 8: 235–243. doi:10.2147/TACG.S69969. PMC 4621202. PMID 26527893.
- ^ a b c Lupski JR, Reid JG, Gonzaga-Jauregui C, Rio Deiros D, Chen DC, Nazareth L, et al. (April 2010). "Whole-genome sequencing in a patient with Charcot-Marie-Tooth neuropathy". The New England Journal of Medicine. 362 (13): 1181–1191. doi:10.1056/NEJMoa0908094. PMC 4036802. PMID 20220177.
- ^ Florescu C, Albu CV, Dumitrescu C, Târtea GC, Florescu OA, Târtea EA (2017). "Sleep and Memory Disorders in a Patient Suffering from Charcot-Marie-Tooth Disease". Current Health Sciences Journal. 43 (1): 73–77. doi:10.12865/CHSJ.43.01.11. PMC 6286719. PMID 30595858.
- ^ Baloh RH, Schmidt RE, Pestronk A, Milbrandt J (January 2007). "Altered axonal mitochondrial transport in the pathogenesis of Charcot-Marie-Tooth disease from mitofusin 2 mutations". The Journal of Neuroscience. 27 (2): 422–430. doi:10.1523/JNEUROSCI.4798-06.2007. PMC 6672077. PMID 17215403.
- ^ a b Berger P, Young P, Suter U (March 2002). "Molecular cell biology of Charcot-Marie-Tooth disease". Neurogenetics. 4 (1): 1–15. doi:10.1007/s10048-002-0130-z. PMID 12030326. S2CID 25129077.
- ^ Kleopa KA (December 2011). "The role of gap junctions in Charcot-Marie-Tooth disease". The Journal of Neuroscience. 31 (49): 17753–17760. doi:10.1523/JNEUROSCI.4824-11.2011. PMC 6634164. PMID 22159091.
- ^ Szigeti K, Lupski JR (June 2009). "Charcot-Marie-Tooth disease". European Journal of Human Genetics. 17 (6): 703–710. doi:10.1038/ejhg.2009.31. PMC 2947101. PMID 19277060.
- ^ Koutsis G, Breza M, Velonakis G, Tzartos J, Kasselimis D, Kartanou C, et al. (February 2019). "X linked Charcot-Marie-Tooth disease and multiple sclerosis: emerging evidence for an association". Journal of Neurology, Neurosurgery, and Psychiatry. 90 (2): 187–194. doi:10.1136/jnnp-2018-319014. PMID 30196252. S2CID 52175657.
- ^ Yiu EM, Burns J, Ryan MM, Ouvrier RA (September 2008). "Neurophysiologic abnormalities in children with Charcot-Marie-Tooth disease type 1A". Journal of the Peripheral Nervous System. 13 (3): 236–241. doi:10.1111/j.1529-8027.2008.00182.x. PMID 18844790. S2CID 205694771.
- ^ a b "CMT2 - Types of Charcot-Marie-Tooth Disease (CMT) - Diseases". Muscular Dystrophy Association. 2015-12-23. Retrieved 2022-05-10.
- ^ a b c Sleigh JN, Mech AM, Aktar T, Zhang Y, Schiavo G (2020). "Altered Sensory Neuron Development in CMT2D Mice Is Site-Specific and Linked to Increased GlyRS Levels". Frontiers in Cellular Neuroscience. 14: 232. doi:10.3389/fncel.2020.00232. PMC 7431706. PMID 32848623.
- ^ "Charcot-Marie-Tooth disease type 2D (Concept Id: C1832274)". MedGen - NCBI. Retrieved 2022-05-10.
- ^ Sleigh JN, Grice SJ, Burgess RW, Talbot K, Cader MZ (2014). "Neuromuscular junction maturation defects precede impaired lower motor neuron connectivity in Charcot-Marie-Tooth type 2D mice". Hum Mol Genet. 15 (10): 2639–50. doi:10.1093/hmg/ddt659. PMC 3990164. PMID 24368416.
- ^ Spaulding EL, Sleigh JN, Morelli KH, Pinter MJ, Burgess RW, Seburn KL (2016). "Synaptic Deficits at Neuromuscular Junctions in Two Mouse Models of Charcot-Marie-Tooth Type 2d". J Neurosci. 16 (11): 3254–67. doi:10.1523/JNEUROSCI.1762-15.2016. PMC 4792937. PMID 26985035.
- ^ Sleigh JN, Mech AM, Schiavo G (2020). "Developmental demands contribute to early neuromuscular degeneration in CMT2D mice". Cell Death Dis. 11 (7): 564. doi:10.1038/s41419-020-02798-y. PMC 7378196. PMID 32703932.
- ^ Sleigh JN, Dawes JM, West SJ, Wei N, Spaulding EL, Gómez-Martín A, Zhang Q, Burgess RW, Cader MZ, Talbot K, Yang XL, Bennett DL, Schiavo G (2017). "Trk receptor signaling and sensory neuron fate are perturbed in human neuropathy caused by Gars mutations". Proc Natl Acad Sci U S A. 114 (16): E3324–E3333. Bibcode:2017PNAS..114E3324S. doi:10.1073/pnas.1614557114. PMC 5402433. PMID 28351971.
- ^ "OMIM Entry - # 601472 - Charcot–Marie–Tooth disease, axonal, type 2D; CMT2D". Online Mendelian Inheritance in Man. Retrieved 2022-05-10.
- ^ "OMIM Entry- * 600287 - Glycl-tRNA Synthetase 1; GARS1". Online Mendelian Inheritance in Man. Retrieved 2022-05-10.
- ^ Wei N, Zhang Q, Yang XL (2019). "Neurodegenerative Charcot-Marie-Tooth disease as a case study to decipher novel functions of aminoacyl-tRNA synthetases". J Biol Chem. 294 (14): 5321–5339. doi:10.1074/jbc.REV118.002955. PMC 6462521. PMID 30643024.
- ^ a b He W, Bai G, Zhou H, Wei N, White NM, Lauer J, et al. (October 2015). "CMT2D neuropathy is linked to the neomorphic binding activity of glycyl-tRNA synthetase". Nature. 526 (7575): 710–714. Bibcode:2015Natur.526..710H. doi:10.1038/nature15510. PMC 4754353. PMID 26503042.
- ^ Mendonsa S, von Kuegelgen N, Bujanic L, Chekulaeva M (September 2021). "Charcot-Marie-Tooth mutation in glycyl-tRNA synthetase stalls ribosomes in a pre-accommodation state and activates integrated stress response". Nucleic Acids Research. 49 (17): 10007–10017. doi:10.1093/nar/gkab730. PMC 8464049. PMID 34403468.
- ^ "Diagnosing CMT". Charcot–Marie–Tooth Association. Retrieved 2020-05-30.
- ^ Wade N (2010-03-10). "Disease Cause Is Pinpointed With Genome". New York Times. Archived from the original on 2022-01-01.
- ^ Midroni G, Bilbao JM, Cohen SM (1995). Biopsy diagnosis of peripheral neuropathy. Boston: Butterworth-Heinemann. pp. 75–103. ISBN 978-0-7506-9552-7.
- ^ Dubowitz V, Sewry CA, Oldfors A, Lane R (2013). Muscle biopsy : a practical approach (Fourth ed.). Philadelphia: Saunders/Elsevier. ISBN 978-0-7020-4340-6.
- ^ "Medical Alert". Charcot-Marie-Tooth Association. Archived from the original on 2007-07-02. Retrieved 2007-08-21.
- ^ 앤 앤 앤, 레빈, DB, 버크 S, 밴살 M. Charcot–Marie의 신경병증성 척추 위축증-치아 질환. J 뼈 관절 수술 1997; 79-A:1235–39.
- ^ Aguirre-Rodríguez FJ, Lucenilla MI, Alvarez-Cubero MJ, Mata C, Entrala-Bernal C, Fernandez-Rosado F (October 2015). "Novel FA2H mutation in a girl with familial spastic paraplegia". Journal of the Neurological Sciences. 357 (1–2): 332–334. doi:10.1016/j.jns.2015.08.1183. PMID 26344562.
- ^ Kobayashi T, Leung AK, Akazawa Y, Hutchins SW (March 2013). "The effect of varying the plantarflexion resistance of an ankle-foot orthosis on knee joint kinematics in patients with stroke". Gait & Posture. 37 (3): 457–459. doi:10.1016/j.gaitpost.2012.07.028. PMID 22921491.
- ^ Meyns P, Kerkum YL, Brehm MA, Becher JG, Buizer AI, Harlaar J (May 2020). "Ankle foot orthoses in cerebral palsy: Effects of ankle stiffness on trunk kinematics, gait stability and energy cost of walking". European Journal of Paediatric Neurology. 26: 68–74. doi:10.1016/j.ejpn.2020.02.009. PMID 32147412. S2CID 212641072.
- ^ Meyns P, Kerkum Y, Buizer A, Becher J, Brehm M, Harlaar J (2016-09-01). "The effect of ankle foot orthosis stiffness on trunk movement and walking energy cost in cerebral palsy". Gait & Posture (in German). 49. p. 2. doi:10.1016/j.gaitpost.2016.07.070. ISSN 0966-6362.
- ^ Kerkum YL, Buizer AI, van den Noort JC, Becher JG, Harlaar J, Brehm MA (2015-11-23). "The Effects of Varying Ankle Foot Orthosis Stiffness on Gait in Children with Spastic Cerebral Palsy Who Walk with Excessive Knee Flexion". PLOS ONE (in German). 10 (11): e0142878. Bibcode:2015PLoSO..1042878K. doi:10.1371/journal.pone.0142878. PMC 4658111. PMID 26600039.
- ^ Ploeger HE, Waterval NF, Nollet F, Bus SA, Brehm MA (2019). "Stiffness modification of two ankle-foot orthosis types to optimize gait in individuals with non-spastic calf muscle weakness - a proof-of-concept study". Journal of Foot and Ankle Research (in German). 12: 41. doi:10.1186/s13047-019-0348-8. PMC 6686412. PMID 31406508.
- ^ Pareyson D, Marchesi C (July 2009). "Diagnosis, natural history, and management of Charcot-Marie-Tooth disease". The Lancet. Neurology. 8 (7): 654–667. doi:10.1016/S1474-4422(09)70110-3. PMID 19539237. S2CID 665324.
- ^ Aboussouan LS, Lewis RA, Shy ME (2007-02-09). "Disorders of pulmonary function, sleep, and the upper airway in Charcot-Marie-Tooth disease". Lung. 185 (1): 1–7. doi:10.1007/s00408-006-0053-9. PMID 17294338. S2CID 12889721.
외부 링크
 Wikimedia Commons의 Charcot-Marie-Tooth 질병 관련 미디어
Wikimedia Commons의 Charcot-Marie-Tooth 질병 관련 미디어- 샤르코트-마리-컬리의 치아병





