SDHA
SDHA| SDHA | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||
| 식별자 | |||||||||||||||||||||||||
| 별칭 | SDHA, CMD1GG, FP, PGL5, SDH1, SDH2, SDHF, 부단위 A, MC2DN1, NDAXOA, 숙성 탈수소효소 복합 플라보프로테이트 | ||||||||||||||||||||||||
| 외부 ID | OMIM: 600857 MGI: 1914195 호몰로진: 3073 GeneCard: SDHA | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| 직교체 | |||||||||||||||||||||||||
| 종 | 인간 | 마우스 | |||||||||||||||||||||||
| 엔트레스 | |||||||||||||||||||||||||
| 앙상블 | |||||||||||||||||||||||||
| 유니프로트 | |||||||||||||||||||||||||
| RefSeq(mRNA) | |||||||||||||||||||||||||
| RefSeq(단백질) | |||||||||||||||||||||||||
| 위치(UCSC) | Chr 5: 0.22 – 0.26Mb | Chr 13: 74.32 – 74.35Mb | |||||||||||||||||||||||
| PubMed 검색 | [3] | [4] | |||||||||||||||||||||||
| 위키다타 | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
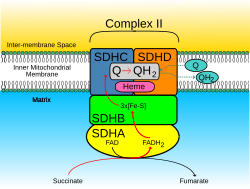
숙진성 탈수소효소 복합체, 서브유닛 A, 플라보프로테인 변종은 인간에서 SDHA 유전자에 의해 인코딩되는 단백질이다.[5] 이 유전자는 미토콘드리아 호흡 체인의 복합체인 숙신-유비키논 산화유효소의 주요 촉매 서브단위를 인코딩한다. 이 단지는 4개의 핵 인코딩 서브유닛으로 이루어져 있으며 미토콘드리아 내막에 국산화되어 있다. SDHA는 숙취가 감압되어 후마레이트로 변환되는 FAD 결합 사이트를 포함한다. 이 유전자의 돌연변이는 레이 신드롬으로 알려진 미토콘드리아 호흡기 연쇄 결핍의 한 형태와 연관되어 왔다. 3Q29 염색체에서 유사 유전자가 확인되었다. 대안으로 다른 ISO 양식을 인코딩하는 분할된 대본 변형이 이 유전자에 대해 발견되었다.[6]
구조
SDHA 유전자는 locus 15의 5번 염색체의 p 암에 위치하며 16 exon으로 구성되어 있다.[6] 이 유전자가 인코딩한 SDHA 단백질은 길이 664개의 아미노산이고 무게는 72.7kDA이다.[7][8]
SDHA 단백질은 캡팅 도메인, 헬리컬 도메인, C-터미네랄 도메인을 포함한 4개의 하위 도메인을 가지고 있으며, 특히 N-terminus의 β-barrel FAD 바인딩 도메인을 포함한다. 따라서 SDHA는 보형물군 플라빈 아데닌 디뉴클레오티드(FAD)로 인해 플라보프로틴(Fp)이다. 결정 구조는 FAD가 히스티딘 잔여물(His99)에 공칭적으로 결합되고 FAD 바인딩 도메인 내의 다른 아미노산 잔류물의 수와 수소 결합에 의해 더욱 조정된다는 것을 시사한다. 리보플라빈(비타민B2)에서 파생된 FAD는 SDHA와 전체 복합 II 기능에 필수적인 공동 인자다.[9]
함수
SDH 콤플렉스는 미토콘드리아의 내막에 위치하며 구연산 사이클과 호흡 체인에 모두 참여한다. 숙성 탈수소효소(SDH) 단백질 복합체는 숙산염(수치 + 유비쿼시논 => 후마레이트 + 유비쿼리놀)의 산화를 촉진한다. SDHA에 대한 항복 전달에서 제거된 전자는 미토콘드리아 막에 고정된 복합체의 소수성 단부에 있는 SDHC/SDHD 하위 유니트로 철황 클러스터를 통해 SDHB를 가로질러 전달된다.
처음에 SDHA는 FAD 결합 사이트에서 감응을 통해 숙성되어 FADH를2 형성하고 활성 사이트에 느슨하게 바인딩된 후, 단백질을 자유롭게 배출한다. [3Fe-4S] 철 황 클러스터에 도달할 때까지 SDHB 서브 유닛의 [Fe-S] 릴레이를 따라 굴착 터널에서 파생된 전자. 그런 다음 전자는 SDHC/SDHD 조광기의 Q 풀 활성 부지에 대기 중인 유비쿼시논 분자로 전달된다. 유비쿼시논의 O1 카보닐 산소는 SDHD의 Tyr83과의 수소 결합 상호작용에 의해 활성 부위(이미지 4)를 향한다. [3Fe-4S] 철황 성단에 전자가 존재하면 유비퀴논이 제2의 방향으로 이동하게 된다. 이를 통해 유비쿼시논의 O4 카보닐 그룹과 SDHC의 Ser27 사이의 두 번째 수소 결합 상호작용을 촉진한다. 첫 번째 단일 전자 감소 단계에 이어, 세미키논 급진 종(種)이 형성된다. 두 번째 전자는 유비퀴니온을 유비퀴니놀로 완전히 감소시키기 위해 [3Fe-4S] 군집으로부터 도착한다.[10]
SDHA는 기본 SDH 효소 작용의 중간 역할을 한다.
- SDHA는 구연산 사이클의 일부로서 후마레이트(fumarate)에 굴복한다. 이 반응은 또한 FADH를 FADH로2 전환시킨다.
- FADH의2 전자는 SDHB 서브유닛 철 클러스터[2Fe-2S][4Fe-4S][3Fe-4S]로 전송된다. 이 기능은 Respiratory 체인의 일부임
- 마지막으로 전자는 SDHC/SDHD 하위 단위를 통해 유비쿼터스노네(Q) 풀로 전달된다.
임상적 유의성
바이앨릭 돌연변이(즉, 유전자의 두 복사본이 모두 변이됨)는 일반적으로 유아기 또는 유아기에 나타나는 진행성 뇌질환인 레이 증후군에 설명되어 왔다. 환자들은 구토, 발작, 발육 지연, 근육 약화, 운동장애 등을 경험할 수 있다. 심장병, 신장병, 호흡곤란도 이 장애를 가진 사람들에게서 발생할 수 있다.[11] Leigh 증후군을 일으키는 SDHA 유전자 돌연변이는 다수의 환자에게서 관찰된 G555E 돌연변이와 같이 SDHA 단백질의 단일 아미노산을 변화시키거나 비정상적으로 단단백질을 초래한다.[12][13] 이러한 유전적 변화는 SDH 효소의 활동을 방해하여 미토콘드리아의 에너지 생산 능력을 손상시킨다. 그러나 SDHA 유전자의 돌연변이가 레이 증후군의 특정 특징과 어떤 관련이 있는지는 알려지지 않았다.
SDHA는 종양 억제 유전자로, 이질 운반체는 페로크롬세포와 신장암뿐만 아니라 파라강리오마 위험도 증가한다.[14] SDHA 돌연변이의 이항체 캐리어의 위험 관리는 메탄페린과 3-메톡시티라민 및 MRI에 대한 연간 소변 검사를 포함할 수 있다.[15]
대화형 경로 지도
각 기사에 연결하려면 아래의 유전자, 단백질, 대사물을 클릭하십시오. [§ 1]
- ^ 대화형 경로 맵은 WikiPathways에서 편집할 수 있다. "TCACycle_WP78".
참조
- ^ a b c GRCh38: 앙상블 릴리스 89: ENSG000073578 - 앙상블, 2017년 5월
- ^ a b c GRCm38: 앙상블 릴리스 89: ENSMUSG000021577 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Hirawake H, Wang H, Kuramochi T, Kojima S, Kita K (July 1994). "Human complex II (succinate-ubiquinone oxidoreductase): cDNA cloning of the flavoprotein (Fp) subunit of liver mitochondria". Journal of Biochemistry. 116 (1): 221–7. doi:10.1093/oxfordjournals.jbchem.a124497. PMID 7798181.
- ^ a b "Entrez Gene: succinate dehydrogenase complex".
- ^ Zong NC, Li H, Li H, Lam MP, Jimenez RC, Kim CS, et al. (October 2013). "Integration of cardiac proteome biology and medicine by a specialized knowledgebase". Circulation Research. 113 (9): 1043–53. doi:10.1161/CIRCRESAHA.113.301151. PMC 4076475. PMID 23965338.
- ^ "SDHA - Succinate dehydrogenase [ubiquinone] flavoprotein subunit, mitochondrial". Cardiac Organellar Protein Atlas Knowledgebase (COPaKB).
- ^ Van Vranken JG, Na U, Winge DR, Rutter J (March–April 2015). "Protein-mediated assembly of succinate dehydrogenase and its cofactors". Critical Reviews in Biochemistry and Molecular Biology. 50 (2): 168–80. doi:10.3109/10409238.2014.990556. PMC 4653115. PMID 25488574.
- ^ Horsefield R, Yankovskaya V, Sexton G, Whittingham W, Shiomi K, Omura S, et al. (March 2006). "Structural and computational analysis of the quinone-binding site of complex II (succinate-ubiquinone oxidoreductase): a mechanism of electron transfer and proton conduction during ubiquinone reduction". The Journal of Biological Chemistry. 281 (11): 7309–16. doi:10.1074/jbc.m508173200. PMID 16407191.
- ^ "Leigh syndrome". Genetics Home Reference. U.S. National Library of Medicine. Retrieved 30 July 2018.
- ^ Pagnamenta AT, Hargreaves IP, Duncan AJ, Taanman JW, Heales SJ, Land JM, et al. (November 2006). "Phenotypic variability of mitochondrial disease caused by a nuclear mutation in complex II". Molecular Genetics and Metabolism. 89 (3): 214–21. doi:10.1016/j.ymgme.2006.05.003. PMID 16798039.
- ^ Van Coster R, Seneca S, Smet J, Van Hecke R, Gerlo E, Devreese B, et al. (July 2003). "Homozygous Gly555Glu mutation in the nuclear-encoded 70 kDa flavoprotein gene causes instability of the respiratory chain complex II". American Journal of Medical Genetics. Part A. 120A (1): 13–8. doi:10.1002/ajmg.a.10202. PMID 12794685. S2CID 30987591.
- ^ Reference, Genetics Home. "SDHA". Genetics Home Reference. Retrieved 2016-08-31.
- ^ Online, eviQ Cancer Treatments. "eviQ Cancer Treatments Online > eviQ home". www.eviq.org.au. Retrieved 2016-08-31.
추가 읽기
- Aboulaich N, Vainonen JP, Strålfors P, Vener AV (October 2004). "Vectorial proteomics reveal targeting, phosphorylation and specific fragmentation of polymerase I and transcript release factor (PTRF) at the surface of caveolae in human adipocytes". The Biochemical Journal. 383 (Pt 2): 237–48. doi:10.1042/BJ20040647. PMC 1134064. PMID 15242332.
- Bonache S, Martínez J, Fernández M, Bassas L, Larriba S (June 2007). "Single nucleotide polymorphisms in succinate dehydrogenase subunits and citrate synthase genes: association results for impaired spermatogenesis". International Journal of Andrology. 30 (3): 144–52. doi:10.1111/j.1365-2605.2006.00730.x. PMID 17298551.
- Horváth R, Abicht A, Holinski-Feder E, Laner A, Gempel K, Prokisch H, et al. (January 2006). "Leigh syndrome caused by mutations in the flavoprotein (Fp) subunit of succinate dehydrogenase (SDHA)". Journal of Neurology, Neurosurgery, and Psychiatry. 77 (1): 74–6. doi:10.1136/jnnp.2005.067041. PMC 2117401. PMID 16361598.
- Kullberg M, Nilsson MA, Arnason U, Harley EH, Janke A (August 2006). "Housekeeping genes for phylogenetic analysis of eutherian relationships". Molecular Biology and Evolution. 23 (8): 1493–503. doi:10.1093/molbev/msl027. PMID 16751257.
- Tomitsuka E, Kita K, Esumi H (2009). "Regulation of succinate-ubiquinone reductase and fumarate reductase activities in human complex II by phosphorylation of its flavoprotein subunit". Proceedings of the Japan Academy. Series B, Physical and Biological Sciences. 85 (7): 258–65. Bibcode:2009PJAB...85..258T. doi:10.2183/pjab.85.258. PMC 3561849. PMID 19644226.
- Hao HX, Khalimonchuk O, Schraders M, Dephoure N, Bayley JP, Kunst H, et al. (August 2009). "SDH5, a gene required for flavination of succinate dehydrogenase, is mutated in paraganglioma". Science. 325 (5944): 1139–42. Bibcode:2009Sci...325.1139H. doi:10.1126/science.1175689. PMC 3881419. PMID 19628817.
- Kimura K, Wakamatsu A, Suzuki Y, Ota T, Nishikawa T, Yamashita R, et al. (January 2006). "Diversification of transcriptional modulation: large-scale identification and characterization of putative alternative promoters of human genes". Genome Research. 16 (1): 55–65. doi:10.1101/gr.4039406. PMC 1356129. PMID 16344560.
- González-Cabo P, Vázquez-Manrique RP, García-Gimeno MA, Sanz P, Palau F (August 2005). "Frataxin interacts functionally with mitochondrial electron transport chain proteins". Human Molecular Genetics. 14 (15): 2091–8. doi:10.1093/hmg/ddi214. PMID 15961414.
- Baysal BE, Lawrence EC, Ferrell RE (March 2007). "Sequence variation in human succinate dehydrogenase genes: evidence for long-term balancing selection on SDHA". BMC Biology. 5: 12. doi:10.1186/1741-7007-5-12. PMC 1852088. PMID 17376234.
- Eng C, Kiuru M, Fernandez MJ, Aaltonen LA (March 2003). "A role for mitochondrial enzymes in inherited neoplasia and beyond". Nature Reviews. Cancer. 3 (3): 193–202. doi:10.1038/nrc1013. PMID 12612654. S2CID 20549458.
- Brière JJ, Favier J, El Ghouzzi V, Djouadi F, Bénit P, Gimenez AP, Rustin P (October 2005). "Succinate dehydrogenase deficiency in human". Cellular and Molecular Life Sciences. 62 (19–20): 2317–24. doi:10.1007/s00018-005-5237-6. PMID 16143825. S2CID 23793565.
- Korsten A, de Coo IF, Spruijt L, de Wit LE, Smeets HJ, Sluiter W (February 2010). "Patients with Leber hereditary optic neuropathy fail to compensate impaired oxidative phosphorylation". Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1797 (2): 197–203. doi:10.1016/j.bbabio.2009.10.003. PMID 19836344.
- Hendrickson SL, Lautenberger JA, Chinn LW, Malasky M, Sezgin E, Kingsley LA, et al. (September 2010). "Genetic variants in nuclear-encoded mitochondrial genes influence AIDS progression". PLOS ONE. 5 (9): e12862. Bibcode:2010PLoSO...512862H. doi:10.1371/journal.pone.0012862. PMC 2943476. PMID 20877624.
- Van Coster R, Seneca S, Smet J, Van Hecke R, Gerlo E, Devreese B, et al. (July 2003). "Homozygous Gly555Glu mutation in the nuclear-encoded 70 kDa flavoprotein gene causes instability of the respiratory chain complex II". American Journal of Medical Genetics. Part A. 120A (1): 13–8. doi:10.1002/ajmg.a.10202. PMID 12794685. S2CID 30987591.
- Wang L, McDonnell SK, Hebbring SJ, Cunningham JM, St Sauver J, Cerhan JR, et al. (December 2008). "Polymorphisms in mitochondrial genes and prostate cancer risk". Cancer Epidemiology, Biomarkers & Prevention. 17 (12): 3558–66. doi:10.1158/1055-9965.EPI-08-0434. PMC 2750891. PMID 19064571.
- Huang G, Chen Y, Lu H, Cao X (February 2007). "Coupling mitochondrial respiratory chain to cell death: an essential role of mitochondrial complex I in the interferon-beta and retinoic acid-induced cancer cell death". Cell Death and Differentiation. 14 (2): 327–37. doi:10.1038/sj.cdd.4402004. PMID 16826196.
- Sifroni KG, Damiani CR, Stoffel C, Cardoso MR, Ferreira GK, Jeremias IC, et al. (September 2010). "Mitochondrial respiratory chain in the colonic mucosal of patients with ulcerative colitis". Molecular and Cellular Biochemistry. 342 (1–2): 111–5. doi:10.1007/s11010-010-0474-x. PMID 20440543. S2CID 34103232.
- Ma YY, Wu TF, Liu YP, Wang Q, Li XY, Ding Y, et al. (May 2014). "Two compound frame-shift mutations in succinate dehydrogenase gene of a Chinese boy with encephalopathy". Brain & Development. 36 (5): 394–8. doi:10.1016/j.braindev.2013.06.003. PMID 23849264. S2CID 24730430.