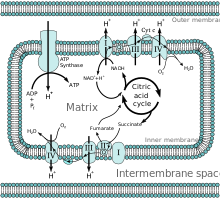
미토콘드리아 매트릭스
Mitochondrial matrix| 세포생물학 | |
|---|---|
| 미토콘드리아 | |
 |
미토콘드리아에서 매트릭스는 내막 내의 공간이다.매트릭스라는 단어는 상대적으로 수성 세포질에 비해 이 공간이 점성이라는 사실에서 유래했다.미토콘드리아 매트릭스는 미토콘드리아 DNA, 리보솜, 가용성 효소, 작은 유기 분자, 뉴클레오티드 보조 인자, 무기 [1]이온을 포함합니다.매트릭스의 효소는 구연산 회로, 산화적 인산화, 피루브산의 산화, 지방산의 [1]베타 산화와 같은 ATP 생성을 담당하는 반응을 촉진합니다.
그 구조와 내용에 근거한 매트릭스의 구성은 동화 경로와 이화 경로를 유리하게 진행할 수 있는 환경을 만든다.매트릭스 내의 전자전달사슬과 효소는 구연산 순환과 산화적 인산화에서 큰 역할을 한다.구연산 회로는 산화를 통해 NADH와 FADH2를 생성하며 산화적 인산화에서 감소하여 ATP를 [2][3]생성한다.
세포질의 막간 공간 구획은 수분 함량이 3.8 μL/mg인 반면 미토콘드리아 매트릭스는 0.8 μL/[4]mg 단백질이다.미토콘드리아가 어떻게 내부 미토콘드리아 막을 가로질러 삼투압 균형을 유지하는지 알려지지 않았지만, 그 막에는 조절된 물 수송을 위한 도관으로 여겨지는 아쿠아포린이 포함되어 있다.미토콘드리아 매트릭스의 pH는 약 7.8로 미토콘드리아 막간 공간의 pH(약 7.0~7.4)[5]보다 높다.미토콘드리아 DNA는 1963년 내쉬와 마짓에 의해 발견되었다.미토콘드리아 매트릭스에는 주로 이중 가닥이 있는 원형 DNA가 존재한다.미토콘드리아 DNA는 세포 총 DNA의 1%이다.그것은 구아닌과 시토신 함량이 풍부하다.포유류의 미토콘드리아는 55s의 리보솜을 가지고 있다.
구성.
대사물
매트릭스는 매트릭스 내의 프로세스에 관여하는 다양한 대사물의 숙주이다.구연산 회로는 아실-CoA, 피루브산, 아세틸-CoA, 구연산, 이소시트레이트, α-케토글루타르산, 숙시닐-CoA, 푸마르산, 석신산, L-말산 [2]및 옥살아세트산을 포함한다.요소 회로는 오르니틴L-오르니틴, 카르바모일 인산 및 L-시트룰린을 [4]사용한다.전자전달계는 코엔자임 NADH와 FADH2를 산화시킨다.단백질 합성은 미토콘드리아 DNA, RNA, tRNA를 [5]사용하며, 공정 조절은 이온(Ca/K+/Mg+)[6]을2+ 이용한다.매트릭스에 존재하는 추가 대사물은 COHO2, O2, ATP, ADP 및i [1]P이다2,.
효소
매트릭스에서 일어나는 효소들구연산 회로는 피루브산탈수소효소, 구연산합성효소, 아코니타아제, 이소질산탈수소효소, α-케토글루타르산탈수소효소, 숙시닐-CoA합성효소,[2] 후마라아제 및 사과산탈수소효소에 의해 촉진된다.요소 회로는 카르바모일 인산합성효소 I과 오르니틴 트랜스카르바밀라아제에 [4]의해 촉진된다.β-산화효소는 피루브산 카르복실화효소, 아실-CoA 탈수소효소 [1]및 β-케토티오라아제를 사용한다.아미노산 생성은 아미노산 전이효소에 의해 [7]촉진된다.아미노산 대사는 전순서 단백질 분해효소 [8]등의 단백질 분해 효소에 의해 매개된다.
내막구성요소
내막은 산화적 인산화 복합체를 포함하는 인지질 이중층이다.이것은 내막의 세포에서 발견되는 전자전달계를 포함하고 4개의 단백질 복합체와 ATP 합성효소로 구성됩니다.이러한 복합체는 복합체 I(NADH:coenzyme Q 산화환원효소), 복합체 II(숙신산염:coenzym Q 산화환원효소), 복합체 III(cytocrome c 산화환원효소) 및 복합체 IV(cytocrome c 산화환원효소)[6]이다.
매트릭스 구성에 대한 내부 막 제어
전자 전달 사슬은 양성자의 펌핑을 통해 ATP의 생산을 촉진하는 pH와 전기 화학적 구배를 설정하는 역할을 합니다.또한 구배는 미토콘드리아 막 [1]전위에 의해 구동되는 Ca와 같은2+ 이온 농도의 제어를 제공한다.막은 CO와 O와2 같은2 무극성 분자와 HO와 같은2 작은 무전하 극성 분자가 매트릭스로 들어가는 것을 허용합니다.분자는 운반 단백질과 이온 운반체를 통해 미토콘드리아 매트릭스로 들어오고 나간다.그리고 나서 분자는 [9]포린을 통해 미토콘드리아를 떠날 수 있다.이러한 귀속 특성은 조절에 필요한 이온 및 대사물의 농도를 제어하고 ATP [10][11]생산 속도를 결정합니다.
과정
구연산 회로
해당과정에 이어 아세틸-CoA의 생성에 의해 구연산 회로가 활성화된다.피루브산 탈수소효소에 의한 피루브산의 산화는 CO, 아세틸-CoA, NADH를 생성하며2, 지방산의 베타 산화는 아세틸-CoA, NADH,[1] FADH를2 생성하는 대체 이화 경로 역할을 한다.아세틸-CoA의 생산은 구연산 순환을 시작하며 생성된 보조효소는 전자전달계에서 [11]사용된다.
구연산회로의 모든 효소는 내막상에 존재하며 전자수송사슬의 단백질 복합체 II의 일부인 숙신산탈수소효소를 제외하고 매트릭스(예를 들어 구연산합성효소, 이소질산탈수소효소, α-케토글루타르산탈수소효소, 푸마라아제 및 사과산탈수소효소)에 포함된다.이 사이클은 두 사이클의 탄소의 산화를 통해 코엔자임 NADH와2 FADH를 생성한다.NADH와 FADH의2 산화는 숙시닐-CoA [2]합성효소로부터 GTP를 생성한다.
산화적 인산화
NADH 및 FADH는2 산화적 [1]인산화 과정을 거치기 위해 매트릭스에서 생성되거나 포린 및 수송 단백질을 통해 운반된다.NADH 및 FADH는2 전자를 전달하여 NADand FAD를 재생함으로써+ 전자전달계에서 산화를 일으킨다.양성자는 전자전달계를 통과하는 전자의 에너지에 의해 막 사이의 공간으로 끌어당긴다.4개의 전자가 산소에 의해 최종적으로 받아들여져 전자전달사슬이 완성됩니다.양성자는 단백질 ATP 합성효소를 통해 미토콘드리아 매트릭스로 돌아간다.에너지는 양성자의 통과를 촉진하는 ATP 합성효소를 회전시키기 위해 사용되어 ATP를 생산한다.매트릭스와 막간 공간 간의 pH 차이는 ATP 합성효소가 매트릭스 [6]내에 양성자를 유리하게 통과할 수 있는 전기화학적 구배를 생성한다.
요소 순환
요소 순환의 처음 두 단계는 간과 신장 세포의 미토콘드리아 매트릭스 안에서 일어난다.첫 번째 단계에서 암모니아는 2개의 ATP 분자의 투자를 통해 인산카르바모일로 변환된다.이 단계는 카르바모일 인산합성효소 I에 의해 촉진된다.오르니틴 트랜스카르바밀라아제에 의해 촉진되는 두 번째 단계는 카르바모일 인산염과 오르니틴을 시트룰린으로 변환한다.이러한 초기 단계 후 요소 주기는 오르니틴이 다시 한 번 전달 채널을 통해 매트릭스에 들어가 매트릭스 [12]내의 첫 단계를 계속하기 전까지 내부 막 공간에서 계속됩니다.
트랜스아미네이션
α-케토글루타르산 및 옥살아세트산은 아미노산 트랜스아미네이션 과정을 통해 매트릭스 내에서 아미노산으로 전환될 수 있다.이러한 반응은 옥살아세트산으로부터 아스파라긴과 아스파라긴을 생성하기 위해 트랜스아미나아제들에 의해 촉진된다.α-케토글루타르산염의 트랜스아미네이션은 글루탐산염, 프롤린, 아르기닌을 생성한다.이 아미노산들은 [7][13]기질 내에서 사용되거나 단백질을 생산하기 위해 세포로 운반된다.
규정
매트릭스 내의 조절은 주로 이온 농도, 대사물 농도 및 에너지 전하로 제어됩니다.Ca와 같은2+ 이온의 가용성은 구연산 회로의 다양한 기능을 제어합니다.매트릭스에서 피루브산탈수소효소, 이소질산탈수소효소, [14]α-케토글루타르산탈수소효소를 활성화하여 사이클에서 반응 속도를 증가시킨다.매트릭스에서 중간체 및 조효소의 농도는 또한 과민증 및 대뇌변성 효과로 인해 ATP 생성 속도를 증가시키거나 감소시킨다.NADH는 α-케토글루타르산염, 이소질산탈수소효소, 구연산합성효소 및 피루브산탈수소효소의 억제제로 작용할 수 있다.특히 옥살아세트산염의 농도는 낮게 유지되므로, 이 농도의 변동은 구연산 순환을 [2]촉진하는 역할을 한다.ATP의 생산은 또한 이소시트르산탈수소효소, 피루브산탈수소효소, 전자전달사슬단백질복합체 및 ATP합성효소의 억제제 역할을 함으로써 조절 수단으로 작용한다.ADP는 [1]액티베이터로서 기능합니다.
단백질 합성
미토콘드리아는 전자전달계에서 발견되는 단백질을 생산하는데 사용되는 그들만의 DNA 세트를 가지고 있다.미토콘드리아 DNA는 전자전달계의 단백질 복합체에서 발견되는 미토콘드리아 전사물, 리보솜 단백질,[15][16] 리보솜 RNA, 전달 RNA, 단백질 서브유닛을 처리하는 데 사용되는 약 13개의 단백질만을 코드화한다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b c d e f g Voet, Donald; Voet, Judith; Pratt, Charlotte (2013). Fundamentals of Biochemistry Life at the Molecular Level. New York City: John Wiley & Sons, Inc. pp. 582–584. ISBN 978-1118129180.
- ^ a b c d e Stryer, L; Berg, J; Tymoczko, JL (2002). Biochemistry. San Francisco: W.H. Freeman. pp. 509–527, 569–579, 614–616, 638–641, 732–735, 739–748, 770–773. ISBN 978-0-7167-4684-3.
- ^ Mitchell, Peter; Moyle, Jennifer (1967-01-14). "Chemiosmotic Hypothesis of Oxidative Phosphorylation". Nature. 213 (5072): 137–139. Bibcode:1967Natur.213..137M. doi:10.1038/213137a0. PMID 4291593. S2CID 4149605.
- ^ a b c Soboll, S; Scholz, R; Freisl, M; Elbers, R; Heldt, H.W. (1976). Distribution of metabolites between mitochondria and cytosol of perfused liver. New york: Elsevier. pp. 29–40. ISBN 978-0-444-10925-5.
- ^ a b Porcelli, Anna Maria; Ghelli, Anna; Zanna, Claudia; Pinton, Paolo; Rizzuto, Rosario; Rugolo, Michela (2005-01-28). "pH difference across the outer mitochondrial membrane measured with a green fluorescent protein mutant". Biochemical and Biophysical Research Communications. 326 (4): 799–804. doi:10.1016/j.bbrc.2004.11.105. PMID 15607740.
- ^ a b c Dimroth, P.; Kaim, G.; Matthey, U. (2000-01-01). "Crucial role of the membrane potential for ATP synthesis by F(1)F(o) ATP synthases". The Journal of Experimental Biology. 203 (Pt 1): 51–59. doi:10.1242/jeb.203.1.51. ISSN 0022-0949. PMID 10600673.
- ^ a b Karmen, A.; Wroblewski, F.; Ladue, J. S. (1955-01-01). "Transaminase activity in human blood". The Journal of Clinical Investigation. 34 (1): 126–131. doi:10.1172/JCI103055. ISSN 0021-9738. PMC 438594. PMID 13221663.
- ^ King, John V.; Liang, Wenguang G.; Scherpelz, Kathryn P.; Schilling, Alexander B.; Meredith, Stephen C.; Tang, Wei-Jen (2014-07-08). "Molecular basis of substrate recognition and degradation by human presequence protease". Structure. 22 (7): 996–1007. doi:10.1016/j.str.2014.05.003. ISSN 1878-4186. PMC 4128088. PMID 24931469.
- ^ Alberts, Bruce; Johnson, Alexander; Lewis, julian; Roberts, Keith; Peters, Walter; Raff, Martin (1994). Molecular Biology of the Cell. New york: Garland Publishing Inc. ISBN 978-0-8153-3218-3.
- ^ Anderson, S.; Bankier, A. T.; Barrell, B. G.; de Bruijn, M. H. L.; Coulson, A. R.; Drouin, J.; Eperon, I. C.; Nierlich, D. P.; Roe, B. A. (1981-04-09). "Sequence and organization of the human mitochondrial genome". Nature. 290 (5806): 457–465. Bibcode:1981Natur.290..457A. doi:10.1038/290457a0. PMID 7219534. S2CID 4355527.
- ^ a b Iuchi, S.; Lin, E. C. C. (1993-07-01). "Adaptation of Escherichia coli to redox environments by gene expression". Molecular Microbiology. 9 (1): 9–15. doi:10.1111/j.1365-2958.1993.tb01664.x. ISSN 1365-2958. PMID 8412675. S2CID 39165641.
- ^ Tuchman, Mendel; Plante, Robert J. (1995-01-01). "Mutations and polymorphisms in the human ornithine transcarbamylase gene: Mutation update addendum". Human Mutation. 5 (4): 293–295. doi:10.1002/humu.1380050404. ISSN 1098-1004. PMID 7627182. S2CID 2951786.
- ^ Kirsch, Jack F.; Eichele, Gregor; Ford, Geoffrey C.; Vincent, Michael G.; Jansonius, Johan N.; Gehring, Heinz; Christen, Philipp (1984-04-15). "Mechanism of action of aspartate aminotransferase proposed on the basis of its spatial structure". Journal of Molecular Biology. 174 (3): 497–525. doi:10.1016/0022-2836(84)90333-4. PMID 6143829.
- ^ Denton, Richard M.; Randle, Philip J.; Bridges, Barbara J.; Cooper, Ronald H.; Kerbey, Alan L.; Pask, Helen T.; Severson, David L.; Stansbie, David; Whitehouse, Susan (1975-10-01). "Regulation of mammalian pyruvate dehydrogenase". Molecular and Cellular Biochemistry. 9 (1): 27–53. doi:10.1007/BF01731731. ISSN 0300-8177. PMID 171557. S2CID 27367543.
- ^ Fox, Thomas D. (2012-12-01). "Mitochondrial Protein Synthesis, Import, and Assembly". Genetics. 192 (4): 1203–1234. doi:10.1534/genetics.112.141267. ISSN 0016-6731. PMC 3512135. PMID 23212899.
- ^ Grivell, L.A.; Pel, H.J. (1994). "Protein synthesis in mitochondria" (PDF). Mol. Biol. Rep. 19 (3): 183–194. doi:10.1007/bf00986960. PMID 7969106. S2CID 21200502.