덴티노제네시스 불완전성
Dentinogenesis imperfecta| 덴티노제네시스 불완전성 | |
|---|---|
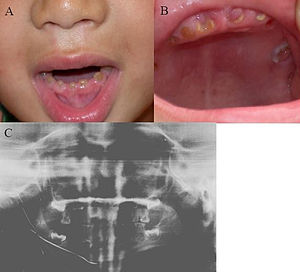 | |
| 덴티노제네시스 불완전성을 가진 사람의 구강 사진 | |
| 전문 | 치의학 |
Dentinogenesis 불완전성(DI)은 치아발달의 유전적 질환이다.그것은 4q21 염색체의 돌연변이의 결과로, 덴틴 시알로인스포프로틴 유전자(DSPP)에서 자가 우성 패턴으로 유전된다.[1][2][3][4][5]그것은 인간에게 가장 자주 발생하는 자기 면역 지배적 특징 중 하나이다.[6]Dentinogenesis 불완전성은 6,000명에서 8,000명 사이의 사람들에게 영향을 미친다.[7]
이 상태는 치아가 변색(대부분 청회색 또는 황갈색)되고 반투명하게 되어 치아의 발수성 광택을 유발할 수 있다.[2][3][8][5][9]치아 또한 평상시보다 약해 빠른 마모, 깨짐, 상실을 일으키기 쉽다.[2][3][4][5][8]이러한 문제들은 유아용 치아를 단독으로 또는 유아용 치아와 성인용 치아를 모두 손상시킬 수 있으며, 일반적으로 유아용 치아는 더 심하게 영향을 받는다.[5][8]
유전적 요인이 질병의 주범이지만, 칼슘의 석회화나 신진대사를 방해하는 환경적 또는 전신적 이상도 변칙적인 덴틴을 유발할 수 있다.
프리젠테이션
임상발표
임상적 특징에는 다음이 포함된다.
- 변색된 톱니 - 톱니가 황색, 갈색, 파란색 또는 오팔색일 수 있음
- 경추 수축으로 인해 치아관에 전구 모양
- 치아 마모/비충돌 치아 표면 손실(NCTSL) - 광물질화된 덴틴으로 인해 치아의 에나멜은 지원되지 않으며, 그 후에 물어뜯는 힘에 의해 벗겨지거나 벗겨진다.이것은 마모에 대한 내성이 낮은 기초 미네랄이 부족한 덴틴을 노출시킨다.따라서 마모 및 소모의 특성이 명백해질 수 있다.
- OVD(Closal Vertical Dimension) 감소 - 이는 치아 마모/NCTSL에 보조적이다. OVD 감소는 뇌척수성 이상, 치아 미학 및 씹기, 삼키기, 말하기 및 먹는 동안 장애를 초래할 수 있다.[2][3][4][5][8]
아기 치아는 보통 성인 치아보다 더 심하게 영향을 받는다.[3][5][8]
에나멜은 보통 덴티노나멜 접합부(DEJ)에서 가리비 분실이 없어져 더 일찍 소실되는 경향이 있기 때문에 일찍 소실된다.가리비는 에나멜과 덴틴 사이의 닻을 강화하여 치아의 기계적 특성에 이롭다는 의견이 제시되었다.[10]그러나 치아는 일반 치아보다 치아 카리에 더 약하지 않다.
치주질환, 즉 잇몸질환은 충치(치과)에 대한 임상적 발견이 없음에도 불구하고 치주발생 불완전성을 가진 개인들 사이에서 흔히 발견되는 질환이다.그 이유는 현재 잘 알려져 있지 않다.[3]
의치노제네시스 불완전성을 가진 일부 환자들은 2차적으로 맥박 교살에서 맥박 말리기에 기인하거나 광범위한 관상 마모로 인한 펄프 노출에 기인하는 것으로 보이는 여러 가지 근막종기를 앓게 될 것이다.그들은 관련된 치아를 살리기 위해 비수술적 수술이 필요할지도 모른다.[11]
덴틴 노출이 일반적인 임상 소견이지만, 덴티노제네시스 불완전성을 가진 개인은 일반적으로 노출된 덴틴이 경화(강화)되어 유리/샤이니가 나타나기 때문에 치아 민감성을 경험하지 않는다.[2]
방사선 프리젠테이션
방사선 촬영 기능:
- 경추 수축이 뚜렷한 전구 모양의 치아 크라운
- 작은 펄프 또는 전체 펄프 제거
- 작거나 소거된 뿌리 운하
- 펄프 스톤 유무
- 좁고 작은 뿌리
- 충치(치과)와 같은 임상 병리학적 증거가 없는 경피적 방사선 투과(치과)[2][3][5][12]
Dentinogenesis 불완전성의 하위 유형별 표시
임상 및 방사선 특성은 덴티노제네시스 불완전성의 하위 유형으로 분류할 수 있다(분류 섹션의 실드 분류 참조).
제1종
임상적으로 아기(1차)와 성인(영구) 치아는 모두 황색이나 반투명해 보이는 경우가 많으며 심한 소모의 징후를 보인다.원치아는 덴틴 위에 에나멜을 덧댄 층이 얇아 외관이 더욱 뚜렷해 이상색인 덴틴이 더 눈에 띈다.[2]
방사선학적으로, 영향을 받은 치아는 짧고 좁은 뿌리를 가지고 있으며, 치아의 분화 직전 또는 직후에 덴티네 비대증으로 인한 맥박이 없어진다.[2]
이러한 특징의 심각성은 가변적이며, 어떤 치아는 펄프가 완전히 없어지는 것으로 나타나는 반면, 다른 치아는 정상적이고 건강한 틀니를 가지고 있는 것으로 보인다.[2]
일부 제1형 케이스는 방사선학적 이상만 있을 뿐 임상적 소견 없이 나타난다.[4]
타입 II
타입 II는 타입[13] I과 유사한 임상 및 방사선 외관을 가지며 다음과 같은 특징을 가지고 있다.
- 전구관은 경추 수축이 뚜렷하게 나타나는 경우가 많다.
- 입안의 모든 치아가 영향을 받아 아기(1차)와 성인(영구) 치아 모두에 심각한 이상이 나타난다.이는 프레젠테이션이 더 가변적인 I 유형과 대조적이다.
- 드물게, 개인들은 감각 청각 장애를 보인다.이러한 청력 손실은 감소의 부차적인 특징으로 제안된다. 이러한 유형의 치아 마모로 인해 내이 모양의 후속 변경으로 턱이 과도하게 노출되어 청력 손실이 발생할 수 있다.그러나 진짜 원인은 아직 밝혀지지 않았다.[2][4]
타입 III
성인(영구) 치아의 경우 타입 I 및 II와 유사한 임상 및 방사선 특징이 뚜렷하게 나타난다.주된 특징으로는 아기 치아의 독특한 외관을 묘사하는 용어인 "껍질 치아"가 있다. 주된 치아는 여러 개의 펄프 노출을 가지고 있으며, 덴틴 층이 얇고(덴틴 저혈압) 펄프실이 매우 커 방사선학적으로 속이 빈 상태로 나타난다.[2][3][4][12]
역사학
에나멜은 일정한 구조를 가지고 있지만, 덴틴의 구조와 아멜로-덴티날 접합부에 이상이 있다.[4][5]이러한 이상에는 다음이 포함된다.
- 의치관 감소
- 덴티날 관은 직경이 더 작고 모양이 불규칙하며 또한 지워질 수 있다.
- 아파타이트 결정의 이상 형태학
- 덴틴의 유기성분 내 수분 및 콜라겐 함량 증가(자세한 내용은 덴틴 페이지의 구조 섹션 참조)
분류
실드 분류(1973)
이것은 의치신생성 불완전성에 가장 널리 사용되는 분류로, 그 상태를 3가지 유형으로 세분화한다.
제1종
OI(Ostegenesis 불완전성)와 관련된 DI.[2][5][14]유사한 치아 이상을 가진 DI 타입은 대개 표현성이 가변적인 자기공명 지배적 특성이지만 관련 골생성 불완전성이 열성형인 경우 열성이 될 수 있다.[15]
최근의 유전자 연구는 콜라겐 타입 1 단백질인 COL1A1과 COL1A2에 대한 유전자 코딩의 돌연변이가 이러한 유형의 DI와 관련이 있다는 것을 확인했다.[2][8]
OI를 가진 모든 개인이 의치노제네시스 불완전성을 가지고 있는 것은 아니며, DI의 유병률은 OI의 하위 유형에 따라 다르다.
- OI 타입 III와 IV를 가진 개인들의 DI 유병률이 각각 43-82%, 37-100%로 높았다.
- OI 타입 I의 개인에서 DI 유병률이 8-40%로 낮음
- 다른 OI 하위 유형에[5][14] 사용할 수 있는 데이터 없음
타입 II
DI가 OI와 연관되지 않음.다른 유전적 장애가 없는 사람들에게서 발생한다.그것은 자가 면역 지배적 특성이다.제2형인 몇몇 가정에서는 치아 이상 외에도 진행성 청력 손실이 있다.유전성 오팔레스센트 덴틴이라고도 한다.[11]
타입 III
브랜디와인은 격리시켜이 유형은 미국 메릴랜드주 외딴 지역에서만 발생하는 경우는 드물다.[3][16][12] DI 타입 II와 마찬가지로 OI와도 관련이 없다.[2]특히 영구적인 틀니에서 종 모양의 관이 두드러진 특징이다.타입Ⅰ·Ⅱ와는 달리 껍질 같은 외관과 다수의 펄프 노출이 있는 치아를 포함한다.[11]
덴틴 시알로인스포프로테인(DSPP)에 대한 유전자 코딩의 돌연변이는 DI 타입 II 및 III와 관련이 있다.DSPP는 3개의 단백질을 발생시키는 폴리펩타이드로, 덴틴 시알로프로테인(DSP), 덴틴 글리콥트로틴(DGP), 덴틴 인산프로테인(DPP)이다.DPP 단백질은 미네랄화된 덴틴과 에나멜에 널리 분포하는 기본 결정인 히드록시파타이트 결정 형성과 성장에 기여할 것으로 생각된다.DGP와 DSP 단백질의 기능은 잘 이해되지 않는다.[2][3][4]
유전학 연구에 따르면 타입 II와 타입 III는 덴티노제네시스 불완전성의 동일한 하위 유형일 수 있으며, 심각도에 의해서만 차이가 난다.[4]
드 라 두레-몰라, 포루너 및 베르달(2015년)
De La Dure-Molla, Foruner 및 Berdal(2015)이 실드 분류(1973)를 대체하는 새로운 분류를 제안했다.이 새로운 분류는 주로 하위 유형 사이에 징후와 증상이 겹쳐 실드 분류 사용의 임상적 어려움을 극복하기 위해 고안되었다.[3]
이 분류에서 저자들은 덴티노제네시스 불완전성과 덴티네 이형성증인 DSPP(덴티닌 시알로인스포프로테아) 질환을 공동으로 "덴티노제네시스 불완전성"이라고 명명하고, 그 상태의 심각도에 따라 하위유형을 결정할 것을 제안한다.몇 가지 예외가 있다.
- 실즈의 덴틴 이형성증 타입 I - 이 질환은 뿌리발달에만 영향을 미친다는 점에서 독특하며, 새로운 분류에서는 별도로 "라디칼 덴틴 이형성증"이라고 불린다.
- 실즈의 덴티노제네시스 불완전성 I형 - 이 하위형은 골성 불완전성의[3] 증후군이기 때문에 저자들이 다른 질병으로 간주하기 때문에 이 새로운 분류에서는 인정되지 않는다.
마일드형
일차(아기) 치아는 적당히 영향을 받는다.
영구(성인) 치아는 변색되지 않거나, 변색은 온화(회색)하다.거의 또는 전혀 소모되지 않는 것이 명백하다.치아의 크라운은 전구성이며 시멘토-에나멜 접합부(CEJ)에서 현저하게 수축될 수 있다.
방사선 촬영상, " 엉겅퀴 모양의 모양"[3]을 가진 부분 펄프 제거의 증거.
중간형
치아는 적당히 변색된다(파란색, 회색 또는 황색 오팔레센트).왕관 높이의 단축으로 더 많은 소모가 명백하다.크라운은 CEJ에서 수축이 두드러진 전구체로 보일 수 있다.
방사선학적으로 펄프는 작거나 완전히 없어졌다.뿌리는 평균보다 얇고 짧아 보인다.병리학적 병리학도 있을 수 있다.[3]
중증형
치아는 현저하게 변색된다.왕관은 심한 소모로 매우 짧다.크라운은 CEJ에서 수축이 두드러진 전구체로 보일 수 있다.
방사선학적으로 펄프는 크게 보이고 덴티네 층은 얇다("프레젠테이션 섹션에 설명된 조개 톱니").뿌리는 가늘고 짧다.여러 가지 병리학적 병리학이 있을 수 있다.[3]
래디컬 덴틴 이형성증
이 서브타입은 치아의 뿌리만 영향을 받는 실즈의 덴틴 이형성증 1형 대신 사용된다.
1차 치아와 영구치 모두 영향을 받는다.
치아는 임상적으로 정상으로 보인다.방사선학적으로, 뿌리는 더 짧고 둥근 꼭지점과 함께 융합된다.[3]
진단
그 상태가 유전되었는지를 판단하기 위해서는 다른 가족 구성원 중 덴티노제네시스 불완전성을 가지고 있는 사람이 있는지 물어보는 것이 좋다.가족력이 부족하면 그 조건을 획득했다는 것을 나타낼 수 있다.[2]
치과/의학 전문가는 이 질환이 다음과 같은 또 다른 유전 질환의 증후군인지 여부를 확립할 것을 제안한다.
- 골생성 불완전성 - 타입 I 덴티노제네시스 불완전성을 나타낸다(분류 섹션의 실드 분류 참조).
- 엘러스 단로스 증후군
- 골드블랫 증후군
- Schimke 면역-오세우스 이형성증
- 브라키오 스켈레토 유전 증후군
- 골이식성 및 원시적 단신형이며 심한 미량감소증
- 오팔레스틱 치아
- 뿌리없는 어금니[2]
[이것은 포괄적인 목록이 아니다]
제1종 덴티노제네시스 불완전성(방패 분류)은 골형성 불완전성과 연관되어 있으므로 골형성 불완전성의 증상에 대해 문의하는 것이 유용할 수 있다.[2]주목할 만한 정보는 다음과 같다.
골형성 불완전성의 일반적인 치아 특징은 다음과 같다.
차등진단
- 아멜로제네시스 불완전성의 저초점화 형태
- 선천성 적혈구균
- 치아의 조기 상실을 초래할 수 있는 상태(예:코스트만병, 순환 중성미자, 체디아크-헤가시 증후군, 히스티로시토시스 X, 파필론-레페브르 증후군
- 테트라사이클린 등의 약물에 의한 영구치 변색 또는 구루병과[2] 같은 의학적 상태
치료
예방적, 회복적 관리는 미학뿐만 아니라 고려사항으로서 중요하다.이를 통해 상하 치아를 함께 물어뜯을 때 환자의 수직 얼굴 높이를 보존할 수 있다.예방, 얼굴 높이의 보존, 기능의 유지, 미적 욕구가 우선인 다양한 유형의 DI에 걸쳐 치료의 기초가 표준적이다.예방적 노력은 펄프 내에서 발생하는 병리학을 제한할 수 있으며, 이는 미래의 내선성 절차를 덜 도전적으로 만들고 더 나은 결과를 얻을 수 있다.
- 도전은 펄프실과 뿌리관 파괴로 인해 DI의 영향을 받는 치아의 뿌리관 치료 또는 그러한 공간의 축소와 관련이 있다.
- 뿌리관 시술이 지시되면 다른 치아처럼 비슷한 방법으로 시술해야 한다.[19]뿌리 처리된 치아는 치아가 약한 치아를 가지고 있어 복원에 견디지 못할 수 있으므로 복원에 대한 추가 검토가 필요하다.
피복부 높이 보존은 피복부 표면 높이가 감소, 에나멜 침식으로 인해 피복부 표면 높이가 크게 손상될 수 있는 일차 치아를 위해 옹호하는 스테인리스 스틸 크라운을 사용하여 해결할 수 있다.[12]
대부분의 경우 심미적인 외관뿐만 아니라 추가적인 소모를 막기 위해 완전한 커버리지 크라운이나 베니어(복합/포르셀라)가 필요하다.[9]또 다른 치료 방법은 치아 본딩으로 치아의 약해진 에나멜에 가벼운 에나멜을 바르는 것이다. 그리고 이 본딩의 많은 치료로, 치아는 눈에 윙윙거리는 것처럼 보이지만, 안쪽과 그 커버 아래의 치아는 여전히 같다.치아 상태가 약해진 탓에 교정기, 교량 등 흔한 미용 시술이 덴티노제네시스 불완전성을 가진 환자에게는 부적절하며, 교정하고자 했던 상황보다 훨씬 더 큰 손상을 입힐 가능성이 높다.
치아 미백(피부)은 어느 정도 성공했을 때 DI 치아의 색깔을 밝게 하는 것으로 보고되었지만, 변색은 주로 밑의 황갈색 덴틴에 의해 발생하기 때문에 이것만으로는 상당한 변색의 경우 정상적인 외관을 만들어낼 가능성이 낮다.[11]
상당한 소진이 있는 경우 남은 치아의 추가 소모를 방지하고 외관상 높이를 보존하기 위해 과다 복용을 규정할 수 있다.[12]
OI와 관련된 DI 관리
비스포스포네이트는 최근 골형성 불완전성을 포함한 몇몇 뼈 질환을 치료하기 위해 도입되었다.[citation needed]
치과 치료와 관련된 이 약물의 인정된 위험은 턱의 비스포스포네이트 관련 골원증이다([20][21]BRONJ이 위험의 발생은 추출과 같은 치과 수술 절차와 관련이 있다.
따라서 치과 전문의는 비스포스포네이트 약물 치료를 받을 수 있는 타입 2 DI를 가진 환자에게 치과 시술을 실시할 때 주의 깊게 진행해야 한다.[citation needed]
참고 항목
참조
- ^ Beattie ML, Kim JW, Gong SG, Murdoch-Kinch CA, Simmer JP, Hu JC (April 2006). "Phenotypic variation in dentinogenesis imperfecta/dentin dysplasia linked to 4q21". Journal of Dental Research. 85 (4): 329–333. doi:10.1177/154405910608500409. PMC 2238637. PMID 16567553.
- ^ a b c d e f g h i j k l m n o p q r s t Barron MJ, McDonnell ST, Mackie I, Dixon MJ (November 2008). "Hereditary dentine disorders: dentinogenesis imperfecta and dentine dysplasia". Orphanet Journal of Rare Diseases. 3 (1): 31. doi:10.1186/1750-1172-3-31. PMC 2600777. PMID 19021896.
- ^ a b c d e f g h i j k l m n o p de La Dure-Molla M, Philippe Fournier B, Berdal A (April 2015). "Isolated dentinogenesis imperfecta and dentin dysplasia: revision of the classification". European Journal of Human Genetics. 23 (4): 445–451. doi:10.1038/ejhg.2014.159. PMC 4666581. PMID 25118030.
- ^ a b c d e f g h i j Soliman S, Meyer-Marcotty P, Hahn B, Halbleib K, Krastl G (September 2018). "Treatment of an Adolescent Patient with Dentinogenesis Imperfecta Using Indirect Composite Restorations - A Case Report and Literature Review". The Journal of Adhesive Dentistry. 20 (4): 345–354. doi:10.3290/j.jad.a40991. PMID 30206577.
- ^ a b c d e f g h i j k l Malmgren B, Norgren S (March 2002). "Dental aberrations in children and adolescents with osteogenesis imperfecta". Acta Odontologica Scandinavica. 60 (2): 65–71. doi:10.1080/000163502753509446. PMID 12020117. S2CID 110970.
- ^ Thotakura SR, Mah T, Srinivasan R, Takagi Y, Veis A, George A (March 2000). "The non-collagenous dentin matrix proteins are involved in dentinogenesis imperfecta type II (DGI-II)". Journal of Dental Research. 79 (3): 835–839. doi:10.1177/00220345000790030901. PMID 10765957. S2CID 38418321.
- ^ Witkop CJ (January 1975). "Hereditary defects of dentin". Dental Clinics of North America. 19 (1): 25–45. PMID 162890.
- ^ a b c d e f g Ma MS, Najirad M, Taqi D, Retrouvey JM, Tamimi F, Dagdeviren D, et al. (March 2019). "Caries prevalence and experience in individuals with osteogenesis imperfecta: A cross-sectional multicenter study". Special Care in Dentistry. 39 (2): 214–219. doi:10.1111/scd.12368. PMC 6402806. PMID 30758072.
- ^ a b Bath-Balogh M (2011). Illustrated Dental Embryology, Histology, and Anatomy (3rd ed.). Elsevier Health Sciences. p. 64. ISBN 978-0-323-29086-9.
- ^ Shimizu D, Macho GA (January 2007). "Functional significance of the microstructural detail of the primate dentino-enamel junction: a possible example of exaptation". Journal of Human Evolution. 52 (1): 103–111. doi:10.1016/j.jhevol.2006.08.004. PMID 16997355.
- ^ a b c d Guideline on Dental Management of Heritable Dental Developmental Anomalies (PDF). American Academy of Pediatric Dentistry. 2013.
- ^ a b c d e Pettiette MT, Wright JT, Trope M (December 1998). "Dentinogenesis imperfecta: endodontic implications. Case report". Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology, and Endodontics. 86 (6): 733–737. doi:10.1016/s1079-2104(98)90213-x. PMID 9868734.
- ^ Rios D, Falavinha A, Tenuta L, Machado M (2005). "Osteogenesis imperfecta and dentinogenesis imperfecta: associated disorders". Quintessence International (Berlin, Germany : 1985). Quintessence Int. 36 (9): 695–701. PMID 16163872.
- ^ a b c Andersson K, Dahllöf G, Lindahl K, Kindmark A, Grigelioniene G, Åström E, Malmgren B (2017-05-12). Divaris K (ed.). "Mutations in COL1A1 and COL1A2 and dental aberrations in children and adolescents with osteogenesis imperfecta - A retrospective cohort study". PLOS ONE. 12 (5): e0176466. Bibcode:2017PLoSO..1276466A. doi:10.1371/journal.pone.0176466. PMC 5428910. PMID 28498836.
- ^ Nanci A (2013). Ten Cate's oral histology : development, structure, and function (8th ed.). St. Louis, Mo.: Elsevier. p. 15. ISBN 978-0-323-07846-7.
- ^ Huth KC, Paschos E, Sagner T, Hickel R (September 2002). "Diagnostic features and pedodontic-orthodontic management in dentinogenesis imperfecta type II: a case report". International Journal of Paediatric Dentistry. 12 (5): 316–321. doi:10.1046/j.1365-263X.2002.00390.x. PMID 12199890.
- ^ Jensen BL, Lund AM (1997-07-01). "Osteogenesis imperfecta: clinical, cephalometric, and biochemical investigations of OI types I, III, and IV". Journal of Craniofacial Genetics and Developmental Biology. 17 (3): 121–132. PMID 9338855.
- ^ Waltimo-Sirén J, Kolkka M, Pynnönen S, Kuurila K, Kaitila I, Kovero O (March 2005). "Craniofacial features in osteogenesis imperfecta: a cephalometric study". American Journal of Medical Genetics. Part A. 133A (2): 142–150. doi:10.1002/ajmg.a.30523. PMID 15666304. S2CID 23172499.
- ^ Henke DA, Fridrich TA, Aquilino SA (May 1999). "Occlusal rehabilitation of a patient with dentinogenesis imperfecta: a clinical report". The Journal of Prosthetic Dentistry. 81 (5): 503–506. doi:10.1016/s0022-3913(99)70201-5. PMID 10220651.
- ^ Woo SB, Hellstein JW, Kalmar JR (May 2006). "Narrative [corrected] review: bisphosphonates and osteonecrosis of the jaws". Annals of Internal Medicine. 144 (10): 753–761. doi:10.7326/0003-4819-144-10-200605160-00009. PMID 16702591. S2CID 53091343.
- ^ Khosla S, Burr D, Cauley J, Dempster DW, Ebeling PR, Felsenberg D, et al. (October 2007). "Bisphosphonate-associated osteonecrosis of the jaw: report of a task force of the American Society for Bone and Mineral Research". Journal of Bone and Mineral Research. 22 (10): 1479–1491. doi:10.1359/jbmr.0707onj. PMID 17663640.
이 글에는 미국 국립 의학 도서관의 공용 도메인 텍스트가 통합되어 있다.


