백혈구 차등
White blood cell differential| 백혈구 차등 | |
|---|---|
 | |
| 동의어 | 차등 백혈구 수,[1] 백혈구 수,[2] 자동 이송, [3]수동 확산[1] |
| 목적 | 말초혈액 내 백혈구 모집단 설명 |
| 메드라인플러스 | 003657 |
| e메디컬 | 2085133 |
| 로인크 | 33255-1, 24318-8, 69738-3 |
백혈구 차등검사는 사람의 혈액 속에 있는 백혈구의 종류와 양에 대한 정보를 제공하는 의학 실험실 검사다.보통 완전혈구수(CBC)의 일부로 명령되는 이 검사는 중성미자, 림프구, 단세포, 이오시노필스, 기저세포 등 5가지 정상 백혈구 유형의 양과 그것들이 존재하는 경우 비정상적인 세포 유형의 양을 측정한다.이러한 결과는 백분율과 절대값으로 보고되며, 기준 범위와 비교하여 값이 정상인지, 낮는지 또는 높음인지를 판단한다.백혈구 양의 변화는 바이러스, 박테리아, 기생충 감염과 백혈병과 같은 혈액 질환을 포함한 많은 건강 상태를 진단하는데 도움을 줄 수 있다.
백혈구 차이는 자동 분석기(실험실 테스트를 수행하도록 설계된 기계)에 의해 수행되거나 현미경으로 혈흔을 검사하여 수동으로 수행할 수 있다.검사는 1970년대 백혈구 차등분석기가 도입될 때까지 수작업으로 이뤄져 자동 차등화가 가능해졌다.자동 미분에서는 혈액 샘플이 분석기에 실려서 소량의 혈액을 샘플링하고 백혈구의 다양한 성질을 측정하여 미분 카운트를 생성한다.염색 현미경 슬라이드에 백혈구가 계수되는 수동 미분류는 이제 자동 미분으로부터 비정상적인 결과를 조사하기 위해 수행되거나 의료 제공자의 요청에 따라 수행된다.수동 미분류는 자동화된 방법에 의해 계산되지 않는 세포 유형을 식별하고 임상적으로 백혈구의 외관상 중대한 변화를 감지할 수 있다.
1674년 안토니 판 리우웬후크(Antonie van Leeuwenhoek)는 최초로 혈액세포에 대한 현미경 관측을 발표했다.18세기와 19세기에 걸친 현미경 기술의 향상으로 혈액의 세 가지 세포 성분을 확인하고 셀 수 있게 되었다.1870년대에 폴 에를리히는 백혈구의 각 유형을 구별할 수 있는 얼룩 기술을 발명했다.드미트리 레오니도비치 로마노프스키가 나중에 에를리히의 얼룩을 수정하여 더 넓은 범위의 색상을 만들어내면서 로마노프스키 얼룩을 만들었는데, 로마노프스키 얼룩은 여전히 수동 차이의 혈흔을 얼룩지게 하는데 사용된다.
백혈구 차이의 자동화는 1950년대 초 최초의 자동 혈액학 분석기인 콜터 카운터가 발명되면서 시작되었다.이 기계는 전기 임피던스 측정을 이용해 세포를 세고 크기를 결정해 백혈구와 적혈구를 열거할 수 있게 했다.1970년대에는 자동화된 차등계수를 수행하기 위한 두 가지 기법이 개발되었는데, 그것은 현미경 슬라이드의 디지털 이미지 처리와 빛 산란과 세포 얼룩을 이용한 흐름 세포측정 기법이다.이 방법들은 현대 혈액학 분석기에 여전히 사용되고 있다.
의학적 용법
| 세포형 | 성인 기준 범위 (× 109/L) | 성인 기준 범위 (iii) |
|---|---|---|
| 중성미자 | 1.7–7.5 | 50–70 |
| 림프구 | 1.0–3.2 | 18–42 |
| 단세포 | 0.1–1.3 | 2–11 |
| 어시노필스 | 0.0–0.3 | 1–3 |
| 바소필스 | 0.0–0.2 | 0–2 |
백혈구 차등검사는 흔히 전체 혈액수와 함께 처방되는 일반적인 혈액검사다.검사는 일상적인 건강 검사의 일환으로 수행될 수 있다; 특히 감염이나 혈액학적 장애를 암시하는 특정 증상들을 조사하거나,[5][6] 혈액 장애나 염증성 질환과 같은 현재의 상태를 감시하기 위해 수행될 수 있다.[7]
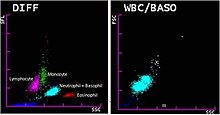
백혈구의 다섯 종류는 보통 혈액에서 발견된다: 중성미자, 림프구, 단세포, 이오시노필, 기저세포.[8]자동 또는 수동 차이에 의해 측정된 이러한 세포 유형의 비율의 현저한 변화는 다양한 건강 상태를 나타낼 수 있다.[9]또한 블라스트 셀과 같이 혈액에서 일반적으로 발생하지 않는 세포 유형은 수동 미분류에 의해 식별될 수 있다.이러한 세포 유형은 혈액 장애와 다른 병리학적 상태에서 발견될 수 있다.[10][11]수동 미분류는 또한 반응성 림프구와 같은 백혈구의 외관상 [12]변화나 중성미자의 유독성 과립과 같은 특징들을 확인할 수 있다.[13]백혈구 차이의 결과는 백분율과 절대값으로 보고된다.절대 카운트는 보통 마이크로 리터당(µL) 또는 리터당 10개9 셀 단위로 보고된다.[6]그 다음 결과는 개별 실험실에서 정의하며 환자 모집단과 시험 방법의 차이로 인해 달라질 수 있는 기준 범위와 비교된다.[14]
CBC와 차등 시험은 보통 정맥이나 모세혈관에 대해 시행된다.모세혈관은 일반적으로 혈관이 접근하기 어려운 유아와 개인에게 사용된다.[15]응고를 방지하기 위해 시료를 항응고제 화합물인 에틸렌디아미나메트라아세트산(EDTA)이 들어 있는 튜브에 끌어 넣는다.[16]구연산나트륨을 함유한 튜브는 EDTA가 혈소판 덩어리를 일으키는 환자를 위한 것일 수 있다.[17]이 검사는 전혈에 대해 실시되는데, 이는 원심분리되지 않은 혈액을 의미한다.[18]
종류들
수동 차동
수동 미분에서는 얼룩진 혈흔을 현미경으로 검사하고 백혈구를 세어 외관에 따라 분류한다.수동 미분류는 일반적으로 자동 미분류에 검토를 위해 플래그를 지정하거나 의료 제공자가 요청할 때 수행된다.[1][9]수동 차이에 백혈병 등 특정 심각한 상태를 암시하는 소견이 나타날 경우, 혈액 얼룩은 의사(일반적으로 혈액학자 또는 병리학자)에게 확인을 의뢰한다.[1]
절차
혈흔은 현미경 슬라이드에 한 방울의 혈액을 올려놓고 비스듬히 잡은 두 번째 슬라이드를 이용해 혈액을 퍼트린 뒤 미끄럼틀을 가로질러 끌어당겨 얼룩 끝부분에 한 겹의 세포로 구성된 '발진 가장자리'를 형성함으로써 준비된다.[19]이 작업은 손으로 수행하거나 혈액학 분석기에 연결된 자동 슬라이드 제작기를 사용하여 수행할 수 있다.미끄럼틀은 로마노프스키 얼룩으로 처리되는데, 보통 라이트의 얼룩이나 라이트-젬사(Wright-Giemsa)로 처리되어 현미경으로 검사한다.얼룩은 깃털날개 가장자리 내에서 좌우로 스캔하고 연속적으로 셀을 세는 체계적인 패턴으로 검사된다.미분류는 일반적으로 400배 또는 500배의 배율로 수행되지만, 비정상적인 세포가 존재할 경우 1000배 배율을 사용할 수 있다.[20]세포는 세포핵의 크기와 구조, 세포질의 색과 질감 등 형태적 특징을 바탕으로 식별된다.이를 통해 비정상적인 세포 유형과 세포 외관 변화를 파악할 수 있다.[8]대부분의 경우 현미경 검사자는 백혈구 100개를 세지만 백혈구 수치가 높으면 200개를 세어 더 잘 나타낼 수도 있다.[21]수동 차등 카운트는 각 세포 유형의 백분율을 생성하며, 분석기의 총 백혈구 카운트를 곱하여 절대값을 도출할 수 있다.[22]
수동차이는 인공지능(AI)을 이용해 혈흔의 포토믹크로그래프에서 백혈구를 분류하는 디지털 현미경 소프트웨어로 부분적으로 자동화할 수 있다.[23][24]그러나 이 기법은 수작업 검토에 의한 확인이 필요하다.[25][26]
제한 사항
수동 차이에 셀이 상대적으로 적기 때문에, 특히 셀이 적은 양으로 존재할 때는 자동화된 기법보다 가변성이 더 높다.[27]예를 들어, 5%의 단세포가 포함된 표본의 경우, 샘플링 변동으로 인해 수동 미분 결과는 1에서 10퍼센트 사이가 될 수 있다.[28]또한 세포 식별은 주관적이며 정확도는 슬라이드를 읽는 사람의 기술에 따라 달라진다.[27][29]혈액 얼룩 제제가 제대로 되지 않으면 백혈구가 불균일하게 분포되어 계산이 부정확해지고,[30] 부적절한 얼룩이 세포 식별을 방해할 수 있다.[31]전체적으로 수동 미분계수는 5~10%의 변동 계수(CV)를 보이는 반면, 정상 중성미자와 림프구의 자동 미분계수는 약 3%의 CV를 가진다.[31]
백혈병과 기타 혈액학적 악성종양에서 백혈구의 혈통 및 유전적 특성은 치료와 예후에 중요한 의미를 가지며, 세포의 미세한 외관이 정확한 분류에 불충분한 경우가 많다.[32][14]이 경우 흐름 세포측정법에 의한 면역항진법이나 특수한 얼룩에 의한 면역항진법 등의 다른 기법을 사용하여 세포를 확실하게 식별할 수 있다.[33]
자동 미분
대부분의 혈액학 분석기기는 5부 차이의 중성미자, 림프구, 단세포자, 어시노필, 기저포필을 제공한다.일부 기구는 미성숙 과립구와 핵화된 적혈구를 셀 수도 있다.[34]혈액학 분석기는 임피던스, 빛 산란 파라미터, 얼룩 반응 등 백혈구의 다양한 특성을 측정한다.이 데이터는 산점그램에 분석 및 표시되며 백혈구 유형에 해당하는 뚜렷한 군집을 형성한다.[35]분석기는 수동 미분에서 계산된 것보다 더 많은 셀을 계수하여 정밀도를 향상시킨다.[27]분석기가 식별할 수 없는 비정상적인 특징이나 세포 집단이 존재하는 경우 계측기는 수동 혈액 얼룩 검토를 위해 결과에 플래그를 표시할 수 있다.[34][35]
절차
혈액학 분석기자들이 세포를 식별하기 위해 사용하는 일반적인 기법으로는 빛 산란, 쿨터 계수, 사이토케미컬 얼룩기법 등이 있다.일부 분석기자는 또한 세포 식별을 위해 무선주파수 분석과 단핵항체 태깅을 사용한다.[27][36]미분해석기기에 사용되는 스테인닝 기법에는 미엘로이드 계통의 세포에서 발견되는 [31]효소인 미엘로페록시디아제의 얼룩과 미성숙 세포에서 더 높은 농도에서 발견되는 핵산 등이 있다.[37][38]
소량의 혈액(낮은 150마이크로리터)을 분석기로 흡인하여 시약을 적혈구에 바르고 백혈구를 보존한다.샘플은 희석되어 플로우 셀로 전달되는데, 유체역학적 포커스를 사용하여 단일 셀의 성질을 정확하게 분석하기 위해 분리한다.크기, 복잡성, 얼룩진 반응과 같은 다양한 세포 매개변수를 측정하고 분석하여 세포 집단을 식별한다.바소필은 다른 백혈구의 세포질을 침윤하지만 바소필은 그대로 두는 시약을 사용하여 정량화하는 경우가 많다.[31]비정상적인 결과가[1] 있거나 비정상적인 세포를 포함하고 있는 것으로 의심되는 검체는 분석기에 의해 수동 혈액 얼룩 검사를 위해 플래그 지정된다.[35]
자동화 분석기의 결과가 올바른지 확인하기 위해 품질 관리 샘플을 하루에 한 번 이상 실행한다.이러한 샘플은 계기 제조업체가 가장 자주 제공하는 알려진 결과를 가진 샘플이다.실험실은 계측기가 올바르게 작동하는지 확인하기 위해 알려진 값과 차등 결과를 비교한다.환자 검체의 평균 결과를 일정한 간격으로 측정하는 이동 평균 측정도 사용할 수 있다.시간이 지남에 따라 환자 모집단의 특성이 거의 동일하게 유지된다고 가정하면 평균은 일정하게 유지되어야 한다.평균값의 큰 변화는 계측기 문제를 나타낼 수 있다.[39][40]
제한 사항
미성숙하거나 비정상적인 백혈구가 존재할 경우 자동화된 미분 결과가 부정확할 수 있으므로 수동 혈액 얼룩 검토가 필요하다.전체적으로 CBC 검체의 10~25%가 분석기의 수동 검토를 위해 플래그 지정된다.[41]대부분의 비정상적인 샘플은 자동으로 플래그 지정되지만 일부는 누락될 수 있다.[42] 반대로 분석기는 비정상적인 셀이 없을 때 거짓 양성 플래그를 생성할 수 있다.[41]혈액학 실험실은 분석기 플래그의 유무에 관계 없이 차등 또는 CBC 결과가 특정 수치 임계값을 벗어날 경우 얼룩 검토를 요구함으로써 이러한 문제를 보상한다.[1]분석기 플래깅의 민감도와 특수성은 분석기 플래그를 수동 차동 결과와 비교하여 결정할 수 있다.[40]
자동화된 바소필 카운트는 믿을 수 없다고 악명 높으며,[11][31] 종종 바소필리아 카운트를 과소평가하고 비정상적인 세포의 존재에서 거짓으로 상승된 결과를 만들어 낸다.[43]따라서 수동 미분은 이러한 셀에 대한 기준 방법으로 간주된다.[11][44]
분석가들은 핵화된 적혈구, 거대하고 뭉친 혈소판, 그리고 비정상적인 헤모글로빈을 함유한 적혈구( 낫세포 질환의 헤모글로빈 S 등)를 백혈구로 계산하여 잘못된 미분 결과를 초래할 수 있다.노화된 시료에 대한 자동화된 차등계수는 세포 변성으로 인해 부정확할 수 있다.[45]
세포유형 및 결과해석
중성미자 수는 일반적으로 신생아와 임산부가 다른 그룹에 비해 높다.[48]이러한 조건들을 벗어나면 증가된 중성미자 수(중성체수)는 박테리아 감염, 염증, 다양한 형태의 생리학적 스트레스와 관련이 있다.[49]중성미자 수치는 일부 감염과 염증 상태에 반응하여 극도로 높을 수 있는데, 백혈구 수치가 높으면 백혈구 수치가 백혈병을 모방하기 때문에 백혈구 반응이라고 불린다.[50]중성미자는 골수성 장애에서도 발생할 수 있다.[49]
중성미자 수가 적다는 뜻인 중성미자는 약물치료(특히 화학요법)[51]에 대한 반응으로 발생하거나 결핵이나 그램-네그로피스와 같은 특정 감염에서 발생할 수 있다.중성미자는 백혈병, 골수이식성 증후군 등 많은 혈액학적 장애와 다양한 자가면역 및 선천성 질환에서도 발생한다.[52]기준 간격 아래의 중성미자 카운트는 특정 인종의 개인에서 정상일 수 있다. 이를 양성 민족 중성미자라고 한다.[53][54]매우 낮은 중성미자 수치는 면역억제와 관련이 있다.[55]
중성미자는 감염이나 염증에 자극을 받으면 세포질 내에 독성 과립, 독성 퇴색, 뒤흘레와 같은 비정상적인 특징이 생길 수 있다.이러한 특징들은 사이토카인 방출로 인해 발생하는 것으로서 총체적으로 독성 변화라고 알려져 있다.[56][13]
- 림프구
- 성인에게서 두 번째로 흔한 백혈구 타입인 림프구는 전형적으로 둥글고 어두운 핵과 옅은 푸른색의 세포질의 얇은 띠를 가진 작은 세포들이다.어떤 림프구는 더 크고 몇 개의 푸른 과립을 포함하고 있다.[57]
림프구 수 증가(림프포시증)는 바이러스[58] 감염에 의해 발생할 수 있으며, 비장 절제 수술 후에도 발생할 수 있다.아이들은 어른들보다 림프구 수치가 더 높다.[59]만성 림프구 백혈병은 림프구 수치가 증가하고 림프구 형태학이 비정상적인 림프구 형태학으로 나타나는데, 림프구는 극도로 조밀하고 뭉친 핵을[60] 가지고 있으며 일부 세포는 혈액 얼룩에 얼룩진 것처럼 보인다.[61]
낮은 림프구 수치(림프포니아)는 HIV/AIDS, 인플루엔자, 바이러스성 간염과 같은 감염뿐만 아니라 단백질 에너지 영양실조,[62] 급성 질환, 약물 반응에서도 나타날 수 있다.[59]
바이러스성 감염(특히 전염성 단핵증)에 대응하여 림프구는 크기가 크게 증가하여 비정상적으로 생긴 핵과 다량의 짙은 청색 세포질이 발생할 수 있다.그러한 세포는 반응성 림프구[63] 또는 비정형 림프구라고 하며, 존재하는 경우 수동 미분류에 있는 정상 림프구와 별도로 주석되거나 계수된다.[14]
- 단모세포
- 단세포는 핵이 구부러지거나 접힌 큰 세포와 잘게 과립된 회색-푸른 색의 세포질을 가진 세포로, 종종 빈혈이 포함되어 있다.단세포는 중성미자와 림프구에 이어 세 번째로 흔한 백혈구다.[64]
만성적인 감염과 염증에서 증가된 단세포수(단세포증)가 나타난다.극히 높은 단모세포 수뿐만 아니라 미성숙한 형태의 단모세포도 만성 골수성 백혈병과 단모세포 유래 급성 백혈병에서 발생한다.[65]화학요법을 받고 있는 개인뿐만 아니라 재생불량성빈혈, 중증 화상, 에이즈 환자에서도 모노사이토페니아 수치가 감소할 수 있다.[66]
상승된 어시노필 수치(eosinophilia)는 알레르기 반응, 기생 감염, 천식과 관련이 있다.[67][68]어시노필 수치는 임신 중이고 생리적 스트레스, 염증 또는 스테로이드나 에피네프린과 같은 특정 약물에 대한 치료에 반응하여 감소할 수 있다.[68]
만성 골수성 백혈병 및 기타 골수성 백혈병에서 다른 백혈구 이상과 함께 기저혈증 및 우조증후군이 발생할 수 있다.[69]또한 과민성 반응과 비장절제술 후 기저세포의 수가 증가하는 것을 볼 수 있다.배란, 스테로이드 치료, 생리학적 스트레스 기간 동안 기저세포 수는 감소할 수 있다.[70]
좌뇌교대(left shift)는 밴드 중성미자나 미성숙 과립구의 증가를 의미하는 것으로 임신 중 정상적인 발견이 될 수도 있지만 감염, 염증 또는 골수 질환을 나타낼 수 있다.[71][72]일부 실험실은 분류가 매우 주관적이고 신뢰할 수 없기 때문에 차등 계수에서 성숙한 중성미자와 밴드를 분리하지 않는다.[14]
- 미성숙 과립구
- 미성숙 과립세포는 미숙한 형태의 중성미자와 다른 과립세포(eosinophils와 basophils)이다.이 분류는 metatyelocity, myelocity, promyelocity로 구성되는데, 이는 수동 미분류에 별도로 열거하거나 자동화된 방법에 의해 미성숙 과립세포(IG)로 함께 보고될 수 있다.[73]미성숙 과립세포는 보통 골수에서 발견되지만 말초혈액에서는 발견되지 않는다.[74]
혈액에 상당한 양이 있을 때 미성숙 과립세포는 골수에 영향을 미치는 골수성 질환,[11] 백혈병 및 기타 질환뿐만 아니라 감염과 염증을 나타낼 수 있다.[74]IG는 스테로이드 사용과 임신에서도 증가할 수 있다.[11]만성 골수성 백혈병은 말초혈액에 미성숙 과립구 수가 많은 경우가 많다.[75]faggot 세포라고 불리는 여러 개의 아우어 로드를 가진 비정상적인 프로밀로세포는 급성 프로밀로피성 백혈병에서 발생한다.[76]
- 블라스트 셀
- 송풍세포는 골수에서 보통 발견되는 매우 미성숙한 세포로, 혈액으로 배출되기 전에 성숙한 세포(혈액세포)로 발달한다.그것들은 큰 전체 크기, 진한 청색 세포질, 미세한 염색질과 두드러진 핵이 있는 큰 핵으로 식별할 수 있다.[10]
혈액 얼룩에서 볼 때, 폭발 세포는 비정상적인 발견이며 급성 백혈병이나 다른 심각한 혈액 장애를 나타낼 수 있다.드물게 좌교대 현상이 심한 경우 볼 수 있다.송풍 세포 안에 아우어 로드가 있다는 것은 그들이 골수성 백혈병 치료에 중요한 영향을 미치는 근원이라는 것을 나타낸다.[10][77]다른 형태학적 특징들은 폭발 세포의 혈통에 대한 정보를 제공할 수 있다. 예를 들어 골수성형은 뚜렷한 핵열을 가진 큰 경향이 있는 반면, 림프성형은 더 밀도가 높은 염색체 패턴으로 더 작을 수 있다.그러나 이러한 특징들은 진단이 아니며, 일반적으로 혈통을 확인하기 위해 흐름 세포측정법이나 특수한 얼룩이 사용된다.[78]
- 기타세포
- 다양한 다른 비정상적인 세포들이 특정 조건에서 혈액 속에 존재할 수 있다.예를 들어 림프종의 경우 수동미분에서 림프종 세포가 발견되기도 하고,[79] 마스트 세포 백혈병에서는 일반적으로 조직에 국한된 마스트 세포가 혈액 속에서 순환하기도 한다.[80]말초혈액에 종양세포를 보이는 암세포라는 매우 드문 현상이 있다.[81]
역사
자동화된 세포 카운터가 도입되기 전에, 세포 카운트는 수동으로 수행되었다; 백혈구와 적혈구, 혈소판은 현미경을 사용하여 계수되었다.[82]혈액 세포에 대한 현미경 관찰을 최초로 발표한 사람은 안토니 판 루웬후크(Antonie van Leeuwenhoek)로,[83] 런던 왕립 협회에 보낸 1674년 편지에서 적혈구의 출현에 대해 보고했다.[84] 얀 수영머담(Jan Swinmerdam)은 몇 년 전에 적혈구를 설명했지만, 그 당시에는 그의 연구 결과를 발표하지 않았다.18세기와 19세기에 걸쳐 무채색 렌즈와 같은 현미경 기술의 향상은 백혈구와 혈소판을 무균 샘플로 셀 수 있게 했다.1870년대에 폴 에를리치는 다섯 가지 백혈구 유형을 구별할 수 있는 얼룩 기술을 개발했다.에를리히의 얼룩은 산성염료와 염료의 조합을 사용하여 백혈구와 적혈구를 동시에 얼룩지게 했다.[85]드미트리 레오니도비치 로마노프스키는 1890년대에 에오신과 노화 메틸렌 블루를 혼합하여 이 기법을 개선하였는데, 이 기법은 두 가지 얼룩을 단독으로 사용했을 때는 존재하지 않는 광범위한 색조를 생성하였다.이것은 로마노프스키 효과라고 불렸으며, 로마노프스키 얼룩의 기초가 되었는데, 이 기술은 여전히 수동 미분을 위해 피를 얼룩지게 하는 데 사용된다.[86]
20세기 초까지, 백혈구 차이는 미국에서 흔한 관습이 되었지만, 결과를 해석하는 데 어려움이 이 테스트의 효용성에 의문을 던졌다.[87]1906년 찰스 랭던 깁슨은 [88]깁슨 차트를 도입했는데, 이 차트는 백혈구 총수를 중성미자수와 비교하여 '피로겐'과 '비피로겐' 상태를 구분하고 감염의 심각성을 예측하기 위해 도입되었다.비슷한 시기에 요제프 아르네스는 중성미자를 핵로브의 수("로베 지수" 또는 아네스 카운트)에 따라 분류하는 시스템을 제안하고 중성미자에 대한 일련의 기준 범위를 설정했다.에르네스의 중성미 분절 분석은 나중에 임상적 의미가 제한적인 것으로 밝혀졌으나 비타민 B12와 엽산 결핍을 가진 초절연 중성미자의 연관성은 여전히 인정되고 있다.[89][90][91]빅토르 실링은 1912년 중성미자의 다른 분류를 제안하여, 이들을 "골격포, 주겐드리히, 찌르케르니게, 세그먼트케르니게" - 즉 골모세포, "청소년" (메타밀세포), 밴드 중성미자('stabs') 및 성숙하고 완전하게 분할된 중성미자 - 그리고 그 임상적 중요성에 대해 언급했다.백혈구 수 및 독성 변화 유무와 관련하여 중성미자 좌변위실링의 모노그래프인 Das Blutbild und Seine Klinische Verwertung(혈액사진과 그 임상적 중요성)은 1926년에 영어로 번역되었고, 그의 중성미자 분류 시스템은 미국의 실험실에서 빠르게 수용을 발견하였다.[92][93]
최초의 자동화된 혈액학 분석기 콜터 카운터는 1950년대 초에 월리스 H. 콜터에 의해 발명되었다.[94][95]분석기는 전류를 운반하는 유체에 셀이 매달려 개구부를 통과할 때 전기 전도도가 떨어져 부피에 비례하는 전류 감소를 유발한다는 쿨터 원리를 연구했다.이러한 감소의 수와 크기는 혈구를 세고 그 크기를 계산하는 데 사용될 수 있다.콜터 카운터는 처음에는 적혈구 수를 세도록 설계되었지만, 백혈구 계수에도 효과가 있다는 것이 증명되었다.[95]
기본 세포 계산이 자동화된 후에도 백혈구 차이는 과제로 남았다.차등 계수 자동화에 대한 연구는 1970년대에 시작되었고 디지털 이미지 처리와 흐름 사이토메트리라는 두 가지 주요 접근법을 취하였다.1950년대와 60년대에 개발된 기술을 사용하여 Pap smear의 판독을 자동화함으로써, 이미지 처리 분석기의 여러 모델이 생산되었다.[96]이 기구들은 세포핵을 찾기 위해 얼룩진 혈액을 스캔한 다음, 밀도측정법을 통해 분석하기 위해 세포의 고해상도 스냅숏을 찍을 것이다.[97]그것들은 값비싸고 느리고 실험실에서 작업량을 줄이는 데 거의 도움이 되지 않았다. 왜냐하면 그들은 여전히 혈흔을 준비하고 얼룩을 지워야 하기 때문이다.[98][99] 그래서 흐름 세포측정기 기반 시스템이 더 인기를 끌게 되었고 1990년경에는 미국이나 서유럽에서 상업적으로 사용할 수 있는 디지털 이미지 분석기가 없었다.[100]이러한 기법들은 2000년대에 인공 신경망을 이용한 보다 진보된 영상 분석 플랫폼이 도입되면서 부활을 누렸다.[25][101][102]
초기 흐름 세포측정기기는 특정 파장의 세포에 빛의 빔을 쏘고 그 결과 흡광도, 형광도 또는 빛 산란도를 측정하여 세포의 특징에 대한 정보를 수집하고 DNA와 같은 세포 내용을 정량화할 수 있게 했다.[103]그러한 도구 중 하나인 Louis Kamentsky가 1965년에 자궁경부 세포학을 자동화하기 위해 개발한 Rapid Cell Spectrophotometer는 세포 화학적 얼룩 기술을 사용하여 혈구 산란을 발생시킬 수 있었다.Rapid Cell Spectrophotometer의 Staining 시스템 개발을 도왔던 Leonard Ornstein과 그의 동료들은 후에 최초의 상업적 흐름 세포 세포 차등 분석기인 Hemalog D를 만들었다.[104][105]1974년에 도입된 이 분석기는 보통 비정형 림프구나 발파세포로 구성된 분류인 "큰 정체불명의 세포" 외에 5가지 정상 백혈구 유형을 식별하기 위해 빛 산란, 흡광도, 세포 얼룩을 사용했다.[106][107]Hemalog D는 한 번의 실행으로 10,000개의 셀을 셀 수 있으며, 이는 수동 차이에 비해 현저한 개선이다.[105][108]1977년까지 "최소한 200"의 자동화된 차동 분석기가 전세계에서 사용되고 있는 것으로 추정되었다.[109]1981년 테크니콘은 헤말로그 D를 헤말로그-8 분석기와 결합하여 최초의 완전한 혈액수와 미분 분석기인 테크니콘 H6000을 생산하였다.이 분석기는 조작이 노동집약적이어서 혈액학 실험실에서 인기가 없었지만, 1980년대 후반부터 1990년대 초반까지 유사한 시스템이 시스멕스, 애보트, 로슈, 벡만 쿨터 등 다른 제조사에 의해 널리 생산되었다.[110]
참고 항목
참조
- ^ a b c d e f Gulati, Gene; Song, Jinming; Dulau Florea, Alina; Gong, Jerald (2013). "Purpose and Criteria for Blood Smear Scan, Blood Smear Examination, and Blood Smear Review". Annals of Laboratory Medicine. 33 (1): 1–7. doi:10.3343/alm.2013.33.1.1. ISSN 2234-3806. PMC 3535191. PMID 23301216.
- ^ Cornell University College of Veterinary Medicine. "Leukogram". eClinpath. Retrieved 9 August 2019.
- ^ Lutinger, Irina (2002). "Getting the most from your laboratory information system in the hematology laboratory". Accreditation and Quality Assurance. 7 (11): 494–497. doi:10.1007/s00769-002-0539-y. ISSN 0949-1775. S2CID 110787482.
- ^ Keohane, E et al. (2015).앞물.
- ^ "Blood Differential: MedlinePlus Lab Test Information". MedlinePlus. Archived from the original on 13 August 2019. Retrieved 12 August 2019.
- ^ a b American Association for Clinical Chemistry (1 May 2019). "WBC Differential". Lab Tests Online. Archived from the original on 14 April 2019. Retrieved 8 July 2019.
- ^ Kotke-Marchant, K; Davis, B(2012).페이지 33.
- ^ a b 터건, ML (2016년)303 페이지
- ^ a b Barnes, P. W.; Mcfadden, S. L.; Machin, S. J.; Simson, E. (2005). "The International Consensus Group for Hematology Review: Suggested Criteria for Action Following Automated CBC and WBC Differential Analysis". Laboratory Hematology. 11 (2): 83–90. doi:10.1532/LH96.05019. ISSN 1080-2924. PMID 16024331.
- ^ a b c 도노프리오, G 외 (2014). 페이지 289.
- ^ a b c d e Chabot-Richards, Devon S.; George, Tracy I. (2015). "White Blood Cell Counts". Clinics in Laboratory Medicine. 35 (1): 11–24. doi:10.1016/j.cll.2014.10.007. ISSN 0272-2712. PMID 25676369.
- ^ 베인, B 외 (2012)95-7페이지
- ^ a b 씨슬라, B(2018). 페이지 153.
- ^ a b c d Palmer, L.; Briggs, C.; McFadden, S.; Zini, G.; Burthem, J.; Rozenberg, G.; Proytcheva, M.; Machin, S. J. (2015). "ICSH recommendations for the standardization of nomenclature and grading of peripheral blood cell morphological features". International Journal of Laboratory Hematology. 37 (3): 287–303. doi:10.1111/ijlh.12327. ISSN 1751-5521. PMID 25728865. S2CID 4649418.
- ^ 베인, B 외 (2012)2-4 페이지
- ^ Smock, Greer의 KJ. 1장 JP 외 에드(2018), sec. "사양 컬렉션".
- ^ Keohane, E 외 (2015). 페이지 118.
- ^ 와레코이스, R; 로빈슨, R. (2013). 페이지 116.
- ^ 터건, ML (2016)346-8페이지
- ^ 왕, S; 하세르지안, R. (2018)페이지 10–1
- ^ 왕, S; 하세르지안, R. (2018). 페이지 10.
- ^ 터건, ML (2016)페이지 329.
- ^ 터건, ML (2016)페이지 318.
- ^ 베인, B 외 (2012)44-5 페이지
- ^ a b Kratz, Alexander; Lee, Szu‐hee; Zini, Gina; Riedl, Jurgen A.; Hur, Mina; Machin, Sam (2019). "Digital morphology analyzers in hematology: ICSH review and recommendations". International Journal of Laboratory Hematology. 41 (4): 437–447. doi:10.1111/ijlh.13042. ISSN 1751-5521. PMID 31046197.
- ^ Da Costa, Lydie (2015). "Digital Image Analysis of Blood Cells". Clinics in Laboratory Medicine. 35 (1): 105–122. doi:10.1016/j.cll.2014.10.005. ISSN 0272-2712. PMID 25676375.
- ^ a b c d Smock, Greer, JP 등 (2018), sec. "Cell counts"
- ^ Ruemke, C. L. (1978). "The statistically expected variability in differential leukocyte counting" (PDF). In Koepke, J. A. (ed.). Differential leukocyte counting. College of American Pathologists Conference / Aspen 1997. Skokie, Illinois: College of American Pathologists.
- ^ 맥클라치, K(2002년).809 페이지
- ^ 베인, B 외 (2012)30–1페이지
- ^ a b c d e Smock, KJ. Greer, JP et al. ed.(2018). sec. "유전세포 미분"
- ^ 해크닝, D(2009)페이지 336.
- ^ 왕, S; 하세르지안, R. (2018)페이지 9.
- ^ a b 해크닝, D(2009)795 페이지
- ^ a b c 베인, B 외 (2012)페이지 43.
- ^ 해크닝, D(2009)795-803 페이지
- ^ 나이엠, F 등(2009).페이지 210.
- ^ Arneth, Borros M.; Menschikowki, Mario (2015). "Technology and New Fluorescence Flow Cytometry Parameters in Hematological Analyzers". Journal of Clinical Laboratory Analysis. 29 (3): 175–183. doi:10.1002/jcla.21747. ISSN 0887-8013. PMC 6807107. PMID 24797912.
- ^ Kotke-Marchant, K; Davis, B(2012).697-8페이지
- ^ a b Vis, JY; Huisman, A (2016). "Verification and quality control of routine hematology analyzers". International Journal of Laboratory Hematology. 38: 100–9. doi:10.1111/ijlh.12503. ISSN 1751-5521. PMID 27161194.
- ^ a b Smock, Greer, JP 등 (2018), sec. "자동 혈액학으로 인한 장점과 오류 발생원"
- ^ 베인, B 외 (2012)43-4 페이지
- ^ Buttarello, Mauro; Plebani, Mario (2008). "Automated Blood Cell Counts". American Journal of Clinical Pathology. 130 (1): 104–116. doi:10.1309/EK3C7CTDKNVPXVTN. ISSN 0002-9173. PMID 18550479.
- ^ 깁스, B(2014). 페이지 88.
- ^ Keohane, E et al. (2015).226 페이지
- ^ 해크닝, D(2009)306 페이지
- ^ 베인, B 외 (2012)88-93 페이지
- ^ 포르위트, A 외(2011. 페이지 252).
- ^ a b 터건, ML (2016)306 페이지
- ^ 포르위트, A 외(2011). 페이지 253.
- ^ 호프만, R 외 (2013). 페이지 644.
- ^ 포르위트, A 외(2011년).247-52 페이지
- ^ 포르위트, A 외(2011년).8페이지
- ^ Atallah-Yunes, Suheil Albert; Ready, Audrey; Newburger, Peter E. (2019). "Benign ethnic neutropenia". Blood Reviews. 37: 100586. doi:10.1016/j.blre.2019.06.003. ISSN 0268-960X. PMC 6702066. PMID 31255364.
- ^ 해크닝, D(2009)308-11 페이지
- ^ 혈액학 및 임상 현미경 검사 위원회(2019) 페이지 4.
- ^ 터건, ML (2016)308-9페이지
- ^ 터건, ML (2016년)페이지 309.
- ^ a b Porwit, A 외(2011). 페이지 258–9.
- ^ Oscier, David; Else, Monica; Matutes, Estella; Morilla, Ricardo; Strefford, Jonathan C.; Catovsky, Daniel (2016). "The morphology of CLL revisited: the clinical significance of prolymphocytes and correlations with prognostic/molecular markers in the LRF CLL4 trial". British Journal of Haematology. 174 (5): 767–775. doi:10.1111/bjh.14132. ISSN 0007-1048. PMC 4995732. PMID 27151266.
- ^ Kaseb, Hatem; Taneja, Alankrita; Master, Samip (2019). "Cancer, Chronic Lymphocytic Leukemia (CLL)". StatPearls. Retrieved 24 July 2019.
- ^ Territo, Mary (2018). "Lymphocytopenia". Merck Manuals Professional Edition. Archived from the original on 10 October 2018. Retrieved 22 July 2019.
- ^ 베인, B 외 (2012)95-7페이지
- ^ a b 터건, ML (2016)307 페이지
- ^ 베인, B 외 (2012)페이지 95.
- ^ 포르위트, A 외(2011). 페이지 258.
- ^ 베인, B 외 (2012)페이지 94.
- ^ a b 포르위트, A 외(2011. 페이지 256).
- ^ a b 베인, B 외 (2012)94-5 페이지
- ^ 포르위트, A 외(2011. 페이지 257).
- ^ a b 베인, B 외 (2012)페이지 93.
- ^ 씨슬라, B. (2018년)153-4 페이지
- ^ 베인, B 외 (2012)페이지 44.
- ^ a b Curry, Choladda Vejabhuti; Staros, Eric (14 January 2015). "Differential Blood Count". EMedicine. Archived from the original on 12 July 2019. Retrieved 17 July 2019.
- ^ Emadi, Ashkan; Law, Jennie (2018). "Chronic Myeloid Leukemia (CML)". Merck Manuals Professional Edition. Archived from the original on 18 August 2019. Retrieved 30 August 2019.
- ^ Adams, Julia; Nassiri, Mehdi (2015). "Acute Promyelocytic Leukemia: A Review and Discussion of Variant Translocations". Archives of Pathology & Laboratory Medicine. 139 (10): 1308–1313. doi:10.5858/arpa.2013-0345-RS. ISSN 0003-9985. PMID 26414475.
- ^ 글래시, E.(1998) 페이지 6-7.
- ^ 혈액학 및 임상 현미경 검사 위원회(2019).13-22 페이지
- ^ 글래시, E. (1998년). 228페이지.
- ^ 글래시, E.(1998) 페이지 328.
- ^ 페레이라, 나 외(2011. 페이지 185).
- ^ Keohane, E et al. (2015).1-4 페이지
- ^ Kotke-Marchant, K; Davis, B. (2012). 페이지 1.
- ^ 윈트로브, MM(1985) 페이지 10.
- ^ Kotke-Marchant, K; Davis, B.(2012).3-4 페이지
- ^ Bezrukov, AV (2017). "Romanowsky staining, the Romanowsky effect and thoughts on the question of scientific priority". Biotechnic & Histochemistry. 92 (1): 29–35. doi:10.1080/10520295.2016.1250285. ISSN 1052-0295. PMID 28098484. S2CID 37401579.
- ^ 쿱케, JA(1977). 페이지 2.
- ^ Gibson, CL (1906). "The value of the differential leukocyte count in acute surgical diseases". Annals of Surgery. 43 (4): 485–499. doi:10.1097/00000658-190604000-00001. ISSN 0003-4932. PMC 1426203. PMID 17861781.
- ^ 쿱케, JA(1977). 페이지 2-3.
- ^ Kotke-Marchant, K; Davis, B(2012).593-4 페이지
- ^ Arneth, J (1904). Die neutrophilen weissen Blutkörperchen bei Infektionskrankheiten (in German). Fischer.
- ^ 쿱케, JA(1977). 페이지 3-4.
- ^ Schilling, V (1912). Das Blutbild und seine klinische Verwertung, mit Einschluss der Tropenkrankheiten; kurzgefasste technische, theoretische und praktische Anleitung zur mikroskopischen Blutuntersuchung (in German). Fischer.
- ^ 해크닝, D(2009)794 페이지
- ^ a b Graham, M (2003). "The Coulter principle: foundation of an industry". Journal of the Association for Laboratory Automation. 8 (6): 72–81. doi:10.1016/S1535-5535(03)00023-6. ISSN 1535-5535.
- ^ Groner, W (1995)12-4 페이지
- ^ Lewis, SM (1981). "Automated differential leucocyte counting: Present status and future trends". Blut. 43 (1): 1–6. doi:10.1007/BF00319925. ISSN 0006-5242. PMID 7260399. S2CID 31055044.
- ^ 다 코스타, L (2015). 페이지 5
- ^ Groner, W (1995)12-5 페이지
- ^ Bentley, SA (1990). "Automated differential white cell counts: a critical appraisal". Baillière's Clinical Haematology. 3 (4): 851–69. doi:10.1016/S0950-3536(05)80138-6. ISSN 0950-3536. PMID 2271793.
- ^ Da Costa, L (2015). "Digital image analysis of blood cells". Clinics in Laboratory Medicine. 35 (1): 105–22. doi:10.1016/j.cll.2014.10.005. ISSN 0272-2712. PMID 25676375.
- ^ 맥캔, SR (2016). 193 페이지.
- ^ 멜라메드, M(2001)5-6페이지
- ^ HM(2003)의 샤피로.84-5 페이지
- ^ a b 멜라메드, M. (2001)8페이지
- ^ Picot, Julien; Guerin, Coralie L.; Le Van Kim, Caroline; Boulanger, Chantal M. (2012). "Flow cytometry: retrospective, fundamentals and recent instrumentation". Cytotechnology. 64 (2): 109–130. doi:10.1007/s10616-011-9415-0. ISSN 0920-9069. PMC 3279584. PMID 22271369.
- ^ Mansberg, H. P.; Saunders, Alex M.; Groner, W. (1974). "The Hemalog D White Cell Differential System". Journal of Histochemistry & Cytochemistry. 22 (7): 711–724. doi:10.1177/22.7.711. ISSN 0022-1554. PMID 4137312.
- ^ Pierre, Robert V (2002). "Peripheral blood film review: the demise of the eyecount leukocyte differential". Clinics in Laboratory Medicine. 22 (1): 279–297. doi:10.1016/S0272-2712(03)00075-1. ISSN 0272-2712. PMID 11933579.
- ^ 쿱케, JA(1977년). 96페이지.
- ^ Kotke-Marchant, K; Davis, B(2012).8~9페이지
참고 문헌 목록
- Bain, Barbara; Bates, Imelda; Laffan, Mike (2012). Dacie and Lewis practical haematology. Edinburgh: Elsevier Churchill Livingstone. ISBN 978-0-7020-3407-7. OCLC 780445109.
- Betty Ciesla (27 November 2018). Hematology in Practice. F.A. Davis. ISBN 978-0-8036-6825-6.
- Gibbs, Bernhard (2014). "The absolute basophil count". Basophils and mast cells : methods and protocols. New York, NY: Humana Press. ISBN 978-1-4939-1172-1. OCLC 889943963.
- Eric F. Glassy (1998). Color Atlas of Hematology: An Illustrated Field Guide Based on Proficiency Testing. College of American Pathologists. ISBN 978-0-930304-66-9.
- John P. Greer; Daniel A. Arber; Bertil E. Glader; Alan F. List; Robert M. Means; George M. Rodgers (19 November 2018). Wintrobe's Clinical Hematology (14th ed.). Wolters Kluwer Health. ISBN 978-1-4963-6713-6.
- Denise Harmening (2009). Clinical Hematology and Fundamentals of Hemostasis (5th ed.). F. A. Davis Company. ISBN 978-0-8036-1732-2.
- Hematology and Clinical Microscopy Committee (2019). "Blood cell identification" (PDF). Hematology and Clinical Microscopy Glossary. College of American Pathologists. Archived (PDF) from the original on 28 June 2019. Retrieved 28 June 2019.
- Ronald Hoffman; Edward J. Benz Jr.; Leslie E. Silberstein; Helen Heslop; John Anastasi; Jeffrey Weitz (1 January 2013). Hematology: Basic Principles and Practice. Elsevier Health Sciences. ISBN 978-1-4377-2928-3.
- Elaine Keohane; Larry Smith; Jeanine Walenga (20 February 2015). Rodak's Hematology: Clinical Principles and Applications. Elsevier Health Sciences. ISBN 978-0-323-23906-6.
- Koepke, JA (1977). Differential leukocyte counting. College of American Pathologists. ISBN 0-930304-12-8.
- Kandice Kottke-Marchant; Bruce Davis (6 June 2012). Laboratory Hematology Practice. John Wiley & Sons. ISBN 978-1-4443-9857-1.
- McCann, SR (3 March 2016). A History of Haematology: From Herodotus to HIV. OUP Oxford. ISBN 978-0-19-102713-0.
- Kenneth D. McClatchey (2002). "Chapter 40: Peripheral blood and bone marrow assessment". Clinical Laboratory Medicine (2nd ed.). Lippincott Williams & Wilkins. ISBN 978-0-683-30751-1.
- Melamed, Myron (2001). "Chapter 1 A brief history of flow cytometry and sorting". Methods in Cell Biology. Vol. 63 part A. Elsevier. pp. 3–17. doi:10.1016/S0091-679X(01)63005-X. ISBN 9780125441667. PMID 11060834.
- Faramarz Naeim; P. Nagesh Rao; Wayne W. Grody (5 March 2009). Hematopathology: Morphology, Immunophenotype, Cytogenetics, and Molecular Approaches. Academic Press. ISBN 978-0-08-091948-5.
- Giuseppe d'Onofrio; Gina Zini (21 October 2014). "Acute Myeloid Leukaemia". Morphology of Blood Disorders (2nd ed.). Wiley. p. 289. ISBN 978-1-118-44258-6.
- Shapiro, Howard (2003). Practical Flow Cytometry (4 ed.). John Wiley & Sons. ISBN 978-0-471-43403-0.
- Irma Pereira; Tracy I. George; Daniel A. Arber (7 December 2011). "Chapter 20: Nonhematopoietic tumors in the blood". Atlas of Peripheral Blood: The Primary Diagnostic Tool. Lippincott Williams & Wilkins. ISBN 978-1-4511-6366-7.
- Anna Porwit; Jeffrey McCullough; Wendy N Erber (27 May 2011). Blood and Bone Marrow Pathology. Elsevier Health Sciences. ISBN 978-0-7020-4535-6.
- Robin S. Warekois; Richard Robinson (27 December 2013). Phlebotomy: Worktext and Procedures Manual. Elsevier Health Sciences. ISBN 978-0-323-29284-9.
- Turgeon, ML (2016). Linné & Ringsrud's Clinical Laboratory Science: Concepts, Procedures, and Clinical Applications (7 ed.). Elsevier Mosby. ISBN 978-0-323-22545-8.
- Sa A. Wang; Robert P. Hasserjian (4 June 2018). Diagnosis of Blood and Bone Marrow Disorders. Springer. ISBN 978-3-319-20279-2.
- Wintrobe, MM (1985). Hematology, the Blossoming of a Science: A Story of Inspiration and Effort. Lea & Febiger. ISBN 978-0-8121-0961-0.