모낭수상세포육종
Follicular dendritic cell sarcoma| 모낭수상세포육종 | |
|---|---|
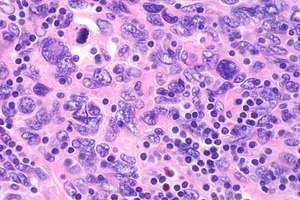 | |
| 난포성 수상 세포 육종을 보여주는 현미경 사진이야암세포는 더 크고 창백한 염색핵을 가지고 있다.더 작은(검정색) 간 림프구(더 진한 파란색)가 일반적이며 진단을 제안합니다.H&E 염색. | |
| 전문 | 종양학 |
모낭수상세포육종(FDCS)은 극히 드문 종양이다.1978년 레너트에 의해 FDC 종양의 존재가 예측된 반면, 그 종양은 몬다 등에 [1][2]의해 특징지어진 1986년까지 자신의 암으로 완전히 인식되지 않았다.연조직 육종의 0.4%에 불과하지만 유의한 재발 및 전이 잠재성을 가지며 중간급 악성 [3]종양으로 간주된다.FDCS를 치료하는데 있어 가장 큰 장애물은 오진이었다.이것은 새롭게 특징지어지는 암으로, Hodgkin 아형과 Non-Hodgkin 아형 모두 림프종과 증상과 마커가 유사하기 때문에 FDCS의 진단이 [4]어려울 수 있다.최근 암 생물학이 발전함에 따라 FDCS를 [citation needed]보다 정확하게 진단하고 치료할 수 있는 더 나은 진단 분석과 화학 치료제가 만들어졌다.
징후 및 증상
모낭수상세포는 림프모낭의 생식중심부에 국재되어 생식중심반응 조절에 불가결한 역할을 하며 B세포에 [5][6]항원을 제시한다.FDCS의 대부분의 경우 림프절에서 발생하지만 약 30%는 척외 부위에서 발생한다.1998년에 그 질병에 대한 가장 큰 연구는 51명의 [7]환자를 대상으로 한 소급 검토였다.이 51명의 환자 중 연령, 성별, 인종, 외모에 관한 결정적인 패턴은 발견되지 않았다.중위 환자 연령은 41세(범위 14-76)였으며, 대부분의 환자가 자궁경부 및 액와 림프절 장애를 보였지만, 17세는 간, 비장, 장, [7]췌장을 포함한 비외측 부위에서 나타났다.이러한 환자 기록의 범위에서는 FDCS와 관련된 명확한 원인은 없습니다.그러나 이전에 EBV(Epstein Bar Virus)에 노출되거나 Castleman 질병 진단이 FDCS 발병 위험을 높일 수 있다는 증거가 일부 있었다. 2000년 의학 문헌에서는 FDC 종양의 약 12%가 EBV와 관련되어 있으며 다른 장기에 차이가 있다고 보고되었지만 EBV의 역할은 여전히 불분명하다.n FDC 종양 병인은 Castleman의 질병과 관련된 모든 사례가 EBV [8][9][10]음성이었기 때문에 EBV는 Castleman의 질병이 FDC 육종으로 전환되는 과정에서 역할을 하지 않는 것으로 보인다.
FDCS의 증상은 다양하며 종양이 발생하는 신체 부위에 따라 크게 달라집니다.가장 흔한 증상은 림프절의 통증 없는 붓기이다.그러나 이 증상만으로는 일반 감기를 포함한 많은 다른 질병과 관련이 있기 때문에 비독점적이다.다른 증상으로는 기침, 인후통, 삼키기 어려움, 체중 감소, 피로 등이 있습니다.머리와 목 부위 이외의 치외 부위에 나타나는 경우 장기 고유의 증상이 [citation needed]관찰됩니다.
진단.
염색
FDC세포의 증식은 모낭과형성증, 모낭림프종, 결절림프구 우성 호지킨병 및 혈관면역아세포 T세포 [11]림프종을 포함한 많은 신형성 질환의 특징이다.1986년 마침내 자신의 질병으로 인정받았음에도 불구하고 FDCS의 진단은 여전히 어렵다.FDC 세포는 크고, 2개의 핵을 포함하고 있으며, 염색에서 구별하기 어려운 림프구와 함께 클러스터를 형성한다.이들 세포는 FDC 마커 CD21, CD35, R4/23, 클러스터인 및 KiM4p를 [11]사용한 면역 유지로 가장 잘 시각화된다. 마커 분석은 또한 세포 유형의 기원에 대한 논쟁을 불러왔다. 이는 백혈구 공통 항원인 CD45와 단구 공통 [7]항원인 CD15를 공존시킨다.염색에 대한 논란과 어려움 때문에 병리학적 진단은 형태학적, 세포 화학적, 전자 현미경 분석도 필요로 한다.[7]
세포 돌연변이
FDCS 종양에서 발견된 세포 이상은 진단 목적으로 이용되었습니다.특징적으로 FDCS는 미르코투브룰로레큘러 구조(MTRS)와 세포 내 클러스터인의 [12][13]증가된 수치를 가지고 있다.MTRS는 세포 분열 중에 유사분열 방추체를 포함한 많은 구조의 미세관 형성에 기여한다.이것은 증식 신호, 성장 활성화, 그리고 반복 [14]불멸을 포함한 암의 많은 특징에 기여합니다.클러스터린은 세포 부스러기를 제거하는 것을 돕고 아포토시스(apoptosis)에 관여하는 헤테로다이머 단백질이다.클러스터인은 FDCS를 구별하기 위해 염색될 수 있으며 세포사멸에 대한 저항성과 성장억제제 [14]회피 등 많은 중요한 암 표식에 관여합니다.
치료
잘라내다
모낭수상세포육종 발견 당시 화학요법과 방사선의 영향에 대한 정보는 존재하지 않았다.의사들이 할 수 있는 최선의 방법은 기존의 화학요법제를 시험하는 것이었다.화학요법의 임상적 유익성에 대한 증거가 없는 상태에서, 첫 번째 환자 중 많은 수가 완전한 절제 및/또는 방사선으로만 치료되었다.그러나 1차 치료로 단독 수술을 받은 환자 31명 중 12명은 [7]재발했다.수술과 방사선 치료를 받은 환자 중 8명 중 2명이 [7]재발했다.더 나은 치료 방법이 필요하다는 것이 분명해졌다.림프종과 매우 유사하기 때문에 의사들은 FDCS 환자에게 일반적인 백혈병과 비호지킨 림프종 화학요법인 [citation needed]CHOP을 사용하기 시작했다.

CHOP 요법은 시클로포스파미드, 독소루비신, 온코빈 및 프레디손(CHOP)으로 구성됩니다.그들은 모두 암세포에서 흔히 볼 수 있는 다른 경로를 이용한다.시클로포스파미드는 세포 성장을 늦추거나 멈추게 한다.성장신호에 자급자족하고 항증신호에 둔감한 암세포를 포함한 빠르게 분열하는 세포를 대상으로 한다.더 중요한 것은 시클로포스파미드의 생물학적 작용이 용량에 [15]의존한다는 것이다.고용량에서 그것은 매우 세포독성이 있다; 그것의 대사물 인광화물은 구아닌의 N7 위치에 알킬기를 첨가하여 성장 정지 및 세포 사멸을 초래한다.대사물은 세포질 알데히드탈수소효소(ALDH)가 낮은 세포에서만 형성되어 골수와 같은 다른 비암세포에서 상대적으로 낮은 화학요법 독성을 일으킨다.그것은 또한 면역 억제제이며 염증 반응을 감소시킨다.저용량에서는 세포독성은 떨어지지만 항혈관신생 특성을 보인다.그 메커니즘은 완전히 이해되지 않았다; 그것은 종양 미세 [16]환경 및 주변에서 생성된 VEGF 성장 인자를 방해한다고 생각된다.
Doxorubicin은 DNA에서 인터컬레이션하여 세포의 성장과 복제를 방해합니다.이것은 토포이소머라아제 II가 DNA 가닥을 이완시키는 것을 막고 전사를 억제한다.또한 최근 연구에 따르면 독소르비신은 PI3K/AKT/mTOR [17]경로에 관여할 수 있다.암의 중요한 특징인 Akt는 아포토시스를 억제함으로써 세포 생존 경로의 일부이다.또한 Akt가 혈관신생과 혈관 [18]성숙에 관여한다는 증거가 있다.PI3K/AKT/mTOR 경로의 활성화는 세포 [18]내 VEGF 생성을 매개한다.그러므로, 독소루비신은 암 치료에서 두 가지 역할을 한다: 그것은 세포 생존을 억제하고 혈관신생을 [citation needed]감소시킨다.
흔히 빈크리스틴으로 알려진 온코빈은 유사분열 억제제이다.그것은 튜브린 이합체에 결합되어 세포골격과 유사분열방추와 같은 미세관 구조의 집약을 억제합니다.이 약은 아직 암세포를 엄밀하게 겨냥할 수는 없지만, 암세포는 온코빈의 세포독성에 더 민감하게 만드는 미세관의 평균 회전율이 더 높다.프레드니손은 CHOP 병용요법의 마지막 약물로 면역억제제 [citation needed]역할을 하는 코르티코스테로이드입니다.
CHOP으로 치료한 FDCS 환자에서 일부 결과가 나타났지만 일관성이 전혀 없었다.다른 암을 위해 고안된 화학요법 요법을 사용하는 것은 질병을 치료하는 오래된 "추측하고 확인하는" 방법이다.2008년 FDCS에 대한 가장 큰 리뷰는 98명의 환자에 대한 소급 분석으로 발표되었으며, 저자는 보조 치료 없이 수술을 FDCS [19]치료의 표준으로 권장했다.수술로 치료받은 환자만 해도 재발률이 40%에 달했고 수술 후 보조요법으로 치료받은 환자도 재발률이 [19]크게 다르지 않았다.방사선 및/또는 화학요법은 환자의 무병 생존을 개선하는 데 유의미한 효과가 없었다.그러나 암의 특징에 대한 이해가 발전함에 따라 FDCS를 대상으로 하고 치료하기 위한 새로운 접근법이 [citation needed]개발되고 있다.
(PEG) 리포좀독소르비신
그러한 발전 중 하나는 독소르비신의 전달이다.독소르비신은 아포토시스의 효과적인 유도제이지만 빠르게 체외로 걸러진다.PEG리포좀에 독소르비신을 장전함으로써 순환시간과 종양에 대한 국재성을 크게 [3]높인다.암종양은 특징적으로 광범위한 혈관신생과 누출성 혈관구조를 가지고 있으며, 이는 PEG-리포솜이 종양에 자연적으로 축적되는 원인이 된다.이것은 또한 환자들이 점점 더 적은 양의 약을 받고 부작용을 덜 경험할 수 있게 해준다.
택소테레 및 보석시타빈

새로운 사례들은 또한 택소테어와 젬시타빈에 의해 치료되기 시작하고 있다.Taxotere는 CHOP에 사용되는 Oncovin과 유사하며, 미세관의 베타 튜브린 정지 형성을 불가역적으로 결합시킨다.Taxotere는 부가적인 이점을 가지고 있다; 그것은 또한 항아포토시스 [20]경로를 멈추기 위해 BCL-2를 인산화한다.Taxotere가 통합된 암 경로에 미치는 이중 효과는 Oncovin보다 더 강력한 약으로 만든다.젬시타벤은 뉴클레오시드 유사체이며 복제 중에 DNA에 통합되면 아포토시스로 이어진다; 2' 탄소 원자의 불소는 다른 뉴클레오시드의 [21]부착을 막는다.그러나 이 복합요법의 가장 중요한 부분은 약물 간의 상승효과이다.연구자들이 그 메커니즘에 대해 완전히 확신하지는 못하지만,[22][23] 함께 사용할 때 택소테어와 젬시타빈의 상승 효과가 있다는 증거가 있다.이를 통해 각 단일 에이전트의 투여량을 줄이고 아포토시스 [citation needed]응답을 높일 수 있습니다.
조사.
FDCS에 대한 이해와 치료의 모든 발전은 다른 암의 발전에서 비롯된다.연구에 대한 자금을 마련하는 것은 어렵고 희귀 암인 FDCS는 금전적인 우선권을 받지 못한다.CHOP, Gemcitabine, Taxotere는 모두 다른 암을 위해 개발되었지만, 상호 돌연변이 경로를 통해 FDCS에서 사용할 수 있다.암의 특징은 의사들이 새롭고 더 나은 치료 [14]계획을 개발하기 위해 이용될 수 있는 겉으로 보기에 매우 다른 종류의 암 사이에 생물학적 공통점이 있다는 것을 깨닫는 데 도움을 주었다.
레퍼런스
- ^ Lennert, Karl (1978). Malignant lymphomas other than Hodgkin's disease, histology, cytology, ultrastructure, immunology. Berlin: Springer-Verlag. pp. 59–64. ISBN 978-0-387-08020-8.
- ^ Monda, Lauren; Warnke, Roger; Rosai, Juan (1986). "A primary lymph node malignancy with features suggestive of dendritic reticulum cell differentiation. A report of 4 cases". The American Journal of Pathology. 122 (3): 562–72. PMC 1888214. PMID 2420185.
- ^ a b Sharpe, Miriam; Easthope, Stephanie E.; Keating, Gillian M.; Lamb, Harriet M. (2002). "Polyethylene glycol-liposomal doxorubicin: a review of its use in the management of solid and haematological malignancies and AIDS-related Kaposi's sarcoma". Drugs. 62 (14): 2089–126. doi:10.2165/00003495-200262140-00012. PMID 12269857. S2CID 46974328.
- ^ Fonseca, Rafael; Tefferi, Ayalew; Strickler, John G. (1997). "Follicular dendritic cell sarcoma mimicking diffuse large cell lymphoma: A case report". American Journal of Hematology. 55 (3): 148–55. doi:10.1002/(SICI)1096-8652(199707)55:3<148::AID-AJH6>3.0.CO;2-S. PMID 9256295.
- ^ Kosco, Marie H.; Gray, David (1992). "Signals Involved in Germinal Center Reactions". Immunological Reviews. 126: 63–76. doi:10.1111/j.1600-065X.1992.tb00631.x. PMID 1597321. S2CID 6172404.
- ^ Tew, John G.; Kosco, Marie H.; Burton, Gregory F.; Szakal, Andras K. (1990). "Follicular Dendritic Cells as Accessory Cells". Immunological Reviews. 117: 185–211. doi:10.1111/j.1600-065X.1990.tb00573.x. PMID 2258191. S2CID 5556197.
- ^ a b c d e f Fonseca, R.; Yamakawa, M.; Nakamura, S.; Van Heerde, P.; Miettinen, M.; Shek, T.W. H.; Jensen, O. Myhre; Rousselet, M. C.; Tefferi, A. (1998). "Follicular dendritic cell sarcoma and interdigitating reticulum cell sarcoma: A review". American Journal of Hematology. 59 (2): 161–7. doi:10.1002/(SICI)1096-8652(199810)59:2<161::AID-AJH10>3.0.CO;2-C. PMID 9766802.
- ^ Biddle, David A.; Ro, Jae Y.; Yoon, Gil S.; Yong, Yap-Whang H.; Ayala, Alberto G.; Ordonez, Nelson G.; Ro, J (2002). "Extranodal Follicular Dendritic Cell Sarcoma of the Head and Neck Region: Three New Cases, with a Review of the Literature". Modern Pathology. 15 (1): 50–8. doi:10.1038/modpathol.3880489. PMID 11796841.
- ^ Chen Tse-Ching; Kuo Tseng-tong; Ng Kwai-Fong (2001). "Follicular Dendritic Cell Tumor of the Liver: A Clinicopathologic and Epstein-Barr Virus Study of Two Cases". Modern Pathology. 14 (4): 354–360. doi:10.1038/modpathol.3880315. PMID 11301353.
- ^ Horiguchi H.; Matsui-Horiguchi M.; Sakata H.; Ichinose M.; Yamamoto T.; Fujiwara M.; Ohse H. (February 2004). "Inflammatory pseudotumor-like follicular dendritic cell tumor of the spleen". Pathology International. 54 (2): 124–131. doi:10.1111/j.1440-1827.2004.01589.x. PMID 14720144. S2CID 8651824.
- ^ a b Chan, John K. C.; Fletcher, Christopher D. M.; Nayler, Simon J.; Cooper, Kum (1997). "Follicular dendritic cell sarcoma". Cancer. 79 (2): 294–313. doi:10.1002/(SICI)1097-0142(19970115)79:2<294::AID-CNCR13>3.0.CO;2-W. PMID 9010103.
- ^ Ono, Yuri; Terashima, Kazuo; Liu, Aimin; Yokoyama, Munehiro; Yokoshima, Kazuhiro; Mizukami, Miki; Watanabe, Ken; Mochimaru, Yoko; et al. (2009). "Follicular dendritic cell sarcoma with microtubuloreticular structure and virus-like particle productionin vitro". Pathology International. 59 (5): 332–44. doi:10.1111/j.1440-1827.2009.02375.x. PMID 19432677. S2CID 41080132.
- ^ Grogg, Karen L; Macon, William R; Kurtin, Paul J; Nascimento, Antonio G (2004). "A survey of clusterin and fascin expression in sarcomas and spindle cell neoplasms: strong clusterin immunostaining is highly specific for follicular dendritic cell tumor". Modern Pathology. 18 (2): 260–6. doi:10.1038/modpathol.3800294. PMID 15467709.
- ^ a b c Hanahan, Douglas; Weinberg, Robert A. (2011). "Hallmarks of Cancer: The Next Generation". Cell. 144 (5): 646–74. doi:10.1016/j.cell.2011.02.013. PMID 21376230.
- ^ Nicolini, A; Mancini, P; Ferrari, P; Anselmi, L; Tartarelli, G; Bonazzi, V; Carpi, A; Giardino, R (2004). "Oral low-dose cyclophosphamide in metastatic hormone refractory prostate cancer (MHRPC)". Biomedicine & Pharmacotherapy. 58 (8): 447–50. doi:10.1016/j.biopha.2004.08.006. PMID 15464874.
- ^ Nelius, Thomas; Klatte, Tobias; Riese, Werner; Haynes, Allan; Filleur, Stephanie (2009). "Clinical outcome of patients with docetaxel-resistant hormone-refractory prostate cancer treated with second-line cyclophosphamide-based metronomic chemotherapy". Medical Oncology. 27 (2): 363–7. doi:10.1007/s12032-009-9218-8. PMID 19365737. S2CID 27539332.
- ^ Wendel, Hans-Guido; Stanchina, Elisa de; Fridman, Jordan S.; Malina, Abba; Ray, Sagarika; Kogan, Scott; Cordon-Cardo, Carlos; Pelletier, Jerry; Lowe, Scott W. (2004). "Survival signalling by Akt and eIF4E in oncogenesis and cancer therapy". Nature. 428 (6980): 332–7. Bibcode:2004Natur.428..332W. doi:10.1038/nature02369. PMID 15029198. S2CID 4426215.
- ^ a b Chen, Juhua; Somanath, Payaningal R; Razorenova, Olga; Chen, William S; Hay, Nissim; Bornstein, Paul; Byzova, Tatiana V (2005). "Akt1 regulates pathological angiogenesis, vascular maturation and permeability in vivo". Nature Medicine. 11 (11): 1188–96. doi:10.1038/nm1307. PMC 2277080. PMID 16227992.
- ^ a b Depas, T; Spitaleri, G; Pruneri, G; Curigliano, G; Noberasco, C; Luini, A; Andreoni, B; Testori, A; Debraud, F (2008). "Dendritic cell sarcoma: An analytic overview of the literature and presentation of original five cases". Critical Reviews in Oncology/Hematology. 65 (1): 1–7. doi:10.1016/j.critrevonc.2007.06.003. PMID 17658269.
- ^ Pathan, N; Aime-Sempe, C; Kitada, S; Basu, A; Haldar, S; Reed, JC (2001). "Microtubule-Targeting Drugs Induce Bcl-2 Phosphorylation and Association with Pin1". Neoplasia. 3 (6): 550–9. doi:10.1038/sj.neo.7900213. PMC 1506558. PMID 11774038.
- ^ Mini, E.; Nobili, S; Caciagli, B; Landini, I; Mazzei, T (2006). "Cellular pharmacology of gemcitabine". Annals of Oncology. 17: v7–12. doi:10.1093/annonc/mdj941. PMID 16807468.
- ^ Leu, K. M.; Ostruszka, LJ; Shewach, D; Zalupski, M; Sondak, V; Biermann, JS; Lee, JS; Couwlier, C; et al. (2004). "Laboratory and Clinical Evidence of Synergistic Cytotoxicity of Sequential Treament With Gemcitabine Followed by Docetaxel in the Treatment of Sarcoma". Journal of Clinical Oncology. 22 (9): 1706–12. doi:10.1200/JCO.2004.08.043. PMID 15117993.
- ^ Bay, Jacques-Olivier; Ray-Coquard, Isabelle; Fayette, Jérôme; Leyvraz, Serge; Cherix, Stephane; Piperno-Neumann, Sophie; Chevreau, Christine; Isambert, Nicolas; et al. (2006). "Docetaxel and gemcitabine combination in 133 advanced soft-tissue sarcomas: A retrospective analysis". International Journal of Cancer. 119 (3): 706–11. doi:10.1002/ijc.21867. PMID 16496406.


