펨피고이드
Pemphigoid| 펨피고이드 | |
|---|---|
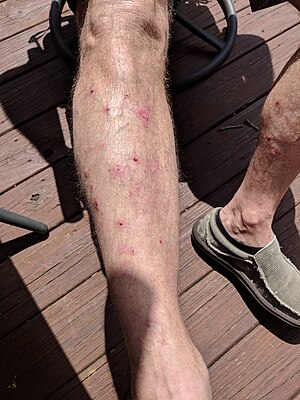 | |
| 하퇴부에 나타난 염소와 불개, 일부는 파열되어 황소 펨피고이드에 지각된 부위가 남아있다. | |
| 전문 | 피부과 |
펨피고이드(Pemphigoid)는 희귀 자가면역성 수포성 피부질환과 점막의 집단이다.이름에서 알 수 있듯이 펨피고이드는 일반적인 외형은 펨피고스와 유사하지만 [1]펨피고이드는 피부세포 사이의 연결부 상실인 아칸톨리시스(acantolyis)를 특징으로 하지 않는다.[2]
펨피고이드는 펨피고스보다 더 흔하며, 남성보다 여성에게 조금 더 흔하다.그것은 또한 젊은 사람들보다 70세 이상의 사람들에게 더 흔하다.[3]
분류
IgG
펨피고이드의 형태는 결합조직 자가면역 피부질환으로 간주된다.다음과 같은 몇 가지 유형이 있다.
- 게신성 펨피고이드(PG) (이전에는 헤르페스 게신이라고 불림)
- 황소 펨피고이드(BP) 입안에 거의 영향을 주지 않는다.
- 점막 펨피고이드(MMP) 또는 (시카트리컬 펨피고이드), (피부 관여 없음)
황소와 점막 펨피고이드는 보통 60세 이상의 사람들에게 영향을 미친다.[4][5]임신성 펨피고이드(pemphigoid)는 임신 중에 발생하며,[6] 일반적으로 임신 직후 또는 두 번째 또는 세 번째에 발생한다.
이가
펨피고이드는 보통 IgG에 의해 매개되는 것으로 간주되지만 IgA에 의해 매개된 형태도 또한 설명되어 왔다.[7]
IgA 매개 면역억제성 질환은 리툭시맙과 같은 보통 효과적인 약물로도 치료가 어려운 경우가 많다.[8]
황소 펨피고이드
황소 펨피고이드는 황소라고 불리는 큰 소엽수집들에 의해 특징지어지는 희귀하고 만성적인 자가면역 장애로 주로 피부에 관여하고 점막은 덜 흔하게 발생한다.펨피고이드 집단의 가장 흔한 유형으로, 소피내 면역불가증 환자의 80%를 대표한다.[9]그것은 피하 펨피고이드로 더 잘 알려져 있다.
프리젠테이션
Vesicle과 bullae라고 알려진 작고 큰 물집의 일차적인 병변은 피부에서 발견되고 때로는 점막에서 발견된다.[10]
비불화 펨피고이드
어떤 환자들에서는 펨피고이드가 그 병의 유일한 징후로 황소 없이 BP의 피부 발현으로 시작된다.Pruric eczematous, papular, 또는 두드러기 같은 피부병변도 몇 주 또는 몇 달 동안 지속될 수 있다.[11]
황소상
BP의 황소 단계는 소변과 황소를 보여주며, 겉보기에는 정상 또는 적혈성 피부에 나타나며, 주로 사지와 아랫줄기의 굴곡적인 측면에 나타난다.[11]일반적으로 구강 점막의 에로스인 점막 병변은 환자의 10~30%에 존재한다.[12]가끔 수포액이 피가 흐르기도 한다.물집은 지름이 약 1~4cm로 팽팽하게 긴장되어 있어 침식되고 지각된 부위가 남으며, 요골과 함께 고리형 또는 구상형 무늬로 침투한 교황과 판자무늬가 있다.[11][12]
피부 내 황소 펨피고이드 항원과 중추신경계 내 뉴런 항원 사이의 동질학은 유전적 소인과 더불어 황소 펨피고이드와 신경학적 질병 사이의 관찰된 연관성의 원인으로 제안되어 왔다.황소 펨피고이드 환자들은 보통 신경 질환(치병, 파킨슨병, 뇌졸중)과 같은 2개 이상의 다른 만성 질환을 가지고 있다.그러나 이러한 장애들 사이의 관계를 탐구하기 위해서는 더 많은 연구가 필요하다.[12]
원인
물집 형성의 병생적 메커니즘이 알려져 있으며, 혈류모좀 항원에 대한 항체 형성의 방아쇠는 아직 알려져 있지 않다.[13]대부분의 황소 펨피고이드 케이스는 피부-피질 접합부에 배열된 항원(BP180과 BP230)을 지향하는 자가항체(대부분 IgG) 때문이다.[14]However, most commonly, drug can be one of the cause of bullous pemphigoid, such as thiazide diuretics, antibiotics (e.g., penicillins, vancomycin), nonsteroidal anti-inflammatory drugs (NSAIDs) and angiotensin-converting enzyme (ACE) inhibitors (e.g., captopril) and possibly angiotensin receptor blockers (ARBs, e.g., valsartan).[10]
The implicated drugs include penicillin derivatives, sulfasalazine, ibuprofen, phenacetin, enalapril, captopril, lisinopril, gabapentin, novoscabin, levobunolol ophthalmic solution, tetracoq, influenza, tetanus, and other vaccinations, a homeopathy regimen, nifedipine, 5-aminosalicylic acid, doxazosin, serratiopeptidase, losartan, cephalexin, bumet아나이드, 플루옥세틴, 클로로킨, 항정신병 약물, 에녹사파린, 시프로플록사신, 푸로세미드(furosemide), 신경절제, 페니실라민, 글립틴 플러스 메트포민, 정맥 요오드, 에탄셉트, 레보플록사신, 국소 불소.독감 예방접종은 황소 펨피고이드에게 중요한 자극제가 되지 않는 것으로 보인다.외상, 화상, 림프부종, 광선요법, 방사선 등이 아주 적은 수의 사례에 관련되어 있다.[13]
병리학
황소 펨피고이드의 병태생리학은 면역성과 염증성인 두 가지 주요 성분으로 구성되어 있다.면역성 성분에서 자가항체체는 지하 막대의 라미나 루치다에 위치한 혈모세포 황소 펨피고이드 항원 BP230(BPAg1)과 BP 180(BPAg2 또는 타입 XVII 콜라겐)에 대하여 작용한다.이들 항원은 상피-스트롬 접착을 촉진하는 접착 복합체에 중요한 역할을 한다.[9]항원에 대해 작용하는 항체의 주요 하위 등급은 IgG4이다.IgG1 항체와 IgG2 항체는 IgG4 항체에 비해 검출 빈도가 낮은 반면 IgG3 항체는 주로 없는 것으로 나타났다.[14]오토앤티비데스가 특별히 표적 항원에 결합하면, 보완시스템과 돛대 세포가 활성화되어 염증 성분을 나타낸다.그런 다음 중성미자와 어시노필과 같은 염증성 세포를 환부에 끌어들인다.그것들은 단백질 분해 효소를 방출하기 위해 가정되며, 이것은 혈중모세포 단백질을 저하시켜 수포 형성을 초래한다.[9]
또한 유전적 요인, 감염 및 약물에 대한 환경 노출, 상피 확산 현상 등 다른 잠재적 기여 요인도 황소 펨피고이드를 유발하는 것으로 알려져 있다.[14]
진단
황소 펨피고이드 진단에는 임상평가, 조직병리학 및 직접면역결핍을 위한 피부생검, 간접면역결핍, ELISA 테스트 등이 포함된다.그 중에서도 직접 면역플루오르증은 황소 펨피고이드 진단에 있어 금본위제다.
임상평가
70세 이상 환자의 경우
- 다른 식별 가능한 원인 없이 점막에서 드물게 발생하는 긴장된 물집과 에로스가 존재하는 것이 특징인 수포성 피부병.
- 설명할 수 없는 프리루투스, 프루라이틱 에크제마토스 분출 또는 요골판
조직병리학
병변 조직은 가급적 온전한 음낭 또는 온전한 불라의 가장자리 중 하나로 해모톡시린과 에오신(H&E) staining을 위해 펀치 생검을 사용하여 얻는다.
전형적인 조직병리학적 소견에는 다음이 포함된다.[17][13]
- 구획 내에 있는 수많은 어시노필과 함께 소엽 분열.
- 림프구, 어시노필, 중성미자와 함께 가변 강도의 표면적 피부 염증 세포 침투.
- Eosinophlic spunliosis(특히 초기 병변에서 또는 수포를 둘러싸고 있는 임상적으로 적혈성 피부에서 발견될 수 있음)
직접면역결핍증
직접 면역유동체(DIF) 연구는 조직 결합 항체를 직접 검출하는 것을 포함한다.H&E 조직병리학적 평가를 위해서는 DIF용 생검 시료를 병변 피부 대신 위상 피부에서 채취해야 한다.DIF 시료는 포르말린 대신 Michel의 용액이나 Zeuss 수송 매체에 넣어야 한다.
황소 펨피고이드의 DIF는 표피 지하막을 따라 IgG 및/또는 C3의 미세하고 연속적이며 선형적인 침전물의 존재를 보여줄 것이다.IgM과 IgA와 같은 다른 종류의 면역글로불린은 약 20%의 사례에 존재하며 보통 덜 강렬하다.IgA의 퇴적물이 있는 경우에, 환자는 구강 병변이 있을 수 있다.질병의 초기 단계에는 C3만 존재할 수 있다.[13]
간접면역결핍증
간접면역결핍은 펨피고이드 환자들의 지하 막대에서 항원을 대상으로 하는 순환항체를 검출하는데 사용된다.이 시술에서는 환자의 혈청을 채취하여 염분 분해 정상인 피부에 덧씌워 배양한다.이어 항체의 형광 검출로 시료가 얼룩진다.
황소 펨피고이드에서는 주로 BP180과 BP230혈모세포단백질인 지하막을 대상으로 순환 IgG가 환자의 60~80%에서 검출된다.IgA 및 IgE 클래스도 탐지할 수 있지만 탐지 빈도는 적다.[13]
효소연계 면역항암제 검사(ELISA)
황소 펨피고이드용 ELISA는 각각 황소 펨피고이드 항원 2[BPAg2]와 황소 펨피고이드 항원 1[BPAg1]로 알려진 BP180의 NC16A 영역에 대해 Ig 순환 테스트를 위해 상업적으로 이용할 수 있다.BP180NC16A영역에 대한 항체는 민감도가 89%, 특이도가 98%[18]로 불소 펨피고이드 진단에 유용하다.
혈청 내 BP180 및/또는 BP230 항체를 검출해도 황소 펨피고이드에 대한 확증적 진단은 하지 않는다.한 연구에 따르면, 7%가 황소 펨피고이드가 없는 337명의 한 시리즈에서 한 명 또는 두 명 모두에서 양성 반응을 보였다고 한다.[19]ELISA 연구결과는 DIF와 상관관계가 있어야 오진의 위험을 줄일 수 있다.
치료
황소 펨피고이드 치료법에는 다음이 포함된다.
1. 코르티코스테로이드
i. 국소 코르티코스테로이드
ii. 전신 코르티코스테로이드
2. 글루코코르티코이드보충제
i. 면역억제제
ii. 항염증제
3.생물학적 요법
i. 정맥내 면역글로불린
ii. 리툭시맙
무엇보다도 국소적 또는 전신적 코르티코스테로이드는 황소 펨피고이드를 조절하는 첫 번째 라인 요법으로 간주된다.코르티코스테로이드의 장기간 사용으로 인한 부작용을 최소화하고 병의 치유를 개선하기 위해 다른 약물과 면역억제 요법이 보조제로 쓰이는 경우가 많다.
환자에게 주어진 치료법을 선택할 때 고려해야 할 몇 가지 요인은 다음과 같다: (a) 환자의 나이 (b) 고혈압, 당뇨병, 기타 심혈관 질환과 같은 기저 질환 (c) 약물 사용 (d) 환자의 중증도와 질병의 정도에 대한 준수 능력에 대한 부작용 (e)) 약값.
코르티코스테로이드
1차 치료로는 전신 코르티코스테로이드에 비해 효능이 높고 전신 부작용도 적어 국소성 코르티코스테로이드가 선호된다.국소 코르티코스테로이드(Topical Clobetasol Propionate 0.05% 크림)로 치료한 광범위한 황소 펨피고이드 환자(하루에 10개씩 새로 정의)가 전신 글루코코르티코르티코이드 치료(프레디손)로 치료받은 광범위한 황소 펨피고이드 환자보다 임상 결과가 더 좋다는 연구결과가 나왔다.[20]
전신 글루코코르티코이드(glucocorticoid)는 고령 환자가 크림을 스스로 바르지 못하거나 비용이나 환자 자신의 선호도와 같이 국소 코르티코스테로이드의 사용을 불가능하게 하는 요인이 있을 때 환자에게 사용할 수 있다.
국소 코르티코스테로이드
국소적인 클로베타솔 프로피오네이트 0.05% 크림은 보통 매일 두 번 사용하고 바른다.Joly 외 연구진의 연구는 질병 통제 후 15일까지 하루에 10~20g의 클로베타솔 프로피오네이트를 하루에 20~30g씩 사용하다가 4개월에 걸쳐 중단하는 것이 표준체제에 버금가는 효과(하루 40g이 12개월에 걸쳐 서서히 가늘어짐)를 보인다는 것을 입증했다.[21]
전신 코르티코스테로이드
프레드니손은 보통 황소 펨피고이드를 치료하는데 사용된다.투여량은 0.2~0.5mg/kg/일 사이에 변화하며 활성 염증, 새로운 물집 형성, 프리리투스가 최소 2주 동안 멈출 때까지 계속된다.그리고 나서 그 복용량은 몇 달 동안 서서히 줄어들게 된다.초기에 프레드니솔론은 상대적으로 많은 양(약 10mg)으로 줄일 수 있고, 그 후에는 적은 양(2.5~5mg)으로 줄일 수 있다.환자가 병변의 플레어 업(fler up)이 발생하는 경우 선량은 이전 수준 이상으로 증가해야 하며 더 오래 전에 더 느리게 테이퍼링을 유지해야 한다.[22]
글루코르티코이드 스파링제
청소나 유지관리를 위해 코르티코스테로이드를 많이 복용해야 하는 환자의 경우 면역억제제, 항염증제 등 글루코코르티코이드 스파링제를 보조요법으로 사용하면 코르티코스테로이드의 전신적 부작용을 줄일 수 있다.코르티코스테로이드에 대한 합병증과 금지가 있는 환자들은 또한 이 글루코코르티코이드 스파링제를 고려할 수 있다.
면역억제제
면역억제제로는 아자티오프린(균등분할 용량에 하루 1~3mg/kg), 마이코페놀레이트 모페틸(일 1000~3000mg/day 또는 2분할 용량에 40mg/kg/day), 메토트렉세이트(10~15mg/week) 등이 있다.[22]
항염증제
테트라사이클린 항생제는 불소 펨피고이드를 치료하기 위해 니코틴아마이드와 함께 종종 사용된다.[23][24]약물 투여의 경우 테트라시클린은 매일 4회 500mg, 복시사이클린과 미노시클린은 매일 2회 100mg, 니코틴아미드는 4회 500mg으로 처방된다.댑손은 황소 펨피고이드 치료에도 효과가 있는 것으로 나타났다.[25]그러나 답슨의 효능은 제한적이다.댑손은 보통 하루 25~50mg의 저선량으로 시작하여 상태가 호전될 때까지 매주 25mg씩 증가한다.처방할 수 있는 최대 선량은 하루 250mg이다.[22]
생물학적 요법
내화성 질환의 경우 정맥내 면역글로불린, 리툭시맙 등의 생물학적 치료법을 고려해야 한다.[1,19,20][9][26][27]
역학
황소 펨피고이드는 주로 노인들의 질병으로 어린이들에게서 거의 발생하지 않는다.대부분의 경우 60세에서 80세 사이의 개인들이 관련되었다.두 개의 유럽 연구들은 또한 나이가 들면서 황소 펨피고이드의 위험 증가도 시사했다.[28][29]
몇몇 소급 연구 결과에 따르면, 황소 펨피고이드의 발병률이 증가하고 있다.[30][31][32]황소 펨피고이드는 유럽에서 가장 흔한 자가면역성 물집병으로 간주될 수 있는 반면 펨피고스는 태국이나 말레이시아와 같은 지역에서 더 흔할 수 있다.황소 펨피고이드는 여성보다 약간 우세하다고 보고되었다.그러나 그 이유는 알 수 없다.[14]
점막펨피고이드
점막 펨피고이드(MMP)는 희귀하고 만성적인 자가면역성 수포성 질환으로 주로 점막에 관여하며 환부의 흉터를 유발하는 경향이 있다.[11]어떤 점막이든 관여할 수 있지만 가장 많이 관여하는 부위는 구강 점막이고, 그 다음은 결막, 피부, 인두, 외부 성기, 비강 점막, 후두, 항문, 식도 등이다.[33]MMP는 실명, 기도압박 등 심각한 합병증으로 이어질 수 있기 때문에 조기 및 적극적인 치료 개시가 필요할 수 있다.[34]
프리젠테이션
흉터는 이 변종이 전형적으로 흉터가 없는 황소 펨피고이드에 점막 관여와 구별되는 MMP의 일반적인 결과물이다.점막 섬유증을 나타내는 망막형 백색 줄무늬가 종종 치유된 병변 부위에 존재하며 흉터에 보조적인 기능 제한이 발생할 수 있다.예를 들어, 안구 점막과 관련된 MMP는 심블파론, 안클로로블포론, 궁극적인 실명으로 이어질 수 있으며, 점진적인 후두막과 기관지 관여는 질식사 결과를 초래할 수 있다.[14]
구강병
가장 일반적으로 입안에 영향을 주는 것은 부칼 점막, 긴기바, 혀, 수백만 개의 입술, 미각을 포함한다.탈수성 치염은 가장 빈번한 발현이다.[35][34]깅기바는 홍반인데, 환자들이 보통 양치질할 때 출혈을 호소한다.[34]구강 방수성 병변의 파열은 깨끗하고, 비인플레이션적이며, 고통 없는 에로스를 남긴다.펨피거스에서 흔히 볼 수 있는 입술의 경계선은 살려준다.후두부 관련으로 인한 성급함은 8%의 사례에서 볼 수 있다.일부 환자들은 구강 질환만 가지고 있는데, 구강과 다른 점막 및 피부 관련 환자에 비해 상대적으로 양성 코스를 가지고 있다.[34]
안구병
눈은 케이스의 65%에 관련되어 있다.처음에는 일방적인 결막염(연소나 과도한 찢김 등)이 나타났다가 결막상피하 섬유화.[35][36]결막의 수축은 결막낭의 소멸로 이어진다.[35]심블파론은 뚜껑의 결막을 지구로 연결하는 섬유 가닥이다.[34]게다가 각막의 침식과 신근육화로 인한 찢김을 줄이면 각막의 오패션과 천공을 초래한다.[35]뚜껑의 흉터는 엔트로피온(뚜껑의 안쪽 회전)과 삼치경(속눈썹의 뒤틀림)을 일으킨다.[37]이러한 질환은 궁극적으로 약 20%의 경우 실명으로 이어진다.완치 및 치료를 받지 않은 22%의 환자에서 재발은 발생하기 때문에 사후관리를 위해 가는 것이 중요하다.[35]
기타점막
관련될 수 있는 덜 흔한 부위는 비인두, 식도, 요도 등이다.[35]비인두염의 관여는 기관절제술이 필요할 수 있는 패혈증과 기도폐쇄의 궤양을 초래할 수 있다.[35]식도 질환은 궤양, 이상증, 혐오증, 협착증을 동반할 수 있다.요도, 질 오리피스, 직장 등의 협착증도 만성 염증과 흉터에서 비롯됐다.[35]
피부병
환자의 약 25%가 피부병변을 가지고 있으며, 주로 얼굴, 목, 두피에 긴장된 Vesicle이나 황소가 있다.침식의 치료는 위축된 흉터가 있든 없든 둘 중 하나이다.[35]점막 펨피고이드의 피부병변은 두 가지 아형으로 나타난다. (1)흉터 없는 긴장성 황소의 일반화된 분출로 나타난다 (2) 적혈성 염기 위에 국소화된 물집으로 나타나서 위축성 흉터가 발생한다.[36]
점막 펨피고이드는 악성종양과도 관련이 있다.
Malignancy — 라미네인 332(이전에는 라미네인 5 및 에필리그린으로 알려져 있음)에 대한 항체가 있는 MMP는 내부 악성코드에 대한 위험 증가와 관련이 있다.펨피고이드(면역 침강으로 진단 받은)이런 종류의 35의 환자들이 집단에서는 10(29%) 후 MMP.[14]Occurrences 비호지킨 림프종과 피부 T세포 림프종의 진단 또한anti-laminin과 개별 환자들에서 보고되고 있7의 14개월 이내에 진단 받았다 고체 장기 종양이 개발해 냈다. 332MMP. 이 아형의 MMP와 암의 병리학적 관계는 알려져 있지 않다.그러나 악성 세포에서 라미네인 332의 발현이 검출되었으며, 라미네인 332는 종양 세포의 성장, 침입, 전이 등을 촉진할 수 있는 것으로 보인다.[14]
라미네인 332 항체를 가진 환자의 MMP 임상 징후는 다른 항체 프로파일을 가진 MMP의 특징과 유사하다.[14]따라서 임상검사는 다른 형태의 MMP와 안티라미닌 332 MMP를 신뢰성 있게 구별할 수 없다. 새로운 효소연계 면역항체검사(ELISA)를 통해 라미네인 332 항체의 검출과 연관성이 있는 154명의 MPP 환자에 대한 소급연구 결과를 확인하기 위해 추가적인 연구가 필요하다.중병을 위하여
라미네인 332 항체에 대한 진단 실험실 테스트는 상업적으로 이용할 수 없기 때문에, 라미네인 332에 대한 의심은 주로 면역 플루오렌스 현미경 검사 결과에 근거한다.[14]라미네인 332 MPP에만 국한된 것은 아니지만, 지하 막구 스플릿(소금 스플릿) 피부의 진피측과 결합한 항체가 검출되면 이러한 진단의 가능성을 시사한다.
라미네인 332 항체에 대한 최종 테스트가 가능해질 때까지, 혈청 간접 면역불루오렌스(IIIF) 연구를 하는 MMP 환자들에게 지하 막구-분할 피부의 진피측과 결합한 항체가 노화 및 성별에 적합한 암 검사를 받을 것을 권고한다.[14]악성코드에 대한 추가 평가는 증상의 검토, 신체검사, 연령에 적합한 검진 결과에 기초하여 지시된 대로 수행해야 한다.
원인
점막 펨피고이드에서 지하 막 구역의 구성요소를 대상으로 한 자동항체체가 병원성으로 확인되었다.항원에는 180kD급 황소 펨피고이드 항원(BP180), 라미네인 332, 베타-4-integrin 등이 있으며, 완전히 발견되지 않은 다른 항원은 지하막에서 확인된다.[34]D-페니실라민 치료의 합병증은 점막 펨피고이드를 유발할 수 있다.스티븐스존슨 증후군 환자에게 급성 심한 안구염증후군이 발생한 뒤에도 발생한다.[38]
병리학
오토안티비데스는 점막과 피부의 지하막대 내에서 유착을 촉진하는 역할을 하는 지하막대 단백질을 대상으로 한다.확인된 주요 지하막대 단백질은 다음을 포함한다.
- BP180의 C-단자
- BP230
- 라미네인 332(라미네인 5 또는 에피글린이라고도 함)
- 알파-6-베타-4 통합 타입 VII 콜라겐.
황소 펨피고이드의 헤미데스모솜과 상부 라미나 루치다에 위치한 BP180의 N-terminus의 표적항원과는 대조적으로, MMP의 표적항원은 BP180의 C-terminus로, 하부 라미나 루치다와 라미나 밀도에 위치한다.이로 인해 황소 펨피고이드에 흉터가 남을 것 같지 않은 보다 표면적인 물집과 비교해 흉터가 더 깊게 분리된다.
알파-6-베타-4 통합의 베타-4 통합 서브유닛에 대한 항체는 안구질환과 관련이 있는 반면 구강 관여는 알파-6 서브유닛에 대한 항체 반응과 연관되어 있는 것으로 보인다.게다가, 라미네인 332에 대한 항체 반응을 가진 MMP는 내부 악성코드에 대한 위험이 증가하는 연관성을 가지고 있다.
황소 펨피고이드와 유사하게 유전적 요인, 환경적 노출, 상피 확산 현상과 같은 다른 요인들도 MMP를 유발할 수 있다고 보고되었다. 복수의 연구들은 또한 HLA-DQB1*0301과 MPP의 연관성을 보고했다.[14][39][40][41][42]
진단
황소 펨피고이드 진단에는 임상평가, 조직병리학 및 직접면역결핍을 위한 피부생검, 간접면역결핍, ELISA 테스트 등이 포함된다.그 중에서도 직접면역결핍은 점막 펨피고이드 진단을 위한 금본위제다.
임상평가
- 다른 식별 가능한 원인 없이 피부에 발생하는 긴장된 물집 및 에로스의 존재.
- 구강, 안구, 비강, 생식기, 항문, 인두, 후두 및/또는 식도 점막염을 포함하는 데스콰민성 치염 또는 점막염
- 식별 가능한 원인이 없는 프루라이트의 에크제마토스 분출 또는 소변표 존재.
- 환갑이 넘은 환자 나이.
조직병리학
병변 조직은 가급적 온전한 음낭 또는 온전한 불라의 가장자리 중 하나로 해모톡시린과 에오신(H&E) staining을 위해 펀치 생검을 사용하여 얻는다.
이번 연구결과는 림프구, 중성미자, 어시노필과 함께 침투한 진피질의 아질성 물집이다.추가적인 발견은 오래된 병변에서 점막 펨피고이드의 흉터 성질과 일치하는 아피더피피질 섬유화와 혈장 세포 침투가 있다.[37][36]
직접면역결핍 연구
직접 면역유동체(DIF) 연구는 조직 결합 항체를 직접 검출하는 것을 포함한다.H&E 조직병리학적 평가를 위해서는 DIF용 생검 시료를 병변 피부 대신 위상 피부에서 채취해야 한다.지하막을 따라 IgG와 C3 퇴적물의 선형 띠가 발견된다.간혹 지하 막구역에서 IgA의 선형 침적도 볼 수 있다.[43][44]여러 번 반복된 생체검사는 MMP를 진단하기 위한 DIF 연구의 민감도를 높인다.
간접면역결핍증
간접면역결핍은 펨피고이드 환자들의 지하 막대에서 항원을 대상으로 하는 순환항체를 검출하는데 사용된다.일상적인 기법을 사용한 초기 연구에서, MPP를 가진 환자의 3분의 1만이 양성 반응을 보이고 있었다.순환 IgG와 IgA 항체는 환자의 혈청에서 발견된다.순환 항체를 검출할 가능성을 높이려면 인간의 지하 막구-구역-분할 피부 및/또는 농축 세럼을 사용해야 한다.[37][45][46]
항원특정 세롤로그 검사
BP180, BP230, 라미네인 332, 타입 VII 콜라겐 등 다양한 항원을 대상으로 한 오토앤티비데이즈가 검출될 수 있다.[47][48][49]그러나 ELISA 테스트는 감도가 제한적이기 때문에 이 테스트를 유일한 진단 도구로 사용할 수 없었다.
치료
점막 펨피고이드에 사용되는 치료법의 유형을 결정하는 요인은 [1]개소 관여부위, [2]개 질환의 중증도, [3]개진율이다.
구강 점막은 점막 펨피고이드에 영향을 받는 가장 흔한 부위다.
경구 점막병변에는 0.05% 클로베타솔 프로피온산염과 같은 높은 효력 국소 스테로이드가 사용된다.구강 점막을 건조시킨 후 하루 2~3회 연고나 젤을 바르면 구강 점막에 대한 조정의 밀착력을 높일 수 있다.신청 후 최소 30분 이상 음주나 식사를 피하도록 안내한다.치과용 트레이는 또한 징기벌과 관련된 환자들의 폐색에 따른 병변 현장에 국소 스테로이드를 적용하는 데 도움을 주기 위해 제작될 수 있다.게다가 국소 코르티코스테로이드에 잘 반응하지 못한 일부 환자를 포함하여, 캘시네린 억제제인 국소 타크로리무스도 이 질환을 조절하는 데 효과가 있는 것으로 나타났다.국소 타크로리무스 0.1% 연고를 하루 2~3회 바르고 펨피고이드의 치유 개선 후 테이퍼 처리한다.또 다른 방법은 뇌내 코르티코스테로이드(트리암시놀론 아세토니드, 5~10mg/ml 희석, 2~4주마다 반복)를 사용하는 것이다.환자가 국소요법에 반응하지 않을 때 내성요법을 사용한다.
보통에서 중증의 질병(안경, 비인두 또는 비인두 점막과 관련된 질병 포함)과 국소 요법에 적절하게 반응하지 않은 환자의 경우 전신 약제를 사용해야 한다.이런 경우 전신 코르티코스테로이드와 댑손 등이 사용된다.댑손의 복용량은 매일 50~200mg이다.답슨은 전신 코르티코스테로이드에 반응하지 않는 점막 펨피고이드 치료에 효과가 있는 것으로 나타났다.[37]전신성 코르티코스테로이드의 경우 하루에 0.25~0.5mg/kg의 프레드니솔론이 처방된다(급성 단계에서는 하루 2회 복용량을 사용하고 새로운 물집 형성이 멈춘 후 매일 아침 1회 복용량으로 변경한다).그 후 프레드니솔론의 복용량은 국소치료제 또는 글루코코르티코이드-스파잉제(예: 답손, 아자티오프라린)와 결합하여 수개월에 걸쳐 서서히 가늘어진다.
위의 개입으로 조절할 수 없는 심각한 점막 펨피고이드를 가진 환자들은 병변을 통제하기 위해 공격적인 면역억제적 요법과 생물학적 치료가 필요할 것이다.[37]아자티오프린 또는 사이클로인산아미드(Cyclosphamide)는 사용할 수 있는 면역억제제의 선택이다.때로는 댑손이 병세를 개선하지 못하면 면역억제제와 프레드니솔론이 결합될 수 있다.마지막으로 기존 치료법에 반응하지 않는 환자에게 리툭시맙이 선택사항이 될 수 있다.[35]
코르티코스테로이드와 결합한 사이클로인산화물이 점막 펨피고이드 치료에 효과적이라는 증거가 불충분하다.[50]
그 외 구강관리는 점막 펨피고이드 치료에 있어 중요한 부분이기 때문에 환자에게 구강위생지시를 해야 한다.[51]식전에 과산화수소(1:4 또는 1:6 농도로 물로 희석)와 디펜하이드라민으로 헹궈 통증을 줄이는 것이 좋다.그런 다음 과산화수소로 헹구어 음식 입자와 이물질을 제거하고 나중에 소염 효과를 위해 덱사메타손로 헹구었다.과산화수소, 덱사메타손의 덱사메타손의 렉시르, 디펜하이드라민의 렉시르는 각각 1:4 또는 1:6 농도로 물로 희석되어 결국 삼키지 않도록 지시된다.[35]
역학
MMP는 주로 60세에서 80세 사이의 노인 인구와 드물게 어린이들에게 영향을 미친다.여성들은 남성들보다 두 배나 더 자주 영향을 받는다.[52]알려진 인종적 또는 지리적 선호성은 없지만, 여러 연구에서 MMP와 특정 면역유전성 happlotype HLA-DQB1*0301의 연관성이 있음을 시사했다.[11][39][40][41][42]
참고 항목
참조
- ^ 도랜드 의학 사전의 "펨피고이드"
- ^ 미국 국립 의학 도서관의 펨피고이드 제목(MesH)
- ^ "British Association of Dermatologists - Patient Information Leaflets (PILs)". www.bad.org.uk. Retrieved 11 June 2020.
- ^ e메디컬의 시카트리시알 펨피고이드
- ^ e메디컬의 불루스 펨피고이드
- ^ e메디컬의 펨피고이드 제스처
- ^ Provost TT, Flynn JA (2001). Cutaneous medicine: cutaneous manifestations of systemic disease. PMPH-USA. pp. 209–. ISBN 978-1-55009-100-7. Retrieved 25 June 2010.
- ^ He Y, Shimoda M, Ono Y, Villalobos IB, Mitra A, Konia T, et al. (June 2015). "Persistence of Autoreactive IgA-Secreting B Cells Despite Multiple Immunosuppressive Medications Including Rituximab". JAMA Dermatology. 151 (6): 646–50. doi:10.1001/jamadermatol.2015.59. PMID 25901938.
- ^ a b c d Baigrie D, Nookala V (2020). "Bullous Pemphigoid". StatPearls. StatPearls Publishing. PMID 30570995. Retrieved 2019-01-19.
- ^ a b Mirowski GW, Leblanc J, Mark LA (2016). "Oral disease and oral-cutaneous manifestations of gastrointestinal and liver disease". In Feldman M (ed.). Sleisenger & Fordtran's Gastrointestinal and Liver Disease (10th ed.). Philadelphia, Pa: Saunders Elsevier. pp. 377–396.
- ^ a b c d e Bernard P, Borradori L (2018). "Pemphigoid Group". In Bolognia JL (ed.). Dermatology (4th ed.). Philadelphia, Pa: Elsevier Limited. pp. 510–526.
- ^ a b c Chow YW, Pietranico R, Mukerji A (October 1975). "Studies of oxygen binding energy to hemoglobin molecule". Biochemical and Biophysical Research Communications. 66 (4): 1424–31. doi:10.1016/0006-291X(75)90518-5. PMID 6.
- ^ a b c d e Patterson JW, Hosler GA, Weedon D (2016). Weedon's Skin Pathology (4th ed.). London: Churchill Livingstone Elsevier. ISBN 978-0-7020-5183-8.
- ^ a b c d e f g h i j k Leiferman KM. Zone JJ, Ofori AO (eds.). "Epidemiology and pathogenesis of bullous pemphigoid and mucous membrane pemphigoid". UpToDate. Wolters Kluwer. Retrieved 2019-01-17.
- ^ Vaillant L, Bernard P, Joly P, Prost C, Labeille B, Bedane C, et al. (September 1998). "Evaluation of clinical criteria for diagnosis of bullous pemphigoid. French Bullous Study Group". Archives of Dermatology. 134 (9): 1075–80. doi:10.1001/archderm.134.9.1075. PMID 9762017.
- ^ Kershenovich R, Hodak E, Mimouni D (2014-04-01). "Diagnosis and classification of pemphigus and bullous pemphigoid". Autoimmunity Reviews. Diagnostic criteria in Autoimmune diseases. 13 (4–5): 477–81. doi:10.1016/j.autrev.2014.01.011. PMID 24424192.
- ^ Schmidt E, della Torre R, Borradori L (July 2011). "Clinical features and practical diagnosis of bullous pemphigoid". Dermatologic Clinics. 29 (3): 427–38, viii–ix. doi:10.1016/j.det.2011.03.010. PMID 21605808.
- ^ Samuel M, Pixley RA, Villanueva MA, Colman RW, Villanueva GB (September 1992). "Human factor XII (Hageman factor) autoactivation by dextran sulfate. Circular dichroism, fluorescence, and ultraviolet difference spectroscopic studies". The Journal of Biological Chemistry. 267 (27): 19691–7. doi:10.1016/S0021-9258(18)41830-3. PMID 1527088.
- ^ Wieland CN, Comfere NI, Gibson LE, Weaver AL, Krause PK, Murray JA (January 2010). "Anti-bullous pemphigoid 180 and 230 antibodies in a sample of unaffected subjects". Archives of Dermatology. 146 (1): 21–5. doi:10.1001/archdermatol.2009.331. PMID 20083688.
- ^ Joly P, Roujeau JC, Benichou J, Picard C, Dreno B, Delaporte E, et al. (January 2002). "A comparison of oral and topical corticosteroids in patients with bullous pemphigoid". The New England Journal of Medicine. 346 (5): 321–7. doi:10.1056/NEJMoa011592. PMID 11821508.
- ^ Joly P, Roujeau JC, Benichou J, Delaporte E, D'Incan M, Dreno B, et al. (July 2009). "A comparison of two regimens of topical corticosteroids in the treatment of patients with bullous pemphigoid: a multicenter randomized study". The Journal of Investigative Dermatology. 129 (7): 1681–7. doi:10.1038/jid.2008.412. PMID 19177141.
- ^ a b c Kellerman RD, Rakel D, eds. (2020). "Bulbous Disease: Method of Diya F. Mutasim". Conn's current therapy 2020 (20th ed.). Philadelphia: Elsevier. p. 228. ISBN 978-0-323-71184-5.
- ^ Berk MA, Lorincz AL (June 1986). "The treatment of bullous pemphigoid with tetracycline and niacinamide. A preliminary report". Archives of Dermatology. 122 (6): 670–4. doi:10.1001/archderm.1986.01660180076019. PMID 2940979.
- ^ Thomas I, Khorenian S, Arbesfeld DM (January 1993). "Treatment of generalized bullous pemphigoid with oral tetracycline". Journal of the American Academy of Dermatology. 28 (1): 74–7. doi:10.1016/0190-9622(93)70013-J. PMID 8425974.
- ^ Bouscarat F, Chosidow O, Picard-Dahan C, Sakiz V, Crickx B, Prost C, et al. (April 1996). "Treatment of bullous pemphigoid with dapsone: retrospective study of thirty-six cases". Journal of the American Academy of Dermatology. 34 (4): 683–4. doi:10.1016/S0190-9622(96)80085-5. PMID 8601662.
- ^ Czernik A, Toosi S, Bystryn JC, Grando SA (February 2012). "Intravenous immunoglobulin in the treatment of autoimmune bullous dermatoses: an update". Autoimmunity. 45 (1): 111–8. doi:10.3109/08916934.2011.606452. PMID 21923613. S2CID 19942412.
- ^ Kasperkiewicz M, Shimanovich I, Ludwig RJ, Rose C, Zillikens D, Schmidt E (September 2011). "Rituximab for treatment-refractory pemphigus and pemphigoid: a case series of 17 patients". Journal of the American Academy of Dermatology. 65 (3): 552–558. doi:10.1016/j.jaad.2010.07.032. PMID 21641080.
- ^ Marazza G, Pham HC, Schärer L, Pedrazzetti PP, Hunziker T, Trüeb RM, et al. (October 2009). "Incidence of bullous pemphigoid and pemphigus in Switzerland: a 2-year prospective study". The British Journal of Dermatology. 161 (4): 861–8. doi:10.1111/j.1365-2133.2009.09300.x. PMID 19566661. S2CID 30118554.
- ^ Bertram F, Bröcker EB, Zillikens D, Schmidt E (May 2009). "Prospective analysis of the incidence of autoimmune bullous disorders in Lower Franconia, Germany". Journal of the German Society of Dermatology. 7 (5): 434–40. doi:10.1111/j.1610-0387.2008.06976.x. PMID 19170813. S2CID 25769559.
- ^ Joly P, Baricault S, Sparsa A, Bernard P, Bédane C, Duvert-Lehembre S, et al. (August 2012). "Incidence and mortality of bullous pemphigoid in France". The Journal of Investigative Dermatology. 132 (8): 1998–2004. doi:10.1038/jid.2012.35. PMID 22418872.
- ^ Försti AK, Jokelainen J, Timonen M, Tasanen K (November 2014). "Increasing incidence of bullous pemphigoid in Northern Finland: a retrospective database study in Oulu University Hospital". The British Journal of Dermatology. 171 (5): 1223–6. doi:10.1111/bjd.13189. PMID 24934834. S2CID 207071905.
- ^ Brick KE, Weaver CH, Lohse CM, Pittelkow MR, Lehman JS, Camilleri MJ, et al. (July 2014). "Incidence of bullous pemphigoid and mortality of patients with bullous pemphigoid in Olmsted County, Minnesota, 1960 through 2009". Journal of the American Academy of Dermatology. 71 (1): 92–9. doi:10.1016/j.jaad.2014.02.030. PMC 4324601. PMID 24704091.
- ^ Habif TP, Campbell JL, Chapman MS, Dinulos JG, Zug KA (2011), "Vesicular and bullous diseases", Skin Disease, Elsevier, pp. 366–377, doi:10.1016/b978-0-323-07700-2.00013-5, ISBN 9780323077002
- ^ a b c d e f Tolaymat L, Hall MR (2020). "Cicatricial Pemphigoid". StatPearls. StatPearls Publishing. PMID 30252376. Retrieved 2019-01-19.
- ^ a b c d e f g h i j k Mascaró JM (2010). "Other Vesiculobullous Diseases". Sleisenger & Fordtran's Gastrointestinal and Liver Disease (9th ed.). Philadelphia, Pa: Saunders Elsevier.
- ^ a b c Domloge-Hultsch N, Gammon WR, Briggaman RA, Gil SG, Carter WG, Yancey KB (October 1992). "Epiligrin, the major human keratinocyte integrin ligand, is a target in both an acquired autoimmune and an inherited subepidermal blistering skin disease". The Journal of Clinical Investigation. 90 (4): 1628–33. doi:10.1172/JCI116033. PMC 443212. PMID 1401088.
- ^ a b c d e Fleming TE, Korman NJ (October 2000). "Cicatricial pemphigoid". Journal of the American Academy of Dermatology. 43 (4): 571–91, quiz 591–4. doi:10.1067/mjd.2000.107248. PMID 11004612.
- ^ Hamodat M. "Cicatricial pemphigoid". www.pathologyoutlines.com. Retrieved 2019-01-17.
- ^ a b Chan LS, Hammerberg C, Cooper KD (February 1997). "Significantly increased occurrence of HLA-DQB1*0301 allele in patients with ocular cicatricial pemphigoid". The Journal of Investigative Dermatology. 108 (2): 129–32. doi:10.1111/1523-1747.ep12332352. PMID 9008223.
- ^ a b Delgado JC, Turbay D, Yunis EJ, Yunis JJ, Morton ED, Bhol K, et al. (August 1996). "A common major histocompatibility complex class II allele HLA-DQB1* 0301 is present in clinical variants of pemphigoid". Proceedings of the National Academy of Sciences of the United States of America. 93 (16): 8569–71. Bibcode:1996PNAS...93.8569D. doi:10.1073/pnas.93.16.8569. PMC 38713. PMID 8710911.
- ^ a b Setterfield J, Theron J, Vaughan RW, Welsh KI, Mallon E, Wojnarowska F, et al. (September 2001). "Mucous membrane pemphigoid: HLA-DQB1*0301 is associated with all clinical sites of involvement and may be linked to antibasement membrane IgG production". The British Journal of Dermatology. 145 (3): 406–14. doi:10.1046/j.1365-2133.2001.04380.x. PMID 11531829.
- ^ a b Yunis JJ, Mobini N, Yunis EJ, Alper CA, Deulofeut R, Rodriguez A, et al. (August 1994). "Common major histocompatibility complex class II markers in clinical variants of cicatricial pemphigoid". Proceedings of the National Academy of Sciences of the United States of America. 91 (16): 7747–51. Bibcode:1994PNAS...91.7747Y. doi:10.1073/pnas.91.16.7747. PMC 44479. PMID 8052655.
- ^ Bean SF, Waisman M, Michel B, Thomas CI, Knox JM, Levine M (August 1972). "Cicatricial pemphigoid. Immunofluorescent studies". Archives of Dermatology. 106 (2): 195–9. doi:10.1001/archderm.1972.01620110031007. PMID 4558699.
- ^ Leonard JN, Wright P, Williams DM, Gilkes JJ, Haffenden GP, McMinn RM, Fry L (March 1984). "The relationship between linear IgA disease and benign mucous membrane pemphigoid". The British Journal of Dermatology. 110 (3): 307–14. doi:10.1111/j.1365-2133.1984.tb04636.x. PMID 6365149. S2CID 8889595.
- ^ Kelly SE, Wojnarowska F (January 1988). "The use of chemically split tissue in the detection of circulating anti-basement membrane zone antibodies in bullous pemphigoid and cicatricial pemphigoid". The British Journal of Dermatology. 118 (1): 31–40. doi:10.1111/j.1365-2133.1988.tb01747.x. PMID 3277659. S2CID 43832261.
- ^ Setterfield J, Shirlaw PJ, Kerr-Muir M, Neill S, Bhogal BS, Morgan P, et al. (April 1998). "Mucous membrane pemphigoid: a dual circulating antibody response with IgG and IgA signifies a more severe and persistent disease". The British Journal of Dermatology. 138 (4): 602–10. doi:10.1046/j.1365-2133.1998.02168.x. PMID 9640363. S2CID 20114355.
- ^ Bernard P, Antonicelli F, Bedane C, Joly P, Le Roux-Villet C, Duvert-Lehembre S, et al. (May 2013). "Prevalence and clinical significance of anti-laminin 332 autoantibodies detected by a novel enzyme-linked immunosorbent assay in mucous membrane pemphigoid". JAMA Dermatology. 149 (5): 533–40. doi:10.1001/jamadermatol.2013.1434. PMID 23426192.
- ^ Yasukochi A, Teye K, Ishii N, Hashimoto T (August 2016). "Clinical and Immunological Studies of 332 Japanese Patients Tentatively Diagnosed as Anti-BP180-type Mucous Membrane Pemphigoid: A Novel BP180 C-terminal Domain Enzyme-linked Immunosorbent Assay". Acta Dermato-Venereologica. 96 (6): 762–7. doi:10.2340/00015555-2407. PMID 26984589.
- ^ Sezin T, Egozi E, Hillou W, Avitan-Hersh E, Bergman R (July 2013). "Anti-laminin-332 mucous membrane pemphigoid developing after a diphtheria tetanus vaccination". JAMA Dermatology. 149 (7): 858–62. doi:10.1001/jamadermatol.2013.741. PMID 23700098.
- ^ Kirtschig G, Murrell D, Wojnarowska F, Khumalo N, et al. (Cochrane Skin Group) (2003-01-20). "Interventions for mucous membrane pemphigoid and epidermolysis bullosa acquisita". The Cochrane Database of Systematic Reviews. 2015 (1): CD004056. doi:10.1002/14651858.CD004056. PMC 8406492. PMID 12535507.
- ^ Knudson RM, Kalaaji AN, Bruce AJ (May 2010). "The management of mucous membrane pemphigoid and pemphigus". Dermatologic Therapy. 23 (3): 268–80. doi:10.1111/j.1529-8019.2010.01323.x. PMID 20597945. S2CID 205694155.
- ^ Xu HH, Werth VP, Parisi E, Sollecito TP (October 2013). "Mucous membrane pemphigoid". Dental Clinics of North America. 57 (4): 611–30. doi:10.1016/j.cden.2013.07.003. PMC 3928007. PMID 24034069.