알칼로이드
Alkaloid알칼로이드(Alkaloids)는 적어도 하나의 질소 원자를 포함하는 자연적으로 발생하는 염기성 유기 화합물의 한 종류입니다.이 소분류는 중성 및 심지어 약산성을 [3]가진[2] 일부 관련 화합물도 포함한다.유사한 구조의 일부 합성 화합물은 알칼로이드라고도 [4]할 수 있다.알칼로이드는 탄소, 수소 및 질소 외에도 산소, 황, 그리고 더 드물게 염소, 브롬, [5]인과 같은 다른 원소들을 포함할 수 있다.
알칼로이드는 박테리아, 곰팡이, 식물,[6] 동물을 포함한 다양한 유기체에 의해 생산된다.이들은 산염기 추출 또는 실리카겔 컬럼 크로마토그래피 [7]후 용매 추출에 의해 이들 유기체의 조 추출물로부터 정제될 수 있다.Alkaloids 약리학적 활동의 항말라리아(예를 들어 quinine),antiasthma(예를 들어 ephedrine), 항암(예를 들어 homoharringtonine)[8]콜린 자극제(예를 들어 galantamine)[9]vasodilatory(예를 들어 vincamine), 항부 정맥 약(예를 들어 quinidine), 진통제(예를 들어 morphine)[10]항균(예를 들어 chelerythrine)[11]과antihyp 포함한 넓은 행동할 수 있다.erglycemic 교류활성(예: 피페린)[12][failed verification]많은 사람들이 전통 의학이나 현대 의학에서, 또는 약물을 발견하기 위한 출발점으로 사용되었습니다.다른 알칼로이드는 향정신성(예: 실로신)과 자극제 활동(예: 코카인, 카페인, 니코틴, 테오브로민)[13]을 가지고 있으며, 장출 의례 또는 레크리에이션 약물로 사용되어 왔다.알칼로이드도 독성이 있을 수 있다(예: 아트로핀, 투보쿨라린).[14]비록 알칼로이드가 인간과 다른 동물들의 다양한 대사 체계에 작용하지만, 그들은 거의 균일하게 쓴 [15]맛을 냅니다.
알칼로이드와 다른 질소를 함유한 천연 화합물 사이의 경계가 [16]명확하지 않다.아미노산 펩타이드, 단백질, 뉴클레오티드, 핵산, 아민, 항생제와 같은 화합물은 보통 알칼로이드라고 [2]불리지 않는다.질소(메스칼린, 세로토닌, 도파민 등)를 포함한 천연화합물은 보통 알칼로이드가 [17]아닌 아민으로 분류된다.그러나 일부 저자들은 알칼로이드를 [18][19][20]아민의 특별한 경우로 간주한다.
명명
'알칼로이드'(독일어:알칼로이드)는 1819년 독일의 화학자 카를 프리드리히 빌헬름 메이너에 의해 도입되었으며, 후기 라틴어 뿌리 알칼리와 접미사 - εεήή(( - ('like')[nb 1]에서 유래했다.하지만, 이 용어는 1880년대 [21][22]오스카 야콥센이 알버트 라덴버그의 화학사전에 쓴 리뷰 기사가 발표된 후에야 널리 쓰이게 되었다.
알칼로이드를 [23]명명하는 독특한 방법은 없다.많은 개별 이름들은 종이나 속 이름에 접미사 "ine"[24]을 추가함으로써 형성된다.예를 들어 아트로핀은 아트로파 벨라도나 식물에서 분리되며 스트리치닌은 스트리치닌 나무의 씨앗(Strychnos nux-vomica L.)[5]에서 얻을 수 있다.한 식물에서 여러 개의 알칼로이드를 추출할 경우, 그 이름은 종종 접미사의 변형으로 구별된다: "idine", "anine", "aline", "inine" 등.빈카 로제아(Catharanthus roseus)[25]와 같은 빈카 식물에서 추출되었기 때문에 이름이 "vin"을 포함하는 최소 86개의 알칼로이드가 있습니다. 이러한 알칼로이드를 [26][27][28]빈카 알칼로이드라고 합니다.
역사

알칼로이드를 함유한 식물은 고대부터 치료와 레크리에이션을 위해 인간에 의해 사용되어 왔다.예를 들어,[29] 약용 식물은 기원전 2000년부터 메소포타미아에서 알려져 왔다.호메로스의 오디세이는 이집트 여왕이 헬렌에게 준 선물, 망각을 가져오는 약물을 언급했습니다.그 선물은 아편이 함유된 [30]약이었던 것으로 믿어지고 있다.기원전 1세기-3세기에 쓰여진 화분에 관한 중국의 책에는 에페드라나 아편 [31]양귀비의 의학적 사용에 대해 언급되어 있다.또한 코카 잎은 [32]고대부터 남미 인디언들에 의해 사용되어 왔다.
아코니틴과 투보쿨라린과 같은 독성 알칼로이드를 함유한 식물의 추출물은 고대부터 [29]독화살에 사용되었다.
알칼로이드 연구는 19세기에 시작되었다.1804년, 독일의 화학자 프리드리히 세르튀르너는 아편으로부터 "소포리픽 원리"(라틴어: Principium somniferum)를 분리했는데, 그는 그것을 "모르피움"이라고 불렀고, 그리스 꿈의 신 모페우스를 지칭했다.독일과 다른 중앙 유럽 언어에서는 이것이 여전히 약의 이름이다.영어와 프랑스어로 사용되는 "모르핀"이라는 용어는 프랑스 물리학자 조셉 루이 게이 루삭에 의해 만들어졌다.
개발 초기 알칼로이드의 화학 작용에 중요한 기여를 한 것은 프랑스 연구자 피에르 조셉 펠레티에와 조셉 비에나이메 카벤투가 키니네와 스트리치닌을 발견했다.크산틴(1817), 아트로핀(1819), 카페인(1820), 코니인(1827), 니코틴(1828), 코르히틴(1833), 스파르테인(1851), 코카인(1860)[33]을 포함한 몇몇 다른 알칼로이드들이 그 시기에 발견되었다.알칼로이드 화학의 발달은 20세기 분광법과 크로마토그래피 방법의 등장으로 가속화되었고,[34] 2008년까지 12,000개 이상의 알칼로이드가 확인되었다.
알칼로이드의 첫 완전한 합성은 1886년 독일의 화학자 알베르트 라덴버그에 의해 이루어졌다.그는 2-메틸피리딘과 아세트알데히드를 반응시켜 2-프로페닐피리딘을 [35][36]나트륨과 환원시켜 코니인을 생성하였다.
분류
대부분의 다른 종류의 천연 화합물에 비해 알칼로이드는 구조적 다양성이 큰 것이 특징이다.균일한 [37]분류는 없습니다.처음에는 화학 구조에 대한 지식이 부족할 때, 선원 발전소의 식물 분류에 의존했다.이 분류는 [5][38]이제 사용되지 않는 것으로 간주됩니다.
보다 최근의 분류는 탄소 골격(예: 인돌, 이소퀴놀린, 피리딘 유사) 또는 생화학적 전구체(오르니틴, 리신, 티로신, 트립토판 등)[5]의 유사성에 기초한다.그러나 니코틴은 니코틴아미드의 피리딘 단편과 오르니틴의[39] 피롤리딘 부분을 포함하므로 두 가지 [37][40]부류에 모두 할당될 수 있습니다.
알칼로이드는 종종 다음과 같은 주요 그룹으로 [41]나뉩니다.
- "진짜 알칼로이드"는 헤테로 고리에 질소를 포함하고 아미노산에서 [42]유래합니다.그들의 특징적인 예로는 아트로핀, 니코틴, 모르핀이 있다.이 그룹은 또한 질소 헤테로 고리 외에 테르펜(예: 에보닌[43]) 또는 펩타이드 조각(예: 에르고타민[44])을 포함하는 일부 알칼로이드를 포함한다.피페리딘 알칼로이드 코니인과 코니세인은 아미노산에서 [46]유래하지 않지만 진정한 알칼로이드(pseudo alkaloids가 아닌 아래 [45]참조)로 간주될 수 있다.
- "프로토알칼로이드"는 질소(질소 헤테로사이클이 아님)를 포함하고 아미노산에서 [42]유래한다.예를 들어 메스칼린, 아드레날린, 에페드린 등이 있습니다.
- 폴리아민 알칼로이드 – 푸트레신, 스펠미딘 및 스펠민의 유도체.
- 펩타이드 및 시클로펩타이드 알칼로이드.[47]
- 유사 알칼로이드 – 아미노산에서 [48]유래하지 않은 알칼로이드 유사 화합물.이 소분류는 테르펜 유사 및 스테로이드 유사 알칼로이드뿐만 [49]아니라 카페인, 테오브로민, 테아크린 및 테오필린과 [50]같은 푸린 유사 알칼로이드를 포함한다.일부 저자는 에페드린이나 카시논과 같은 화합물을 의사 알칼로이드로 분류한다.그것들은 아미노산 페닐알라닌에서 유래하지만, 아미노산이 아닌 트랜스아미네이션에 [50][51]의해 질소 원자를 얻는다.
몇몇 알칼로이드들은 그들 그룹의 특징적인 탄소 골격을 가지고 있지 않다.따라서 갈란타민과 호모아포핀은 이소퀴놀린 단편을 포함하지 않지만 일반적으로 이소퀴놀린 알칼로이드에 [52]기인한다.
단량체 알칼로이드의 주요 분류는 아래 표에 나와 있습니다.
| 학급 | 주요 그룹 | 주요 합성 단계 | 예 |
|---|---|---|---|
| 질소 복소환을 가진 알칼로이드(진짜 알칼로이드) | |||
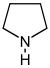
| 피롤리딘 유도체[53] | 오르니틴 또는 아르기닌 → 푸트레신 → N-메틸푸트레신 → N-메틸-δ-피롤린1 | Cuscohygrine, Hygrine, Hygroine, Stachydrine[53][55] | |
| 트로판 유도체[56] | 아트로핀기 포지션 3, 6, 또는7에서의 대체 | 오르니틴 또는 아르기닌 → 푸트레신 → N-메틸푸트레신 → N-메틸-δ-피롤린1 | 아트로핀, 스코폴라민, 히요시아민[53][56][57] |
| 코카인족 포지션 2와 3의 대체 | 코카인, 에코닌[56][58] | ||
| 피롤리지딘유도체[59] | 비에스터 | 식물: 오르니틴 또는 아르기닌 → 푸트레신 → 호모스페르미딘 → 레트로네신[54] | 레트로네신, 헬리오트리딘, 라부닌 |
| 모노카르본산의 복합 에스테르 | 인디케인, 린델로핀, 사라신 | ||
| 대환상 다이스터 | 플라티필린, 트리코데스민[59] | ||
| 1-아미노피롤리진(아미노피롤리진) | 곰팡이 : L-프롤린 + L-호모세린 → N-(3-아미노-3-카르복시프로필)프롤린 → 노르롤린[61][62] | Loline, N-포름올린, N-아세틸린[63] | |
| 피페리딘 유도체[64] | 리신 → 카다베린 → δ-피페리딘1 | 세다민, 로벨린, 아나페린, 피페린[45][66] | |
| 옥탄산→코니세인→코니인[46] | 코니네, 코니세인 | ||
| 퀴놀리지딘 유도체[67][68] | 루피닌기 | 리신 → 카다베린 → δ-피페리딘1 | 루피닌, 누파리딘 |
| 시티신기 | 시티신[67] | ||
| 스파르타인군 | 스파르타인, 루파닌, 아나히그린[67] | ||
| 마트린 그룹. | 마트린, 옥시마트린, 알로마트리딘[67][70][71] | ||
| 오르모사닌기 | 오르모사닌, 핍탄틴[67][72] | ||
| 인돌리지딘유도체[73] | 리신 →α-아디핀산의 γ-세미알데히드 → 파이프콜산 → 1 인돌리지논 | 스와인소닌, 카스타노스페르민[75] | |
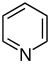
| 피리딘 유도체[76][77] | 피리딘의 단순 유도체 | 니코틴산→디히드로니코틴산→1,2-디히드로피리딘 | 트리고넬린, 리시닌, 아레콜린[76][79] |
| 다환식 비응축 피리딘 유도체 | 니코틴, 노르니코틴, 아나바신, 아나타빈 | ||
| 다환축합피리딘유도체 | 악티니딘, 겐티아닌, 페디쿨리닌 | ||
| 세스키테르펜피리딘유도체 | 니코틴산, 이소류신[20] | 에보닌, 히포크라테인, 트립토닌 | |
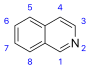
| 이소퀴놀린 유도체 및 관련 알칼로이드 | 이소퀴놀린의 단순 유도체 | 티로신 또는 페닐알라닌 → 도파민 또는 티라민(알칼로이드 아마릴리스용) | 살솔린, 로포세린 |
| 1-이소퀴놀린 및 3-이소퀴놀린 유도체 | N-메틸코리달딘, 노르옥시히드라스티닌 | ||
| 1-페닐테트라히드로이소퀴놀린 유도체 | 크립토스티린 | ||
| 5-나프틸-이소퀴놀린 유도체 | 안키스트로클라딘 | ||
| 1-벤질-이조퀴놀린 및 2-벤질-이조퀴놀린 | 파파베린, 라우다노신, 센다베린 | ||
| 쿨라린기[89] | 쿨라린, 야고닌 | ||
| 파빈과 이소파빈 | 아르게모닌, 아무렌신[90] | ||
| 벤조피로콜린 | 크립토스토린 | ||
| 프로토베루스속 | 베르베린, 카나딘, 오피오카르핀, 메카브리딘, 코리달린 | ||
| 프탈리디소퀴놀린 | 하이드라스틴, 나르코틴(노스카핀) | ||
| 스피로벤질리소퀴놀린 | 푸마르틴 | ||
| 이페카쿠아나 알칼로이드[94] | 에메틴, 프로테메틴, 이페코사이드 | ||
| 벤조페난트리딘 | 산기나린, 옥시니티딘, 코리놀록신 | ||
| 아포르핀류 [82] | 글라우신, 코리딘, 리리오데닌 | ||
| 프로아포핀류 | 프로누시페린, 글라지오빈 | ||
| 호모아포핀류 | 크레시기닌, 멀티클로로민 | ||
| 호모프로아포핀류 | 불보코딘 | ||
| 모르핀[98] | 모르핀, 코데인, 테바인, 시노메닌[99] | ||
| 호모모르 | 크레시기닌, 안드로심빈 | ||
| 트로폴로이소퀴놀린류 | 이미루브린 | ||
| 아조플루오란테네스 | 루페스킨, 이멜루테인 | ||
| 아마릴리스 알칼로이드[102] | 리코린, 암벨린, 타제틴, 갈란타민, 몬타닌 | ||
| 에리스리나 알칼로이드[86] | 에리소딘, 에리소딘 | ||
| 페넌트렌 유도체 | 아테로스페르미닌 | ||
| 프로토핀 [82] | 프로토핀, 옥소무라민, 코리카비딘 | ||
| 아리스톨락탐 | 도리플라빈 | ||
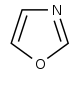
| 옥사졸 유도체[104] | 티로신 → 티라민[105] | Annuloline, halfordinol, texaline, texamine[106] | |
| 이소옥사졸 유도체 | 이보텐산→무시몰 | 이보텐산, 무시몰 | |
| 티아졸 유도체[107] | 1-디옥시-D-자일로오스5-인산(DOXP), 티로신, 시스테인[108] | 노스토시클라미드, 티오스트렙톤 | |
| 키나졸린 유도체[110] | 3,4-디히드로-4-퀴나졸론 유도체 | 안트라닐산, 페닐알라닌 또는 오르니틴[111] | 페브리푸긴[112] |
| 1,4-디히드로-4-퀴나졸론 유도체 | 글리코린, 아르바린, 글리코스미닌[112] | ||
| 피롤리딘 및 피페리딘 키나졸린 유도체 | 바지틴(페가닌) | ||
| 아크리딘 유도체[104] | 안트라닐산[113] | 루타크리돈, 아크로닌[114][115] | |
| 퀴놀린[116][117] 유도체 | 2-퀴놀론 및 4-퀴놀론의 퀴놀린 유도체 단순 유도체 | 안트라닐산 → 3-글리옥시퀴놀린 | 쿠스파린, 에키놉신, 에보카르핀[117][119][120] |
| 삼환식 테르페노이드 | 플린더신[117][121] | ||
| 후라노퀴놀린 유도체 | 딕탐나인, 파가린, 스키미아닌[117][122][123] | ||
| 퀴닌즈 | 트립토판 → 트립타민 → 스트릭토시딘(세콜로가닌 포함) → 코리난탈 → 신호니논[84][118] | 키니네, 키니딘, 신초닌, 시노니딘 | |
| 인돌[99] 유도체 | 비이소프렌 인돌 알칼로이드 | ||
| 단순 인돌 유도체 | 트립토판 → 트립타민 또는 5-히드록시[125] 트립토판 | 세로토닌, 실로시빈, 디메틸트립타민(DMT), 부포테닌[126][127] | |
| β-카르보린의[128] 단순 유도체 | 하만, 하르민, 하르말린, 엘레아닌 | ||
| 필로인돌알칼로이드 | 피소스티그민(에세린), 에테르아민, 피소베닌, 엡타스티그민[129] | ||
| 세미테르페노이드인돌알칼로이드 | |||
| 에르고트 알칼로이드[99] | 트립토판 → chanoclavine → agroclavine → elimoclavine → paspalic → lysergic[129] acid | 에르고타민, 에르고바신, 에르고신[130] | |
| 모노텔페노이드 인돌 알칼로이드 | |||
| 코리난테형 알칼로이드[125] | 트립토판 → 트립타민 → 스트릭토시딘(세콜로가닌 포함) | 아즈말리신, 사르파긴, 보바신, 아즈말린, 요힌빈, 레세르핀, 미트라기닌,[131][132] 그룹스트리치닌 및 (스트리치닌 브루신, 아쿠아마이신, 보미신[133]) | |
| 이보가형 알칼로이드[125] | 이보가민, 이보가인, 보아캉진[125] | ||
| 아스피도스페르마형 알칼로이드[125] | 빈카민, 빈카알칼로이드,[26][134] 빈코틴, 아스피도스페르민[135][136] | ||
| 이미다졸 유도체[104] | 히스티딘에서[137] 직접 추출 | 히스타민, 필로카르핀, 필로신, 스티븐신[104][137] | |
| 푸린 유도체[138] | 크산토신(푸린 생합성에서 형성됨) → 7 메틸크산토신 → 7-메틸크산틴 → 테오브로민[84] → 카페인 | 카페인, 테오브로민, 테오필린, 색시톡신[139][140] | |
| 사이드 체인 내에 질소가 있는 알칼로이드(프로토알칼로이드) | |||
| β-페닐에틸아민유도체[91] | 티로신 또는 페닐알라닌 → 디옥시페닐알라닌 → 도파민 → 아드레날린 및 메스칼린 티로신 → 티라민페닐알라닌 → 1-페닐프로판-1,2-디온 → 카티논 → 에페드린 및 푸소드에페드린[20][51][141] | 티라민, 에페드린, 푸소드에페드린, 메스칼린, 캐시논, 카테콜아민(아드레날린, 노르아드레날린, 도파민)[20][142] | |
| 코르히틴 알칼로이드 | 티로신 또는 페닐알라닌→도파민→가을랄린→콜히틴[144] | 콜히틴, 콜카민[143] | |
| 무스카린[145] | 글루탐산 → 3-케토글루탐산 → 무스카린(피루브산 [146]포함) | 무스카린, 알로무스카린, 에피무스카린, 에피알로무스카린[145] | |
| 벤질아민[147] | 발린, 류신 또는 이소류신을[148] 포함한 페닐알라닌 | 캡사이신, 디히드로캅사이신, 노르디히드로캅사이신, 바닐라민[147][149] | |
| 폴리아민 알칼로이드 | |||
| 푸트레신 유도체[150] | 오르니틴 → 푸트레신 → 스펠미딘 → 스펠민[151] | 포신 | |
| 스펠미딘 유도체[150] | 루나인, 코도노카르핀[150] | ||
| 스펠민 유도체[150] | 베르바세닌, 아펠란드린 | ||
| 펩타이드(시클로펩타이드) 알칼로이드 | |||
| 13원 사이클의 펩타이드 알칼로이드 | Nummuline C 타입 | 다른 아미노산으로부터 | Nummuline C, Nummuline S |
| 지핀형 | 지지핀 A, 새티바닌 H | ||
| 14원 사이클의 펩타이드 알칼로이드 | 프랑굴라닌형 | 프랑굴라닌, 스쿠티아닌 J | |
| 스쿠티아닌 A형 | 스쿠티아닌 A | ||
| Integerrine 유형 | Integerrine, discarine D [152] | ||
| 수륙양용 F형 | 수륙양용기 F, 스피나닌 A | ||
| 암피빈 B형 | 양서류 B, 로터스 C | ||
| 15원 사이클의 펩타이드 알칼로이드 | 뮤크로닌 A형 | 뮤크로닌 A | |
| 의사알칼로이드(테르펜 및 스테로이드) | |||
| 디터펜스 | 리콕토닌형 | 메발론산→이소펜테닐피로인산→제라닐피로인산[153][154] | 아코니틴, 델피닌[44][155] |
| 스테로이드 알칼로이드 [156] | 콜레스테롤, 아르기닌[157] | 솔라니딘, 시클로파민, 바트라코톡신[158] | |
특성.
대부분의 알칼로이드는 분자 구조에 산소를 포함하고 있으며, 이러한 화합물은 주변 조건에서는 보통 무색의 결정체입니다.니코틴이나 [35]코닌과 같은[159] 산소가 없는 알칼로이드는 전형적으로 휘발성, 무색, 기름진 [160]액체입니다.베르베린(노란색)과 산기나린(오렌지색)[160]과 같은 몇몇 알칼로이드들은 색깔이 있습니다.
대부분의 알칼로이드들은 약한 염기들이지만, 테오브로민과 테오필린과 같은 몇몇 알칼로이드들은 양성체이다.[161]많은 알칼로이드는 물에 잘 녹지 않지만 디에틸에테르, 클로로포름 또는 1,2-디클로로에탄과 같은 유기 용제에 쉽게 녹는다.카페인, 코카인,[163] 코데인[164] 및[165] 니코틴은 [162]물에 약간 용해되는 반면(용해도가 1g/L 이하), 모르핀과[167] 요힌빈을[166] 포함한 다른 것들은 매우 미미한 수용성(0.1~1g/L)이다.알칼로이드와 산은 다양한 강도의 소금을 형성한다.이러한 소금은 일반적으로 물과 에탄올에 자유롭게 용해되며 대부분의 유기 용제에 잘 용해되지 않습니다.예외는 유기 용제에 용해되는 스코폴라민 하이드로브로미드와 수용성 황산 [160]키니네를 포함한다.
대부분의 알칼로이드는 맛이 쓰거나 섭취 시 독성이 있다.식물에서 알칼로이드 생산은 초식동물의 먹이에 반응하여 진화한 것으로 보이지만, 일부 동물들은 알칼로이드를 [168]해독하는 능력을 발전시켰다.일부 알칼로이드는 알칼로이드를 섭취하지만 해독할 수 없는 동물의 자손에게 발달 결함을 일으킬 수 있다.한 가지 예는 옥수수 백합 잎에서 생성되는 알칼로이드 시클로파민입니다.1950년대 동안, 옥수수 백합에 풀을 뜯은 양이 낳은 양의 25%가 심각한 얼굴 기형을 가지고 있었다.이는 변형된 턱부터 사이클로피아까지 다양했다(그림 참조).수십 년에 걸친 연구 끝에 1980년대에 이러한 기형의 원인이 된 화합물은 알칼로이드 11-디옥시저빈으로 확인되었고, 나중에 시클로파민으로 [169]이름이 바뀌었다.
자연에서의 분포
알칼로이드는 다양한 생물, 특히 고등 식물에 의해 생성되며, 그 중 약 10-25%가 알칼로이드를 [170][171]포함하고 있습니다.그래서 과거에는 "알칼로이드"라는 용어가 [172]식물과 연관되어 있었다.
식물의 알칼로이드 함량은 보통 몇 퍼센트 이내이며 식물 조직 전체에 걸쳐 불균일하다.식물의 종류에 따라, 최대 농도는 잎(예: 검은 헨베인), 과일이나 씨앗(스트리치닌 나무), 뿌리(라우볼피아 독사) 또는 나무껍질(신코나)[173]에서 관찰된다.또, 같은 식물의 조직 마다 다른 알칼로이드를 [174]함유해도 좋다.
식물 외에 알칼로이드는 사일로시베 균의 실로시빈과 같은 특정 종류의 곰팡이에서 발견되며, 일부 두꺼비 및 다수의 곤충, 현저하게 [175]개미의 피부에 있는 부포테닌과 같은 동물에서 발견됩니다.많은 해양 생물들은 또한 알칼로이드를 [176]포함하고 있다.고등 동물에서 중요한 역할을 하는 아드레날린과 세로토닌과 같은 일부 아민은 구조와 생합성 면에서 알칼로이드와 유사하며 때때로 [177]알칼로이드라고 불립니다.
추출.
알칼로이드의 구조적 다양성 때문에 천연 [178]원료에서 추출하는 단일 방법은 없습니다.대부분의 방법은 대부분의 알칼로이드의 성질을 유기용매에 녹지만 물에 녹지 않는다는 점과 염분의 반대 경향을 이용한다.
대부분의 식물은 여러 개의 알칼로이드를 함유하고 있다.이들의 혼합물을 먼저 추출한 후 개별 알칼로이드를 [179]분리한다.식물은 [178][180]뽑기 전에 완전히 갈아진다.대부분의 알칼로이드는 [178]유기산염의 형태로 원료 식물에 존재한다.추출된 알칼로이드는 염기로 남거나 [179]염기로 변할 수 있다.원료를 알칼리성 용액으로 가공하고 알칼로이드 염기를 1,2-디클로로에탄, 클로로포름, 디에틸에테르, 벤젠 등의 유기용매로 추출함으로써 염기 추출을 할 수 있다.그런 다음, 불순물은 약한 산에 의해 용해됩니다. 이것은 알칼로이드 염기를 물로 씻어내는 소금으로 변환합니다.필요에 따라 알칼로이드염 수용액을 다시 알칼리성으로 하여 유기용매로 처리한다.이 과정은 원하는 순도에 도달할 때까지 반복됩니다.
산성 추출에서 식물 원료는 약산성 용액(예를 들어 물 속의 아세트산, 에탄올 또는 메탄올)에 의해 처리된다.다음으로 염기를 첨가하여 알칼로이드를 유기용매로 추출하는 염기성 형태로 변환한다(알코올로 추출한 경우에는 먼저 제거하고 나머지는 물에 용해한다).용액을 [178][181]위와 같이 정제한다.
알칼로이드는 특정 용제의 용해도 및 특정 시약과의 반응성 또는 [182]증류를 통해 혼합물에서 분리된다.
많은 알칼로이드가 곤충에서 확인되는데, 그 중 솔레놉신이라고 알려진 불개미 독 알칼로이드는 [183]연구자들로부터 더 많은 관심을 받고 있다.이러한 곤충 알칼로이드는 살아있는 불개미의 용매 침지 또는 살아있는 개미의 원심 분리 후 실리카-겔 크로마토그래피 [185]정화를 통해 효율적으로 추출될 수 있습니다.추출된 솔레놉신 개미 알칼로이드의 추적 및 투여는 약 232나노미터의 [186]흡광도 피크를 바탕으로 가능한 것으로 기술되었다.
생합성
대부분의 알칼로이드의 생물학적 전구체는 오르니틴, 리신, 페닐알라닌, 티로신, 트립토판, 히스티딘, 아스파라긴산 [187]및 안트라닐산 등의 아미노산이다.니코틴산은 트립토판 또는 아스파라긴산으로부터 합성할 수 있다.알칼로이드 생합성 방법은 너무 많아 쉽게 [84]분류할 수 없다.그러나 쉬프 염기의 합성과 만니히 [187]반응을 포함한 다양한 종류의 알칼로이드의 생합성에는 몇 가지 전형적인 반응이 있다.
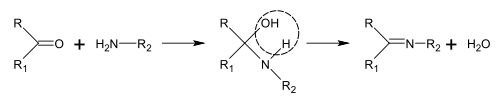
시프 염기의 합성
시프 염기는 아민과 케톤 또는 알데히드를 [188]반응시켜 얻을 수 있다.이러한 반응은 C=N [189]결합을 생성하는 일반적인 방법이다.
알칼로이드의 생합성에서 이러한 반응은 [40]피페리딘의 합성과 같이 [187]분자 내에서 발생할 수 있다.
만니히 반응
아민 및 카르보닐 화합물 외에 만니히 반응의 일체성 성분은 카르보닐이며, [189]카르보닐과 아민의 반응에 의해 형성되는 이온에 대한 친핵성 첨가에서 친핵성 역할을 한다.
Mannich 반응은 분자간 및 [190][191]분자내 모두에서 진행될 수 있습니다.
이합체 알칼로이드
상기 단량체 알칼로이드 외에 2량체, 3량체 및 4량체 알칼로이드의 축합에 의해 형성되는 3량체 및 4량체 알칼로이드도 있다.이합체 알칼로이드는 일반적으로 다음과 같은 메커니즘을 [192]통해 동일한 유형의 모노머로 형성됩니다.
- 예를 들어 보아카민을 일으키는 만니히 반응
- 마이클 리액션(빌랄스토닌)
- 알데히드와 아민(톡시페린)의 응축
- 페놀(Dauricine, Tubokurarine)의 산화적 첨가
- 락톤화(카페인).
또한 카타르란틴과 빈돌린의 [193][194]결합으로 형성되는 빈카 알칼로이드 빈블라스틴과 [26][134]빈크리스틴과 같은 두 개의 뚜렷한 단량체로 형성되는 이합체 알칼로이드도 있다.새로운 반합성 화학요법제 비노렐빈은 비소세포 폐암 [134][195]치료에 사용된다.그것은 빈돌린과 카타란틴의 또 다른 유도체 이합체이며, 루로신[197][198] 또는 모노머 [134][194]자체에서 시작하여 안히드로빈블라스틴으로부터 [196]합성된다.
생물학적 역할
알칼로이드는 가장 중요하고 가장 잘 알려진 2차 대사물, 즉 생물의 정상적인 성장, 발달 또는 번식에 직접적으로 관여하지 않는 생물 발생 물질 중 하나이다.대신, 그들은 일반적으로 생태학적 상호작용을 중재하는데, 이것은 생존성이나 번식력을 증가시킴으로써 유기체의 선택적 이점을 만들어 낼 수 있다.경우에 따라서는 기능이 [199]불분명한 채로 남아 있습니다.요소나 요산이 포유류에 있는 것처럼 알칼로이드가 식물의 질소 대사의 최종 산물이라는 초기 가설은 그들의 농도가 꾸준히 [16]증가하기 보다는 변동한다는 발견으로 반박되었다.
알칼로이드의 알려진 기능 대부분은 보호와 관련이 있다.예를 들어 튤립나무가 생산하는 아포르핀 알칼로이드 리리오데닌은 기생버섯으로부터 보호한다.또한 식물 내에 알칼로이드가 존재하기 때문에 곤충이나 현생동물이 알칼로이드를 섭취하는 것을 방지할 수 있다.하지만, 어떤 동물들은 알칼로이드에 적응하고 심지어 그들의 [200]신진대사에 그것들을 사용한다.세로토닌, 도파민, 히스타민과 같은 알칼로이드 관련 물질은 동물의 중요한 신경 전달 물질이다.알칼로이드는 또한 식물의 [201]성장을 조절하는 것으로 알려져 있다.보호를 위해 알칼로이드를 사용하는 유기체의 한 예는 흔히 화려한 나방으로 알려진 우테히사 오르나트릭스이다.피롤리지딘 알칼로이드는 이러한 유충과 성충 나방을 콕시넬리드 딱정벌레, 녹색 레이스윙, 식충성 반쪽박쥐와 식충성 [202]박쥐와 같은 천적들에게 불쾌하게 만듭니다.이용되고 있는 알칼로이드의 또 다른 예는 독침나방(Agonopterix alstroemeriana)에서 나타난다.이 나방은 애벌레 단계에서 독성이 강하고 알칼로이드가 풍부한 숙주 식물 독을 먹고 산다.A. 알스트로이메리아나는 자연적으로 발생하는 알칼로이드의 독성으로부터 두 가지 이점을 얻을 수 있는데, 이는 포식자에 대한 종의 호감도와 A. 알스트로이메리아나가 원추마쿨라툼을 [203]난소의 정확한 위치로 인식할 수 있는 능력을 통해서이다.솔레놉신이라고 알려진 불개미 독 알칼로이드는 새로운 둥지를 만드는 동안 침입하는 불개미들의 여왕들을 보호하는 것으로 증명되었고, 따라서 이 해충개미 종들이 [204]전 세계로 퍼지는 데 중심적인 역할을 하고 있다.
적용들
의학에서
알칼로이드 함유 식물의 의학적 사용은 오랜 역사를 가지고 있기 때문에, 19세기에 최초의 알칼로이드가 분리되었을 때, 그들은 즉시 임상 [205]실무에 적용되었다.많은 알칼로이드가 여전히 의학에 사용되며,[16][206] 일반적으로 다음과 같은 염류 형태로 널리 사용됩니다.
| 알칼로이드 | 액션. |
|---|---|
| 아즈마린 | 부정맥 방지 |
| 에메틴 | 항원충제, |
| 에르고트 알칼로이드 | 혈관 수축, 환각 유발, 자궁 수축 |
| 글라우신 | 안티바이러스 |
| 모르핀 | 진통제 |
| 니코틴 | 자극제, 니코틴성 아세틸콜린 수용체 작용제 |
| 피소스티그민 | 아세틸콜린에스테라아제억제제 |
| 키니딘 | 부정맥 방지 |
| 키니네 | 항열제, 항말라리아제 |
| 재서핀 | 강압성의 |
| 투보쿨라린 | 근육 이완제 |
| 빈블라스틴, 빈크리스틴 | 항종양제 |
| 빈카민 | 혈관 확장, 항고혈압 |
| 요힌빈 | 흥분제, 최음제 |
많은 합성 및 반합성 약물은 알칼로이드의 구조적 변형으로, 약물의 1차 효과를 강화 또는 변화시키고 원치 [207]않는 부작용을 줄이기 위해 설계되었다.예를 들어 오피오이드 수용체 길항제인 나록손은 [208]아편에 존재하는 테바인의 유도체이다.
농업에서
비교적 독성이 낮은 합성 살충제가 광범위하게 개발되기 전에는 니코틴과 아나바신의 소금과 같은 일부 알칼로이드가 살충제로 사용되었다.인간에 [209]대한 높은 독성으로 인해 사용이 제한되었다.
정신 치료제로 사용
알칼로이드와 그 추출물을 함유한 식물, 그리고 나중에는 순수한 알칼로이드를 함유한 식물 제제는 오랫동안 정신작용 물질로 사용되어 왔다.코카인, 카페인, 그리고 캐시논은 중추신경계의 [210][211]자극제이다.메스칼린과 많은 인돌 알칼로이드(예: 실로시빈, 디메틸트립타민, 이보가인)는 환각 유발 [212][213]효과가 있다.모르핀과 코데인은 강한 마약성 [214]진통제이다.
그 자체로는 강한 정신작용 효과가 없지만 반합성 정신작용 약물의 전조물질인 알칼로이드가 있다.예를 들어 메카티논과 필로폰 [215]제조에는 에페드린과 푸소이드에페드린 등이 사용된다.테바인은 옥시코돈과 같은 많은 진통제의 합성에 사용된다.
「 」를 참조해 주세요.
설명 메모
- ^ 그의 기사의 마지막 문장, W. 마이스너(1819) "위버 플란젠알칼리엔: II. 위버 에인 니에 프란젠알칼리 (알칼로이드)" (식물 알칼리: II)새로운 식물 알칼리(알칼로이드)에 대해 저널 für Chemie und Physik, 25:379–381 ; 온라인:Hathi Trust – Meissner는 다음과 같이 썼다: "Uberhaupt schemint es auch angemessen, die be bezzzt bekannkant Pflanzzenstoffe niche Nich Denstoffet Namennich Demen, Namen, Namen, Namen Damen Demen Den Demenal, Namen Dendem Abschnitt der Pfranzenchemie vor den Pfranzensaeuren Ihre Stelle finden." (즉, 일반적으로 "알칼리"라는 이름이 아닌 "알칼로이드"라는 현재 알려진 식물 물질에 부과하는 것이 적절하다고 생각됩니다. 왜냐하면 그것들은 알칼리 식물의 화학 성분과 크게 다르기 때문입니다.광석은 식물산보다 제자리를 찾는다('알칼로이드'는 'Söure'(산)보다 앞서는 대신 'Alkalien'을 따르기 때문이다).
인용문
- ^ Andreas Luch (2009). Molecular, clinical and environmental toxicology. Springer. p. 20. ISBN 978-3-7643-8335-0.
- ^ a b IUPAC, 화학 용어집, 제2판('골드북') (1997).온라인 수정판: (2006–) "alkaloids"doi: 10.1351/goldbook.A00220
- ^ R. H. F. 만스케알칼로이드들. 화학과 생리학.제8권 - 뉴욕: 학술 출판사, 1965년, 673페이지
- ^ 로버트 앨런 루이스.루이스의 독물학 사전CRC Press, 1998, 51페이지 ISBN 1-5670-223-2
- ^ a b c d 화학 백과사전: 알칼로이드.xumuk.ru
- ^ Roberts, M. F. (Margaret F.) (1998). Alkaloids : Biochemistry, Ecology, and Medicinal Applications. Wink, Michael. Boston, MA: Springer US. ISBN 9781475729054. OCLC 851770197.
- ^ a b c Gonçalves Paterson Fox, Eduardo; Russ Solis, Daniel; Delazari dos Santos, Lucilene; Aparecido dos Santos Pinto, Jose Roberto; Ribeiro da Silva Menegasso, Anally; Cardoso Maciel Costa Silva, Rafael; Sergio Palma, Mario; Correa Bueno, Odair; de Alcântara Machado, Ednildo (April 2013). "A simple, rapid method for the extraction of whole fire ant venom (Insecta: Formicidae: Solenopsis)". Toxicon. 65: 5–8. doi:10.1016/j.toxicon.2012.12.009. hdl:11449/74946. PMID 23333648.
- ^ Kittakoop P, Mahidol C, Ruchirawat S (2014). "Alkaloids as important scaffolds in therapeutic drugs for the treatments of cancer, tuberculosis, and smoking cessation". Curr Top Med Chem. 14 (2): 239–252. doi:10.2174/1568026613666131216105049. PMID 24359196.
- ^ Russo P, Frustaci A, Del Bufalo A, Fini M, Cesario A (2013). "Multitarget drugs of plants origin acting on Alzheimer's disease". Curr Med Chem. 20 (13): 1686–93. doi:10.2174/0929867311320130008. PMID 23410167.
- ^ Raymond S. Sinatra; Jonathan S. Jahr; J. Michael Watkins-Pitchford (2010). The Essence of Analgesia and Analgesics. Cambridge University Press. pp. 82–90. ISBN 978-1139491983.
- ^ Cushnie TP, Cushnie B, Lamb AJ (2014). "Alkaloids: An overview of their antibacterial, antibiotic-enhancing and antivirulence activities". Int J Antimicrob Agents. 44 (5): 377–386. doi:10.1016/j.ijantimicag.2014.06.001. PMID 25130096.
- ^ Qiu S, Sun H, Zhang AH, Xu HY, Yan GL, Han Y, Wang XJ (2014). "Natural alkaloids: basic aspects, biological roles, and future perspectives". Chin J Nat Med. 12 (6): 401–406. doi:10.1016/S1875-5364(14)60063-7. PMID 24969519.
- ^ "Alkaloid". 2007-12-18.
- ^ Robbers JE, Speedie MK, Tyler VE (1996). "Chapter 9: Alkaloids". Pharmacognosy and Pharmacobiotechnology. Philadelphia: Lippincott, Williams & Wilkins. pp. 143–185. ISBN 978-0683085006.
- ^ Rhoades, David F (1979). "Evolution of Plant Chemical Defense against Herbivores". In Rosenthal, Gerald A.; Janzen, Daniel H (eds.). Herbivores: Their Interaction with Secondary Plant Metabolites. New York: Academic Press. p. 41. ISBN 978-0-12-597180-5.
- ^ a b c 로버트 A.마이어스 물리과학기술 백과사전– 알칼로이드, 제3판ISBN 0-12-227411-3
- ^ Leland J. Cseke Natural Products from Plants 제2판.– CRC, 2006, 30페이지 ISBN 0-8493-2976-0
- ^ A. William Johnson 유기화학 초청, Jones and Bartlett, 1999, 433 ISBN 0-7637-0432-6 페이지
- ^ Raj K Bansal 유기화학 교과서.뉴에이지 인터내셔널 제4판, 2004년, 644페이지 ISBN 81-224-1459-1
- ^ a b c d 아니스체프스키, 110페이지
- ^ 헤세, 1~3페이지
- ^ 오스카 야콥센, "알칼로이드" (Ladenburg, Handwörterbuch der Chemie, 독일, 브레슬라우: Eduard Trewendt, 1882), 제1, 페이지 213–422.
- ^ a b 헤세, 5페이지
- ^ 접미사 "ine"은 그리스 여성 후견인의 접미사로 "의 딸"을 의미한다. 따라서 "아트로핀"은 "아트로파의 딸"(벨라도나)을 의미한다.2012-03-16 웨이백 머신에 보관된 단순 알칸의 계통명 개발yale.edu
- ^ 헤세, 7페이지
- ^ a b c van der Heijden, Robert; Jacobs, Denise I.; Snoeijer, Wim; Hallard, Didier; Verpoorte, Robert (2004). "The Catharanthus alkaloids: Pharmacognosy and biotechnology". Current Medicinal Chemistry. 11 (5): 607–628. doi:10.2174/0929867043455846. PMID 15032608.
- ^ Cooper, Raymond; Deakin, Jeffrey John (2016). "Africa's gift to the world". Botanical Miracles: Chemistry of Plants That Changed the World. CRC Press. pp. 46–51. ISBN 9781498704304.
- ^ Raviña, Enrique (2011). "Vinca alkaloids". The evolution of drug discovery: From traditional medicines to modern drugs. John Wiley & Sons. pp. 157–159. ISBN 9783527326693.
- ^ a b 아니스체프스키, 페이지 182
- ^ 헤세, 338페이지
- ^ 헤세, 페이지 304
- ^ 헤세, 350페이지
- ^ 헤세, 313–316페이지
- ^ 베글리, 식물의 천연물.
- ^ a b 1969년-1978년 대소련 백과사전에 수록되어 있다.
- ^ 헤세, 페이지 204
- ^ a b 헤세, 11페이지
- ^ 오레호프, 페이지 6
- ^ 아니스체프스키, 페이지 109
- ^ a b 데윅, 페이지 307
- ^ 헤세, 12페이지
- ^ a b 플레멘코프, 페이지 223
- ^ 아니스체프스키, 페이지 108
- ^ a b c d 헤세, 84페이지
- ^ a b 헤세, 31페이지
- ^ a b c 데윅, 381페이지
- ^ a b c d e f g h i Dimitris C. Gournelif; Gregory G. Laskarisb; Robert Verpoorte (1997). "Cyclopeptide alkaloids". Nat. Prod. Rep. 14 (1): 75–82. doi:10.1039/NP9971400075. PMID 9121730.
- ^ 아니스체프스키, 페이지 11
- ^ 플레멘코프, 페이지 246
- ^ a b 아니스체프스키, 페이지 12
- ^ a b 데윅, 382페이지
- ^ 헤세, 페이지 44, 53
- ^ a b c 플레멘코프, 페이지 224
- ^ a b c 아니스체프스키, 페이지 75
- ^ 오레호프, 33페이지
- ^ a b c 화학 백과사전: 트로판 알칼로이드.xumuk.ru
- ^ 헤세, 34페이지
- ^ 아니스체프스키, 페이지 27
- ^ a b c d 화학 백과사전: 피롤리지딘 알칼로이드xumuk.ru
- ^ 플레멘코프, 페이지 229
- ^ Blankenship JD, Houseknecht JB, Pal S, Bush LP, Grossman RB, Schardl CL (2005). "Biosynthetic precursors of fungal pyrrolizidines, the loline alkaloids". ChemBioChem. 6 (6): 1016–1022. doi:10.1002/cbic.200400327. PMID 15861432. S2CID 13461396.
- ^ Faulkner JR, Hussaini SR, Blankenship JD, Pal S, Branan BM, Grossman RB, Schardl CL (2006). "On the sequence of bond formation in loline alkaloid biosynthesis". ChemBioChem. 7 (7): 1078–1088. doi:10.1002/cbic.200600066. PMID 16755627. S2CID 34409048.
- ^ Schardl CL, Grossman RB, Nagabhyru P, Faulkner JR, Mallik UP (2007). "Loline alkaloids: currencies of mutualism". Phytochemistry. 68 (7): 980–996. doi:10.1016/j.phytochem.2007.01.010. PMID 17346759.
- ^ 플레멘코프, 페이지 225
- ^ 아니스체프스키, 95페이지
- ^ 오레호프, 페이지 80
- ^ a b c d e f 화학 백과사전: 퀴놀리지딘 알칼로이드.xumuk.ru
- ^ 색스턴, 제1권, 93쪽
- ^ 아니스체프스키, 98페이지
- ^ 색스턴, 제1권, 91페이지
- ^ Joseph P. Michael (2002). "Indolizidine and quinolizidine alkaloids". Nat. Prod. Rep. 19 (5): 458–475. doi:10.1039/b208137g. PMID 14620842.
- ^ 색스턴, 제1권, 92페이지
- ^ 데윅, 310페이지
- ^ 아니스체프스키, 96페이지
- ^ 아니스체프스키, 97페이지
- ^ a b c 플레멘코프, 페이지 227
- ^ a b 화학 백과사전: 피리딘 알칼로이드.xumuk.ru
- ^ a b 아니스체프스키, 페이지 107
- ^ a b 아니스체프스키, 페이지 85
- ^ 플레멘코프, 페이지 228
- ^ a b 헤세, 36페이지
- ^ a b c d e f g h i j k l m n o p q r s t 화학 백과사전: 이소퀴놀린 알칼로이드.xumuk.ru
- ^ 아니스체프스키, 77~78페이지
- ^ a b c d 베글리, 알칼로이드 생합성
- ^ a b 색스턴, 제3권, 페이지 122
- ^ a b c 헤세, 54페이지
- ^ a b 헤세, 37페이지
- ^ 헤세, 38페이지
- ^ a b c 헤세, 페이지 46
- ^ a b c 헤세, 50페이지
- ^ a b c Kenneth W. Bentley (1997). "β-Phenylethylamines and the isoquinoline alkaloids" (PDF). Nat. Prod. Rep. 14 (4): 387–411. doi:10.1039/NP9971400387. PMID 9281839.
- ^ a b 헤세, 47페이지
- ^ 헤세, 39페이지
- ^ a b 헤세, 페이지 41
- ^ a b 헤세, 페이지 49
- ^ 헤세, 44페이지
- ^ a b c 색스턴, 제3권, 164페이지
- ^ a b 헤세, 51페이지
- ^ a b c 플레멘코프, 페이지 236
- ^ 색스턴, 제3권, 163페이지
- ^ 색스턴, 제3권, 168페이지
- ^ 헤세, 52페이지
- ^ 헤세, 53페이지
- ^ a b c d e 플레멘코프, 페이지 241
- ^ 브로시, 제35권, 261쪽
- ^ 브로시, 제35권, 260~263페이지
- ^ a b 플레멘코프, 페이지 242
- ^ 베글리, 보조인자 생합성
- ^ John R. Lewis (2000). "Amaryllidaceae, muscarine, imidazole, oxazole, thiazole and peptide alkaloids, and other miscellaneous alkaloids". Nat. Prod. Rep. 17 (1): 57–84. doi:10.1039/a809403i. PMID 10714899.
- ^ 화학 백과사전: 키나졸린 알칼로이드.xumuk.ru
- ^ 아니스체프스키, 페이지 106
- ^ a b 아니스체프스키, 페이지 105
- ^ Richard B. Herbert; Herbert, Richard B.; Herbert, Richard B. (1999). "The biosynthesis of plant alkaloids and nitrogenous microbial metabolites". Nat. Prod. Rep. 16 (2): 199–208. doi:10.1039/a705734b.
- ^ 플레멘코프, 페이지 231, 246
- ^ 헤세, 58페이지
- ^ 플레멘코프, 페이지 231
- ^ a b c d 화학 백과사전: 퀴놀린 알칼로이드.xumuk.ru
- ^ a b 아니스체프스키, 페이지 114
- ^ 오레호프, 페이지 205
- ^ 헤세, 55페이지
- ^ a b 플레멘코프, 232페이지
- ^ 오레호프, 페이지 212
- ^ 아니스체프스키, 118페이지
- ^ a b 아니스체프스키, 112페이지
- ^ a b c d e f 아니스체프스키, 페이지 113
- ^ 헤세, 15페이지
- ^ 색스턴, 제1권, 467페이지
- ^ 데윅, 349–350페이지
- ^ a b c 아니스체프스키, 페이지 119
- ^ 헤세, 29페이지
- ^ 헤세, 23-26페이지
- ^ 색스턴, 제1권, 169페이지
- ^ 색스턴, 제5권, 210페이지
- ^ a b c d Keglevich, Péter; Hazai, Laszlo; Kalaus, György; Szántay, Csaba (2012). "Modifications on the basic skeletons of vinblastine and vincristine". Molecules. 17 (5): 5893–5914. doi:10.3390/molecules17055893. PMC 6268133. PMID 22609781.
- ^ 헤세, 17~18페이지
- ^ 데윅, 페이지 357
- ^ a b 아니스체프스키, 페이지 104
- ^ 헤세, 페이지 72
- ^ 헤세, 페이지 73
- ^ 데윅, 396페이지
- ^ PlantCyc 경로: 2011년 12월 10일 웨이백 머신에 보관된 에페드린 생합성
- ^ 헤세, 76페이지
- ^ a b 화학 백과사전: 코르히틴 알칼로이드.xumuk.ru
- ^ 아니스체프스키, 페이지 77
- ^ a b 헤세, 페이지 81
- ^ 브로시, 제23권, 376쪽
- ^ a b 헤세, 77페이지
- ^ 브로시, 제23권, 268쪽
- ^ 브로시, 제23권, 231쪽
- ^ a b c d e f 헤세, 82페이지
- ^ 스펠민생합성
- ^ a b c d e f 플레멘코프, 페이지 243
- ^ 화학 백과사전: 테르페네.xumuk.ru
- ^ 베글리, 천연 제품:개요
- ^ Atta-ur-Rahman and M. Iqbal Choudhary (1997). "Diterpenoid and steroidal alkaloids". Nat. Prod. Rep. 14 (2): 191–203. doi:10.1039/np9971400191. PMID 9149410.
- ^ 헤세, 88페이지
- ^ 데윅, 388페이지
- ^ 플레멘코프, 페이지 247
- ^ Никотин in the Great Soviet Encyclopedia, 1969–1978 (in Russian)
- ^ a b c 그리케비치, 페이지 131
- ^ G. A. 스필러 카페인, CRC 프레스, 1997년 ISBN 0-8493-2647-8
- ^ "Caffeine". DrugBank. Retrieved 12 February 2013.
- ^ "Cocaine". DrugBank. Retrieved 12 February 2013.
- ^ "Codeine". DrugBank. Retrieved 12 February 2013.
- ^ "Nicotine". DrugBank. Retrieved 12 February 2013.
- ^ "Morphine". DrugBank. Retrieved 12 February 2013.
- ^ "Yohimbine". DrugBank. Archived from the original on 30 January 2013. Retrieved 12 February 2013.
- ^ Fattoruso, 53페이지
- ^ Thomas Acamovic; Colin S. Stewart; T. W. Pennycott (2004). Poisonous plants and related toxins, Volume 2001. CABI. p. 362. ISBN 978-0-85199-614-1.
- ^ 아니스체프스키, 13페이지
- ^ 오레호프, 11페이지
- ^ 헤세, 페이지 4
- ^ 그리케비치, 페이지 122~123
- ^ 오레호프, 12페이지
- ^ Touchard, Axel; Aili, Samira; Fox, Eduardo; Escoubas, Pierre; Orivel, Jérôme; Nicholson, Graham; Dejean, Alain (2016-01-20). "The Biochemical Toxin Arsenal from Ant Venoms". Toxins. 8 (1): 30. doi:10.3390/toxins8010030. ISSN 2072-6651. PMC 4728552. PMID 26805882.
- ^ 파토루소, 페이지 17
- ^ 아니스체프스키, 110-111페이지
- ^ a b c d 헤세, 페이지 116
- ^ a b 그리케비치, 페이지 132
- ^ 그리케비치, 페이지 5
- ^ 그리케비치, 132-134페이지
- ^ 그리케비치, 134-136페이지
- ^ Fox, Eduardo Gonçalves Paterson (2016). "Venom Toxins of Fire Ants". In Gopalakrishnakone, P.; Calvete, Juan J. (eds.). Venom Genomics and Proteomics. Springer Netherlands. pp. 149–167. doi:10.1007/978-94-007-6416-3_38. ISBN 978-94-007-6415-6.
- ^ Fox, Eduardo G. P.; Xu, Meng; Wang, Lei; Chen, Li; Lu, Yong-Yue (2018-05-01). "Speedy milking of fresh venom from aculeate hymenopterans". Toxicon. 146: 120–123. doi:10.1016/j.toxicon.2018.02.050. ISSN 0041-0101. PMID 29510162.
- ^ Chen, Jian; Cantrell, Charles L.; Shang, Han-wu; Rojas, Maria G. (2009-04-22). "Piperideine Alkaloids from the Poison Gland of the Red Imported Fire Ant (Hymenoptera: Formicidae)". Journal of Agricultural and Food Chemistry. 57 (8): 3128–3133. doi:10.1021/jf803561y. ISSN 0021-8561. PMID 19326861.
- ^ Fox, Eduardo G. P.; Xu, Meng; Wang, Lei; Chen, Li; Lu, Yong-Yue (2018-06-01). "Gas-chromatography and UV-spectroscopy of Hymenoptera venoms obtained by trivial centrifugation". Data in Brief. 18: 992–998. doi:10.1016/j.dib.2018.03.101. ISSN 2352-3409. PMC 5996826. PMID 29900266.
- ^ a b c 플레멘코프, 페이지 253
- ^ 플레멘코프, 페이지 254
- ^ a b 데윅, 19페이지
- ^ 플레멘코프, 페이지 255
- ^ 데윅, 페이지 305
- ^ 헤세, 91~105페이지
- ^ Hirata, K.; Miyamoto, K.; Miura, Y. (1994). "Catharanthus roseus L. (Periwinkle): Production of Vindoline and Catharanthine in Multiple Shoot Cultures". In Bajaj, Y. P. S. (ed.). Biotechnology in Agriculture and Forestry 26. Medicinal and Aromatic Plants. Vol. VI. Springer-Verlag. pp. 46–55. ISBN 9783540563914.
- ^ a b Gansäuer, Andreas; Justicia, José; Fan, Chun-An; Worgull, Dennis; Piestert, Frederik (2007). "Reductive C—C bond formation after epoxide opening via electron transfer". In Krische, Michael J. (ed.). Metal Catalyzed Reductive C—C Bond Formation: A Departure from Preformed Organometallic Reagents. Topics in Current Chemistry. Vol. 279. Springer Science & Business Media. pp. 25–52. doi:10.1007/128_2007_130. ISBN 9783540728795.
- ^ Faller, Bryan A.; Pandi, Trailokya N. (2011). "Safety and efficacy of vinorelbine in the treatment of non-small cell lung cancer". Clinical Medicine Insights: Oncology. 5: 131–144. doi:10.4137/CMO.S5074. PMC 3117629. PMID 21695100.
- ^ Ngo, Quoc Anh; Roussi, Fanny; Cormier, Anthony; Thoret, Sylviane; Knossow, Marcel; Guénard, Daniel; Guéritte, Françoise (2009). "Synthesis and biological evaluation of Vinca alkaloids and phomopsin hybrids". Journal of Medicinal Chemistry. 52 (1): 134–142. doi:10.1021/jm801064y. PMID 19072542.
- ^ Hardouin, Christophe; Doris, Eric; Rousseau, Bernard; Mioskowski, Charles (2002). "Concise synthesis of anhydrovinblastine from leurosine". Organic Letters. 4 (7): 1151–1153. doi:10.1021/ol025560c. PMID 11922805.
- ^ Morcillo, Sara P.; Miguel, Delia; Campaña, Araceli G.; Cienfuegos, Luis Álvarez de; Justicia, José; Cuerva, Juan M. (2014). "Recent applications of Cp2TiCl in natural product synthesis". Organic Chemistry Frontiers. 1 (1): 15–33. doi:10.1039/c3qo00024a.
- ^ 아니스체프스키, 페이지 142
- ^ 헤세, 283~291페이지
- ^ 아니스체프스키, 페이지 142~143
- ^ W.E. 코너(2009년).호랑이 나방과 양털곰—악티과 행동, 생태 및 진화.뉴욕: 옥스포드 대학 출판부. 페이지 1~10.ISBN 0195327373.
- ^ Castells, Eva; Berenbaum, May R. (June 2006). "Laboratory Rearing of Agonopterix alstroemeriana, the Defoliating Poison Hemlock (Conium maculatum L.) Moth, and Effects of Piperidine Alkaloids on Preference and Performance". Environmental Entomology. 35 (3): 607–615. doi:10.1603/0046-225x-35.3.607. S2CID 45478867 – via ResearchGate.
- ^ Fox, Eduardo G. P.; Wu, Xiaoqing; Wang, Lei; Chen, Li; Lu, Yong-Yue; Xu, Yijuan (2019-02-01). "Queen venom isosolenopsin A delivers rapid incapacitation of fire ant competitors". Toxicon. 158: 77–83. doi:10.1016/j.toxicon.2018.11.428. ISSN 0041-0101. PMID 30529381. S2CID 54481057.
- ^ 헤세, 303페이지
- ^ 헤세, 303-309페이지
- ^ 헤세, 페이지 309
- ^ 데윅, 335페이지
- ^ Györgi Matolcsy, Miklos Nadasy, Victor Andriska 농약 화학, Elsevier, 2002, 페이지 21-22 ISBN 0-444-98903-X
- ^ 베셀롭스카야, 75페이지
- ^ 헤세, 페이지 79
- ^ 베셀롭스카야, 136페이지
- ^ Ibogaine: Proceedings from the First International Conference (The Alkaloids Book 56). 1950. p. 8. ISBN 978-0-12-469556-6.
- ^ 베셀롭스카야, 6페이지
- ^ 베셀롭스카야, 51-52페이지
일반 참고 자료 및 인용 참고 자료
- Aniszewski, Tadeusz (2007). Alkaloids: secrets of life. Amsterdam: Elsevier. ISBN 978-0-444-52736-3.
- Begley, Tadhg P. (2009). Encyclopedia of Chemical Biology. ChemBioChem. Vol. 10. Wiley. pp. 1569–1570. doi:10.1002/cbic.200900262. ISBN 978-0-471-75477-0.
- Brossi, Arnold (1989). The Alkaloids: Chemistry and Pharmacology. Academic Press.
- Dewick, Paul M. (2002). Medicinal Natural Products: A Biosynthetic Approach (Second ed.). Wiley. ISBN 978-0-471-49640-3.
- Fattorusso, E.; Taglialatela-Scafati, O. (2008). Modern Alkaloids: Structure, Isolation, Synthesis and Biology. Wiley-VCH. ISBN 978-3-527-31521-5.
- Grinkevich NI; Safronich LN, eds. (1983). The chemical analysis of medicinal plants (in Russian). Moscow: Vysshaya Shkola.
- Hesse, Manfred (2002). Alkaloids: Nature's Curse or Blessing?. Wiley-VCH. ISBN 978-3-906390-24-6.
- Knunyants, IL (1988). Chemical Encyclopedia. Soviet Encyclopedia.
- Orekhov, AP (1955). Chemistry alkaloids (Acad. 2nd ed.). Moscow.
- Plemenkov, VV (2001). Introduction to the Chemistry of Natural Compounds. Kazan.
- Saxton, J. E. (1971). The Alkaloids: A Specialist Periodical Report. London: The Chemical Society.
- Veselovskaya, N. B.; Kovalenko, A. E. (2000). Drugs. Moscow: Triada-X.
- Wink, M (2009). "Mode of action and toxicology of plant toxins and poisonous plants". Mitt. Julius Kühn-Inst. 421: 93–112x.