전상
Prophase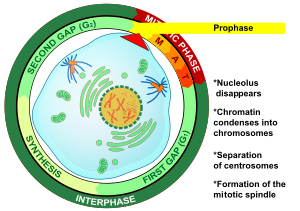
전상(고대 그리스어)은 유사분열과 감수분열 모두에서 세포분열의 첫 단계이다.세포가 전기에 들어갔을 때 중간상 후에 DNA는 이미 복제되었다.전기의 주요 발생은 염색질 망막의 응축과 핵의 [3]소실이다.
염색 및 현미경 검사
현미경은 응축된 염색체가 감수분열과 [4]유사분열을 거치면서 시각화하는 데 사용될 수 있다.
응축 염색체가 [4]전상을 통과하는 움직임을 시각화할 수 있도록 세포를 치료하기 위해 다양한 DNA 얼룩이 사용됩니다.
젬사 G밴딩 기술은 포유류의 염색체 식별에 흔히 사용되지만 식물세포의 [5][4]염색체 압축 정도가 높아 식물세포에 대한 활용은 당초 어려웠다.식물 염색체에 대한 G-밴드화는 [6]1990년에 완전히 실현되었다.감수분열 및 유사분열 전기에 걸쳐 젬사염색을 세포에 적용하여 염색체의 [2]G-밴드화를 유도할 수 있다.보다 현대적인 기술인 은 염색은 Giesma 염색과 함께 감수 분열 전 단계의 [7]다양한 단계에서 시냅토네말 복합체를 촬영하는데 사용될 수 있습니다.G밴딩을 하려면 염색체를 고정해야 하기 때문에 살아있는 세포로는 [8]할 수 없다.
DAPI와 같은 형광 얼룩은 살아있는 식물 세포와 동물 세포 모두에서 사용할 수 있습니다.이러한 얼룩은 염색체를 묶는 것이 아니라 특정 영역과 유전자의 DNA 탐사를 가능하게 한다.형광 현미경의 사용은 공간 [9]분해능을 크게 향상시켰다.
유사분열전기
전기는 동물 세포에서 유사분열의 첫 단계이고 식물 [10]세포에서 유사분열의 두 번째 단계이다.전상이 시작될 때 세포 내 각 염색체의 두 개의 동일한 복사본이 상간 복제로 인해 있습니다.이 복사본들은 자매 염색체라고 불리며 센트로미어라고 [11]불리는 DNA 원소에 의해 결합됩니다.전기의 주요 사건은 염색체의 응축, 중심체의 움직임, 유사분열 방추의 형성, 그리고 핵 [3]분열의 시작이다.
염색체의 응축
중간상 복제한 DNA는 길이가 0.7μm~0.2~0.[3]3μm인 DNA 가닥에서 응축된다.이 과정은 응축 [11]복합체를 사용한다.응축 염색체는 [12]동원체에서 결합된 두 자매 염색체로 구성되어 있다.
중심체의 이동
동물 세포의 전기에, 중심체는 빛 현미경을 [3]사용하여 분해될 수 있을 만큼 충분히 멀리 떨어져 움직인다.γ-튜브린의 보급에 의해 각 중심체의 미소관 활성이 증가한다.중간상으로부터 복제된 중심체는 중심체와 관련된 운동 [13]단백질에 의해 동력을 공급받아 세포의 반대 극을 향해 멀어집니다.각각의 중심체로부터 나온 극간 중간 미세관은 서로 상호작용을 하여 중심체를 반대 [13][3]극으로 이동시키는 것을 돕는다.
유사분열 방추 형성
복제된 중심체가 [3]분리됨에 따라 상간 비계에 관여하는 미세관이 분해된다.동물 세포에서 중심체가 반대 극으로 이동하는 것은 각각의 동원체에 의한 개별 방사상 미소관 배열(aster)[13]의 구성에 의해 동반된다.두 중심체의 극간 미세관은 상호작용하여 일련의 미세관과 결합하고 유사분열 [13]방추체의 기본 구조를 형성합니다.식물 세포는 중심체를 가지고 있지 않으며 염색체는 유사분열 기구에 [13]미세관 조립체를 핵으로 만들 수 있다.식물 세포에서 미세관은 반대 극에 모여 포치라고 [10]불리는 위치에서 방추 장치를 형성하기 시작합니다.유사분열 방추는 유사분열 과정에서 매우 중요하며 결국 중기에서 [3]자매 염색체를 분리할 것이다.
핵분열 시작
핵소체는 전기에 분해되기 시작하여 리보솜 [3]생산을 중단한다.이는 일반적인 세포 대사에서 세포 [3]분열로 세포 에너지가 리디렉션됨을 나타냅니다.이 과정에서 [10]핵 엔벨로프는 손상되지 않은 상태로 유지됩니다.
감수생물전상
감수분열은 두 번의 염색체 분리를 수반하며 따라서 전기를 두 번 거치고 전기와 [12]전기를 두 번 겪는다.상동 염색체가 짝을 이루고 [3]: 98 유전 정보를 교환해야 하기 때문에 전 단계 1은 모든 감수 분열에서 가장 복잡한 단계이다.전상 II는 유사분열 [12]전상과 매우 유사하다.
프로 단계 I
프로상 1은 렙토텐, 지고텐, 파치텐, 디플로텐, 디아키네시스 등 5상으로 나뉜다.유사분열 전기에 발생하는 사건 외에도, 상동 염색체 쌍과 상동 염색체 간의 유전 물질의 상호 교환과 같은 몇 가지 중요한 사건들이 이러한 단계에서 발생한다.1단계는 종과 성별에 따라 다른 속도로 발생한다.많은 종들이 배란이 [3]: 98 될 때까지 프로기 I의 디플로텐에서 감수분열을 멈춘다.인간의 경우 난모세포가 배란 [12]전에 감수분열 I을 빨리 완료하기 위해 1단계 전기에 정지된 상태로 남아 있기 때문에 수십 년이 경과할 수 있다.
렙토텐
전기의 첫 번째 단계인 렙토텐은 염색체가 응축되기 시작합니다.각 염색체는 반수체 상태이고 두 개의 자매 염색체로 구성되어 있다. 그러나 자매 염색체의 염색질은 현미경으로 분해될 [3]: 98 수 있을 만큼 아직 충분히 응축되지 않았다.상동 염색체 쌍 내의 상동 영역은 서로 [2]연관되기 시작한다.
지고텐
전기의 두 번째 단계인 zygotene (그리스어로 "결합"을 의미)에서, 모든 모계 및 부계 유래 염색체들은 그들의 상동성 [3]: 98 짝을 찾았다.상동 염색체 [3]: 98 [12]쌍은 상동 염색체 쌍의 모계 및 부계 유도 비자매 염색체 상에서 시냅스 복합체(단백질 구조)가 유전 정보의 해당 영역을 정렬하는 과정을 거친다.시냅토네마 복합체에 의해 결합된 쌍상동 염색체를 이원체 또는 [10][3]: 98 4원체라고 한다.성(X와 Y) 염색체는 염색체의 작은 영역만이 [3]: 98 상동성이기 때문에 완전히 시냅스가 되지 않는다.
핵은 [14]핵의 중심 위치에서 말초 위치로 이동합니다.
빠치텐
전기의 세 번째 단계인 파치텐(그리스어로 [3]: 98 "두꺼움"을 의미함)은 시냅시스가 끝날 때 시작됩니다.염색질은 현미경으로 [10]염색체를 분해할 수 있을 정도로 응축되어 있다.재조합결절이라 불리는 구조가 이원체의 시냅토네말 복합체에 형성된다.이러한 재조합 결절은 교차 또는 유전자 [3]: 98 재조합으로 알려진 경우 시냅토네말 복합체의 비자매 염색체 간의 유전자 교환을 촉진합니다.각각의 2가마다 다중 재조합 이벤트가 발생할 수 있습니다.인간의 경우, [13]: 681 각 염색체마다 평균 2-3개의 사건이 발생한다.
디플로텐
전상 I의 네 번째 단계인 디플로텐(그리스어로 "2중"을 의미함)에서 교차가 [3]: 99 [10]완료된다.상동 염색체는 완전한 유전자 정보를 보유하고 있지만, 상동 염색체는 현재 모계 및 부계 [3]: 99 혼혈이다.키아스마타라고 불리는 눈에 보이는 접합부는 시냅토네마 복합체가 [12][3]: 99 분해되면서 재조합이 일어난 위치에서 상동 염색체를 함께 고정시킵니다.많은 [3]: 99 종에서 감수성 정지가 일어나는 것은 이 단계이다.
디아키네시스
전상 I의 5단계이자 마지막 단계인 디아키네시스(그리스어로 "이중 운동"을 뜻하는)에서 완전한 염색질 응축이 발생했으며 4개의 자매 염색체 모두 현미경으로 이원체에서 볼 수 있다.나머지 단계는 유사분열성 프로메타파제의 초기 단계와 유사하며, 감수생물학적 전기는 스핀들 장치가 형성되기 시작하고 핵막이 [10][3]: 99 분해되기 시작합니다.
프로 단계 II
감수 분열의 전 단계 II는 유사 분열의 전 단계와 매우 유사하다.가장 눈에 띄는 차이는 전상 II가 [12][10]유사분열 전상에서의 이배체 수와 달리 반수체 염색체 수에서 발생한다는 것이다.동물세포와 식물세포 모두에서 염색체는 말기II 중에 축합해 [3]: 100 [10]전상II에서 재축합하도록 요구할 수 있다.염색체가 재응축할 필요가 없다면 모델 유기체 Arabidopsis에서 [10]볼 수 있듯이 전상 II는 매우 빠르게 진행된다.
제1상 체포
암컷 포유동물과 조류는 미래의 배란에 필요한 모든 난모세포를 가지고 태어나며, 이러한 난모세포는 감수 [15]분열의 전 단계 I에서 멈춘다.예를 들어 인간의 경우 난모세포는 태아 내에서 임신 3~4개월 사이에 형성되어 출생 시에 존재한다.이 전단계에서 나는 수십 년 동안 지속될 수 있는 단계(dictyate)를 체포했다. 게놈의 복사본은 난모세포에 4개 있다.1단계 체포의 적응적 의미는 아직 완전히 이해되지 않았다.그러나, 4개의 게놈 복사 단계에서 octeyes의 체포는 생식선 [15]DNA의 손상을 복구하는 데 필요한 정보 중복성을 제공할 수 있다고 제안되었다.사용된 복구 과정은 상동 재조합[15][16] 복구로 보입니다. 전상 정지 난모세포는 DNA 손상을 효율적으로 [16]복구하는 높은 능력을 가지고 있습니다.DNA 복구 능력은 암컷 배아 라인의 핵심 품질 관리 메커니즘이자 [16]불임성의 중요한 결정 요인인 것으로 보인다.
동식물 세포 전기의 차이

식물 세포와 동물 세포에서 전기의 가장 두드러진 차이는 식물 세포에 중심세포가 부족하기 때문에 발생한다.스핀들 장치의 구성은 세포의 반대 극에 있는 포치와 연결되거나 염색체에 의해 매개된다.또 다른 주목할 만한 차이점은 프리프로파아제인데, 프리프로파아제 띠를 형성하는 식물 유사 분열의 추가 단계이다.식물의 유사분열 전상 I에서는 이 [10]띠가 사라진다.
셀 체크 포인트
감수분열에서 전기는 식물세포와 동물세포에서 일어나는 [3]전기의 가장 복잡한 반복이다.상동 염색체의 쌍과 유전자 물질의 재조합이 적절히 이루어지도록 하기 위해 세포 검사점이 마련되어 있다.감수성 체크포인트 네트워크는 이중 가닥 절단 복구, 염색질 구조, [17]염색체 이동 및 쌍을 제어하는 DNA 손상 대응 시스템입니다.이 시스템은 세포가 [18]재조합으로 인한 오류와 함께 메타기 I에 진입하는 것을 방지하는 다중 경로(마이오틱 재조합 체크포인트 포함)로 구성됩니다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b Nussbaum RL, McInnes RR, Huntington F (2016). Thompson & Thompson Genetics in Medicine. Philadelphia: Elsevier. pp. 12–20. ISBN 9781437706963.
- ^ a b c Schermelleh L, Carlton PM, Haase S, Shao L, Winoto L, Kner P, et al. (June 2008). "Subdiffraction multicolor imaging of the nuclear periphery with 3D structured illumination microscopy". Science. 320 (5881): 1332–36. Bibcode:2008Sci...320.1332S. doi:10.1126/science.1156947. PMC 2916659. PMID 18535242.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y Hartwell LH, Hood L, Goldberg ML, Reynolds AE, Silver LM, Veres RC (2008). Genetics From Genes to Genomes. New York: McGraw-Hill. pp. 90–103. ISBN 978-0-07-284846-5.
- ^ a b c Singh RJ (2017). Plant Cytogenetics (Third ed.). Boca Raton, FL: CBC Press, Taylor & Francis Group. p. 19. ISBN 9781439884188.
- ^ Wang HC, Kao KN (1988). "G-banding in plant chromosomes". Genome. 30: 48–51. doi:10.1139/g88-009 – via ResearchGate.
- ^ Kakeda K, Yamagata H, Fukui K, Ohno M, Fukui K, Wei ZZ, Zhu ES (August 1990). "High resolution bands in maize chromosomes by G-banding methods". Theoretical and Applied Genetics. 80 (2): 265–72. doi:10.1007/BF00224397. PMID 24220906. S2CID 6600449.
- ^ Pathak S, Hsu TC (January 1979). "Silver-stained structures in mammalian meiotic prophase". Chromosoma. 70 (2): 195–203. doi:10.1007/bf00288406. PMID 85512. S2CID 27763957.
- ^ Sumner AT (May 1982). "The nature and mechanisms of chromosome banding". Cancer Genetics and Cytogenetics. 6 (1): 59–87. doi:10.1016/0165-4608(82)90022-x. PMID 7049353.
- ^ de Jong H (December 2003). "Visualizing DNA domains and sequences by microscopy: a fifty-year history of molecular cytogenetics". Genome. 46 (6): 943–6. doi:10.1139/g03-107. PMID 14663510.
- ^ a b c d e f g h i j k Taiz L, Zeiger E, Moller IM, Murphy A (2015). Plant Physiology and Development. Sunderland MA: Sinauer Associates. pp. 35–39. ISBN 978-1-60535-255-8.
- ^ a b Zeng XL, Jiao MD, Wang XG, Song ZX, Rao S (2001). "Electron microscopic studies on the Silver-stained Nucleolar Cycle of Physarum Polycephalum" (PDF). Acta Botanica Sinica. 43 (7): 680–5. Archived from the original (PDF) on 2018-10-01. Retrieved 24 February 2015.
- ^ a b c d e f g Nussbaum RL, McInnes RR, Willard HF (2016). Thompson & Thompson Genetics in Medicine. Philadelphia: Elsevier. pp. 12–20. ISBN 978-1-4377-0696-3.
- ^ a b c d e f Alberts B, Bray D, Hopkin K, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2004). Essential Cell Biology. New York NY: Garland Science. pp. 639–658. ISBN 978-0-8153-3481-1.
- ^ Zickler D, Kleckner N (1998). "The leptotene-zygotene transition of meiosis". Annual Review of Genetics. 32: 619–97. doi:10.1146/annurev.genet.32.1.619. PMID 9928494.
- ^ a b c Mira A (September 1998). "Why is meiosis arrested?". Journal of Theoretical Biology. 194 (2): 275–87. Bibcode:1998JThBi.194..275M. doi:10.1006/jtbi.1998.0761. PMID 9778439.
- ^ a b c Stringer JM, Winship A, Zerafa N, Wakefield M, Hutt K (May 2020). "Oocytes can efficiently repair DNA double-strand breaks to restore genetic integrity and protect offspring health". Proceedings of the National Academy of Sciences of the United States of America. 117 (21): 11513–11522. doi:10.1073/pnas.2001124117. PMC 7260990. PMID 32381741.
- ^ Hochwagen A, Amon A (March 2006). "Checking your breaks: surveillance mechanisms of meiotic recombination". Current Biology. 16 (6): R217-28. doi:10.1016/j.cub.2006.03.009. PMID 16546077.
- ^ MacQueen AJ, Hochwagen A (July 2011). "Checkpoint mechanisms: the puppet masters of meiotic prophase". Trends in Cell Biology. 21 (7): 393–400. doi:10.1016/j.tcb.2011.03.004. PMID 21531561.
외부 링크
 Wikimedia Commons의 Prophase 관련 미디어
Wikimedia Commons의 Prophase 관련 미디어



