사카로미세스 세레비시아
Saccharomyces cerevisiae| 사카로미세스 세레비시아 | |
|---|---|
 | |
| S. 세레비시아에, 전자 현미경 사진 | |
| 과학적 분류 | |
| 왕국: | 곰팡이 |
| 중분류: | 아스코마이코타 |
| 클래스: | 당균류 |
| 주문: | 당균류 |
| 패밀리: | 사카로미세테과 |
| 속: | 사카로미세스 |
| 종류: | 세레비시아에 |
| 이항명 | |
| 사카로미세스 세레비시아 | |
사카로미세스 세레비시아에(/ɛsərɪvɪsi.i)/)는 효모의 일종이다.그 종은 고대부터 와인 제조, 제빵, 양조 등에 중요한 역할을 해왔다.그것은 원래 [a]포도 껍질에서 분리되었다고 여겨진다.그것은 분자 및 세포 생물학에서 가장 집중적으로 연구된 진핵 생물 모델 유기체 중 하나이며, 모델 박테리아로서의 대장균과 매우 유사합니다.그것은 가장 일반적인 발효의 배후에 있는 미생물이다.S. cerevisiae 세포는 직경 5~10 μm의 둥근 난형이다.싹을 [1]틔움으로써 번식합니다.
인간 생물학에서 중요한 많은 단백질들은 효모의 상동성을 연구함으로써 처음 발견되었다; 이 단백질들은 세포 주기 단백질, 신호 단백질, 그리고 단백질 처리 효소를 포함한다.S. cerevisiae는 현재 특정 분비 경로에 관여하는 버클리 몸체가 존재하는 것으로 알려진 유일한 효모 세포이다.세레비시아에 대한 항체는 크론병 환자의 60~70%, 궤양성 대장염 환자의 10~15%에서 발견되며, 염증성 장질환(예: 궤양성 대장염과 크론병 사이), 국소화 및 [2]중증도를 구별하는 혈청학적 지표 패널의 일부로 유용할 수 있다.
어원학
사카로미케스는 그리스어로 "설탕 몰드" 또는 "설탕-풍구스"를 의미하며, 사카론(άραονν)은 "설탕"과 "풍구스"를 결합한 형태이며, 미세스(μμμμμαη)))는 "풍구스"[3][4]를 의미한다.세레비시아에는 라틴어에서 왔고 "맥주의"[5]라는 뜻이다.다른 생물명은 다음과 같다.
이 종은 또한 영양 효모와 효모 추출물의 주요 공급원이다.
역사
19세기에 제빵사들은 맥주 양조업자들로부터 효모를 얻었고, 이것은 일반적으로 유산균의 산성화에 의해 생기는 신맛이 부족한 제국산 "카이저세멜" [7]롤과 같은 단 발효 빵으로 이어졌다.그러나 맥주 양조업자들은 서서히 상면발효(S. cerevisiae)에서 하면발효(S. pastorianus) 효모로 전환했다.비엔나 프로세스는 [8]1846년에 개발되었습니다.반면 혁신은 종종 일반적으로 베이킹 오븐에서는 다른 지각 특성에 증기를 사용하여에 대해 공로를 인정 받고 있다는 점이 점진적으로 대신 한 패스가 포함되며, top-fermenti 수확하기 더 나은 프로세스와 그들까지 계속 그들 균열 곡물(비엔나 grits[9] 보)의 높은 밀링 위한 절차를 포함하여로 주목할 만하다.쇼핑효모,[citation needed] 프레스 스크래치로 알려져 있습니다.
루이 파스퇴르의 연구에 따른 미생물학의 개선은 순수한 균주를 배양하는 더 발전된 방법으로 이어졌다.1879년, 영국 S.cerevisiae의 생산을 위하여 vats 성장하는 전문화되고, 미국은세기의 원심 분리기가 바뀔 주위의 yeast,[10]고 commercia에 기여한 그것의 유통, 감소된 단가 보다 간소화된 주요 산업 과정에 효모 생산을 돌리고 집중하기에 사용되었다고 소개했다.lis빵과 맥주의 이온과 상품화신선한 "케이크 효모"는 [11]20세기 초 서구 대부분의 빵 제빵업자들에게 표준 효모가 되었다.
제2차 세계대전 중 플라이슈만은 미군을 위해 과립화된 활성 건조 효모를 개발했습니다. 이 효모는 냉장 없이 신선 효모보다 유통기한이 길고 온도 내구성이 뛰어납니다.그 효모는 여전히 미군 레시피의 표준 효모입니다.그 회사는 굽는 시간을 단축하면서 두 배나 빨리 부풀어오르는 효모를 만들었다.Lesaffre는 나중에 1970년대에 인스턴트 효모를 만들었는데, 이 효모는 다양한 [citation needed]응용 분야에서 신선 효모와 건조 효모를 희생시키면서 상당한 사용과 시장 점유율을 얻었다.
생물학
생태학
자연에서, 효모 세포는 주로 포도와 같은 잘 익은 과일에서 발견됩니다.[12]세레비시아에는 참나무 껍질에서도 일년 내내 [13]볼 수 있습니다.S. cerevisiae는 공수가 아니기 때문에 [14]움직이려면 벡터가 필요하다.
성충으로 월동하는 사회적 말벌의 여왕(Vespa crabro와 Polistes spp.)은 가을부터 봄까지 효모 세포를 숨겨서 [15]자손에게 전달할 수 있습니다.사회성 말벌인 폴리스테스 도미눌라의 창자는 S. cerevisiae 변종뿐만 아니라 S. cerevisiae x S. paradoxus 잡종을 수용합니다.Stefanini et al. (2016)는 Polistes dominula의 장이 세포 포자와 포자 [16]발아를 촉진하는 환경 조건을 제공함으로써 그들끼리 그리고 S. paradoxus 세포와의 결합을 선호한다는 것을 보여주었다.
S. cerevisiae의 성장을 위한 최적의 온도는 30–35 °C이다.[15]
라이프 사이클
효모세포의 두 가지 형태는 생존하고 성장할 수 있다: 반수체와 이배체.반수체 세포는 유사분열과 성장의 단순한 라이프사이클을 거치고, 높은 스트레스 조건에서는 일반적으로 죽을 것이다.이건 곰팡이의 무성형이야이배체 세포(효모의 선호적인 '형태')는 유사분열과 성장의 단순한 라이프사이클을 거친다.유사분열 세포 주기가 진행되는 속도는 종종 반배체와 이배체 [17]세포 사이에서 상당히 다르다.스트레스 조건 하에서, 이배체 세포는 포자를 거쳐 감수 분열에 들어가 4개의 반배체 포자를 만들 수 있으며, 이 포자는 이후에 짝짓기를 할 수 있다.이건 곰팡이의 성적인 형태야최적의 조건에서 효모세포는 [18][19]100분마다 개체 수를 두 배로 늘릴 수 있다.그러나 성장률은 변종과 [20]환경에 따라 크게 다릅니다.평균 복제 수명은 약 26개의 세포 [21][22]분열입니다.
야생에서 열성 유해 돌연변이는 이배체의 무성 생식을 하는 동안 축적되고, 자가 생식을 하는 동안 제거된다: 이 제거는 "유전자 재생"[23][24]이라고 불린다.
영양 요구 사항
이 섹션은 어떠한 출처도 인용하지 않습니다. 2021년 1월 (이를 에 대해 설명합니다) |
세레비시아의 모든 변종들은 포도당, 말토스, 트레할로스에서 곡예적으로 자랄 수 있고 유당과 셀로비오스에서는 자라지 못합니다.하지만, 다른 설탕의 성장은 가변적입니다.갈락토스와 과당은 최고의 발효당 중 두 가지이다.효모가 다른 당을 사용하는 능력은 그것들이 곡예적으로 재배되는지 혐기적으로 재배되는지에 따라 달라질 수 있다.몇몇 변종들은 수크로스와 트레할로오스에서는 혐기적으로 자랄 수 없다.
모든 균주는 암모니아와 요소를 유일한 질소원으로 사용할 수 있지만 암모늄 이온으로 환원하는 능력이 없기 때문에 질산염은 사용할 수 없다.그들은 또한 대부분의 아미노산, 작은 펩타이드, 그리고 질소 염기를 질소원으로 사용할 수 있다.그러나 히스티딘, 글리신, 시스틴 및 리신은 쉽게 사용되지 않는다.세레비시아에는 단백질 분해 효소가 배설되지 않기 때문에 세포외 단백질이 대사되지 않습니다.
효모는 또한 인산수소 이온으로 동화되는 인과 황산 이온 또는 아미노산 메티오닌, 시스테인과 같은 유기 황 화합물로 동화될 수 있는 황에 대한 요구 사항을 가지고 있습니다.마그네슘, 철분, 칼슘, 아연과 같은 일부 금속들도 효모의 좋은 성장을 위해 필요합니다.
유기 요구 사항과 관련하여, S. cerevisiae의 대부분의 균주는 비오틴을 필요로 한다.실제로, S. cerevisiae 기반 성장 분석은 비오틴의 분리, 결정화 및 이후 구조 결정을 위한 기초를 마련했다.대부분의 변종들은 또한 완전히 성장하기 위해 판토텐산염이 필요하다.일반적으로 S. cerevisiae는 비타민의 원영양이다.
짝짓기
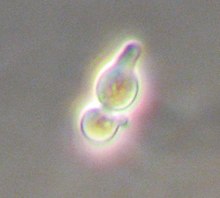
효모는 두 가지 짝짓기 유형인 a와 α(알파)가 있는데, 이는 성 분화의 [25]원시적인 측면을 보여준다.다른 많은 진핵생물들과 마찬가지로, 짝짓기는 유전자 재조합, 즉 염색체의 새로운 조합의 생산으로 이어진다.서로 반대되는 짝짓기 유형의 두 개의 반수체 효모 세포는 포자를 형성하여 또 다른 반수체 세포를 형성하거나 계속해서 이배체 세포로 존재할 수 있는 이배수체 세포는 짝짓기를 할 수 있다.짝짓기는 유전자, 플라스미드 또는 단백질을 마음대로 [citation needed]결합하는 도구로 생물학자들에 의해 이용되어 왔다.
짝짓기 경로는 G단백질 결합 수용체, G단백질, RGS단백질 및 사람에게서 발견되는 것과 상동하는 3층 MAPK 시그널링 캐스케이드를 사용한다.이 기능은 신호 전달 및 [citation needed]감작 해제의 기본 메커니즘을 조사하기 위해 생물학자에 의해 이용되었습니다.
셀 사이클
효모의 성장은 모세포에서 분리될 때 성숙한 세포의 크기에 도달하는 싹의 성장과 동기화된다.영양이 풍부하고 빠르게 성장하는 효모 배양에서, 싹이 형성되는 것이 세포 주기 전체를 차지하기 때문에 모든 세포는 싹을 틔웁니다.모녀 세포는 세포 분리가 일어나기 전에 싹 형성을 시작할 수 있다.효모 배양에서 싹이 부족한 세포는 볼 수 있고 싹 형성은 세포 [citation needed]주기의 일부만 차지한다.
사이토키네시스
Cytokinesis는 발아한 효모 Saccharomyces cerevisiae가 두 개의 딸 세포로 분열할 수 있도록 합니다.세레비시아에는 세포 주기 내내 자랄 수 있는 싹을 형성하고 나중에 유사분열이 [26]완료되면 모세포를 떠납니다.
S. cerevisiae는 다른 운명과 크기를 가진 두 딸을 만들기 위해 편광 세포를 사용하여 비대칭적으로 분열하기 때문에 세포 주기 연구와 관련이 있다.마찬가지로 줄기세포는 자기 재생과 [27]분화를 위해 비대칭 분열을 사용한다.
타이밍.
많은 셀에서 S 단계가 완료될 때까지 M 단계가 발생하지 않습니다.그러나 S. cerevisae에서 유사분열로 진입하는 경우 이는 사실이 아니다.사이토키네시스는 후기 G1의 싹트기 과정부터 시작하여 다음 주기의 중간쯤에야 완성된다.스핀들 조립은 S phase가 염색체 [26]복제를 완료하기 전에 발생할 수 있습니다.또한 M과 S 사이에 명확하게 정의된 G2가 없다.그러므로, 고등 진핵 [26]생물에는 광범위한 조절이 결여되어 있다.
딸이 태어났을 때, 딸은 엄마의 [28]3분의 2 크기입니다.이 과정을 통해 어미의 크기는 거의 [29]또는 전혀 변하지 않습니다.RAM 경로는 사이토키네시스가 완료된 직후 딸 세포에서 활성화된다.이 경로를 통해 딸이 제대로 [28]분리되었는지 확인할 수 있습니다.
악토미오신환 및 일차중격형성
두 개의 상호의존적 사건이 S. cerevisiae에서 사이토키네시스(cytokinesis첫 번째 사건은 수축성 악토미오신 고리(AMR) 수축이고, 두 번째 사건은 사이토키네시스 동안에만 형성될 수 있는 키친성 세포벽 구조인 1차 격막(PS) 형성이다.PS는 동물에서 세포외 매트릭스 [28]리모델링 과정을 닮았다.AMR이 수축하면 PS가 성장하기 시작합니다.AMR이 중단되면 PS가 잘못 배치되어 둘 다 의존적인 역할이 있음을 나타냅니다.또한 PS를 교란시키는 것은 AMR의 교란으로 이어지며, 이는 악토미오신 고리와 1차 격막 모두 상호의존적인 [30][29]관계가 있음을 시사한다.
세포에 접하는 세포막에 부착된 AMR은 세포가 [26]분열하도록 조정되는 액틴과 미오신 II 분자로 구성됩니다.고리는 수축력으로서 [citation needed]플라즈마 막의 침윤에 중요한 역할을 하는 것으로 생각된다.
수축 고리의 적절한 조정 및 올바른 위치 조립은 중격 고리의 전구체인 중격에 따라 달라집니다.이러한 GTPase는 다른 단백질과 복합체를 형성한다.셉틴은 G1 후반기에 싹이 만들어질 장소에서 고리를 형성한다.이러한 메커니즘은 알려지지 않았지만, 그들은 액틴-미오신 고리의 형성을 촉진하는데 도움을 준다.그들은 다른 필요한 사이토키네시스 [26]과정을 위한 구조적 지원을 제공하는 것을 제안합니다.봉오리가 돋으면 셉틴 고리가 모래시계를 형성한다.셉틴 모래시계와 미오신 고리가 함께 있는 것이 미래 분열 [citation needed]사이트의 시작이다.
셉틴과 AMR 복합체는 골지체에서 [31]소포에 의해 보내지는 글루칸과 다른 키친 분자로 구성된 1차 셉텀을 형성한다.AMR 수축이 완료된 후 글루칸에 의해 2차 중격(secondary septum)이 형성된다.AMR 링이 어떻게 분리되는지는 아직 [27]잘 알려지지 않았습니다.
미세관은 AMR과 중격에 비해 사이토키네시스에서는 중요한 역할을 하지 않는다.미소관의 파괴는 분극 [32]성장을 크게 저해하지 않았다.따라서 AMR과 중격 형성은 사이토키네시스([citation needed]cytokinesis)의 주요 동인이다.
핵분열 효모와의 차이점
- 싹트기 시작한 효모는 모세포에서 싹을 틔운다.이 싹은 세포 주기 동안 자라서 분리된다; 핵분열 효모는 세포벽을 형성함으로써 분열한다.
- 사이토키네시스는 효모가 싹트기 시작할 때 G1에서 시작하는 반면, 사이토키네시스는 핵분열 효모를 위해 G2에서 시작됩니다.핵분열 효모는 중간점을 "선택"하는 반면, 싹트는 효모는 싹 부위를 "선택"한다.
- 초기 과민기 동안 액토미오신 고리와 격막은 싹이 트는 효모에서 계속 발달하고 중합기 동안 핵분열 효모에서 발달한다-악토미오신 고리는 발달하기 시작한다
생물학 연구에 있어서
이 섹션은 확인을 위해 추가 인용문이 필요합니다. 2021년 1월 (이를 에 대해 설명합니다) |
모델 유기체

연구자들이 그들의 연구에 사용할 유기체를 찾을 때, 그들은 몇 가지 특징을 찾는다.이 중에는 크기, 생성 시간, 접근성, 조작성, 유전학, 메커니즘의 보존, 잠재적 경제적 이득 등이 있습니다.효모종 S. pombe와 S. cerevisiae는 둘 다 잘 연구되고 있다; 이 두 종은 약 6억에서 3억 년 전에 갈라졌고, DNA 손상과 복구 메커니즘 [34]연구에 중요한 도구이다.
S. 세레비시아이는 여러 가지 기준에서 좋은 점수를 받았기 때문에 모범 유기체로 발전해 왔다.
- 단세포 유기체로서, S. cerevisiae는 짧은 생성 시간(30°C 또는 86°F에서 1.25-2시간[35])으로 작고 쉽게 배양할 수 있다.여러 시료 라인의 신속한 생산과 유지보수를 저비용으로 할 수 있다는 점에서 모두 긍정적인 특징이다.
- S. 세레비시아이는 감수분열로 분열되어 성유전학 연구의 후보가 된다.
- S. 세레비시아에는 새로운 유전자의 추가 또는 상동 재조합을 통한 결실을 허용하도록 변형될 수 있다.또한 S. 세레비시아에 반수체로서 배양할 수 있는 능력은 유전자 녹아웃 균주의 생성을 간략화한다.
- 진핵생물으로서, S. cerevisiae는 고등 진핵생물에서 연구를 혼란시킬 수 있는 높은 비율의 비코드 DNA 없이 식물과 동물의 복잡한 내부 세포 구조를 공유합니다.
- S. cerevisiae 연구는 산업에서의 확립된 사용의 결과로서 적어도 초기에는 강력한 경제적 추진력이다.
노화 연구에 있어서
50년 이상 동안 S. cerevisiae는 노화를 더 잘 이해하기 위해 모델 유기체로 연구되어 왔고 다른 모델 [36]유기체보다 노화에 영향을 미치는 더 많은 포유류의 유전자를 확인하는 데 기여해왔다.효모를 사용하여 연구된 주제 중 일부는 노화에 관련된 유전자와 세포 경로뿐만 아니라 칼로리 제한이다.효모의 노화를 측정하는 가장 일반적인 두 가지 방법은 세포가 분열하는 횟수를 측정하는 Replicative Life Span(RLS; 반복 수명)과 세포가 분열하지 않는 정지 상태에서 [36]얼마나 오래 생존할 수 있는지를 측정하는 CLS(Chronological Life Span)입니다.배지의 포도당 또는 아미노산의 양을 제한하면 효모뿐만 아니라 다른 [37]유기체에서도 RLS와 CLS가 증가하는 것으로 나타났다.처음에 이것은 sir2 효소를 상향 조절함으로써 RLS를 증가시키는 것으로 생각되었지만, 나중에 이 효과가 sir2와 무관하다는 것이 밝혀졌다.sir2 및 fob1 유전자의 과잉 발현은 [37]효모 노화의 원인 중 하나로 생각되는 염색체 외 rDNA 서클의 축적을 방지함으로써 RLS를 증가시키는 것으로 나타났다.식이 제한의 영향은 TOR 세포 [36]경로의 신호 전달 감소의 결과일 수 있다.이 경로는 영양소에 대한 세포의 반응을 조절하고, TOR 활성을 감소시키는 돌연변이는 CLS와 RLS를 [36][37]증가시키는 것으로 확인되었다.이것은 다른 [36][37]동물에서도 마찬가지인 것으로 나타났다.유전자가 결핍된 효모 돌연변이Sch9과 Ras2는 최근 칼로리 제한 조건에서 연대기 수명이 10배 증가하는 것으로 나타났으며, 이는 모든 [38][39]유기체에서 달성된 가장 큰 증가이다.
모세포는 유사분열로 자손의 싹을 낳지만, 연속되는 세대에 걸쳐 반복 노화를 거쳐 결국 죽는다.그러나 모세포가 감수분열과 배우자 형성을 거치면 수명은 [40]재설정된다.노화세포에 의해 형성되는 생식체(포자)의 복제 잠재력은 젊은 세포에 의해 형성되는 생식체와 동일하여 노화모세포의 감수분열로 인해 노화 관련 손상이 제거됨을 나타낸다.이러한 관찰은 감수분열 동안 노화와 관련된 손상을 제거하는 것이 회춘으로 이어진다는 것을 시사한다.그러나 이러한 손상의 본질은 규명되어야 한다.
비증식성 S. 세레비시아에 세포가 기아에 빠지는 동안 활성산소종이 증가하여 아푸린산/아피리미딘산소 부위 및 이중 가닥 [41]절단 등의 DNA 손상이 축적된다.또한 비증식 세포에서 내인성 이중 가닥 절단을 복구하는 능력은 연대 [42]노화 동안 감소한다.
감수분열, 재조합 및 DNA 복구
세레비시아는 영양소가 풍부할 때 유사분열로 이배체 세포로 번식한다.그러나 굶으면 이 세포들은 감수분열을 거쳐 반수체 포자를 [43]형성한다.
S. cerevisiae의 연구에서 나온 증거는 감수 분열과 재조합의 적응 기능과 관련이 있다.S. cerevisae에서 감수분열 및 유사분열 재조합에 필수적인 유전자에 결함이 있는 돌연변이는 방사선 또는 DNA 손상 [44][45]화학물질에 대한 민감도를 증가시킨다.예를 들어 유전자 rad52는[46] 감수성 재조합과 유사분열 [47]재조합 모두에 필요하다.Rad52 돌연변이는 X선, 메틸메탄술폰산메틸 및 DNA 가교제 8-메톡시포랄렌플러스-UVA에 의한 살처분 감수성을 증가시켜 감수성 [45][46][48]재조합 감소를 나타낸다.이러한 연구결과는 감수분열 및 유사분열 시 재조합 복구가 이들 약물에 의해 야기되는 다양한 손상을 복구하기 위해 필요하다는 것을 시사한다.
루더퍼 [44]외(2006)는 천연 세레비시아균주의 조상을 분석하여 세포분열 50,000개당 한 번만 교배가 일어난다는 결론을 내렸다.따라서 자연에서, 짝짓기는 가장 자주 가까운 효모 세포들 사이에서 일어나는 것으로 보인다.짝짓기는 반대쪽 짝짓기 타입의 MATa와 MATα의 반수체 세포가 접촉할 때 발생합니다.Ruderfer et al.[44]은 그러한 접촉은 두 가지 이유로 밀접하게 관련된 효모 세포 사이에서 빈번하게 발생한다고 지적했다.첫 번째는 서로 반대되는 짝짓기 타입의 세포가 같은 자낭에 함께 존재하는 것입니다. 단일 감수 분열에 의해 직접 생성된 세포가 들어 있는 주머니입니다. 그리고 이 세포들은 서로 짝짓기를 할 수 있습니다.두 번째 이유는 짝짓기 타입의 반수체 세포가 세포 분열 시 종종 짝짓기 타입과 반대되는 짝짓기 타입의 세포를 생산하기 때문입니다.교잡으로 인한 감수 분열 사건의 상대적인 희귀성은 유전자 변이의 생산이 이 유기체의 감수 분열을 유지하는 주요 선택적인 힘이라는 생각과 일치하지 않습니다.그러나 이 연구결과는 감수분열을 유지하는 주요 선택력이 [49]DNA 손상의 재조합 수복을 강화한다는 대안적 생각과 일치한다. 왜냐하면 이러한 이점은 각 감수분열에서 실현되기 때문에 교차가 발생하든 발생하지 않든 상관없다.
게놈 배열 분석
S. cerevisiae는 완전히 [50]배열된 최초의 진핵생물 게놈이었다.게놈 배열은 1996년 4월 24일 공개되었다.그 이후, 사카로미세스 게놈 데이터베이스에서 정기적인 업데이트가 유지되고 있다.이 데이터베이스는 효모 연구자를 위한 높은 주석과 상호 참조 데이터베이스입니다.또 다른 중요한 S. cerevisiae 데이터베이스는 MIPS(Munich Information Center for Protein Sequence)에 의해 유지된다.S. cerevisiae 게놈은 약 12,156,677개의 염기쌍과 6,275개의 유전자로 구성되어 있으며, 16개의 [50]염색체에 콤팩트하게 구성되어 있다.이들 유전자 중 약 5,800개만이 기능하는 것으로 알려져 있다.효모 유전자의 최소 31%가 인간 [51]게놈에 상동체를 가지고 있는 것으로 추정된다.효모 유전자는 유전자 기호(Sch9) 또는 계통 이름을 사용하여 분류됩니다.후자의 경우 효모의 16개 염색체를 문자 A~P로 나타내며, 그 후 유전자는 염색체의 왼쪽 또는 오른쪽 팔의 배열 번호 및 두 DNA 가닥 중 어느 것이 코드 [52]배열을 포함하고 있는지를 나타내는 문자로 더욱 분류된다.
| 유전자명 예시 | YGL118W |
|---|---|
| Y | Y는 이것이 효모 유전자임을 나타낸다 |
| G | 유전자가 위치한 염색체(1번 염색체 = A 등) |
| L | 염색체의 왼쪽 또는 오른쪽 팔 |
| 118 | 동원체에서 시작하는 이 팔의 유전자/ORF 배열 번호 |
| W | 코드 시퀀스가 왓슨 또는 크릭 스트랜드에 있는지 여부 |
예:
- YBR134C(eRF1, 번역종료인자를 코드하는 SUP45라고도 함)는 염색체2의 오른팔에 위치하며, 동원체에서 시작하여 그 팔의 134번째 열린 읽기 프레임(ORF)이다.코드 배열은 DNA의 크릭 가닥에 있어요
- YDL102W(DNA 중합효소 델타 서브유닛을 코드하는 POL3)는 염색체 4의 왼팔에 위치하고 있으며, 이는 동원체에서 102번째 ORF이며 DNA 왓슨 가닥에서 코드된다.
유전자 기능과 상호작용
효모[53] 게놈의 90%를 커버하는 S. cerevisiae 게놈 배열과 결실 돌연변이 세트의 가용성은 진핵 세포의 조절을 이해하기 위한 모델로서 S. cerevisiae의 힘을 더욱 강화했다.모든 이중결손 돌연변이의 유전자 상호작용을 합성 유전자 배열 분석을 통해 분석하는 프로젝트는 이 연구를 한 단계 더 진전시킬 것이다.목표는 세포 과정의 기능적 지도를 형성하는 것입니다.
2010년 현재[update] 유전자 상호작용 모델은 "버딩 [54]효모 내 모든 유전자의 약 75%에 대한 상호작용 프로파일"을 포함하여 아직 구축되지 않은 가장 포괄적이다.이 모델은 연구된 유전자의 각 조합에 대해 이중 유전자 녹아웃이 수행된 540만 개의 2-유전자 비교를 통해 만들어졌다.세포의 적합성에 대한 더블 녹아웃의 효과를 예상 적합성과 비교했다.기대 적합성은 비교된 각 유전자에 대한 단일 유전자 녹아웃 적합성에 대한 결과의 합계에서 결정된다.예상과 달리 적합성에 변화가 있을 때, 유전자들은 서로 상호작용하는 것으로 추정됩니다.이는 이전에 알려진 결과와 비교하여 테스트되었습니다.예를 들어 유전자 Par32, Em30 및 Ubp15는 Gap1 정렬 모듈 세포 프로세스에 관여하는 유전자와 유사한 상호작용 프로파일을 가지고 있다.결과와 일관되게, 이 유전자들은, 녹아웃되었을 때, 그 과정을 방해하고, 그들이 그것의 [54]일부라는 것을 확인했습니다.
이를 통해 17만 개의 유전자 상호작용이 발견됐고 비슷한 상호작용 패턴을 가진 유전자를 함께 묶었다.유사한 유전자 상호작용 프로파일을 가진 유전자는 같은 경로나 생물학적 [55]과정의 일부가 되는 경향이 있다.이 정보는 기능별로 정리된 유전자 상호작용의 글로벌 네트워크를 구축하는 데 사용되었다.이 네트워크는 유전자와 [54]그룹화된 유전자의 기능을 바탕으로 특성화되지 않은 유전자의 기능을 예측하는 데 사용될 수 있다.
효모 연구의 기타 도구
효모 과학자들에 의해 생물학 및 의학의 많은 다른 분야에서 적용될 수 있는 접근법이 개발되었습니다.여기에는 단백질 상호작용 및 테트라 분석을 연구하기 위한 효모 2-하이브리드가 포함된다.기타 자원에는 약 4,700개의 생존 가능한 단배체 단일 유전자 결실 균주를 포함하는 유전자 결실 라이브러리를 포함한다.단백질 국재화를 연구하기 위해 사용되는 GFP 융합 변형 라이브러리 및 효모세포 [citation needed]추출물에서 단백질을 정제하기 위해 사용되는 TAP 태그 라이브러리.
스탠포드 대학의 효모 제거 프로젝트는 S. cerevisiae 게놈에 있는 모든 유전자의 녹아웃 돌연변이를 만들어 그들의 [56]기능을 확인했습니다.
합성 효모 염색체 및 게놈
효모 게놈은 조작이 용이하기 때문에 게놈 공학의 훌륭한 모델입니다.
국제 합성 효모 게놈 프로젝트(Sc2.0 또는 Saccharomyces cerevisiae 버전 2.0)는 야생형보다 안정적인 완전히 설계되고 사용자 지정 가능한 합성 S. cerevisiae 게놈을 처음부터 구축하는 것을 목표로 합니다.모든 트랜스포존, 반복요소 및 다수의 인트론을 제거하고 모든 UAG 정지 코돈을 UAA로 치환하여 새로운 네오크로모솜으로 이동시키는 합성 게놈.2017년 3월[update] 현재, 16개의 염색체 중 6개가 합성되어 테스트되었다.심각한 적합성 결함은 [57]발견되지 않았습니다.
16개의 염색체 모두가 연속적인 단대단 염색체 융합과 동원체 결실에 의해 하나의 단일 염색체로 융합될 수 있다.단일 염색체와 야생 효모 세포는 거의 동일한 전사체와 유사한 표현형을 가지고 있다.비록 이 변종이 환경, 경쟁력, 배우자 생산 및 [58]생존력에서 감소된 성장을 보여주지만, 거대한 단일 염색체는 세포 생명을 유지할 수 있다.
우주생물학
다른 미생물들 중에서,[59][60] 살아있는 S. cerevisiae의 샘플은 2011년 말에 발사된 러시아의 포보스-그룬트 우주선을 타고 작은 캡슐을 타고 3년 동안 행성 간 왕복 비행을 완료했을 살아있는 행성간 비행 실험에 포함되었다.그 목표는 선택된 유기체들이 행성간 공간을 통해 비행함으로써 깊은 우주에서 몇 년 동안 생존할 수 있는지를 테스트하는 것이었다.이 실험은 한 행성에서 떨어져 [59][60][61]다른 행성에 착륙하기 위해 폭발한 암석 안에서 생명체가 보호된다면 우주 여행에서 생존할 수 있다는 가설인 트랜스퍼미아(transpermia의 한 측면을 시험했을 것이다.그러나 포보스 그룬트의 임무는 지구 저궤도를 벗어나지 못하면서 성공적으로 끝났다.우주선은 기구들과 함께 2012년 1월 15일 통제 불능의 재진입으로 태평양에 떨어졌다.S. cerevisiae를 사용한 심우주에서의 다음 계획된 노출 미션은 BioSentinel이다.(외계에서 시험한 미생물 목록 참조)
상용 어플리케이션의 경우
양조
사카로미세스 세레비시아에는 맥주를 양조할 때 사용되며, 이것은 때때로 탑 발효 또는 탑 크롭 효모라고 불립니다.발효 과정에서 소수성 표면이 플록이 CO에2 달라붙어 발효 용기의 맨 위로 올라오기 때문에 이렇게 불린다.상부발효효효모는 라거 효모 사카로미세스 파스토리아누스보다 높은 온도에서 발효되며, 제조된 맥주는 라거 효모로 발효된 동일한 음료와는 다른 맛을 낸다."과일에스테르"는 효모가 21°C(70°F) 부근의 온도를 거치거나 공정 중에 음료의 발효 온도가 변동하는 경우 형성될 수 있다.라거 효모는 보통 약 5°C(41°F)의 온도에서 발효되며, 여기서 사카로미세스 세레비시아에는 휴면 상태가 됩니다.Saccharomyces cerevisiae var. diastaticus로 알려진 변형 효모는 포장된 [62]제품에서 2차 발효를 일으킬 수 있는 맥주 스포일러입니다.
2013년 5월 오리건 주 의회는 수제 맥주 양조가 주 경제와 주 [63]정체성에 미치는 영향을 인정하여 S. cerevisiae를 공식 주 마이크로베로 지정했습니다.
베이킹
S. 세레비시아이는 제빵에 사용되며 발효에 의해 발생하는 이산화탄소는 빵 및 기타 소성제품에서 발효제로 사용된다.역사적으로, 이러한 사용은 양조업계의 효모 사용과 밀접하게 관련되어 있습니다. 왜냐하면 제빵업자들이 양조업자의 에일(바름 케이크 생산)에서 바름이나 효모로 채워진 거품을 사들였기 때문입니다. 오늘날, 양조업과 베이킹 효모 균주는 다소 다릅니다.
영양 효모
사카로미세스 세레비시아에는 식품으로 시판되는 영양 효모의 주요 공급원입니다.그것은 치즈 대용품의 성분으로 채식주의자와 채식주의자들에게 인기가 있고, 비타민과 미네랄, 특히 아미노산과 B 복합 비타민의 공급원으로서 일반적인 식품 첨가물로 인기가 있다.
물병에서 사용
상업용2 CO 실린더 시스템의 높은 비용 때문에 효모에 의한 CO 주입은 수중2 수생 식물에 CO를 공급하기2 위한 수생 문화가들이 따르는 가장 인기 있는 DIY 접근법 중 하나입니다.효모 배양은 일반적으로 플라스틱 병에 담겨 유지되며, 일반적인 시스템은 3-7초마다 하나의 거품을 제공합니다.기체가 [64]물에 적절히 흡수될 수 있도록 다양한 접근법이 고안되었다.
약에 직접 사용
이 문서에서는 CNCM I-3856과 같은 비불라디(CBS 5926) 균주에 대한 정보가 누락되어 있습니다.EMA 데이터베이스를 검색하는 것이 좋습니다.(2022년 1월) |
사카로미세스 세레비시아에는 인간과 동물에서 프로바이오틱스로 사용된다.Saccharomyces cerevisiae var. boulardi 균주는 산업적으로 제조되어 임상적으로 의약품으로 사용된다.
여러 임상 및 실험 연구는 S. cerevisiae var. boulardii가 여러 위장 질환의 [65]예방 또는 치료에 다소 또는 더 유용하다는 것을 보여주었다.중간 정도의 품질 증거는 S. cerevisiae var. boulardii가 성인과 어린이 모두에서[66][65][67][66][65] 항생제 관련 설사의 위험을 줄이고 헬리코박터균 근절 치료의 [68][65][67]부작용 위험을 감소시킨다는 것을 보여주었다.여행자 설사[65][67] 예방(그러나 치료가 아닌) 및 최소한 보조 약물로서 성인 및 소아 급성 설사 및 소아 [65]지속적 설사 치료에 있어 S. cerevisiae var. boulardii의 효과를 뒷받침하는 몇 가지 증거가 있다.그것은 또한 알레르기 [69]비염의 증상을 줄일 수 있다.
S. cerevisiae var. boulardii의 투여는 일반적으로 안전한 [67]것으로 간주된다.임상시험에서 이는 환자에 의해 잘 허용되었으며, 부작용률은 대조군(즉, 위약을 사용하거나 [66]치료제를 사용하지 않은 그룹)의 경우와 유사했다.임상시험 [67]중 S. cerevisiae var. boulardi 균혈증 환자는 보고된 바 없다.
그러나 임상 실무에서는 S. cerevisiae var. boulardii에 의해 발생하는 곰팡이혈증 사례가 [67][65]보고된다.면역력이 저하된 환자나 중추 혈관 카테터를 가진 환자는 특별한 위험에 처합니다.일부 연구자들은 이러한 환자에게 [67]S. cerevisiae var. boulardii를 치료제로 사용하지 말 것을 권고했다.다른 이들은 위험군 [65]환자에게만 주의를 기울여야 한다고 제안한다.
인간 병원체
사카로미세스 세레비시아에는 비교적 낮은 [70]독성을 가진 기회주의적 인간 병원체임이 입증되었다.가정과 산업에서 이 미생물이 널리 사용되고 있음에도 불구하고, 그것과 접촉하는 것은 [71]매우 드물게 감염으로 이어진다.사카로미세스 세레비시아이는 건강한[72] 인간의 피부, 구강, 오로파린스, 십이지장 점막, 소화관, 질에서 발견되었다. (한 리뷰는 인체 장[73] 샘플의 6%에 대해 보고되는 것으로 나타났다.)어떤 전문가들은 S. cerevisiae가 인간의 [74]소화관, 호흡기, 질에 있는 정상적인 미생물군의 일부라고 생각하는 반면, 다른 전문가들은 S. cerevisiae가 [73][75]음식에서 유래하기 때문에 진정한 공생이라고 불릴 수 없다고 믿는다.인체 소화기 계통에 S. cerevisiae의 존재는 다소 [75]일시적인 것일 수 있습니다. 예를 들어, 실험 결과 건강한 개인에 대한 경구 투여의 경우 [73][71]투여 종료 후 5일 이내에 장에서 제거되는 것으로 나타났습니다.
면역력 저하와 같은 특정한 상황에서는 사카로미세스 세레비시아에 의해 사람에게 [71][70]감염을 일으킬 수 있다.연구에 따르면 효모 유발 질염의 0.45~1.06%를 유발한다.S. 세레비시아에 의한 질 감염을 앓고 있는 여성은 제빵사의 친밀한 파트너였으며, 그 균주는 파트너가 제빵에 사용한 것과 동일한 것으로 밝혀졌다.1999년 현재, 빵집에서 일했던 여성들에게서 S. 세레비시아에 의해 유발되는 질염의 사례는 과학 문헌에 보고된 바 없다.몇몇 사례들은 연구자들에 의해 가정 [70]제빵에 효모를 사용하는 것과 관련이 있었다.세레비시아에 의한 구강 및 인두 감염 사례도 알려져 [70]있다.
침습성 및 전신성 감염
때때로 사카로미세스 세레비시아에 의해 침습성 감염(즉, 혈류 또는 기타 정상적으로 멸균된 체액 또는 폐, 간 또는 비장과 같은 깊은 부위 조직으로 침투)이 발생할 수 있다(복수의 장기를 포함할 수 있다.그러한 상태는 생명을 [70][75]위협한다.S. 세레비시아이 침습성 감염의 30% 이상이 [75]치료되더라도 사망에 이르게 된다.그러나 세레비시아에 의한 침습성 감염은 [76]암으로 약해진 환자에서도 칸디다 알비칸에[70][76] 의한 침습성 감염보다 훨씬 더 드물다.세레비시아에 의해 1%~3.6%의 병원내 [75]균혈증이 발생한다.S. cerevisiae 침습성 감염 사례에 대한 포괄적인 검토 결과, 모든 환자는 적어도 하나의 소인 조건을 [75]가지고 있는 것으로 밝혀졌다.
사카로미세스 세레비시아에는 구강 또는 장 점막에서 전위 또는 혈관 내 카테터(예: 중앙 정맥 카테터)[74]의 오염을 통해 혈류로 들어가거나 신체의 다른 깊은 부위에 도달할 수 있다.혈관 내 카테터, 항생제 치료 및 면역 저하가 S. 세레비시아에 침습적 [75]감염의 주요 소인자이다.
식이요법이나 치료상의 이유로 살아있는 S. cerevisiae 배양물을 의도적으로 섭취함으로써 균혈증이 발생했으며, 여기에는 Saccharomyces boulardii(S. cerevisiae의 변종이 특정 형태의 [70][75]설사를 치료하기 위해 프로바이오틱으로 사용됨)가 포함된다.사카로미세스 불라르디i는 침습성 사카로미세스 감염의[75] 약 40%를 유발하며,[75] 그러한 부작용은 사카로미세스 불라디 치료 [77]투여와 관련하여 매우 드물지만 (다른 세레비시아에 비해) 면역에 대한 일반적인 문제가 없는 사람에게 침습성 감염을 일으킬 가능성이 더 높다.
S. boulardii는 환자에게 [75]S. boulardii의 프로바이오틱 제제를 투여하는 의료진의 손을 통해 혈관 내 카테터를 오염시킬 수 있다.
전신 감염은 보통 심각한 질병(HIV/AIDS, 백혈병, 다른 형태의 암) 또는 특정 의료 절차(골수 이식, 복부 수술)[70]로 인해 면역력이 손상된 환자에게서 발생한다.
제빵업에 종사하는 남성의 폐에서 결절을 외과적으로 절제하여 조직을 검사한 결과 사카로미세스 세레비시아가 검출된 사례가 보고되었다.이 [78][75]경우 건조 베이킹 효모 분말을 흡입하는 것이 감염원인 것으로 추정된다.
다른 균주의 독성
사카로미세스 세레비시아의 모든 변종이 똑같이 인간에게 독성이 있는 것은 아니다.대부분의 환경 변종은 35°C 이상의 온도(즉, 인간과 다른 포유동물의 생체 온도)에서 자랄 수 없다.그러나 독성 균주는 최소 37°C 이상에서 최대 39°C까지 자랄 수 있습니다(거의 42°[72]C까지).일부 산업용 균주는 37°[70]C 이상으로 성장할 수도 있습니다.유럽식품안전청(2017년 기준)은 식품 또는 사료 사슬에 37°C 이상으로 성장할 수 있는 모든 세레비시아 균주가 안전한 것으로 간주될 수 있도록 효모 [79]감염 치료에 사용되는 항진균제에 내성을 보이지 않아야 한다.
높아진 온도에서 자라는 능력은 균주의 독성에 중요한 요소이지만 유일한 [72]요인은 아니다.
보통 독성과 관련된 발생되었졌다고 믿는다 다른 특성:능력 proteinase[70]과 phospholipase,[72]는 growth[72](그 배양기에 침입과 i.e. 성장), 능력은 포유류의 cells,[72]능력 수소 peroxide[72] 자세한 내용은에서 사용됩니다의 존재에서 살아남기 위해 고수하는 등 어떤 효소 생산.대식 세포를 죽이기효모가 숙주의 [72]면역 반응에 저항하거나 영향을 미칠 수 있도록 하는 기타 능력.일부 연구는 이 특성이 사카로미세스 세레비시아의 독성 및 비독성 [72]변종 모두에게 공통적일 수 있다는 것을 암시하지만, 의사하균으로 알려진 세포의 분기 사슬을 형성하는 능력은 때때로 [70][72]독성과 관련이 있다고 한다.
「 」를 참조해 주세요.
- 사카로미세스 세레비시아 추출물:베지마이트, 마르마이트, 세노비스, 기네스 효모 추출물, 만나올리고당, pg-glucan, 자이모산
- 사카로미세스 세레비시아에 불라디
- 위스콘신 주 도어 카운티 플로라 » 하이브리드 효모
- 카테고리:사카로미세스 세레비시아 유전자
- 자동 양조 증후군
- 바이오스프린트
- BolA유사단백질족
- 효모 프로모터 아틀라스(2010)
레퍼런스
각주
인용문
- ^ Feldmann, Horst (2010). Yeast. Molecular and Cell bio. Wiley-Blackwell. ISBN 978-3527326099.[페이지 필요]
- ^ Walker LJ, Aldhous MC, Drummond HE, Smith BR, Nimmo ER, Arnott ID, Satsangi J (2004). "Anti-Saccharomyces cerevisiae antibodies (ASCA) in Crohn's disease are associated with disease severity but not NOD2/CARD15 mutations". Clin. Exp. Immunol. 135 (3): 490–96. doi:10.1111/j.1365-2249.2003.02392.x. PMC 1808965. PMID 15008984.
- ^ 사카론찰튼 T.루이스와 찰스 쇼트.페르세우스 프로젝트에 관한 라틴어 사전.
- ^ 리델, 헨리 조지, 스콧, 로버트, 페르세우스 프로젝트의 그리스 영어 어휘집.
- ^ 세레비시아, 자궁경부찰튼 T.루이스와 찰스 쇼트.페르세우스 프로젝트에 관한 라틴어 사전.
- ^ a b Moyad MA (2008). "Brewer's/baker's yeast (Saccharomyces cerevisiae) and preventive medicine: Part II". Urol Nurs. 28 (1): 73–75. PMID 18335702.
- ^ Eben Norton Horsford (1875). Report on Vienna bread. U.S. Government Printing Office. p. 86.
sweet.
- ^ Kristiansen, B.; Ratledge, Colin (2001). Basic biotechnology. Cambridge, UK: Cambridge University Press. p. 378. ISBN 978-0-521-77917-3.
- ^ Eben Norton Horsford (1875). Report on Vienna bread. U.S. Government Printing Office. pp. 31–32.
sweet.
- ^ Marx, Jean & Litchfield, John H. (1989). A Revolution in biotechnology. Cambridge, UK: Cambridge University Press. p. 71. ISBN 978-0-521-32749-7.
- ^ Lahue, Caitlin; Madden, Anne A.; Dunn, Robert R.; Smukowski Heil, Caiti (11 November 2020). "History and Domestication of Saccharomyces cerevisiae in Bread Baking". Frontiers in Genetics. 11: 584718. doi:10.3389/fgene.2020.584718. PMC 7686800. PMID 33262788.
- ^ Marshall, Charles, ed. (June 1912). Microbiology. P. Blakiston's son & Company. p. 420. Retrieved November 5, 2014.
- ^ Young, Ed (2012-07-30). "You can thank wasps for your bread, beer and wine". National Geographic.
- ^ Mortimer R, Polsinelli M (1999). "On the origins of wine yeast". Research in Microbiology. 50 (3): 199–204. doi:10.1016/S0923-2508(99)80036-9. PMID 10229949.
- ^ a b Stefanini I, Dapporto L, Legras JL, Calabretta A, Di Paola M, De Filippo C, Viola R, Capretti P, Polsinelli M, Turillazzi S, Cavalieri D (2012). "Role of social wasps in Saccharomyces cerevisiae ecology and evolution". Proc. Natl. Acad. Sci. U.S.A. 109 (33): 13398–403. Bibcode:2012PNAS..10913398S. doi:10.1073/pnas.1208362109. PMC 3421210. PMID 22847440.
- ^ Stefanini I, Dapporto L, Berná L, Polsinelli M, Turillazzi S, Cavalieri D (2016). "Social wasps are a Saccharomyces mating nest". Proc. Natl. Acad. Sci. U.S.A. 113 (8): 2247–51. Bibcode:2016PNAS..113.2247S. doi:10.1073/pnas.1516453113. PMC 4776513. PMID 26787874.
- ^ Zörgö E, Chwialkowska K, Gjuvsland AB, Garré E, Sunnerhagen P, Liti G, Blomberg A, Omholt SW, Warringer J (2013). "Ancient evolutionary trade-offs between yeast ploidy states". PLOS Genet. 9 (3): e1003388. doi:10.1371/journal.pgen.1003388. PMC 3605057. PMID 23555297.
- ^ Herskowitz I (1988). "Life cycle of the budding yeast Saccharomyces cerevisiae". Microbiol. Rev. 52 (4): 536–53. doi:10.1128/MMBR.52.4.536-553.1988. PMC 373162. PMID 3070323.
- ^ Friedman, Nir (January 3, 2011). "The Friedman Lab Chronicles". Growing yeasts (Robotically). Nir Friedman Lab. Retrieved 2012-08-13.
- ^ Warringer J, Zörgö E, Cubillos FA, Zia A, Gjuvsland A, Simpson JT, Forsmark A, Durbin R, Omholt SW, Louis EJ, Liti G, Moses A, Blomberg A (2011). "Trait variation in yeast is defined by population history". PLOS Genet. 7 (6): e1002111. doi:10.1371/journal.pgen.1002111. PMC 3116910. PMID 21698134.
- ^ Kaeberlein M, Powers RW, Steffen KK, Westman EA, Hu D, Dang N, Kerr EO, Kirkland KT, Fields S, Kennedy BK (2005). "Regulation of yeast replicative life span by TOR and Sch9 in response to nutrients". Science. 310 (5751): 1193–96. Bibcode:2005Sci...310.1193K. doi:10.1126/science.1115535. PMID 16293764. S2CID 42188272.
- ^ Kaeberlein M (2010). "Lessons on longevity from budding yeast". Nature. 464 (7288): 513–19. Bibcode:2010Natur.464..513K. doi:10.1038/nature08981. PMC 3696189. PMID 20336133.
- ^ Mortimer, Robert K.; Romano, Patrizia; Suzzi, Giovanna; Polsinelli, Mario (December 1994). "Genome renewal: A new phenomenon revealed from a genetic study of 43 strains ofSaccharomyces cerevisiae derived from natural fermentation of grape musts". Yeast. 10 (12): 1543–52. doi:10.1002/yea.320101203. PMID 7725789. S2CID 11989104.
- ^ Masel, Joanna; Lyttle, David N. (December 2011). "The consequences of rare sexual reproduction by means of selfing in an otherwise clonally reproducing species". Theoretical Population Biology. 80 (4): 317–22. doi:10.1016/j.tpb.2011.08.004. PMC 3218209. PMID 21888925.
- ^ 사카로미세스 세레비시아이 http://bioweb.uwlax.edu/bio203/s2007/nelson_andr/
- ^ a b c d e f Morgan, David (2007).셀 사이클: 제어의 원리.시나우어 어소시에이션스
- ^ a b Bi, Erfei (2017). "Mechanics and regulation of cytokinesis in budding yeast". Seminars in Cell & Developmental Biology. 66: 107–18. doi:10.1016/j.semcdb.2016.12.010. PMC 5474357. PMID 28034796.
- ^ a b c Wloka, Carsten (2012). "Mechanisms of cytokinesis in budding yeast". Cytoskeleton. 69 (10): 710–26. doi:10.1002/cm.21046. PMID 22736599. S2CID 205643309.
- ^ a b Bi, Erfei (2002). "Cytokinesis in Budding Yeast: the Relationship between Actomyosin Ring Function and Septum Formation". Cell Structure and Function. 26 (6): 529–37. doi:10.1247/csf.26.529. PMID 11942606.
- ^ Fang, X (2010). "Biphasic targeting and cleavage furrow ingression directed by the tail of a myosin-II". J Cell Biol. 191 (7): 1333–50. doi:10.1083/jcb.201005134. PMC 3010076. PMID 21173112.
- ^ VerPlank, Lynn (2005). "Cell cycle-regulated trafficking of Chs2 controls actomyosin ring stability during cytokinesis". Mol. Biol. Cell. 16 (5): 2529–43. doi:10.1091/mbc.e04-12-1090. PMC 1087255. PMID 15772160.
- ^ Adams, A (1984). "Relationship of actin and tubulin distribution to bud growth in wild-type and morphogenetic-mutant Saccharomyces cerevisiae". J. Cell Biol. 98 (3): 934–945. doi:10.1083/jcb.98.3.934. PMC 2113156. PMID 6365931.
- ^ a b Balasubramanian, Mohan (2004). "Comparative Analysis of Cytokinesis in Budding Yeast, Fission Yeast and Animal Cells". Curr. Biology. 14 (18): R806–18. doi:10.1016/j.cub.2004.09.022. PMID 15380095. S2CID 12808612.
- ^ Nickoloff, Jac A.; Haber, James E. (2011). "Mating-Type Control of DNA Repair and Recombination in Saccharomyces cerevisiae". In Nickoloff, Jac A.; Hoekstra, Merl F. (eds.). DNA Damage and Repair. Contemporary Cancer Research. pp. 107–124. doi:10.1007/978-1-59259-095-7_5 (inactive 31 July 2022). ISBN 978-1-59259-095-7.
{{cite book}}: CS1 유지 : 2022년 7월 현재 DOI 비활성화 (링크) - ^ Boekhout, T.; Robert, V., eds. (2003). Yeasts in Food: Beneficial and Detrimental aspects. Behr's Verlag. p. 322. ISBN 978-3-86022-961-3. Retrieved January 10, 2011.
- ^ a b c d e Longo VD, Shadel GS, Kaeberlein M, Kennedy B (2012). "Replicative and chronological aging in Saccharomyces cerevisiae". Cell Metab. 16 (1): 18–31. doi:10.1016/j.cmet.2012.06.002. PMC 3392685. PMID 22768836.
- ^ a b c d Kaeberlein M, Burtner CR, Kennedy BK (2007). "Recent developments in yeast aging". PLOS Genet. 3 (5): 655–60. doi:10.1371/journal.pgen.0030084. PMC 1877880. PMID 17530929.
- ^ Wei M, Fabrizio P, Hu J, Ge H, Cheng C, Li L, Longo VD (2008). "Life span extension by calorie restriction depends on Rim15 and transcription factors downstream of Ras/PKA, Tor, and Sch9". PLOS Genet. 4 (1): 139–49. doi:10.1371/journal.pgen.0040013. PMC 2213705. PMID 18225956.
- ^ "10-Fold Life Span Extension Reported". University of Southern California. Archived from the original on 2016-03-04.
- ^ Unal E, Kinde B, Amon A (2011). "Gametogenesis eliminates age-induced cellular damage and resets life span in yeast". Science. 332 (6037): 1554–57. Bibcode:2011Sci...332.1554U. doi:10.1126/science.1204349. PMC 3923466. PMID 21700873.
- ^ Steinboeck F, Hubmann M, Bogusch A, Dorninger P, Lengheimer T, Heidenreich E (June 2010). "The relevance of oxidative stress and cytotoxic DNA lesions for spontaneous mutagenesis in non-replicating yeast cells". Mutat. Res. 688 (1–2): 47–52. doi:10.1016/j.mrfmmm.2010.03.006. PMID 20223252.
- ^ Pongpanich M, Patchsung M, Mutirangura A (2018). "Pathologic Replication-Independent Endogenous DNA Double-Strand Breaks Repair Defect in Chronological Aging Yeast". Front Genet. 9: 501. doi:10.3389/fgene.2018.00501. PMC 6209823. PMID 30410502.
- ^ Herskowitz I (1988). "Life cycle of the budding yeast Saccharomyces cerevisiae". Microbiol. Rev. 52 (4): 536–53. doi:10.1128/MMBR.52.4.536-553.1988. PMC 373162. PMID 3070323.
- ^ a b c Ruderfer DM, Pratt SC, Seidel HS, Kruglyak L (2006). "Population genomic analysis of outcrossing and recombination in yeast". Nat. Genet. 38 (9): 1077–81. doi:10.1038/ng1859. PMID 16892060. S2CID 783720.
- ^ a b Haynes, Robert H.; Kunz, Bernard A. (1981). "DNA repair and mutagenesis in yeast". In Strathern, Jeffrey N.; Jones, Elizabeth W.; Broach, James R. (eds.). The Molecular Biology of the Yeast Saccharomyces: Life Cycle and Inheritance. Cold Spring Harbor, N.Y.: Cold Spring Harbor Laboratory. pp. 371–414. ISBN 978-0-87969-139-4.
- ^ a b Game JC, Zamb TJ, Braun RJ, Resnick M, Roth RM (1980). "The Role of Radiation (rad) Genes in Meiotic Recombination in Yeast". Genetics. 94 (1): 51–68. doi:10.1093/genetics/94.1.51. PMC 1214137. PMID 17248996.
- ^ Malone RE, Esposito RE (1980). "The RAD52 gene is required for homothallic interconversion of mating types and spontaneous mitotic recombination in yeast". Proc. Natl. Acad. Sci. U.S.A. 77 (1): 503–07. Bibcode:1980PNAS...77..503M. doi:10.1073/pnas.77.1.503. PMC 348300. PMID 6987653.
- ^ Henriques, J. A. P.; Moustacchi, E. (1980). "Sensitivity to Photoaddition of Mono-And Bifunctional Furocoumarins of X-Ray Sensitive Mutants of Saccharomyces cerevisiae". Photochemistry and Photobiology. 31 (6): 557–63. doi:10.1111/j.1751-1097.1980.tb03746.x. S2CID 85647757.
- ^ Birdsell, John A.; Wills, Christopher (2003). "The Evolutionary Origin and Maintenance of Sexual Recombination: A Review of Contemporary Models". Evolutionary Biology. pp. 27–138. doi:10.1007/978-1-4757-5190-1_2. ISBN 978-1-4419-3385-0.
- ^ a b Goffeau A, Barrell BG, Bussey H, Davis RW, Dujon B, Feldmann H, Galibert F, Hoheisel JD, Jacq C, Johnston M, Louis EJ, Mewes HW, Murakami Y, Philippsen P, Tettelin H, Oliver SG (1996). "Life with 6000 genes". Science. 274 (5287): 546, 563–67. Bibcode:1996Sci...274..546G. doi:10.1126/science.274.5287.546. PMID 8849441. S2CID 16763139.
- ^ Botstein D, Chervitz SA, Cherry JM (1997). "Yeast as a model organism". Science. 277 (5330): 1259–60. doi:10.1126/science.277.5330.1259. PMC 3039837. PMID 9297238.
- ^ Stamm S, Smith CW, Lührmann R. "Yeast Nomenclature Systematic Open Reading Frame (ORF) and Other Genetic Designations". Alternative Pre-mRNA Splicing: Theory and Protocols. Wiley-Blackwell. pp. 605–7. doi:10.1002/9783527636778.app1. ISBN 9783527636778.
- ^ "YeastDeletionWeb". Retrieved 2013-05-25.
- ^ a b c Costanzo M, Baryshnikova A, Bellay J, Kim Y, Spear ED, Sevier CS, Ding H, Koh JL, Toufighi K, Mostafavi S, Prinz J, St Onge RP, VanderSluis B, Makhnevych T, Vizeacoumar FJ, Alizadeh S, Bahr S, Brost RL, Chen Y, Cokol M, Deshpande R, Li Z, Lin ZY, Liang W, Marback M, Paw J, San Luis BJ, Shuteriqi E, Tong AH, van Dyk N, Wallace IM, Whitney JA, Weirauch MT, Zhong G, Zhu H, Houry WA, Brudno M, Ragibizadeh S, Papp B, Pál C, Roth FP, Giaever G, Nislow C, Troyanskaya OG, Bussey H, Bader GD, Gingras AC, Morris QD, Kim PM, Kaiser CA, Myers CL, Andrews BJ, Boone C (2010). "The genetic landscape of a cell". Science. 327 (5964): 425–31. Bibcode:2010Sci...327..425C. doi:10.1126/science.1180823. PMC 5600254. PMID 20093466.
- ^ Tong AH, Lesage G, Bader GD, Ding H, Xu H, Xin X, Young J, Berriz GF, Brost RL, Chang M, Chen Y, Cheng X, Chua G, Friesen H, Goldberg DS, Haynes J, Humphries C, He G, Hussein S, Ke L, Krogan N, Li Z, Levinson JN, Lu H, Ménard P, Munyana C, Parsons AB, Ryan O, Tonikian R, Roberts T, Sdicu AM, Shapiro J, Sheikh B, Suter B, Wong SL, Zhang LV, Zhu H, Burd CG, Munro S, Sander C, Rine J, Greenblatt J, Peter M, Bretscher A, Bell G, Roth FP, Brown GW, Andrews B, Bussey H, Boone C (2004). "Global mapping of the yeast genetic interaction network". Science. 303 (5659): 808–13. Bibcode:2004Sci...303..808T. doi:10.1126/science.1091317. PMID 14764870. S2CID 11465508.
- ^ Giaever, Guri; Nislow, Corey (2014-06-01). "The Yeast Deletion Collection: A Decade of Functional Genomics". Genetics. 197 (2): 451–465. doi:10.1534/genetics.114.161620. ISSN 0016-6731. PMC 4063906. PMID 24939991.
- ^ "특별호 합성 효모 게놈", 과학, 2017년 3월 10일 제355호, 제6329호
- ^ Shao, Yangyang; Lu, Ning; Wu, Zhenfang; Cai, Chen; Wang, Shanshan; Zhang, Ling-Li; Zhou, Fan; Xiao, Shijun; Liu, Lin; Zeng, Xiaofei; Zheng, Huajun (August 2018). "Creating a functional single-chromosome yeast". Nature. 560 (7718): 331–335. Bibcode:2018Natur.560..331S. doi:10.1038/s41586-018-0382-x. ISSN 1476-4687. PMID 30069045. S2CID 51894920.
- ^ a b Warmflash, David; Ciftcioglu, Neva; Fox, George; McKay, David S.; Friedman, Louis; Betts, Bruce; Kirschvink, Joseph (November 5–7, 2007). Living interplanetary flight experiment (LIFE): An experiment on the survivalability of microorganisms during interplanetary travel (PDF). Workshop on the Exploration of Phobos and Deimos. Ames Research Center.
- ^ a b "Projects: LIFE Experiment: Phobos". The Planetary Society. Archived from the original on 16 March 2011. Retrieved 2 April 2011.
- ^ Anatoly Zak (1 September 2008). "Mission Possible". Air & Space Magazine. Smithsonian Institution. Retrieved 26 May 2009.
- ^ "Controlling Diastaticus in your Brewery". www.chaibio.com. Retrieved 9 April 2019.
- ^ "Designates Saccharomyces cerevisiae as official microbe of State of Oregon". Oregon State Legislature. 29 May 2013. Retrieved 9 April 2019.
- ^ "CO2 Injection: The Yeast Method". www.thekrib.com. Retrieved 2016-11-21.
- ^ a b c d e f g h Kelesidis, Theodoros; Pothoulakis, Chralabos (November 11, 2011). "Efficacy and safety of the probiotic Saccharomyces boulardii for the prevention and therapy of gastrointestinal disorders". Therapeutic Advances in Gastroenterology. 5 (2): 111–125. doi:10.1177/1756283X11428502. PMC 3296087. PMID 22423260.
- ^ a b c Szajewska, H.; Kolodziej, M. (October 2015). "Systematic review with meta-analysis: Saccharomyces boulardii in the prevention of antibiotic-associated diarrhoea". Alimentary Pharmacology & Therapeutics. 42 (7): 793–801. doi:10.1111/apt.13344. PMID 26216624. S2CID 45689550.
- ^ a b c d e f g McFarland, Lynne V. (May 14, 2010). "Systematic review and meta-analysis of Saccharomyces boulardii in adult patients". World Journal of Gastroenterology. 16 (18): 2202–2222. doi:10.3748/wjg.v16.i18.2202. PMC 2868213. PMID 20458757.
- ^ Szajewska, H.; Horvath, A.; Kolodziej, M. (June 2015). "Systematic review with meta-analysis: Saccharomyces boulardii supplementation and eradication of Helicobacter pylori infection". Alimentary Pharmacology & Therapeutics. 41 (12): 1237–1245. doi:10.1111/apt.13214. PMID 25898944. S2CID 21440489.
- ^ Moyad, MA (2009). "Immunogenic yeast-based fermentation product reduces allergic rhinitis-induced nasal congestion: a randomized, double-blind, placebo-controlled trial". Adv Ther. 26 (8): 795–804. doi:10.1007/s12325-009-0057-y. PMID 19672568. S2CID 207417029.
- ^ a b c d e f g h i j k Murphy, Alan; Kavanagh, Kevin (June 15, 1999). "Emergence of Saccharomyces cerevisiae as a human pathogen. Implications for biotechnology" (PDF). Enzyme and Microbial Technology. 25 (7): 551–557. doi:10.1016/S0141-0229(99)00086-1.
- ^ a b c Final Screening Assessment of Saccharomyces cerevisiae strain F53 (PDF). Government of Canada. January 2017. ISBN 978-0-660-07394-1.
- ^ a b c d e f g h i j Anoop, Valar; Rotaru, Sever; Shwed, Philip S.; Tayabali, Azam F.; Arvanitakis, George (July 20, 2015). "Review of current methods for characterizing virulence and pathogenicity potential of industrial Saccharomyces cerevisiae strains towards humans". FEMS Yeast Research. 15 (6): fov057. doi:10.1093/femsyr/fov057. PMID 26195617.
- ^ a b c Hallen-Adams, Heather E.; Suhr, Mallory J. (November 1, 2016). "Fungi in the healthy human gastrointestinal tract". Virulence. 8 (3): 352–358. doi:10.1080/21505594.2016.1247140. PMC 5411236. PMID 27736307.
- ^ a b Pfaller, Michael; Diekema, Daniel (February 2010). "Epidemiology of Invasive Mycoses in North America". Critical Reviews in Microbiology. 36 (1): 1–53. doi:10.3109/10408410903241444. PMID 20088682. S2CID 31989220. Retrieved March 24, 2019.
- ^ a b c d e f g h i j k l Enache-Angoulvant, Adela; Hennequin, Christophe (December 1, 2005). "Invasive Saccharomyces Infection: A Comprehensive Review". Clinical Infectious Diseases. 41 (11): 1559–1568. doi:10.1086/497832. PMID 16267727. Retrieved March 5, 2019.
- ^ a b Chitasombat, Maria; Kofteridis, Diamantis; Jiang, Ying; Tarrand, Jeffrey; Lewis, Russel; Kontoyiannis, Dimitrios (January 2012). "Rare opportunistic (non-Candida, non-Criptococcus) Yeast Bloodstream Infections in Patients with Cancer". Journal of Infection. 64 (1): 68–75. doi:10.1016/j.jinf.2011.11.002. PMC 3855381. PMID 22101079.
- ^ Hennequin, C.; Cauffman-Lacroix, C.; Jobert, A.; Viard, J.P.; Ricour, C.; Jacquemin, J.L.; Berche, P. (February 2000). "Possible Role of Catheters in Saccharomyces boulardii Fungemia". European Journal of Clinical Microbiology and Infectious Diseases. 19 (1): 16–20. doi:10.1007/s100960050003. PMID 10706174. S2CID 10354619. Retrieved April 6, 2019.
- ^ Ren, Ping; Sridhar, Sundara; Chaturvedi, Vishnu (June 2004). "Use of Paraffin-Embedded Tissue for Identification of Saccharomyces cerevisiae in a Baker's Lung Nodule by Fungal PCR and Nucleotide Sequencing". Journal of Clinical Microbiology. 42 (6): 2840–2842. doi:10.1128/JCM.42.6.2840-2842.2004. PMC 427872. PMID 15184487.
- ^ Ricci, Antonia; et al. (March 14, 2017). "Update of the list of QPS-recommended biological agents intentionally added to food or feed as notified to EFSA 5". EFSA Journal. 15 (3): e04663. doi:10.2903/j.efsa.2017.4663. PMC 7328882. PMID 32625420.
추가 정보
- Arroyo-López FN, Orlić S, Querol A, Barrio E (2009). "Effects of temperature, pH and sugar concentration on the growth parameters of Saccharomyces cerevisiae, S. kudriavzevii and their interspecific hybrid" (PDF). Int. J. Food Microbiol. 131 (2–3): 120–27. doi:10.1016/j.ijfoodmicro.2009.01.035. PMID 19246112.
- Jansma, David B. (1999). Regulation and variation of subunits of RNA polymerase II in Saccharomyces cerevisiae (PDF) (Ph.D.). University of Toronto.
외부 링크
- 사카로미세스 게놈 데이터베이스
- 이스트 리소스 센터 퍼블릭 데이터 저장소
- 뮌헨 단백질 배열 정보 센터
- UniProt – 사카로미세스 세레비시아에
- UCSC Genome Browser(UCSC 게놈 브라우저)에서 sacCer3 게놈 어셈블리를 봅니다.