이끌다
Lead | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 이끌다 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 발음 | /ˈ ɛd/ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 외모 | 금속성 회색 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 표준원자량 Ar°(Pb) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 주기율표의 납 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 원자 번호 (Z) | 82 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 그룹. | 14조(탄소군) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 기간 | 6교시 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 블록 | p블록 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 전자배치 | [Xe] 4f14 5d10 6s2 6p2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 쉘당 전자 수 | 2, 8, 18, 32, 18, 4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 물리적 특성 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 단계 STP에서 | 단단한 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 융점 | 600.61 K (327.46°C, 621.43°F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 비등점 | 2022K (1749°C, 3180°F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 밀도 (근처) | 11.34g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 액체 상태일 때(에) | 10.66g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 핵융합열 | 4.77 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 기화열 | 179.5 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 몰열용량 | 26.650 J/(mol·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
증기압
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 원자 특성 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 산화상태 | -4, -2, -1, 0,[2] +1, +2, +3, +4(양수산화물) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 전기 음성도 | 폴링 눈금: 2.33(+4 단위), 1.87(+2 단위) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 이온화 에너지 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 원자 반지름 | 경험 : 오후 175시 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 공유반경 | 146±5pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 반데르발스 반지름 | 오후 202시 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 기타속성 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 자연발생 | 태고의 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 결정구조 | 면심 큐빅(fcc) a=오후 495.08 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 음속 얇은 막대 | 1190 m/s (at) (첨부) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 열팽창 | 28.µm/(m ⋅K)(25°C일 때) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 열전도율 | 35.3 W/(m ⋅K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 전기저항 | 208N ω ⋅m(20°C에서) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 자기순서 | 반자성의 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 어금니 자기 민감도 | -23.0x10cm−63/mol (298K에서)[3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 영률 | 16 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 전단 탄성 계수 | 5.6 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 벌크 모듈러스 | 46 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 포아송 비율 | 0.44 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 모스경도 | 1.5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 브리넬 경도 | 38–50 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS 번호 | 7439-92-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 역사 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 디스커버리 | 중동(7000 BCE) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 기호. | "Pb": 라틴어 plumbum에서 유래 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 납 동위 원소 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
동위원소의 풍부도는[5] 시료에 따라 크게 다릅니다. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
납은 화학 원소로 기호 Pb(라틴어로 납을 의미함)와 원자 번호 82.그것은 대부분의 일반적인 물질보다 밀도가 높은 중금속입니다.납은 부드럽고 가단성이 있으며 녹는점도 상대적으로 낮습니다.갓 자를 때 납은 푸른 빛이 도는 회색입니다.공기에 노출되면 칙칙한 회색으로 변색됩니다.납은 안정한 원소 중 가장 높은 원자 번호를 가지고 있으며, 그 동위 원소 중 세 개는 무거운 원소의 주요 핵붕괴 사슬의 말단입니다.납은 적은 양으로도 독성이 있으며 특히 어린이들에게 더욱 그렇습니다.
납은 상대적으로 반응성이 없는 전이 후 금속입니다.납과 납 산화물은 산과 염기와 반응하여 공유결합을 형성하는 경향이 있습니다.납의 화합물은 일반적으로 탄소 그룹의 가벼운 구성원들과 공통적으로 +4 상태가 아닌 +2 산화 상태에서 발견됩니다.예외는 대부분 유기 납 화합물로 제한됩니다.그룹의 가벼운 구성원들처럼 납은 스스로와 결합하는 경향이 있으며 사슬과 다면체 구조를 형성할 수 있습니다.
납은 광석에서 쉽게 추출되기 때문에, 근동의 선사시대 사람들은 그것을 알고 있었습니다.갈레나는 종종 은을 생산하는 납의 주요 광석입니다.은에 대한 관심은 고대 로마에서 납의 광범위한 추출과 사용을 시작하는 데 도움이 되었습니다.로마의 몰락 이후 납 생산량은 감소했고 산업혁명 때까지 비슷한 수준에 도달하지 못했습니다.납은 활자가 납 합금으로부터 비교적 쉽게 주조될 수 있었기 때문에 인쇄기의 발전에 중요한 역할을 했습니다.[6]2014년 연간 전 세계 납 생산량은 약 1천만 톤이었으며, 이 중 절반 이상이 재활용에서 비롯되었습니다.납의 높은 밀도, 낮은 융점, 연성 및 산화에 대한 상대적 불활성도는 유용합니다.이러한 특성들은 상대적인 풍부함과 낮은 비용과 결합하여 건축, 배관, 배터리, 총알과 총알, 무게, 솔더, 퓨터, 퓨저, 퓨저, 퓨저블 합금, 흰색 페인트, 납 가솔린 및 방사선 차폐에 광범위하게 사용되었습니다.
납은 연조직과 뼈에 축적되는 파괴적이고 지속적인 신경독입니다.신경계를 손상시키고 생물 효소의 기능을 방해해 행동장애부터 뇌 손상에 이르는 신경계 질환을 일으키고, 일반 건강, 심혈관, 신장계에도 영향을 미칩니다.납의 독성은 고대 그리스와 로마 작가들에 의해 처음으로 기록되었는데, 그들은 납 중독 증상의 일부에 주목했지만, 19세기 후반 유럽에서 널리 인정받게 되었습니다.
물리적 특성
아토믹
납 원자는 [Xe]4f5d6s6p의141022 전자 구성으로 배열된 82개의 전자를 가지고 있습니다.두 개의 6p 전자를 제거하는 데 필요한 총 에너지인 납의 첫 번째 및 두 번째 이온화 에너지의 합은 탄소 그룹에서 납의 상부 이웃인 주석의 에너지에 가깝습니다.이것은 특이합니다. 이온화 에너지는 일반적으로 원소의 외부 전자가 핵으로부터 더 멀어지고 더 작은 궤도에 의해 더 많이 차폐됨에 따라 그룹 아래로 떨어집니다.
납의 첫 4개 이온화 에너지의 합은 주기적인 추세가 예측하는 것과는 반대로 주석의 그것을 초과합니다.[7]이것은 상대론적 효과에 의해 설명되는데, 이것은 더 무거운 원자에서 중요하게 되며,[8] 이것은 수축하고 궤도를 선회하여 납의 6초 전자가 5초 전자보다 더 큰 결합 에너지를 갖도록 합니다.[9]그 결과로 소위 비활성 쌍 효과가 있습니다: 납의 6초 전자가 결합에 참여하기를 꺼리게 되어 +2 산화 상태가 안정화되고 결정질 납에서 가장 가까운 원자 사이의 거리가 비정상적으로 길어집니다.[10]
납의 가벼운 탄소 그룹 생성기는 안정적이거나 준안정한 동소체를 형성하며, 사중추가 조정되고 공유 결합된 다이아몬드 큐빅 구조를 가지고 있습니다.그들의 외부 s와 p 궤도의 에너지 수준은 네 개의 하이브리드 sp3 궤도에 혼합될 수 있을 정도로 충분히 가깝습니다.납에서 비활성 쌍 효과는 s와 p 궤도 사이의 간격을 증가시키고, 그 간격은 교배 후 추가적인 결합에 의해 방출되는 에너지로 극복될 수 없습니다.[11]납은 다이아몬드 입방 구조를 갖는 것이 아니라 p-전자만이 비국재화되어 Pb2+ 이온 사이에 공유되는 금속 결합을 형성합니다.결과적으로 납은 비슷한[13] 크기의 2가 금속 칼슘 및 스트론튬과 같은 면심 입방 구조를[12] 갖습니다.[14][a][b][c]
벌크
순수한 납은 밝고 빛나는 회색에 파란색의 기미가 있습니다.[19]습기가 많은 공기와 접촉하면 변색되고 칙칙한 모습을 띠는데, 그 색깔은 일반적인 조건에 따라 달라집니다.납의 특징적인 특성으로는 고밀도, 가단성, 연성, 패시베이션에 의한 부식에 대한 높은 저항성 등이 있습니다.[20]

납의 촘촘한 면심 입방정 구조와 높은 원자량은 철(7.87g/cm3), 구리(8.93g/cm3), 아연(7.14g/cm3) 등 일반 금속보다 밀도가[21] 11.34g/cm으로3 높습니다.[22]이 밀도가 납 풍선처럼 넘어간다는 고사성어의 유래입니다.[23][24][d]텅스텐과 금의 밀도는 모두 19.3g/cm이며3, 알려진 금속 중 가장 밀도가 높은 오스뮴의 밀도는 22.59g/cm으로3 납의 거의 두 배입니다.[25]
납은 모스 경도 1.5의 매우 부드러운 금속입니다. 손톱으로 긁을 수 있습니다.[26]그것은 꽤 잘 휘어지고 다소 신축성이 있습니다.[27][e]납의 부피 모듈러스(압축성의 용이성을 나타내는 척도)는 45.8 GPa입니다.이에 비해 알루미늄은 75.2 GPa, 구리 137.8 GPa, 연강 160–169 GPa이며 [28]납의 인장강도는 12–17 MPa로 낮으며(알루미늄은 6배, 구리는 10배, 연강은 15배) 구리 또는 안티몬을 소량 첨가하여 강화할 수 있습니다.[29]
납의 녹는점은 327.5°C(621.5°F)[30]로 대부분의 금속에 비해 매우 낮습니다.[21][f]1749 °C (3180 °F)[30]의 끓는점은 탄소 그룹 원소들 중에서 가장 낮습니다.20°C에서 납의 전기 저항률은 192나노미터로 다른 산업용 금속(구리 15.43N ω·m, 금 20.51N ω·m, 알루미늄 24.15N ω·m)보다 거의 10배 높습니다.납은 7.19 K보다 낮은 온도에서 초전도체입니다.[33] 이 온도는 모든 유형 I 초전도체 중 가장 높은 임계 온도이며 원소 초전도체 중 세 번째로 높은 온도입니다.[34]
동위 원소
자연 납은 질량수 204, 206, 207, 208의 4개의 안정 동위 [35]원소와 수명이 짧은 5개의 방사성 동위 원소의 흔적으로 구성되어 있습니다.[36][dead link][obsolete source]동위 원소의 수가 많은 것은 납의 원자 번호가 짝수인 것과 일치합니다.[g]납은 마법의 수의 양성자(82)를 가지고 있으며, 이를 위해 핵탄두 모델은 특히 안정적인 핵을 정확하게 예측합니다.[37]납-208은 126개의 중성자를 가지고 있는데, 이것은 납-208이 매우 안정적인 이유를 설명해 줄 수 있습니다.[37]
높은 원자 번호를 가진 납은 자연 동위 원소가 안정적이라고 여겨지는 가장 무거운 원소이고, 납-208은 가장 무거운 안정적인 핵입니다.(이 구별은 이전에는 원자 번호 83의 비스무트로 떨어졌지만, 2003년에 유일한 원시 동위 원소인 비스무트-209가 매우 천천히 붕괴되는 것으로 발견되었습니다.)[h]네 개의 안정한 납 동위 원소는 이론적으로 에너지35 방출과 함께 수은 동위 원소로 알파 붕괴를 겪을 수 있지만, 그들 중 어느 것에서도189[40]25 관측되지 않았습니다.
네 개의 주요 붕괴 사슬 중 세 개의 안정 동위 원소에서 발견됩니다. 각각 납-206, 납-207, 납-208은 우라늄-238, 우라늄-235, 토륨-232의 최종 붕괴 생성물입니다.[41]이러한 붕괴 사슬은 우라늄 사슬, 악티늄 사슬, 토륨 사슬이라고 불립니다.[42]천연 암석 샘플에서의 동위 원소 농도는 이 세 개의 모체 우라늄과 토륨 동위 원소의 존재에 크게 의존합니다.예를 들어, 납-208의 상대적인 풍부도는 정상 샘플의 52%에서 토륨 광석의 90%에 이를 수 있습니다.[43] 이러한 이유로 납의 표준 원자량은 소수점 한 자리에만 주어집니다.[44]시간이 지남에 따라 납-206과 납-207 대 납-204의 비율이 증가하는데, 앞의 두 가지는 무거운 원소의 방사성 붕괴로 보충되지만 뒤의 두 가지는 그렇지 않기 때문입니다. 이는 납-납 연대 측정을 가능하게 합니다.우라늄이 납으로 붕괴되면서 상대적인 양이 변합니다. 이것이 우라늄-납 연대 측정의 기초가 됩니다.[45]Lead-207은 핵자기공명(nuclear magnetic resonance)을 나타내는데, 이러한 특성은 인체 내를 [46][47]포함하여 용액 및 고체 상태에서 그 화합물을 연구하는데 사용되어 왔습니다.[48]

자연적으로 존재하는 거의 모든 납을 구성하는 안정 동위 원소를 제외하고, 극미량의 방사성 동위 원소가 존재합니다.납-210은 반감기가 22.2년에 불과하지만,[35] 납-210은 우라늄-238(지구상에 수십억 년 동안 존재)로 시작하는 긴 붕괴 계열에 의해 생성되기 때문에 자연에서 적은 양이 발생합니다.납-211, -212, 및 -214는 각각 우라늄-235, 토륨-232, 및 우라늄-238의 붕괴 사슬에 존재하므로, 이들 세 개의 납 동위 원소의 흔적은 모두 자연적으로 발견됩니다.납-209의 미세한 흔적은 천연 우라늄-235의 딸 생성물 중 하나인 라듐-223의 매우 드문 군집 붕괴와 우라늄 광석의 중성자 포획으로 생성된 넵투늄-237의 붕괴 사슬에서 비롯됩니다.납-210은 납-206에 대한 비율을 측정함으로써 시료의 나이를 확인하는 데 특히 유용합니다(두 동위 원소 모두 단일 붕괴 사슬에 존재함).[49]
총 43개의 납 동위 원소가 합성되었으며, 질량수는 178~220입니다.[35]납-205는 반감기가 약 1.73×10년으로7 가장 안정한 방사성 동위원소입니다.[i]두 번째로 안정한 것은 납-202로 반감기가 약 52,500년으로 어떤 천연 미량 방사성 동위원소보다도 더 깁니다.[35]
화학

습한 공기에 노출된 벌크 리드는 다양한 구성의 보호층을 형성합니다.탄산 납(II)은 일반적인 구성 성분이며,[51][52][53] 황산염 또는 염화물은 도시 또는 해상 환경에서도 존재할 수 있습니다.[54]이 층은 벌크 납을 효과적으로 화학적으로 불활성화시킵니다.[54]미세하게 가루를 낸 납은 많은 금속과 마찬가지로 피로성이 있고,[55] 청백색의 불꽃으로 화상을 입습니다.[56]
불소는 상온에서 납과 반응하여 납()을 형성합니다.II) 불소.염소와의 반응은 비슷하지만 가열이 필요합니다. 그 결과 생성된 염화물 층이 원소의 반응성을 감소시키기 때문입니다.[54]용융된 납은 칼코겐과 반응하여 납을 생성합니다(II)[57] 칼코게나이드.
납 금속은 황산과 인산에 저항하지만 염산이나 질산에는 저항하지 않습니다. 결과는 불용성 및 제품 염의 후속 부동태에 따라 달라집니다.[58]아세트산과 같은 유기산은 산소가 있을 때 납을 녹입니다.[54]농축된 알칼리는 납을 녹이고 자두를 형성합니다.[59]
무기화합물
납은 +4와 +2의 두 가지 주요 산화 상태를 보여줍니다.4가 상태는 탄소 그룹에서 일반적입니다.2가 상태는 탄소와 실리콘에서는 드물고, 게르마늄에서는 경미하고, 주석에서는 중요하지만, 납에서는 두 산화 상태 중 더 중요합니다.[54]이것은 상대론적 효과, 특히 비활성 쌍 효과에 기인하며, 납과 산화물, 할로겐화물 또는 질화물 음이온 사이에 전기 음성도의 큰 차이가 있을 때 나타나는 것으로 납에 대한 상당한 부분 양전하를 초래합니다.결과적으로 납 6s 오비탈은 6p 오비탈의 경우보다 더 강하게 수축되어 이온성 화합물에서는 비활성화됩니다.불활성 쌍 효과는 유기 납 화합물의 탄소와 같이 납이 유사한 전기 음성도의 원소와 공유 결합을 형성하는 화합물에 적용하기가 어렵습니다.이들에서 6s 및 6p 궤도는 유사한 크기를 유지하고 sp3 혼성화는 여전히 에너지적으로 유리합니다.납은 탄소와 마찬가지로 주로 이러한 화합물에서 4가입니다.[60]
납의 전기 음성도는 비교적 큰 차이가 있음(II) 1.87에서 리드(IV) 2.33에서.이 차이는 탄소 그룹을 내려가는 +4 산화 상태의 안정성이 증가하는 추세에서 역전을 나타냅니다. 반면 주석은 +2 산화 상태에서 1.80, +4 상태에서 1.96의 값을 가집니다.[61]
리드(II)

납(II) 화합물은 납의 무기 화학의 특징입니다.불소와 염소 같은 강한 산화제도 납과 반응하여 PbF와2 PbCl만2 생성됩니다.[54]납(II) 이온은 보통 용액 내에서 무색이며,[62] 부분적으로 가수분해되어 Pb(OH)+ 및 최종적으로4 [Pb(OH)](44+하이드록실 이온이 가교 리간드로 작용함)[63][64]을 형성하지만 주석()으로서 환원제가 아닙니다.II) 이온은.물에서 Pb2+ 이온의 존재를 확인하는 기술은 일반적으로 납의 침전(II) 묽은 염산을 사용한 염화물.염화물 염은 물에 거의 용해되지 않으므로 매우 묽은 용액에서 납의 침전(II) 황화물은 용액을 통해 황화수소를 버블링함으로써 대신 달성됩니다.[65]
일산화납은 두 개의 다형성인 litharge α-PbO (적색)와 massicot β-PbO (황색)에 존재하며, 후자는 약 488 °C 이상에서만 안정적입니다.석영은 납의 무기 화합물 중 가장 일반적으로 사용되는 것입니다.[66]리드가 없습니다().II) 수산화물; 납 용액의 pH 증가(II) 염은 가수분해와 축합을 일으킵니다.[67]납은 일반적으로 더 무거운 칼슘과 반응합니다.황화납은 반도체, 광전도체, 그리고 극도로 민감한 적외선 검출기입니다.다른 두 가지 칼코게나이드인 셀레나이드 납과 텔루라이드 납도 마찬가지로 광전도체입니다.그들은 그룹을 내려갈수록 색이 옅어진다는 점에서 특이합니다.[68]

디아스타타이드와[69] PbFCl과 같은 혼합 할로겐화물을 포함하여, 디할라이드 납 디할라이드는 잘 특징지어집니다.후자의 상대적 불용성은 불소의 중량 측정에 유용한 기초를 형성합니다.디플루오라이드는 최초로 발견된 고체 이온 전도성 화합물입니다(1834년 마이클 패러데이에 의해).[70]다른 디할라이드는 자외선이나 가시광선, 특히 디요오드화물에 노출되면 분해됩니다.[71]많은 납()II) 시안화물, 시안산염, 티오시아네이트 등의 가성할라이드가 알려져 있습니다.[68][72]납(II)은 [PbCl4],2− [PbCl6]4− 및 [PbCl29]n5n− 사슬 음이온과 같은 광범위한 할로겐화물 배위 복합체를 형성합니다.[71]
납(II) 황산염은 다른 무거운 2가 양이온의 황산염처럼 물에 녹지 않습니다.납(II) 질산염 및 납(II) 아세테이트는 매우 용해성이 높으며, 이는 다른 납 화합물의 합성에 이용됩니다.[73]
리드(IV)
무기 납()이 적음)IV) 화합물이 알려져 있습니다.산화성이 높은 용액에서만 형성되며, 일반적으로 표준 조건에서는 존재하지 않습니다.[74]납(II) 산화물은 추가 산화에 혼합 산화물인 PbO를34 제공합니다.납(II)으로 설명됩니다.IV) 산화물, 또는 구조적으로 2PbO·PbO이며2, 가장 잘 알려진 혼합가 납 화합물.이산화 납은 염산을 염소 가스로 산화시킬 수 있는 강력한 산화제입니다.[75]이것은 생성될 것으로 예상되는 PbCl이4 불안정하여 자발적으로2 PbCl과 Cl로2 분해되기 때문입니다.[76]일산화 납과 유사하게 이산화 납은 배관 음이온을 형성할 수 있습니다.이황화납과[77] 이황화납은[78] 고압에서만 안정적입니다.노란색 결정성 분말인 사불화납은 안정적이지만 디플루오라이드보다는 덜 안정적입니다.테트라클로라이드 납(황색 기름)은 상온에서 분해되고, 테트라브로마이드 납은 여전히 안정성이 떨어지며, 테트라요오드화 납의 존재는 의문입니다.[79]
기타 산화상태

일부 납 화합물은 +4 또는 +2가 아닌 다른 형태의 산화 상태로 존재합니다.납(III)은 납()의 중간체로 얻을 수 있습니다.II) 및 납(IV)은, 더 큰 오르간 납 복합체에서; 이 산화 상태는, 납(III) 이온 및 이를 포함하는 더 큰 복합체 모두 라디칼이기 때문에, 안정적이지 않습니다.[81][82][83]이러한 라디칼 종에서 발견되는 납(I)도 마찬가지입니다.[84]
수많은 혼합 납(II,IV) 산화물이 알려져 있습니다.PbO를2 공기 중에서 가열하면 293 °C에서 PbO1219, 351 °C에서1217 PbO, 374 °C에서34 PbO, 그리고 마지막으로 605 °C에서 PbO가 됩니다.추가적인 세스퀴옥사이드인 PbO는23 몇 가지 비양론적 상과 함께 고압에서 얻어질 수 있습니다.그들 중 다수는 일부 산소 원자가 빈 공간으로 대체되는 결함 있는 플루오르화석 구조를 보여줍니다. PbO는 산소 원자의 모든 대체 층이 없는 그러한 구조를 갖는 것으로 간주될 수 있습니다.[85]
산화 음성 상태는 BaPb와2 같이 자유 납 음이온과 같이 Zintl 상으로 발생할 수 있으며, 납은 공식적으로 납(-)입니다.IV),[86] 또는 2개의 납 원자는 납(-I)이고, 3개는 납(0)인 삼각형 이추형 Pb52− 이온과 같은 산소-민감성 고리 모양 또는 다면체 클러스터 이온.[87]이러한 음이온에서, 각각의 원자는 다면체 꼭지점에 있고, 두 개의 전자를 그들의 sp3 하이브리드 오비탈의 가장자리를 따라 각각의 공유 결합에 기여하고, 나머지 두 개는 외부의 외로운 쌍입니다.[63]나트륨에 의해 납이 환원되어 액체 암모니아로 만들어질 수도 있습니다.[88]
오르간납

카본
수소
납
납은 다중 결합 사슬을 형성할 수 있는데, 이는 탄소 그룹에서 더 가벼운 상동성과 공유하는 특성입니다.Pb-Pb 결합 에너지가 C-C 결합 에너지보다 3.5배 이상 낮기 때문에 이를 수행할 수 있는 용량이 훨씬 적습니다.[57]납을 사용하면 최대 3개의 금속-금속 결합을 형성할 수 있습니다.[89]탄소의 경우, 납은 일반적인 유기[90] 화합물과 비슷하지만 일반적으로 (Pb-C 결합이 다소 약하기 때문에) 덜 안정적인 유기 납 화합물을 형성합니다.[63]이것은 납의 유기금속 화학을 주석의 화학적 화학적 화학적 화학적 화학적 화학적 화학적 화학적 화학적 성질보다 훨씬 덜 넓은 범위로 만듭니다.[91]납은 주로 유기 납을 형성합니다(IV) 화합물, 무기 납()으로 시작하는 경우에도)II) 반응물; 극소수의 유기 납(II) 화합물이 알려져 있습니다.가장 잘 특징지어지는 예외는 Pb[CH(SiMe)] 및 Pb( η-CH)입니다.
가장 단순한 유기 화합물인 메탄의 납 유사체는 플럼베인입니다.플럼판은 금속 납과 원자 수소의 반응에서 얻어질 수 있습니다.[92]테트라메틸납과 테트라에틸납의 두 가지 단순한 유도체는 가장 잘 알려진 유기 납 화합물입니다.이 화합물들은 비교적 안정적입니다: 테트라에틸 납은 가열된[93] 경우 또는 햇빛이나 자외선에 노출된 경우에만 분해되기 시작합니다.[94][j]나트륨 금속과 함께 납은 알킬 할라이드와 반응하여 테트라에틸 납과 같은 유기 금속 화합물을 형성하는 등금극 합금을 쉽게 형성합니다.[95]많은 유기 납 화합물의 산화성은 유용하게 이용됩니다: 테트라아세테이트 납은 유기 합성에서 산화를 위한 중요한 실험실 시약입니다.[96]테트라에틸 납은 휘발유에 첨가되면 다른 어떤 유기금속 화합물보다도 많은 양이 생산되었습니다.[91]다른 유기 납 화합물들은 화학적으로 덜 안정적입니다.[90]많은 유기 화합물의 경우 납 유사체가 존재하지 않습니다.[92]
원산지 및 발생
| 아토믹 번호 | 요소 | 관련있는 양 |
|---|---|---|
| 42 | 몰리브덴 | 0.798 |
| 46 | 팔라듐 | 0.440 |
| 50 | 주석 | 1.146 |
| 78 | 플래티넘 | 0.417 |
| 80 | 수성. | 0.127 |
| 82 | 이끌다 | 1 |
| 90 | 토륨 | 0.011 |
| 92 | 우라늄 | 0.003 |
우주에서
태양계에서 납의 입자당 존재량은 0.121 ppb (10억분의 1)입니다.[97][k]이 수치는 백금보다 2배 반, 수은보다 8배, 금보다 17배나 높은 수치입니다.[97]우주의 납의 양은 대부분의 무거운 원자들이 (모두 불안정한) 납으로 서서히 붕괴되면서 천천히 증가하고[98] 있습니다.[99]45억 년 전 태양계가 형성된 이후 납의 양은 약 0.75%[100] 증가했습니다.태양계 풍부도 표를 보면 납은 상대적으로 높은 원자 번호에도 불구하고 원자 번호가 40보다 큰 대부분의 다른 원소들보다 더 많이 존재합니다.[97]
동위원소 납-204, 납-206, 납-207, 납-208로 구성된 원시 납은 대부분 별에서 반복적인 중성자 포획 과정을 통해 생성되었습니다.캡처의 두 가지 주요 모드는 s- 및 r-프로세스입니다.[101]
s 과정에서 포획물은 몇 년 또는 수십 년씩 분리되어 안정성이 떨어지는 핵은 베타 붕괴를 겪습니다.[102]안정한 탈륨-203 핵은 중성자를 포획하여 탈륨-204가 됩니다. 베타 붕괴를 거쳐 안정한 납-204가 됩니다. 다른 중성자를 포획하면 약 1500만 년의 반감기를 가진 납-205가 됩니다.추가로 캡처하면 리드-206, 리드-207 및 리드-208이 됩니다.다른 중성자를 포획하면, 납-208은 납-209가 되고, 이것은 빠르게 비스무트-209로 붕괴됩니다.Bismuth-209 또한 방사성이며, 방해받지 않으면 탈륨-205로 붕괴됩니다.다른 중성자를 포획하면 비스무트-209는 비스무트-210이 되고, 이 베타는 폴로늄-210으로 붕괴되고, 알파는 납-206으로 붕괴됩니다.따라서 이 사이클은 납-206, 납-207, 납-208, 탈륨-205에서 끝납니다.[103]
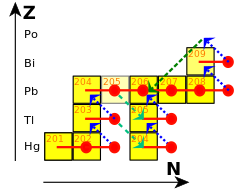
r-과정(r은 "급속"을 의미함)에서 포획은 핵이 붕괴할 수 있는 것보다 더 빨리 발생합니다.[104]이것은 초신성이나 두 중성자별의 결합과 같이 중성자 밀도가 높은 환경에서 발생합니다.관련된 중성자 플럭스는 초당 제곱센티미터당 10개의22 중성자를 나타낼 수 있습니다.[105]r-공정은 s-공정만큼 리드를 형성하지 않습니다.[106]중성자가 풍부한 핵이 126개의 중성자에 도달하면 멈추는 경향이 있습니다.[107]이 시점에서 중성자는 원자핵 안에 완전한 껍질로 배열되어 있고, 더 많은 중성자를 에너지적으로 수용하기가 어려워집니다.[108]중성자 플럭스가 가라앉으면, 이 핵들은 오스뮴, 이리듐, 백금의 안정한 동위원소로 붕괴됩니다.[109]
온 어스
납은 골드슈미트 분류에 따라 칼코필리아로 분류되는데, 이는 일반적으로 유황과 결합되어 발견된다는 것을 의미합니다.[110]그것은 고유의 금속성 형태로 거의 발생하지 않습니다.[111]많은 납 광물들은 비교적 가볍고, 지구의 역사에 걸쳐서, 지구의 내부로 더 깊이 가라앉는 대신 지각에 남아있었습니다.납의 지각 함량은 14ppm으로 비교적 높으며, 지각에서 38번째로 풍부한 원소입니다.[112][l]
주요 납 함유 광물은 아연 광석과 함께 발견되는 갈레나(PbS)입니다.[114]대부분의 다른 납 광물들은 어떤 면에서 갈레나와 관련이 있습니다; 불란게라이트, PbSbS는5411 갈레나에서 유래된 혼합 황화물이고; 앵글사이트, PbSO는4 갈레나 산화의 생성물이고; 세루사이트 또는 백색 납 광석, PbCO는3 갈레나의 분해 생성물입니다.납광물에는 비소, 주석, 안티몬, 은, 금, 구리, 비스무트 등의 불순물이 많이 함유되어 있습니다.[114]
세계의 선도 자원은 20억 톤을 넘습니다.상당한 매장량이 호주, 중국, 아일랜드, 멕시코, 페루, 포르투갈, 러시아 및 미국에 있습니다.2016년 전 세계 매장량은 경제적으로 추출 가능한 자원인 8,800만 톤으로 이 중 호주가 3,500만 톤, 중국이 1,700만 톤, 러시아가 640만 톤을 보유하고 있습니다.[115]
납의 일반적인 배경 농도는 대기 중에서 0.1 μg/m를3 초과하지 않으며 토양 중에서는 100 mg/kg, 식생 중에서는 4 mg/kg, 담수 및 해수 중에서는 5 μg/L를 초과하지 않습니다.[116]
어원
현대 영어 단어 리드는 게르만어에서 유래했으며 중세 영어 리드와 고대 영어 l ē드("e" 위에 마크롱이 있어 해당 글자의 모음 소리가 길다는 것을 나타냄)에서 유래했습니다.고대 영어 단어는 가상적으로 재구된 게르만어 원어 *lauda-('리드')[118]에서 유래했습니다.언어학적 이론에 따르면, 이 단어는 정확히 같은 의미의 여러 게르만 언어들의 후손들을 낳았습니다.[118]
게르만조어 *lauda-의 기원에 대해서는 일치된 의견이 없습니다.한 가설에 따르면 인도유럽조어 *lAudh-('리드'; 모음의 대문자화는 마크롱과 동일함)에서 유래했습니다.[119]또 다른 가설은 켈트조어 * ɸloud-io- ('납')에서 차용했다는 것입니다.이 단어는 라틴어 플럼럼과 관련이 있는데, 이 플럼럼럼은 이 원소에 화학적 기호 Pb를 부여했습니다.* ɸ라우드-이오-라는 단어는 독일어 원어인 *블리와-('납'을 의미하기도 함)의 기원으로 생각되며, 이는 독일어 Blei에서 비롯되었습니다.
화학 원소의 이름은 독일어 원어 *ladijan-('선행하다')에서 유래한 같은 철자의 동사와 관련이 없습니다.[121]
역사
선사와 초기사
기원전 7000년에서 6500년까지 거슬러 올라가는 금속 납 구슬이 소아시아에서 발견되었으며 금속 제련의 첫 번째 예일 수 있습니다.[123]그 당시 납은 부드러움과 둔탁한 외관 때문에 적용이 거의 없었습니다.[123]납 생산이 확산된 주요 원인은 갈레나(일반적인 납 광물)를 태워서 얻을 수 있는 은과의 연관성 때문이었습니다.[124]고대 이집트인들은 화장품에 납광물을 사용한 최초의 사람들이었는데, 이것은 고대 그리스와 그 너머로 퍼져나갔습니다;[125] 이집트인들은 그물, 유리, 안경, 에나멜, 그리고 장식품에 납을 사용했을지도 모릅니다.[124]비옥한 초승달의 다양한 문명들은 납을 문자 재료로, 동전으로,[126] 그리고 건축 재료로 사용했습니다.[124]납은 고대 중국 왕실에서 자극제,[124] 화폐,[127] 피임약으로 사용되었습니다.[128] 인더스 문명과 메소아메리카 사람들은 부적을 만드는데 사용했습니다.[124] 그리고 동부와 남부 아프리카 사람들은 전선 그리기에 납을 사용했습니다.[129]
고전 시대
은이 장식 재료와 교환 매체로 광범위하게 사용되었기 때문에, 납 퇴적물은 기원전 3000년부터 소아시아에서 작업되기 시작했고, 후에 에게 해와 라우리온에서 납 퇴적물이 개발되었습니다.[130]이 세 지역은 기원전 1200년 경까지 채굴된 납의 생산을 총괄했습니다.[131]기원전 2000년경부터 페니키아인들은 이베리아 반도에서 매장량을 만들었고, 기원전 1600년경에는 키프로스, 그리스, 사르디니아에서 납 채굴이 이루어졌습니다.[132]

로마는 유럽과 지중해 전역의 영토 확장과 광업의 발달로 고전 시대 최대의 납 생산국이 되었으며, 연간 생산량은 80,000톤으로 추정됩니다.그들의 전임자들처럼, 로마인들은 대부분 은 제련의 부산물로서 납을 얻었습니다.[122][134]중유럽, 영국, 발칸 반도, 그리스, 아나톨리아, 히스파니아에서 납 채굴이 이루어졌으며, 후자는 전 세계 생산량의 40%를 차지합니다.[122]

납정은 문자의 재료로 흔히 사용되었습니다.[135]납으로 만든 관은 평평한 모래 형태로 주조되었으며, 죽은 사람의 신앙에 맞게 서로 다른 무늬를 가지고 있었습니다.[136]납은 기원전 5세기부터 슬링 탄환을 만드는 데 사용되었습니다.로마 시대에는 납 슬링 탄환이 널리 사용되었으며, 100미터에서 150미터 사이의 거리에서 효과적이었습니다.카르타고 군대와 로마 군대에서 용병으로 사용된 발레아레스 슬링거는 사격 거리와 정확성으로 유명했습니다.[137]

납은 로마 제국에서 수도관을 만드는 데 사용되었습니다; 금속을 뜻하는 라틴어 플럼럼은 영어 "plumbing"의 기원입니다.작업 편의성, 낮은 융점으로 완벽한 방수 용접 접합부를 쉽게 제작할 수 있으며 부식에[138] 대한 저항성으로 인해 의약품, 지붕, 화폐 및 전쟁과 같은 다른 분야에서 널리 사용될 수 있었습니다.[139][140][141]카토 대제, 콜루멜라, 플리니 대제와 같은 당대의 작가들은 와인과 음식에 첨가되는 감미료와 방부제의 제조를 위해 납으로 코팅된 그릇을 추천했습니다.납은 "납의 당"(납()이 형성되어 기분 좋은 맛을 부여했습니다.II), 반면에 구리나 청동 그릇은 녹색 형성을 통해 쓴 맛을 낼 수 있습니다.[142]
이 금속은 고전 고대에 가장 많이 사용된 물질이었고, (로마) 납기 시대를 지칭하는 것은 적절합니다.납은 로마인들에게 플라스틱이 우리에게 주는 것이었습니다.
Heinz Eschnauer and Markus Stoeppler
"Wine—An enological specimen bank", 1992[143]
로마 작가 비트루비우스는 납의[144][145] 건강상의 위험을 보고했고 현대 작가들은 납 중독이 로마 제국의 쇠퇴에 주요한 역할을 했다고 주장했습니다.[146][147][n]다른 연구자들은 예를 들어 모든 복통이 납 중독에 의한 것은 아니라고 지적하면서 이러한 주장을 비판했습니다.[149][150]고고학 연구에 따르면, 로마 납 파이프는 수돗물의 납 수치를 증가시켰지만, 그러한 효과는 "정말로 해로울 것 같지 않다"고 합니다.[151][152]납 중독이 일어났을 때, 희생자들은 어둡고 냉소적인 "새터닌"이라고 불렸는데, 이는 신들의 흉측한 아버지인 새터닌의 이름에서 따온 것입니다.연관성에 의하면, 납은 모든 금속의 아버지로 여겨졌습니다.[153]로마 사회에서 그것은 쉽게 구할[154] 수 있고 가격이 저렴해서 지위가 낮았습니다.[155]
주석 및 안티몬과의 혼동
청동기 시대의 야금공과 기술자들은 구리와 합금하여 질기고 부식에 강한 청동을 생산하는 데 필수적인 희귀 주석과 가치 있는 주석의 차이를 이해해 왔고, '싸고 명랑한' 납의 차이를 이해해 왔습니다.그러나 일부 언어의 명명법은 비슷합니다.로마인들은 납을 납이라고 불렀고, 주석을 납이라고 불렀습니다.납과 주석의 연관성은 다른 언어에서도 볼 수 있는데, 체코어로 olovo는 "납"을 의미하지만, 러시아어로 олово(olovo)는 "주석"을 의미합니다.혼란을 가중시키기 위해, 납은 안티몬과 밀접한 관계를 맺었습니다: 두 원소는 일반적으로 함께 황화물(갈레나와 스티브나이트)로 발생합니다.플리니는 스티브나이트가 안티몬 대신 가열에 납을 공급한다고 잘못 썼습니다.[157]터키와 인도와 같은 나라에서, 원래 페르시아 이름인 술마는 안티몬 황화물 또는 납 황화물 중 하나를 가리키게 되었고, 러시아어와 같은 일부 언어에서는 안티몬 (сурьма)에 그 이름을 붙였습니다.
중세와 르네상스

서유럽의 납 채굴은 서로마 제국의 멸망 이후 감소하였으며, 아라비안 이베리아는 유일하게 상당한 생산량을 기록한 지역입니다.[161][162]납 생산이 가장 많은 지역은 남아시아와 동아시아, 특히 납 채굴이 빠르게 증가한 중국과 인도에서 발생했습니다.[162]
유럽에서는 납 생산이 11세기와 12세기에 증가하기 시작했는데, 이때 다시 지붕과 배관에 사용되었습니다.13세기부터 납은 스테인드 글라스를 만드는 데 사용되었습니다.[163]연금술의 유럽과 아라비아 전통에서 납(유럽 전통의 상징 ♄)은 불순한 기본 금속으로 여겨졌으며, 그 성분의 분리, 정제 및 균형에 의해 순수하고 부패하지 않은 금으로 바뀔 수 있었습니다.그 기간 동안, 납은 와인을 섞는 데 점점 더 많이 사용되었습니다.이런 와인의 사용은 1498년 교황의 황소에 의해 기독교 의식에서 사용이 금지되었지만, 18세기 후반까지 계속해서 음용되어 대량 독극물을 낳았습니다.[161][166]납은 인쇄기 부품의 핵심 소재로, 납 분진은 인쇄공들이 흔히 들이마셔 납 중독을 일으켰습니다.[167]납은 또한 화기용 탄환을 만드는 주요 재료가 되었습니다: 그것은 값이 싸고, 철포통에 손상을 덜 주고, 밀도가 높았으며(속도를 더 잘 유지할 수 있게 해주었다), 그것의 낮은 녹는점은 장작불을 사용하여 탄환을 만들 수 있어서 탄환의 생산을 더 쉽게 만들었습니다.[168]납은 베네치아의 세루(ceruse)의 형태로 서유럽 귀족들에 의해 화장품에 널리 사용되었는데, 하얀 얼굴은 겸손함의 표시로 여겨졌습니다.[169][170]이 관행은 나중에 하얀 가발과 아이라이너로 확대되었고, 18세기 후반 프랑스 혁명과 함께 사라졌습니다.비슷한 방식이 18세기에 일본에서도 나타났는데, 20세기까지 계속된 관습인 게이샤의 출현이 그것입니다.여성들의 하얀 얼굴은 "일본 여성으로서 여성적인 미덕을 나타내게 되었고,[171] 납은 일반적으로 화이트너에 사용됩니다.[172]
유럽 및 아시아 외 지역
신세계에서 납 생산은 유럽 정착민들이 도착한 직후에 기록되었습니다.가장 초기의 기록은 그것이 설립된 지 14년 후인 1621년으로 거슬러 올라갑니다.[173]호주에서는 1841년 식민지 주민들이 대륙에 처음으로 광산을 연 것이 납광이었습니다.[174]아프리카에서 납 채굴과 제련은 유럽인들과의 무역을 위해 사용되었던 베누에 트로프와[175] 콩고 분지 하류 지역에서 알려져 있었고, 아프리카 쟁탈전이 일어나기 훨씬 전인 [176]17세기에 화폐로서 사용되었습니다.
산업혁명

18세기 후반, 영국, 그리고 후에 유럽 대륙과 미국이 산업혁명을 경험했습니다.이것은 로마의 납 생산율을 초과한 최초의 경우였습니다.[177]영국은 19세기 중반까지 광산의 고갈과 독일, 스페인, 미국의 납 광산 개발로 이 지위를 상실한 주요 생산국이었습니다.[178]1900년까지 전 세계 납 생산의 선두는 미국이었고, 그 외 비유럽 국가인 캐나다, 멕시코, 호주 등은 상당한 생산을 시작했으며, 유럽 이외의 국가들은 이를 초과했습니다.[179]납에 대한 수요의 대부분은 배관 및 도장에서 비롯되었으며, 납 페인트는 정기적으로 사용되었습니다.[180]이 시기에 금속에 노출된 (노동자 계층) 사람들이 더 많아졌고 납 중독 사례가 증가했습니다.이것은 납 섭취의 효과에 대한 연구로 이어졌습니다.납은 고체 금속보다 흄의 형태가 더 위험하다는 것이 증명되었습니다.납 중독과 통풍은 관련이 있습니다. 영국 의사 알프레드 배링 개로드는 통풍 환자의 3분의 1이 배관공과 화가라고 지적했습니다.정신 질환을 포함한 납의 만성 섭취의 영향도 19세기에 연구되었습니다.공장에서 납 중독을 줄이기 위한 최초의 법은 1870년대와 1880년대에 영국에서 제정되었습니다.[180]
근세

납이 인간에게 가하는 위협에 대한 추가적인 증거는 19세기 말과 20세기 초에 발견되었습니다.유해 메커니즘을 더 잘 이해하고 납 실명을 기록했으며, 미국과 유럽에서 단계적으로 대중의 사용을 중단했습니다.영국은 1878년에 의무적인 공장 검사를 도입했고 1898년에 최초의 공장 검사관을 임명했습니다. 그 결과 1900년부터 1944년까지 납 중독 사건이 25배나 줄었습니다.[181]대부분의 유럽 국가들은 1930년까지 실내 인테리어에 납 페인트를[182] 사용하는 것을 금지했습니다.[183]
납에 대한 인간의 마지막 주요 노출은 1921년 미국에서 시작된 항노크제로 테트라에틸 납을 휘발유에 첨가한 것입니다.그것은 미국과 유럽연합에서 2000년까지 단계적으로 폐지되었습니다.[180]
1970년대에 미국과 서유럽 국가들은 납 대기오염을 줄이기 위한 법안을 도입했습니다.[184][185]1976-1980년에 미국 질병통제예방센터가 실시한 연구는 인구의 77.8%가 혈중 납 농도가 높다는 것을 보여주었지만, 1991-1994년에 같은 연구소의 연구는 그러한 높은 수치를 가진 사람들의 비율이 2.[186]2%로 떨어졌다는 것을 보여주었습니다.20세기 말까지 납으로 만든 주요 제품은 납축전지였습니다.[187]
1960년부터 1990년까지 서구권의 납 생산량은 약 31%[188] 증가했습니다.동구권의 세계 납 생산 비중은 1950년부터 1990년까지 10%에서 30%로 증가했는데, 1970년대 중반부터 1980년대까지 소련이 세계 최대 생산국이었고, 중국은 20세기 후반부터 주요 납 생산을 시작했습니다.[189]유럽의 공산주의 국가들과 달리, 중국은 20세기 중반에 이르러서는 거의 산업화되지 않았습니다; 2004년에 중국은 호주를 제치고 가장 큰 납 생산국이 되었습니다.[190]유럽의 산업화 때와 마찬가지로 납은 중국의 건강에 부정적인 영향을 끼쳤습니다.[191]
생산.

2014년 현재 납은 전 세계적으로 납 축전지에 사용되기 때문에 생산량이 증가하고 있습니다.[192]생산에는 크게 두 가지 범주가 있습니다: 채굴된 광석에서 1차 생산과 스크랩에서 2차 생산입니다.2014년에는 1차 생산에서 458만 톤, 2차 생산에서 564만 톤이 생산되었습니다.그 해 채굴된 납 농축액의 상위 3개 생산국은 중국, 호주, 미국이었습니다.[115]정제 납의 상위 3개 생산국은 중국, 미국, 인도였습니다.[193]2010년 국제 자원 패널(International Resource Panel)의 금속 재고(Metal Stocks in Society) 보고서에 따르면, 전 세계적으로 사용, 비축, 폐기 또는 환경으로 소멸되는 납의 총량은 1인당 8 kg입니다.이것의 대부분은 후진국(1-4 kg)보다는 후진국(1-1인당 20-150 kg)에 있습니다.[194]
1차 납 생산 공정과 2차 납 생산 공정은 비슷합니다.일부 1차 생산 공장은 현재 스크랩 납으로 운영을 보완하고 있으며, 이러한 추세는 앞으로도 증가할 것으로 보입니다.적절한 기술이 주어지면, 2차 공정을 통해 얻은 납은 1차 공정을 통해 얻은 납과 구별할 수 없습니다.건물 무역의 스크랩 납은 대개 상당히 깨끗하며 제련이 필요한 경우도 있지만, 제련이 필요하지 않은 상태에서 재용융이 필요한 경우도 있습니다.따라서 2차 납 생산은 에너지 요구량 측면에서 1차 생산보다 50% 이상 저렴합니다.[195]
기본적인
대부분의 납 광석은 낮은 비율의 납을 함유하고 있습니다(농축 광석은 일반적인 함량이 3-8%), 추출을 위해 농축되어야 합니다.[196]광석은 일반적으로 초기 가공 동안 파쇄, 조밀-중간 분리, 분쇄, 거품 부유 및 건조 과정을 거칩니다.생성된 농축액은 납 함량이 30~80질량%(일반적으로 50~60질량%)[196]인 납 금속으로 바뀝니다.
이렇게 하는 방법에는 크게 두 가지가 있습니다: 로스팅을 포함한 2단계 공정과 고로 추출을 포함한 별도의 용기에서 수행하는 것, 또는 농축액의 추출을 단일 용기에서 수행하는 직접적인 공정입니다.후자가 가장 일반적인 경로가 되었지만, 전자는 여전히 중요합니다.[197]
| 나라 | 산출량 (천 개의 톤) |
|---|---|
| 2,400 | |
| 500 | |
| 335 | |
| 310 | |
| 250 | |
| 225 | |
| 135 | |
| 80 | |
| 76 | |
| 75 | |
| 41 | |
| 41 | |
| 40 | |
| 40 | |
| 35 | |
| 33 | |
| 33 | |
| 타국 | 170 |
2단공정
첫째, 황화물 농축액을 공기 중에서 볶아서 황화물 납을 산화시킵니다.[198]
- 2 PbS + 3 O(g) → 2 PbO + 2 SO(g)↑
원래 농축액이 순수한 황화납이 아니었기 때문에 로스팅 시 원하는 납(II) 산화물, 납과 광석에 포함된 다른 금속의 산화물, 황산염,[199] 규산염의 혼합물.이 불순한 산화 납은 코크스 연소로에서 (다시, 불순한) 금속으로 환원됩니다.[200]
- 2 PbO + C → 2 Pb + CO(g)↑
불순물은 대부분 비소, 안티몬, 비스무트, 아연, 구리, 은 그리고 금입니다.일반적으로 일련의 파이로메탈 수술 과정에서 제거됩니다.은, 금, 비스무트를 제외한 불순물을 산화시키는 공기, 증기, 유황을 가진 잔향로에서 용융물을 처리합니다.산화된 오염물질은 용융물의 꼭대기까지 떠다니며 벗겨집니다.[201][202]금속 은과 금은 아연을 납에 첨가하는 파크스 공정을 통해 경제적으로 제거되고 회수됩니다.납에 섞이지 않는 아연은 은과 금을 녹입니다.아연 용액을 납에서 분리하여 은과 금을 회수할 수 있습니다.[202][203]은이 제거된 납은 Betterton-Kroll 공정을 통해 금속 칼슘과 마그네슘을 처리하여 비스무트로부터 해방됩니다.생성된 비스무트 드로스는 스킵될 수 있습니다.[202]
Pyrometalurgical process 대신, Betts process를 사용하여 제련된 납을 전해적으로 처리함으로써 매우 순수한 납을 얻을 수 있습니다.불순한 납의 양극과 순수한 납의 양극은 납 플루오로규산(PbSiF6)의 전해질에 위치합니다.전위가 인가되면 양극의 불순한 납이 용해되고 음극에 플레이트가 부착되어 대부분의 불순물이 용액에 남게 됩니다.[202][204]이것은 비용이 많이 드는 공정이므로 불순물이 많이 함유된 금괴를 정제하는데 주로 사용됩니다.[205]
직접공정
이 공정에서 납 금괴와 슬래그는 납 농축물로부터 직접 얻어집니다.황화납 농축액은 용광로에서 용융되어 산화되어 일산화납을 형성합니다.탄소(코크스 또는 석탄 가스와[o] 같은)는 융제제와 함께 용융 전하에 첨가됩니다.따라서 일산화납은 일산화납이 풍부한 슬래그 중간에 금속성 납으로 환원됩니다.[197]
투입물에 납이 풍부할 경우 원래 납의 80%를 금괴로 얻을 수 있으며, 나머지 20%는 일산화납이 풍부한 슬래그를 형성합니다.저급 사료의 경우 납이 모두 고납 슬래그로 산화될 수 있습니다.[197]금속 납은 침지 연료 연소 또는 분사, 전기로에 의해 보조되는 환원, 또는 이들의 조합을 통해 고납(25~40%) 슬래그에서 추가로 얻어집니다.[197]
대안
더 깨끗하고 에너지 집약적이지 않은 납 추출 공정에 대한 연구가 계속되고 있습니다. 주요 단점은 너무 많은 납이 폐기물로 손실되거나 대체 물질이 생성된 납 금속에 높은 황 함량을 초래한다는 것입니다.불순한 납의 양극을 전해질에 침지시키고 순수한 납을 음극에 증착(전동)하는 수소금속추출법은 잠재력을 가질 수 있지만 전기료가 매우 저렴한 경우를 제외하고는 현재 경제성이 없는 기술입니다.[206]
이차적인
1차 생산의 필수적인 부분인 제련은 2차 생산 동안 종종 생략됩니다.금속 납이 상당한 산화를 거친 경우에만 수행됩니다.[195]이 공정은 고로 또는 회전로에서 1차 생산되는 것과 유사하며, 본질적인 차이는 수율의 변동성이 크다는 것입니다. 고로는 경질 납(안티몬 10%)을 생산하고, 잔향 및 회전식 가마로는 반연질 납(안티몬 3~4%)을 생산합니다.[207]
ISAS MELT 공정은 1차 생산의 확장으로 작용할 수 있는 보다 최신의 제련 방법입니다. 사용 후 납-산 배터리(황산납 및 산화납 포함)의 배터리 페이스트는 알칼리 처리를 통해 황산염을 제거한 후 산소가 있는 석탄 연료로에서 처리되어 불순한 납을 생성합니다.안티몬이 가장 일반적인 불순물입니다.[208]2차 납의 정제는 1차 납의 정제와 유사합니다. 재활용된 재료와 잠재적 오염에 따라 일부 정제 과정이 생략될 수 있습니다.[208]
재활용을 위한 납 공급원 중 납축 배터리가 가장 중요합니다. 납 파이프, 시트 및 케이블 피복도 중요합니다.[195]
적용들

일반적인 믿음과는 달리, 나무 연필의 연필심은 결코 납으로 만들어진 적이 없습니다.연필이 포장된 흑연 필기 도구로 시작되었을 때, 사용된 특정 유형의 흑연을 플럼바고(말 그대로 납 또는 납 목업을 위한 동작)라고 이름 지었습니다.[210]
원소형
납 금속은 고밀도, 저융점, 연성, 상대적 불활성 등 여러 가지 유용한 기계적 특성을 가지고 있습니다.많은 금속이 이러한 측면에서 납보다 우수하지만 일반적으로 일반적으로 덜 흔하고 모광에서 추출하기가 더 어렵습니다.납의 독성은 일부 용도로 점차 사라져가고 있습니다.[211]
납은 중세 시대에 발명된 이래로 총알에 사용되어 왔습니다.가격이 저렴하며, 융점이 낮아 소형 무기 탄약과 산탄총 펠릿을 최소한의 기술 장비로 주조할 수 있으며, 다른 일반 금속보다 밀도가 높아 속도를 더 잘 유지할 수 있습니다.탄환의 주재료로 남아있으며, 경화제로서 다른 금속과 합금화되어 있습니다.[168]사냥에 쓰이는 납탄이 환경을 해칠 수 있다는 우려가 제기됐습니다.[p]
납의 높은 밀도와 부식에 대한 내성은 많은 관련 응용 분야에서 활용되고 있습니다.돛단배 용골에서 밸러스트로 사용됩니다. 밀도는 작은 부피를 차지하고 물의 저항을 최소화하여 돛에 바람이 가해지는 힐링 효과를 상쇄할 수 있습니다.[213]잠수부의 부력을 상쇄하기 위해 스쿠버 다이빙 웨이트 벨트에 사용됩니다.[214]1993년에, 피사의 사탑의 기초는 600톤의 납으로 안정화되었습니다.[215]납은 내식성 때문에 수중 케이블의 보호 피복으로 사용됩니다.[216]

납 시트는 지붕 재료, 피복, 섬광, 시궁창 및 시궁창 이음부, 지붕 난간 등에서 건축 금속으로 사용되는 등 건설 산업에서 많은 용도로 사용되고 있습니다.[217][218]납은 아직도 전기자를 [q]포함한 조각상과 조각품에 사용됩니다.[220]과거에는 종종 자동차 휠의 균형을 맞추기 위해 사용되었습니다. 환경적인 이유로 이 사용은 다른 재료에 비해 점차 중단되고 있습니다.[115]
납은 황동이나 청동과 같은 구리 합금에 첨가되어 가공성과 윤활성을 향상시킵니다.구리에 실질적으로 용해되지 않는 납은 알갱이 경계와 같이 합금 전체에 불완전한 고체 덩어리를 형성합니다.윤활제의 역할을 할 뿐만 아니라 저농도의 경우에는 알로이의 작동에 따라 소구가 스와프의 형성을 방해하여 가공성을 향상시킵니다.베어링에는 납의 농도가 더 높은 구리 합금이 사용됩니다.납은 윤활 기능을 제공하고 구리는 하중 지지 기능을 제공합니다.[221]
납의 높은 밀도와 원자수, 그리고 형성성은 소리, 진동, 그리고 방사선을 흡수하는 장벽으로서 납을 사용하는 기초를 형성합니다.[222]납은 자연 공진 주파수가 없기 [222]때문에 음향 스튜디오의 벽, 바닥, 천장 등에서 음침층으로 사용됩니다.[223]오르간 파이프는 종종 납 합금으로 만들어지며, 각 파이프의 음색을 조절하기 위해 다양한 양의 주석과 혼합됩니다.[224][225]납은 밀도가 높고 감쇠 계수가 높기 때문에 원자력 과학과 X선실에서[226] 방사선으로부터 확실하게 보호되는 물질입니다.[227]용융 납은 납으로 냉각된 고속 원자로의 냉각제로 사용되어 왔습니다.[228]
건전지
21세기 초 납을 가장 많이 사용한 것은 납 축전지입니다.배터리의 납은 사람과 직접 접촉하지 않기 때문에 독성 우려가 적습니다.[r]납 배터리 생산 공장에서 일하는 사람들은 납 분진에 노출되어 흡입할 수 있습니다.[230]납, 이산화 납, 황산 사이의 배터리 내 반응은 안정적인 전압 공급원을 제공합니다.[s]납 축전지를 사용하는 슈퍼커패시터는 호주, 일본 및 미국의 킬로와트 및 메가와트 규모 응용 분야에 주파수 조절, 태양열 평활 및 시프트, 바람 평활 및 기타 응용 분야에 설치되었습니다.[232]이 배터리는 리튬이온 배터리에 비해 에너지 밀도와 충방전 효율이 낮지만 가격은 상당히 저렴합니다.[233]
케이블 코팅
납은 절연물로 물이 확산되는 것을 방지하기 위해 쉘 재료로 고전압 전력 케이블에 사용되며, 납이 단계적으로 제거됨에 따라 그 사용이 감소하고 있습니다.[234]일부 국가에서는 환경적으로 유해한 폐기물의 양을 줄이기 위해 전자제품용 솔더에 대한 사용도 단계적으로 폐지하고 있습니다.[235]납은 박물관 자료에 대한 오디 테스트에 사용되는 세 가지 금속 중 하나로 유기산, 알데하이드, 산성 가스를 감지하는 데 도움을 줍니다.[236][237]
컴파운드


납-산 배터리는 납 금속의 주요 용도일 뿐만 아니라 납 화합물의 주요 소비자이기도 합니다.이러한 장치에 사용되는 에너지 저장/방출 반응에는 황산납과 이산화 납이 포함됩니다.
- Pb + PbO + 2HSO(aq) → 2PbSO + 2HO(l)
납 화합물의 다른 용도는 매우 전문적이고 종종 퇴색됩니다.납계 착색제는 세라믹 유리와 유리, 특히 적색과 황색의 색조에 사용됩니다.[238]납 페인트는 유럽과 북미에서는 단계적으로 사용이 중단되지만 중국,[239] 인도 [240]또는 인도네시아와 같은 저개발 국가에서는 여전히 사용됩니다.[241]테트라아세테이트 납과 이산화 납은 유기화학에서 산화제로 사용됩니다.납은 전기 코드의 폴리염화비닐 코팅에 자주 사용됩니다.[242][243]이것은 촛불 심지를 치료하는 데 사용되어 더 길고 더 고른 화상을 보장할 수 있습니다.독성 때문에 유럽과 북미 제조업체들은 아연과 같은 대체 물질을 사용합니다.[244][245]납 유리는 12~28%의 산화 납으로 구성되어 있어 광학적 특성을 변화시키고 음극선관이 있는 오래된 TV와 컴퓨터 모니터에 사용되는 특성인 [246]전리방사선의 투과를 줄입니다.납 텔루라이드 및 납 셀레나이드와 같은 납 기반 반도체는 광전지 및 적외선 검출기에 사용됩니다.[247]
총탄
납은 총 탄약통의 탄환에도 사용됩니다.구리로 덮인 코어 금속으로 사용됩니다.
생물학적 효과
| 유해성 | |
|---|---|
| GHS 라벨링: | |
   | |
| 위험 | |
| H302, H332, H351, H360Df, H373, H410 | |
| P201, P261, P273, P304, P308, P312, P313, P340, P391[248] | |
| NFPA 704 (파이어다이아몬드) | |
납은 생물학적 역할이 확인되지 않았으며, 안전한 수준의 납 노출도 확인되지 않았습니다.[249]2009년 캐나다계 미국인 연구는 위험성이 거의 또는 전혀 없다고 간주되는 수준에서도 납은 "부정적인 정신 건강 결과"를 초래할 수 있다고 결론 내렸습니다.[250]성인 평균 120mg인[t] 인체에서의 유병률은 중금속 중 아연(2500mg)과 철(4000mg)에 의해서만 초과됩니다.[252]납염은 체내에서 매우 효율적으로 흡수됩니다.[253]소량의 납(1%)은 뼈에 저장되며, 나머지는 노출 후 몇 주 이내에 소변과 대변으로 배출됩니다.납의 약 3분의 1만이 아이에 의해 배설됩니다.지속적으로 노출되면 납이 생물학적으로 축적될 수 있습니다.[254]
독성
납은 매우 독성이 강한 금속으로 인체의 거의 모든 기관과 시스템에 영향을 미칩니다.[255]공기 중 농도가 100mg/m이면3 생명과 건강에 즉시 위험합니다.[256]대부분의 섭취된 납은 혈류로 흡수됩니다.[257]독성의 주요 원인은 효소의 적절한 기능을 방해하는 성향 때문입니다.그것은 많은 효소에서 발견되는 술프히드릴 그룹에 결합하거나,[258] 많은 효소 반응에서 보조 인자로 작용하는 다른 금속을 모방하고 대체함으로써 그렇게 합니다.[259]납과 상호작용하는 필수 금속은 칼슘, 철, 아연을 포함합니다.[260]칼슘과 철분의 높은 수준은 납 중독으로부터 어느 정도의 보호를 제공하는 경향이 있습니다; 낮은 수준은 민감도를 증가시킵니다.[253]
영향들
납은 뇌와 신장에 심각한 손상을 입히고 결국 사망에 이를 수 있습니다.칼슘을 모방함으로써, 납은 혈액-뇌 장벽을 넘을 수 있습니다.신경세포의 미엘린 피복을 저하시키고, 수를 감소시키고, 신경전달 경로를 방해하며, 신경세포의 성장을 감소시킵니다.[258]인체에서 납은 포르포빌리노겐 합성효소와 페로첼라타제를 억제하여 포르포빌리노겐 형성과 헴 합성의 마지막 단계인 프로토포르피린 IX에 철이 포함되는 것을 방지합니다.이것은 비효율적인 헴 합성과 미세세포성 빈혈을 일으킵니다.[261]

납 중독의 증상으로는 신증, 산통 같은 복통, 그리고 가능하면 손가락, 손목 또는 발목의 약화가 있습니다.특히 중년 이상의 사람들에게서 혈압이 약간 상승하는 것은 명백할 수 있고 빈혈을 유발할 수 있습니다.[citation needed]대부분 단면적인 여러 연구에서 납 노출의 증가와 심박 변동성의 감소 사이의 연관성을 발견했습니다.[262]임산부의 경우 납에 많이 노출되면 유산의 원인이 될 수 있습니다.만성적인 높은 수준의 노출은 남성의 출산력을 감소시키는 것으로 나타났습니다.[263]
어린이의 발달 중인 뇌에서 납은 대뇌 피질의 시냅스 형성, 신경 화학적 발달(신경 전달 물질 포함), 이온 채널의 조직화를 방해합니다.[264]유아기 노출은 후기 아동기에 수면 장애 및 과도한 낮 졸음의 위험 증가와 관련이 있습니다.[265]높은 혈중 농도는 여자 아이들의 사춘기 지연과 관련이 있습니다.[266]20세기 동안 휘발유의 테트라에틸 납 연소로 인한 공기 중 납 노출의 증감은 범죄 수준의 역사적 증가와 관련이 있습니다.
노출원
납의 채굴과 제련, 배터리의 제조, 폐기, 재활용은 많은 나라에서 보편화되어 있기 때문에 납 노출은 전 세계적인 이슈입니다.납은 흡입, 섭취 또는 피부 흡수를 통해 체내로 들어갑니다.거의 모든 흡입된 납은 체내로 흡수되며, 섭취율은 20-70%이며, 어린이는 성인보다 더 높은 비율을 흡수합니다.[267]
중독은 일반적으로 납으로 오염된 음식이나 물을 섭취함으로써 발생하며, 오염된 토양, 먼지 또는 납 성분의 페인트를 우연히 섭취한 경우는 덜 흔합니다.[268]바닷물 제품은 주변 공업용수의 영향을 받을 경우 납을 함유할 수 있습니다.[269]과일과 채소는 그들이 자란 토양의 높은 수준의 납에 의해 오염될 수 있습니다.토양은 파이프의 납으로 인한 입자 축적, 납 페인트 및 납 가솔린의 잔류 배출을 통해 오염될 수 있습니다.[270]
상수도관에 납을 사용하는 것은 연하거나 산성수가 있는 지역에서 문제가 됩니다.[271]경수는 파이프의 내부 표면에 불용성 보호층을 형성하는 반면, 연하고 산성인 물은 납 파이프를 용해시킵니다.[272]운반된 물에 용해된 이산화탄소는 용해성 중탄산 납을 생성할 수 있으며, 산소가 공급된 물은 납을 납과 유사하게 용해시킬 수 있습니다(II) 수산화물이러한 물을 시간이 지남에 따라 마시면 용해된 납의 독성으로 인해 건강에 문제를 일으킬 수 있습니다.물이 단단할수록 탄산칼슘과 황산칼슘이 더 많이 들어있고, 파이프 내부는 탄산납이나 황산납으로 된 보호층으로 코팅됩니다.[273]

납을 사용한 페인트의 섭취는 아이들에게 노출의 주요 원인입니다: 직접적인 원인은 오래된 페인트 칠된 창턱을 씹는 것입니다.또는 도포된 드라이 페인트가 변질되면서 벗겨져 먼지로 분쇄된 후 손에서 입으로 접촉하거나 오염된 음식물, 물, 알코올 등을 통해 체내로 유입되는 문제점이 있습니다.특정 가정요법을 섭취할 경우 납 또는 그 화합물에 노출될 수 있습니다.[274]
흡입은 흡연자와 특히 납과 관련된 직업에 종사하는 근로자들에게 영향을 미치는 두 번째 주요 노출 경로입니다.[257]담배 연기에는 다른 독성 물질 중에서도 방사성 납-210이 포함되어 있습니다.[275]"미국 환경보호국의 규제 노력의 결과, 2010년과 2020년 사이에 공기 중 납의 양이 86% 감소했습니다."[276]2014년 미국의 공기 중 납 농도는 전국 기준인 0.15μg/m3[277] 이하로 떨어졌습니다.[278]
피부 노출은 유기 납 화합물을 사용하는 사람들에게 중요할 수 있습니다.무기 납의 경우 피부 흡수율이 더 낮습니다.[279]
음식의 납
납은 납이 많은 토양에서 음식이 자라거나, 공기 중에 떠다니는 납이 농작물을 오염시키거나, 동물들이 음식에서 납을 먹거나, 음식에서 납이 음식으로 들어갈 때 음식에서 발견될 수 있습니다.[280]납 페인트와 배터리를 섭취하는 것은 가축의 노출 경로이기도 하며, 이는 결과적으로 사람에게 영향을 미칠 수 있습니다.[281]오염된 소에 의해 생산된 우유는 납 농도를 낮추어 소비하기 위해 판매될 수 있습니다.[282]
방글라데시에서는 강황을 노란색으로 만들기 위해 납 화합물을 강황에 첨가하고 있습니다.[283]이는 1980년대부터 시작되어 2019년[update] 현재까지 지속되고 있는 것으로 판단됩니다.[283]그것은 한국에서 높은 납 레벨의 주요 공급원 중 하나로 여겨지고 있습니다.[284]홍콩에서 백만분의 최대 허용 납 부분은 고형 식품에서 6, 액상 식품에서 1입니다.[285]
2022년 12월, 컨슈머 리포트(Consumer Reports)는 28개의 다크 초콜릿 브랜드를 테스트한 결과, 23개의 브랜드가 잠재적으로 유해한 수준의 납, 카드뮴 또는 둘 다를 함유하고 있는 것으로 나타났습니다.그들은 초콜릿 제조사들에게 특정한 사람들,[286] 특히 임산부들에게 해로울 수 있는 납의 양을 줄일 것을 촉구했습니다.납을 함유한 먼지는 코코아 콩이 오염시키는 산업 공장 근처의 바깥에 놓여질 때 건조시키는 것으로 정착할 수 있습니다.[287]
플라스틱 장난감의 납
미국 질병통제센터에 따르면 플라스틱에 납을 사용하는 것은 금지되지 않았습니다.납은 플라스틱을 부드럽게 하고 원래의 모양으로 돌아갈 수 있도록 더 유연하게 만듭니다.플라스틱 장난감에서도 열로부터 분자를 안정화시키는 데 사용될 수 있습니다.납 먼지는 플라스틱이 햇빛, 공기, 그리고 납과 플라스틱 사이의 화학적 결합을 분해하는 세제에 노출될 때 형성될 수 있습니다.[288]
치료
납 중독의 치료는 일반적으로 다이머카프롤과 석시머의 투여를 수반합니다.[289]급성의 경우 에데테이트 칼슘, 킬레이트 칼슘, 그리고 에틸렌다이아민테트라아세트산(EDTA)의 이나트륨 염의 사용이 필요할 수 있습니다.칼슘보다 납에 더 큰 친화력을 가지고 있는데, 그 결과 교환에 의해 납 킬레이트가 형성되고 소변으로 배출되어 무해한 칼슘을 남깁니다.[290]
환경영향

납과 그 제품들의 추출, 생산, 사용, 폐기는 지구의 토양과 물을 심각하게 오염시켰습니다.납의 대기 배출은 산업 혁명 시기에 최고조에 달했고, 20세기 후반에는 납 휘발유 시대에 절정에 달했습니다.
납 방출은 천연 공급원(즉, 자연적으로 발생하는 납의 농축), 산업 생산, 소각 및 재활용, 이전에 매립된 납의 동원에서 비롯됩니다.[291]특히 납이 다른 용도에서 단계적으로 제거됨에 따라 글로벌 남부 지역에서는 글로벌 제조에 사용되는 저렴한 납을 추출하기 위해 설계된 납 재활용 작업이 잘 문서화된 노출원이 되었습니다.[292]납의 높은 농도는 산업화 이후와 도시 지역의 토양과 퇴적물에 지속됩니다. 석탄 연소에서 발생하는 것을 포함한 산업 배출은 세계의 많은 지역, 특히 개발도상국에서 계속되고 있습니다.[293][294]
납은 토양, 특히 유기물 함량이 높은 토양에서 수백 년에서 수천 년 동안 축적될 수 있습니다.환경 납은 광합성을 억제할 가능성이 있고 충분히 높은 농도로 식물 표면에서 발견되는 다른 금속과 경쟁하여 식물의 성장과 생존에 부정적인 영향을 미칠 수 있습니다.토양과 식물의 오염은 미생물과 동물에 영향을 미치는 먹이 사슬을 상승시킬 수 있습니다.동물에서 납은 많은 기관에서 독성을 나타내어 섭취, 흡입 또는 피부 흡수 후 신경계, 신장계, 생식계, 조혈계, 심혈관계를 손상시킵니다.[295]물고기는 물과 퇴적물 모두에서 납을 흡수합니다;[296] 먹이 사슬의 생물 축적은 물고기, 새, 그리고 바다 포유동물들에게 위험합니다.[297]
인공 납에는 샷과 싱커의 납이 포함됩니다.이들은 납 생산 현장과 함께 납 오염의 가장 강력한 원인 중 하나입니다.[298]납은 2017년 미국에서 총과 싱커에 대해 금지되었지만,[299] 그 금지는 단지 한 달 동안만 효력이 있었고,[300] 유럽 연합에서도 비슷한 금지가 고려되고 있습니다.[301]
환경에서 납을 측정하기 위한 분석 방법으로는 분광광도법, X선 형광법, 원자분광법, 전기화학법 등이 있습니다.이오노포어 S,S'-메틸렌비스(N,N-diisobutyldithiocarbamate)에 기초하여 특정 이온 선택 전극이 개발되었습니다.[302]납 중독에 대한 중요한 바이오마커 검사는 혈장, 혈청 및 소변에서 δ-아미노레불린산 수치입니다.
제한 및 교정

1980년대 중반까지 산업에서 납의 사용은 크게 감소했습니다.[304]미국에서는 환경 규제로 인해 가솔린, 페인트, 솔더 및 수도 시스템을 포함한 비배터리 제품에서 납의 사용을 줄이거나 없앴습니다.석탄화력발전소에는 납 배출가스를 포집하기 위한 입자제어장치가 설치됐습니다.[293]1992년, 미국 의회는 환경보호청에 미국 어린이들의 혈중 납 농도를 줄일 것을 요구했습니다.[305]납 사용은 유럽 연합의 2003년 유해 물질 제한 지침에 의해 더욱 축소되었습니다.[306]네덜란드에서는 1993년 국가적으로 사냥과 스포츠 사격에 납을 사용하는 것을 금지한 이후 납 퇴적량이 크게 감소했습니다. 1990년 230톤에서 1995년 47.5톤으로 증가했습니다.[307]
미국의 경우 금속성 납, 무기성 납 화합물, 납 비누 등으로 구성된 작업장 내 납의 허용 노출기준을 8시간 근무일 동안 50μg/m로3 설정하였고, 2012년 혈중 납 농도 기준을 혈액 100g당 5μg으로 설정하였습니다.[308]납은 석기,[309] 비닐[310](배관 및 전기 코드 절연에 사용되는 것 등) 및 중국 황동에서 여전히 유해한 양으로 발견될 수 있습니다.[u]오래된 집에는 납 페인트가 남아 있을 수 있습니다.[310]백색 납 페인트는 선진국에서 판매가 중단되었지만, 황색 납 크로메이트와 같은 다른 색소의 전문적인 사용은 남아 있습니다.[182]샌딩으로 오래된 페인트를 벗겨내면 흡입할 수 있는 먼지가 발생합니다.[312]납 감소 프로그램은 어린 아이들이 살고 있는 부동산의 일부 당국에 의해 의무화되었습니다.[313]
납 폐기물은 관할 구역과 폐기물의 성격에 따라 가정용 폐기물([314]납 방지 활동을 촉진하기 위해) 또는 전문적인 처리 또는 저장이 필요한 잠재적인 위험 폐기물로 처리될 수 있습니다.[315]납은 촬영 장소에서 환경으로 방출되고 납 오염에 대응하기 위해 여러 가지 납 관리 관행이 개발되었습니다.[316]납 이동은 산성 토양에서 강화될 수 있습니다. 이에 대응하기 위해 토양을 석회로 처리하여 토양을 중화시키고 납의 침출을 방지하는 것이 좋습니다.[317]
생물학적 방법으로 바이오 시스템에서 납을 제거하는 방법에 대한 연구가 수행되었습니다.물고기 뼈는 오염된 토양에서 납을 생물학적으로 처리하는 능력으로 연구되고 있습니다.[318][319]아스페르길루스 베르시컬러라는 곰팡이는 수체로 방출되기 전에 산업 폐기물에서 나오는 납 이온을 흡수하는 데 효과적입니다.[320]수용액에 효과가 높은 황산환원균 Desulfovibrio와 Desulfotomaculum을 포함한 몇몇 박테리아가 환경에서 납을 제거하는 능력에 대해 연구되어 왔습니다.[321]밀레풀 Urochloa ramosa(밀레풀 Urochloa ramosa)는 슛과 뿌리 조직에서 납과 아연과 같은 상당한 양의 금속을 축적하는 능력을 가지고 있어 오염된 토양의 치료를 위한 중요한 식물입니다(Lakshmi et al., 2013).[322]
참고 항목
- Derek Bryce-Smith – 영국에서 휘발유 납에 반대하는 초기 운동가 중 한 명
- Thomas Midgley Jr. – 가솔린에 테트라에틸 납을 첨가하면 내연 기관의 "노킹"을 방지할 수 있음을 발견했습니다.
- 클레어 패터슨 – 미국에서 휘발유의 테트라에틸 납과 식품 캔의 납 납 납을 금지하는 데 중요한 역할을 합니다.
- 로버트 A. Kehoe – 가솔린의 첨가제로서 테트라에틸 납의 사용에 대한 가장 중요한 의학 옹호자.
메모들
- ^ 주석의 사면체 동소체는 α- 또는 회색 주석이라고 불리며, 13.2°C(55.8°F) 이하에서만 안정합니다.이 온도 이상의 안정한 형태의 주석은 β- 또는 백색 주석이라고 불리며, 회색 주석의 4면체를 그들의 입방축을 따라 압축함으로써 유도할 수 있는 왜곡된 면심 입방체(4각형) 구조를 가지고 있습니다.백색 주석은 회색 주석의 정사면체 구조와 납의 정사면체 중심 입방 구조의 중간 구조를 효과적으로 가지고 있으며, 대표적인 그룹으로 갈수록 금속성이 증가하는 일반적인 경향과 일치합니다.[15]
- ^ 2013년에 오각형 대칭을 가진 납의 준결정 박막 동소체가 보고되었습니다.동소체는 정이십면체의 은-인듐-이테르븀 준결정의 표면에 납 원자를 증착함으로써 얻어졌습니다.전도도는 기록되지 않았습니다.[16][17]
- ^ 실리콘의 격자 매개변수 주위에 격자 매개변수를 갖는 다이아몬드 큐빅 구조는 얇은 납 필름과 주석 필름 모두에 존재하며, 질량이 큰 납과 주석에는 ~5 x 10−6 Torr의 진공에서 갓 응고됩니다.납과 주석이 결정화의 초기 단계뿐만 아니라 산화의 초기 단계에서도 실리콘과 같이 작용한다는 것을 보여주는 최소 3가지 산화물 유형의 거의 동일한 구조에 대한 실험적 증거가 제시됩니다.[18]
- ^ 영국식 영어: 납 풍선처럼 아래로 내려갑니다.
- ^ 가단성은 압축 상태에서 얼마나 쉽게 변형되는지를 나타내는 반면, 연성은 신축성을 의미합니다.
- ^ 손가락을 화상의 위험 없이 녹은 납에 담글 수 있습니다.[31]
- ^ 양성자나 중성자가 짝수이면 홀수인 동위원소에 비해 동위원소의 핵 안정성이 높아집니다.홀수 원자 번호를 가진 원소는 2개 이상의 안정 동위 원소를 가지고 있지 않으며, 짝수 원소는 복수의 안정 동위 원소를 가지고 있으며, 주석(원소 50)은 모든 원소 중 가장 많은 10개의 동위 원소를 가지고 있습니다.[35]자세한 내용은 짝수 및 홀수 원자핵을 참조하십시오.
- ^ 이 실험에서 발견된 반감기는 1.9×10년이었습니다19.[38]천연 비스무트 1kg의 활성 값은 약 0.003베크렐(초당 붕괴)입니다.이에 비해 인체의 자연방사선 활성 값은 체중 1kg당 약 65베크렐(평균 4500베크렐).[39]
- ^ 납-205는 전자 포획을 통해서만 붕괴되는데, 이는 이용 가능한 전자가 없고 납이 완전히 이온화된 상태에서 82개의 전자를 모두 제거하면 붕괴할 수 없다는 것을 의미합니다.완전히 이온화된 탈륨-205는 동위 원소 납-205로 붕괴되고 불안정하며 납-205의 결합 상태로 붕괴될 수 있습니다.[50]
- ^ 테트라페닐 납은 270°C에서 분해되어 열적으로 더욱 안정합니다.[91]
- ^ 공급원의 풍부함은 입자별 표기법이 아닌 실리콘에 대해 나열됩니다.실리콘 10부당6 모든 원소의 합은 2.6682×10부이며10 납은 3.258부로 구성됩니다.
- ^ 원소 풍부도 수치는 추정치이며 세부 정보는 출처에 따라 다를 수 있습니다.[113]
- ^ 비문에는 "베스파시아누스 황제가 9선 집정관이었을 때, 티투스 황제가 7선 집정관이었을 때, 그나이우스 일리우스 아그리콜라가 (브리튼의) 제국 총독이었을 때 만들어졌다"는 내용이 적혀 있습니다.
- ^ 율리우스 카이사르가 단 한 명의 아이를 낳았다는 사실과 그의 후계자인 카이사르 아우구스투스의 불임 의혹은 납 중독으로 이어졌습니다.[148]
- ^ 일산화탄소, 수소 및 메탄을 포함하는 코크스 공정의 가스 부산물; 연료로 사용됩니다.
- ^ 캘리포니아는 2015년 7월부터 사냥용 납탄을 금지하기 시작했습니다.[212]
- ^ 예를 들어, "...100년 이상 웨스트 런던에 있는 저희 스튜디오에서 질 좋은 정원 장식품을 생산하고 있습니다."[219]
- ^ 이러한 배터리를 사용하는 일반 사용자의 잠재적 부상은 납의 독성과 관련이 없습니다.[229]
- ^ 납축 배터리의 작동 방식에 대한 자세한 내용은 을 참조하십시오[231].
- ^ 요금은 나라에 따라 매우 차이가 납니다.[251]
- ^ 납, 철, 주석 및 때로는 안티몬과 황동(구리 및 아연)의 합금입니다.[311]
참고문헌
- ^ "Standard Atomic Weights: Lead". CIAAW. 2020.
- ^ 납 원자와 일산화탄소의 반응에서 Pb(0)개의 카보닐이 관찰되었습니다.
- ^ West, Astle & Beyer 1983, p. E110.
- ^ Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S.; Audi, G. (2021). "The NUBASE2020 evaluation of nuclear properties" (PDF). Chinese Physics C. 45 (3): 030001. doi:10.1088/1674-1137/abddae.
- ^ Meija et al. 2016.
- ^ Theodore Low De Vinne 1899, 페이지 9-36
- ^ Lide 2005, p. 10-179.
- ^ Pykkö 1988, 페이지 563-594.
- ^ Claudio, Godwin & Magyar 2002, pp. 1-144
- ^ Norman 1996, 페이지 36. 36.
- ^ Greenwood & Earnshaw 1998, pp. 226-227, 374
- ^ 크리스텐슨 2002, 페이지 867.
- ^ 1964년 후반
- ^ Conceinine & Conceinine 2013, pp. 501, 2970
- ^ 1964년 파르테, 페이지 13.
- ^ Sharma et al. 2013.
- ^ Sharma et al. 2014, p. 174710.
- ^ 페네바, 주네바 & 츠케바 1981.
- ^ 그린우드 & 어언쇼 1998, 페이지 372.
- ^ Greenwood & Earnshaw 1998, 페이지 372-373.
- ^ a b Thornton, Rautiu & Brush 2001, p. 6.
- ^ Lide 2005, pp. 12–35, 12–40.
- ^ 브레너 2003, 페이지 396.
- ^ 존스 2014, 페이지 42.
- ^ Lide 2005, pp. 4-13, 4-21, 4-33.
- ^ 보겔 & 아킬레스 2013, 페이지 8.
- ^ 앤더슨 1869, 페이지 341-343.
- ^ Gale & Totmeier 2003, pp. 15–2–15–3
- ^ Thornton, Rautiu & Brush 2001, p. 8.
- ^ a b Lide 2005, p. 12-219.
- ^ 윌리 1999.
- ^ Lide 2005, p. 12-45.
- ^ 블레이크모어 1985, 페이지 272.
- ^ 웹, 마르시글리오 & 허쉬 2015.
- ^ a b c d e IAEA - 핵 데이터 섹션 2017.
- ^ 캘리포니아 대학 핵 법의학 연구 프로젝트.
- ^ a b 스톤 1997.
- ^ de Marcillac et al. 2003, pp. 876–78.
- ^ 세계 원자력 협회 2015.
- ^ Beeman et al. 2013.
- ^ 방사성 붕괴 시리즈 2012.
- ^ 자연 발생 방사성 물질 노출에 대한 EPA 지침 평가 위원회 등 1999.
- ^ 스미르노프, 보리세비치 & 술라베리제 2012.
- ^ 그린우드 & 어언쇼 1998, 페이지 368.
- ^ 레빈 2009, 페이지 40-41.
- ^ 웹 2000, 115쪽.
- ^ Wrackmeyer & Horchler 1990.
- ^ 캉겔로시 & 페코라로 2015.
- ^ 피오리니 2010, 페이지 7-8.
- ^ 타카하시 외 1987.
- ^ Thürmer, Williams & Reutt-Robey 2002, pp. 2033–2035.
- ^ Tétreault, Sirois & Stamatopoulou 1998, pp. 17-32
- ^ Thornton, Rautiu & Brush 2001, pp. 10-11.
- ^ a b c d e f 그린우드 & 어언쇼 1998, 페이지 373.
- ^ Bretherick 2016, 페이지 1442.
- ^ Harbison, Bourza & Johnson 2015, 페이지 132.
- ^ a b 그린우드 & 어언쇼 1998, 페이지 374.
- ^ Thornton, Rautiu & Brush 2001, pp. 11-12
- ^ 폴리안스키 1986, p. 20.
- ^ 카우프 2014, 페이지 9-10.
- ^ 디터 & 왓슨 2009, 페이지 509.
- ^ Hunt 2014, 페이지 215.
- ^ a b c 킹 1995, 페이지 43-63.
- ^ 벙커 & 케이시 2016, 페이지 89.
- ^ Whitten, Gailey & David 1996, pp. 904-905.
- ^ 그린우드 & 어언쇼 1998, 페이지 384.
- ^ 그린우드 & 어언쇼 1998, 페이지 387.
- ^ a b 그린우드 & 어언쇼 1998, 페이지 389.
- ^ Zuckerman & Hagen 1989, 페이지 426.
- ^ 펑키 2013.
- ^ a b 그린우드 & 어언쇼 1998, 페이지 382.
- ^ Bharara & Atwood 2006, 페이지 4.
- ^ 그린우드 & 어언쇼 1998, 페이지 388.
- ^ 납에 대한 독성학적 프로파일 2007, 페이지 277.
- ^ Downs & Adams 2017, p. 1128.
- ^ 브레시아 2012, 페이지 234.
- ^ 매킨타이어 1992, 페이지 3775.
- ^ 실버맨 1966, pp. 2067–2069
- ^ 그린우드 & 어언쇼 1998, 페이지 381.
- ^ Yong, Hoffmann & Fässler 2006, pp. 4774-4778
- ^ Becker et al. 2008, pp. 9965-9978
- ^ Mosseri, Henglein & Janata 1990, pp. 2722-2726
- ^ Konu & Chivers 2011, 페이지 391-392
- ^ 해들링턴 2017, 페이지 59.
- ^ Greenwood & Earnshaw 1998, 384-386쪽
- ^ 뢰르 2017.
- ^ Alsfasser 2007, 페이지 261-263
- ^ 그린우드 & 어언쇼 1998, 페이지 393.
- ^ Stabenow, Saak & Weidenbruch 2003.
- ^ a b 폴리안스키 1986, 페이지 43.
- ^ a b c d 그린우드 & 어언쇼 1998, 페이지 404.
- ^ a b Wiberg, Wiberg & Holleman 2001, 페이지 918.
- ^ 납에 대한 독성학적 프로파일 2007, 페이지 287.
- ^ 폴리안스키 1986, 페이지 44.
- ^ 윈드홀츠 1976년
- ^ 즈ý카 1966, 페이지 569.
- ^ a b c d Lodders 2003, pp. 1222-1223
- ^ 로더러 외. 2009, pp. 1963-1980.
- ^ Lochner, Rohrbach & Cochrane 2005, p. 12.
- ^ Lodders 2003, 페이지 1224.
- ^ Burbidge et al. 1957, pp. 608-615
- ^ 버비지 외 1957, 페이지 551.
- ^ Burbidge et al. 1957, pp. 608-609
- ^ 버비지 외 1957, 페이지 553.
- ^ 프레벨 2015, 페이지 114-115
- ^ Burbidge et al. 1957, pp. 608-610
- ^ 버비지 외 1957, 페이지 595
- ^ 버비지 외 1957, 페이지 596.
- ^ Burbidge et al. 1957, pp. 582, 609-615
- ^ Langmuir & Broecker 2012, 183-184쪽
- ^ Davidson et al. 2014, pp. 4-5
- ^ Emmsley 2011, pp. 286, passim.
- ^ 콕스 1997, 페이지 182.
- ^ a b 데이빗슨 외. 2014, 페이지 4.
- ^ a b c d 미국 지질조사 2017, 페이지 97.
- ^ Rieuwerts 2015, 페이지 225.
- ^ 메리엄-웹스터.
- ^ a b Krounen 2013, *lauda-.
- ^ 니콜라예프 2012.
- ^ 크루넨 2013, *블리와- 2.
- ^ Krounen 2013, *ladijan-.
- ^ a b c Hong et al. 1994, pp. 1841-1843
- ^ a b 리치 1994, 페이지 4.
- ^ a b c d e 와인더 1993b.
- ^ 화장품의 역사.
- ^ 차푸루카 쿠심바 2017.
- ^ Yu & Yu 2004, 페이지 26.
- ^ 토론토 박물관은 2003년을 탐험합니다.
- ^ Bisson & Vogel 2000, 페이지 105.
- ^ 우드, 슈앤벨 2021.
- ^ 리치 1994, 페이지 5.
- ^ 1973년 미국 지질 조사.
- ^ 납 슬링 탄환.
- ^ de Callata ÿ 2005, 페이지 361-372.
- ^ Ceccarelli 2013, p. 35.
- ^ 오슈어리와 석관.
- ^ Calvo Rebollar 2019, 페이지 45.
- ^ 리치 1994, 6쪽.
- ^ Thornton, Rautiu & Brush 2001, pp. 179–184.
- ^ Bisel & Bisel 2002, pp. 459-460
- ^ Retief & Cilliers 2006, 페이지 149-151.
- ^ 그라우트 2017.
- ^ Eschnauer & Stoppler 1992, p. 58.
- ^ Hodge 1981, 페이지 486-491.
- ^ Marcus Vitruvius Pollio (1914) [c. 15 BC]. De architectura. Book 8, 10-11 fulltext.
- ^ 길필란 1965, 페이지 53-60.
- ^ Nriagu 1983, 660-663쪽
- ^ Frankenburg 2014, p. 16.
- ^ 스카버러 1984
- ^ Waldron 1985, pp. 107–108.
- ^ 레디 & 브라운 2010, 페이지 1052.
- ^ Delile et al. 2014, pp. 6594-6599
- ^ 손가락 2006, 페이지 184.
- ^ 루이스 1985, p. 15.
- ^ Thornton, Rautiu & Brush 2001, 페이지 183.
- ^ 폴리안스키 1986, p. 8.
- ^ 톰슨 1830, 페이지 74.
- ^ 옥스퍼드 영어사전, surma.
- ^ 바슈머 1986-1987, сурьма
- ^ 켈렛 2012, 106-107쪽
- ^ a b 와인더 1993a.
- ^ a b 리치 1994, 7쪽.
- ^ 리치 1994, 8쪽.
- ^ Ede & Cormack 2016, 페이지 54.
- ^ Cotnoir 2006, 페이지 35.
- ^ 샘슨 1885, 페이지 388.
- ^ 신하 외 1993
- ^ a b Ramage 1980, p. 8.
- ^ Tungate 2011, 페이지 14.
- ^ 도넬리 2014, 171-172쪽
- ^ 아시카리 2003, 페이지 65.
- ^ 나카시마 외 1998, p. 59.
- ^ 라비노위츠 1995, 페이지 66.
- ^ 사우스오스트레일리아의 길 & 도서관 위원회 1974, 페이지 69.
- ^ Bisson & Vogel 2000, 페이지 85.
- ^ Bisson & Vogel 2000, 페이지 131-132
- ^ Hong et al. 1994, pp. 1841-43
- ^ 납 채굴.
- ^ 리치 1994, 11쪽.
- ^ a b c Riva et al. 2012, pp. 11-16
- ^ Hernberg 2000, 페이지 246.
- ^ a b 크로우 2007.
- ^ Markowitz & Rosner 2000, 페이지 37.
- ^ 그 외 2017.
- ^ 미국 지구물리학 연합 2017.
- ^ 1997년 질병통제예방센터.
- ^ 리치 1994, 117쪽.
- ^ 리치 1994, 17쪽.
- ^ 리치 1994, 페이지 91-92.
- ^ 미국 지질 조사 2005.
- ^ Zhang et al. 2012, pp. 2261-2273
- ^ 2014년 통행료.
- ^ Guberman 2016, 페이지 42.14-15
- ^ 그레이델 2010.
- ^ a b c Thornton, Rautiu & Brush 2001, 페이지 56.
- ^ a b 데이빗슨 외. 2014, 페이지 6.
- ^ a b c d 데이빗슨 외. 2014, 페이지 17.
- ^ Thornton, Rautiu & Brush 2001, p. 51.
- ^ Davidson et al. 2014, pp. 11-12
- ^ Thornton, Rautiu & Brush 2001, pp. 51-52
- ^ 데이빗슨 외. 2014, 페이지 25.
- ^ a b c d 1차 납 정제.
- ^ 폴링 1947.
- ^ 데이빗슨 외. 2014, 페이지 34.
- ^ 데이빗슨 외. 2014, 페이지 23.
- ^ Thornton, Rautiu & Brush 2001, pp. 52-53
- ^ 미국 환경 보호국 2010, 페이지 1.
- ^ a b Thornton, Rautiu & Brush 2001, 페이지 57.
- ^ Street & Alexander 1998, 페이지 181.
- ^ Evans 1908, 133-179쪽
- ^ Baird & Cann 2012, pp. 537–538, 543–547.
- ^ 캘리포니아 어류 및 야생동물부.
- ^ Parker 2005, pp. 194–195.
- ^ 크레스토프니코프 & 홀스 2006, 페이지 70.
- ^ Street & Alexander 1998, 페이지 182.
- ^ 젠슨 2013, 페이지 136
- ^ 리드 리서치를 생각해 보십시오.
- ^ 파라펫으로 가는 풍화입니다.
- ^ 납으로 된 정원 장식품 2016.
- ^ Putnam 2003, 페이지 216.
- ^ 구리 개발 협회.
- ^ a b 리치 1994, 페이지 101.
- ^ 구루스와미 2000, 페이지 31.
- ^ Audsley 1965, 페이지 250-251.
- ^ Palmieri 2006, pp. 412-413
- ^ 국가 방사선 방호 및 측정 위원회 2004, 페이지 16.
- ^ Thornton, Rautiu & Brush 2001, p. 7.
- ^ Tuchek, Carlson & Wider 2006, p. 1590.
- ^ 콩코르디아 대학 2016.
- ^ 납에 대한 독성학적 프로파일 2007, 페이지 5-6.
- ^ 프로그레시브 다이나믹스
- ^ 2013년 올린스키-폴
- ^ 2014년 굴빈스카.
- ^ 리치 1994, 133-134쪽.
- ^ Zhao 2008, 페이지 440.
- ^ Beiner et al. 2015.
- ^ Szzepanowska 2013, 페이지 84–85.
- ^ Burleson 2001, p. 23.
- ^ Insight Explorer & IPEN 2016.
- ^ 싱 2017.
- ^ Ismawati et al. 2013, p. 2.
- ^ Zweifel 2009, 페이지 438.
- ^ Wilkes et al. 2005, 페이지 106.
- ^ 랜더슨 2002년.
- ^ Nriagu & Kim 2000, 37-41쪽
- ^ Amstock 1997, 페이지 116–119.
- ^ Rogalski 2010, 페이지 485-541
- ^ "Lead 695912".
- ^ 세계보건기구 2018.
- ^ 부샤드 외. 2009.
- ^ 세계보건기구 2000, 페이지 149-153.
- ^ Emsley 2011, 280쪽, 621쪽, 255쪽
- ^ a b Luckey & Venugopal 1979, 177-178쪽
- ^ 독성 물질 포털.
- ^ 미국 식품의약국 2015, 페이지 42.
- ^ 국립산업안전보건연구소.
- ^ a b 산업안전보건국.
- ^ a b 루돌프 외 2003, 페이지 369
- ^ Dart, Hurlbut & Boyer-Hassen 2004, 페이지 1426.
- ^ 코스넷 2006, 페이지 238.
- ^ Cohen, Trotzky & Pincus 1981, pp. 904-906
- ^ Sokol 2005, p. 133, passim.
- ^ Mycyk, Hryhorczuk & Amitai 2005, 페이지 462.
- ^ Liu et al. 2015, pp. 1869–1874.
- ^ Schoeters et al. 2008, pp. 168-175
- ^ 타라고 2012, 페이지 16.
- ^ 납에 대한 독성학적 프로파일 2007, 페이지 4.
- ^ 브렘너 2002, 페이지 101.
- ^ 2007 독성 물질 및 질병 등록 기관.
- ^ Thornton, Rautiu & Brush 2001, p. 17.
- ^ 무어 1977, 109-115쪽.
- ^ Wiberg, Wiberg & Holleman 2001, 페이지 914.
- ^ 타라고 2012, p. 11.
- ^ 질병통제예방센터 2015.
- ^ "Lead (Pb) Air Pollution". epa.gov. United States Environmental Protection Agency. 8 July 2022. Retrieved 22 July 2022.
As a result of EPA's regulatory efforts, levels of lead in the air nationally decreased by 86 percent between 2010 and 2020.
- ^ "NAAQS Table". epa.gov. United States Environmental Protection Agency. 5 April 2022. Retrieved 22 July 2022.
National Ambient Air Quality Standards (40 CFR part 50) for six principal pollutants
- ^ "Lead Trends". epa.gov. United States Environmental Protection Agency. 1 June 2022.
- ^ Wani, Ara & Usman 2015, pp. 57, 58.
- ^ Castellino N, Sannolo N, Castellino P (1994). Inorganic Lead Exposure and Intoxications. CRC Press. p. 86. ISBN 9780873719971. Archived from the original on 5 November 2017.
- ^ Hesami, Reza; Salimi, Azam; Ghaderian, Seyed Majid (10 January 2018). "Lead, zinc, and cadmium uptake, accumulation, and phytoremediation by plants growing around Tang-e Douzan lead–zinc mine, Iran". Environmental Science and Pollution Research. 25 (9): 8701–8714. doi:10.1007/s11356-017-1156-y. ISSN 0944-1344. PMID 29322395. S2CID 3938066.
- ^ Mielke, Howard W.; Reagan, Patrick L. (February 1998). "Soil Is an Important Pathway of Human Lead Exposure". Environmental Health Perspectives. 106 (Suppl 1): 217–229. doi:10.2307/3433922. ISSN 0091-6765. JSTOR 3433922. PMC 1533263. PMID 9539015.
- ^ a b University, Stanford (24 September 2019). "Lead found in turmeric". Stanford News. Retrieved 25 September 2019.
- ^ "Researchers find lead in turmeric". phys.org. Retrieved 25 September 2019.
- ^ "Maximum Permitted Concentration of Certain Metals Present in Specified Foods". www.elegislation.gov.hk. Retrieved 15 April 2020.
- ^ "Consumer Reports urges dark chocolate makers to reduce lead, cadmium levels". www.yahoo.com. 23 January 2023. Retrieved 28 January 2023.
- ^ 다크 초콜릿은 카드뮴과 납 함량이 높습니다.얼마나 먹어도 안전합니까?
- ^ "Lead in Consumer Products Sources of Lead CDC". www.cdc.gov. 1 February 2022. Retrieved 16 June 2022.
- ^ Prasad 2010, 페이지 651-652.
- ^ Masters, Trevor & Katzung 2008, 페이지 481-483
- ^ a b 유엔 환경 프로그램 2010, 페이지 4.
- ^ 렌프루 2019, 페이지 8.
- ^ a b 미량원소 방출 2012.
- ^ 유엔 환경 프로그램 2010, 페이지 6.
- ^ 아시 외 2016.
- ^ 세계보건기구 1995.
- ^ UK Marine SACs Project 1999.
- ^ 유엔환경계획 2010, 페이지 9.
- ^ 맥코이 2017.
- ^ 2017년 카마.
- ^ 레이튼 2017.
- ^ Hauser 2017, 페이지 49-60.
- ^ Lawewery & Hoet 2001, pp. 115, 116-117
- ^ "Lead Poisoning: A Historical Perspective".
- ^ Auer et al. 2016, p. 4.
- ^ Pettzel, Juuti & Sugimoto 2004, pp. 122-124
- ^ Deltares & Netherlands Organization for Applied Scientific Research 2016
- ^ 독성 물질 및 질병 등록 기관 2017.
- ^ 그랑장 1978, 페이지 303-321.
- ^ a b 레빈 외 2008, 페이지 1288.
- ^ Duda 1996, 페이지 242.
- ^ Marino et al. 1990, pp. 1183-1185
- ^ Schoch 1996, 페이지 111.
- ^ 미국 환경보호국 2000.
- ^ 2016년 낭비 선두.
- ^ 미국 환경 보호국 2005, p. I-1.
- ^ 미국 환경 보호국 2005, p. III-5–III-6.
- ^ 프리먼 2012, 페이지 a20-a21.
- ^ 2012년 어린.
- ^ 2013년 법률, 94-95쪽.
- ^ Park et al. 2011, pp. 162-174
- ^ Lakshmi, P.M.; Jaison, S.; Muthukumar, T.; Muthukumar, M. (1 November 2013). "Assessment of metal accumulation capacity of Brachiaria ramosa collected from cement waste dumping area for the remediation of metal contaminated soil". Ecological Engineering. 60: 96–98. doi:10.1016/j.ecoleng.2013.07.043.
서지학
![]() 이 글은 2017년 외부 학술 동료 심사를 위해 위키저널 오브 사이언스에 제출된 것입니다(리뷰어 보고서).업데이트된 콘텐츠는 CC-BY-SA-3.0 라이선스로 위키백과 페이지에 재통합되었습니다(2018).검토한 기록의 버전은 다음과 같습니다.
이 글은 2017년 외부 학술 동료 심사를 위해 위키저널 오브 사이언스에 제출된 것입니다(리뷰어 보고서).업데이트된 콘텐츠는 CC-BY-SA-3.0 라이선스로 위키백과 페이지에 재통합되었습니다(2018).검토한 기록의 버전은 다음과 같습니다.
- Acton, Q. A., ed. (2013). Issues in Global Environment—Pollution and Waste Management: 2012 Edition. ScholarlyEditions. ISBN 978-1-4816-4665-9.
- Agency for Toxic Substances and Disease Registry (20 August 2007). "Information for the Community: Lead Toxicity" (MP4 webcast, 82 MB). Retrieved 11 February 2017.
- Agency for Toxic Substances and Disease Registry (2017). "Lead Toxicity. What Are U.S. Standards for Lead Levels?". Retrieved 12 June 2018.
- Alsfasser, R. (2007). Moderne anorganische Chemie [Modern inorganic chemistry] (in German). Walter de Gruyter. ISBN 978-3-11-019060-1.
- American Geophysical Union (2017). "Human Activity Has Polluted European Air for 2000 Years". Eos Science News. Archived from the original on 27 June 2017. Retrieved 4 July 2017.
- Amstock, J. S. (1997). Handbook of Glass in Construction. McGraw-Hill Professional. ISBN 978-0-07-001619-4.
- Anderson, J. (1869). "Malleability and ductility of metals". Scientific American. 21 (22): 341–43. doi:10.1038/scientificamerican11271869-341.
- Ashikari, M. (2003). "The memory of the women's white faces: Japaneseness and the ideal image of women". Japan Forum. 15 (1): 55–79. doi:10.1080/0955580032000077739. S2CID 144510689.
- Assi, M. A.; Hezmee, M. N. M.; Haron, A. W.; et al. (2016). "The detrimental effects of lead on human and animal health". Veterinary World. 9 (6): 660–671. doi:10.14202/vetworld.2016.660-671. ISSN 0972-8988. PMC 4937060. PMID 27397992.
- Auer, Charles M.; Kover, Frank D.; Aidala, James V.; Greenwood, Mark (1 March 2016). Toxic Substances: A Half Century of Progress (PDF) (Report). EPA Alumni Association. Retrieved 1 January 2019.
- Audsley, G. A. (1965). The Art of Organ Building. Vol. 2. Courier. ISBN 978-0-486-21315-6.
- Baird, C.; Cann, N. (2012). Environmental Chemistry (5th ed.). W. H. Freeman and Company. ISBN 978-1-4292-7704-4.
- Becker, M.; Förster, C.; Franzen, C.; et al. (2008). "Persistent radicals of trivalent tin and lead". Inorganic Chemistry. 47 (21): 9965–78. doi:10.1021/ic801198p. PMID 18823115.
- Beeman, J. W.; Bellini, F.; Cardani, L.; et al. (2013). "New experimental limits on the α decays of lead isotopes". European Physical Journal A. 49 (50): 50. arXiv:1212.2422. Bibcode:2013EPJA...49...50B. doi:10.1140/epja/i2013-13050-7. S2CID 119280082.
- Beiner, G. G.; Lavi, M.; Seri, H.; et al. (2015). "Oddy Tests: Adding the Analytical Dimension". Collection Forum. 29 (1–2): 22–36. doi:10.14351/0831-4985-29.1.22. ISSN 0831-4985.
- Bharara, M. S.; Atwood, D. A. (2006). "Lead: Inorganic ChemistryBased in part on the article Lead: Inorganic Chemistry by Philip G. Harrison which appeared in the Encyclopedia of Inorganic Chemistry, First Edition". Lead: Inorganic Chemistry. doi:10.1002/0470862106.ia118. ISBN 978-0470860786.
- Bisel, S. C.; Bisel, J. F. (2002). "Health and nutrition at Herculaneum". In Jashemski, W. F.; Meyer, F. G. (eds.). The Natural History of Pompeii. Cambridge University Press. pp. 451–75. ISBN 978-0-521-80054-9.
- Bisson, M. S.; Vogel, J. O. (2000). Ancient African Metallurgy: The Sociocultural Context. Rowman & Littlefield. ISBN 978-0-7425-0261-1.
- Blakemore, J. S. (1985). Solid State Physics. Cambridge University Press. ISBN 978-0-521-31391-9.
- Bouchard, M. F.; Bellinger, D. C.; Weuve, J.; et al. (2009). "Blood Lead Levels and Major Depressive Disorder, Panic Disorder, and Generalized Anxiety Disorder in US Young Adults". Archives of General Psychiatry. 66 (12): 1313–9. doi:10.1001/archgenpsychiatry.2009.164. ISSN 0003-990X. PMC 2917196. PMID 19996036.
- Bremner, H. A. (2002). Safety and Quality Issues in Fish Processing. Elsevier. ISBN 978-1-85573-678-8.
- Brenner, G. A. (2003). Webster's New World American Idioms Handbook. John Wiley & Sons. ISBN 978-0-7645-2477-6.
- Brescia, F. (2012). Fundamentals of Chemistry: A Modern Introduction. Elsevier. ISBN 978-0-323-14231-1.
- Bretherick, L. (2016). Bretherick's Handbook of Reactive Chemical Hazards. Elsevier. ISBN 978-1-4831-6250-8.
- Bunker, B. C.; Casey, W. H. (2016). The Aqueous Chemistry of Oxides. Oxford University Press. ISBN 978-0-19-938425-9.
- Burbidge, E. M.; Burbidge, G. R.; Fowler, W. A.; et al. (1957). "Synthesis of the Elements in Stars". Reviews of Modern Physics. 29 (4): 547–654. Bibcode:1957RvMP...29..547B. doi:10.1103/RevModPhys.29.547.
- Burleson, M. (2001). The Ceramic Glaze Handbook: Materials, Techniques, Formulas. Sterling. ISBN 9781579904395.
- California Department of Fish and Wildlife. "Nonlead Ammunition in California". www.wildlife.ca.gov. Retrieved 17 May 2017.
- de Callataÿ, F. (2005). "The Graeco-Roman economy in the super long-run: Lead, copper, and shipwrecks". Journal of Roman Archaeology. 18: 361–72. doi:10.1017/S104775940000742X. S2CID 232346123.
- Cama, T. (2017). "Interior secretary repeals ban on lead bullets". The Hill. Retrieved 30 May 2018.
- Cangelosi, V. M.; Pecoraro, V. L. (2015). "Lead". In Roduner, E. (ed.). Nanoscopic Materials: Size-Dependent Phenomena and Growth Principles. Royal Society of Chemistry. pp. 843–875. ISBN 978-1-78262-494-3.
- Casciani, D. (2014). "Did removing lead from petrol spark a decline in crime?". BBC News. Retrieved 30 January 2017.
- Calvo Rebollar, Miguel (2019). Construyendo la Tabla Periódica. Zaragoza, Spain: Prames. ISBN 978-84-8321-908-9.
- Ceccarelli, P. (2013). Ancient Greek Letter Writing: A Cultural History (600 BC- 150 BC). OUP Oxford. ISBN 978-0-19-967559-3.
- Centers for Disease Control and Prevention (1997). "Update: blood lead levels--United States, 1991-1994". Morbidity and Mortality Weekly Report. 46 (7): 141–146. ISSN 0149-2195. PMID 9072671.
- Centers for Disease Control and Prevention (2015). "Radiation and Your Health". Retrieved 28 February 2017.
- Chapurukha Kusimba (20 June 2017). "Making Cents of Currency's Ancient Rise". Smithsonian Magazine. Retrieved 5 November 2021.
- Christensen, N. E. (2002). "Relativistic Solid State Theory". In Schwerdtfeger, P. (ed.). Relativistic Electronic Structure Theory — Fundamentals. Theoretical and Computational Chemistry. Vol. 11. Elsevier. pp. 867–68. doi:10.1016/s1380-7323(02)80041-3. ISBN 978-0-08-054046-7.
- Claudio, Elizabeth S.; Godwin, Hilary Arnold; Magyar, John S. (2002). "Fundamental Coordination Chemistry, Environmental Chemistry, and Biochemistry of Lead(II)". Progress in Inorganic Chemistry, Volume 51. John Wiley & Sons, Inc. pp. 1–144. doi:10.1002/0471267287.ch1. ISBN 978-0-471-26534-4.
- Cohen, A. R.; Trotzky, M. S.; Pincus, D. (1981). "Reassessment of the Microcytic Anemia of Lead Poisoning". Pediatrics. 67 (6): 904–906. doi:10.1542/peds.67.6.904. PMID 7232054. S2CID 42146120.
- Committee on Evaluation of EPA Guidelines for Exposure to Naturally Occurring Radioactive Materials; Commission on Life Sciences; Division on Earth and Life Studies; National Research Council (1999). Evaluation of Guidelines for Exposures to Technologically Enhanced Naturally Occurring Radioactive Materials. National Academies Press. pp. 26, 30–32. ISBN 978-0-309-58070-0.
- Concordia University (2016). Lead acid batteries (PDF) (Report). Retrieved 17 February 2019.
- Considine, D. M.; Considine, G. D. (2013). Van Nostrand's Scientific Encyclopedia. Springer Science & Business Media. ISBN 978-1-4757-6918-0.
- Copper Development Association. "Leaded Coppers". copper.org. Retrieved 10 July 2016.
- Cotnoir, B. (2006). The Weiser Concise Guide to Alchemy. Weiser Books. ISBN 978-1-57863-379-1.
- Cox, P. A. (1997). The Elements: Their Origin, Abundance and Distribution. Oxford University Press. ISBN 978-0-19-855298-7.
- Crow, J. M. (2007). "Why use lead in paint?". Chemistry World. Royal Society of Chemistry. Retrieved 22 February 2017.
- Dart, R. C.; Hurlbut, K. M.; Boyer-Hassen, L. V. (2004). "Lead". In Dart, R. C. (ed.). Medical Toxicology (3rd ed.). Lippincott Williams & Wilkins. p. 1426. ISBN 978-0-7817-2845-4.
- Davidson, A.; Ryman, J.; Sutherland, C. A.; et al. (2014). "Lead". Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a15_193.pub3. ISBN 978-3-527-30673-2.
- de Marcillac, Pierre; Coron, Noël; Dambier, Gérard; et al. (2003). "Experimental detection of α-particles from the radioactive decay of natural bismuth". Nature. 422 (6934): 876–78. Bibcode:2003Natur.422..876D. doi:10.1038/nature01541. PMID 12712201. S2CID 4415582.
- Delile, H.; Blichert-Toft, J.; Goiran, J.-P.; et al. (2014). "Lead in ancient Rome's city waters". Proceedings of the National Academy of Sciences. 111 (18): 6594–99. Bibcode:2014PNAS..111.6594D. doi:10.1073/pnas.1400097111. ISSN 0027-8424. PMC 4020092. PMID 24753588.
- Deltares; Netherlands Organisation for Applied Scientific Research (2016). Lood en zinkemissies door jacht [Lead and zinc emissions from hunting] (PDF) (Report) (in Dutch). Archived from the original (PDF) on 12 April 2019. Retrieved 18 February 2017.
- Dieter, R. K.; Watson, R. T. (2009). "Transmetalation reactions producing organocopper compounds". In Rappoport, Z.; Marek, I. (eds.). The Chemistry of Organocopper Compounds. Vol. 1. John Wiley & Sons. pp. 443–526. ISBN 978-0-470-77296-6.
- Donnelly, J. (2014). Deep Blue. Hachette Children's Group. ISBN 978-1-4449-2119-9.
- Downs, A. J.; Adams, C. J. (2017). The Chemistry of Chlorine, Bromine, Iodine and Astatine: Pergamon Texts in Inorganic Chemistry. Elsevier. ISBN 978-1-4831-5832-7.
- Duda, M. B. (1996). Traditional Chinese Toggles: Counterweights and Charms. Editions Didier Millet. ISBN 978-981-4260-61-9.
- Ede, A.; Cormack, L. B. (2016). A History of Science in Society, Volume I: From the Ancient Greeks to the Scientific Revolution, Third Edition. University of Toronto Press. ISBN 978-1-4426-3503-6.
- Emsley, J. (2011). Nature's Building Blocks: An A-Z Guide to the Elements. Oxford University Press. ISBN 978-0-19-960563-7.
- "Encyclopedia Judaica: Ossuaries and Sarcophagi". www.jewishvirtuallibrary.org. Retrieved 14 July 2018.
- Eschnauer, H. R.; Stoeppler, M. (1992). "Wine—An enological specimen bank". In Stoeppler, M. (ed.). Hazardous Materials in the Environment. Elsevier Science. pp. 49–72 (58). doi:10.1016/s0167-9244(08)70103-3. ISBN 978-0-444-89078-8.
- Evans, J. W. (1908). "V.— The meanings and synonyms of plumbago". Transactions of the Philological Society. 26 (2): 133–79. doi:10.1111/j.1467-968X.1908.tb00513.x.
- Finger, S. (2006). Doctor Franklin's Medicine. University of Pennsylvania Press. ISBN 978-0-8122-3913-3.
- Fiorini, E. (2010). "2.000 years-old Roman Lead for physics" (PDF). ASPERA: 7–8. Archived from the original (PDF) on 26 April 2018. Retrieved 29 October 2016.
- Frankenburg, F. R. (2014). Brain-Robbers: How Alcohol, Cocaine, Nicotine, and Opiates Have Changed Human History. ABC-CLIO. ISBN 978-1-4408-2932-1.
- Frebel, A. (2015). Searching for the Oldest Stars: Ancient Relics from the Early Universe. Princeton University. ISBN 978-0-691-16506-6.
- Freeman, K. S. (2012). "Remediating soil lead with fishbones". Environmental Health Perspectives. 120 (1): a20–a21. doi:10.1289/ehp.120-a20a. PMC 3261960. PMID 22214821.
- Funke, K. (2013). "Solid State Ionics: from Michael Faraday to green energy—the European dimension". Science and Technology of Advanced Materials. 14 (4): 1–50. Bibcode:2013STAdM..14d3502F. doi:10.1088/1468-6996/14/4/043502. PMC 5090311. PMID 27877585.
- Gale, W. F.; Totemeier, T. C. (2003). Smithells Metals Reference Book. Butterworth-Heinemann. ISBN 978-0-08-048096-1.
- Gilfillan, S. C. (1965). "Lead poisoning and the fall of Rome". Journal of Occupational Medicine. 7 (2): 53–60. ISSN 0096-1736. PMID 14261844.
- Gill, T.; Libraries Board of South Australia (1974). The history and topography of Glen Osmond, with map and illustrations. Libraries Board of South Australia. ISBN 9780724300358.
- Graedel, T. E.; et al. (2010). Metal stocks in Society – Scientific Synthesis (PDF) (Report). International Resource Panel. p. 17. ISBN 978-92-807-3082-1. Archived from the original (PDF) on 26 April 2018. Retrieved 18 April 2017.
- Grandjean, P. (1978). "Widening perspectives of lead toxicity". Environmental Research. 17 (2): 303–21. Bibcode:1978ER.....17..303G. doi:10.1016/0013-9351(78)90033-6. PMID 400972.
- Greenwood, N. N.; Earnshaw, A. (1998). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-7506-3365-9.
- Grout, J. (2017). "Lead poisoning and Rome". Encyclopaedia Romana. Retrieved 15 February 2017.
- Guberman, D. E. (2016). "Lead" (PDF). 2014 Minerals Yearbook (Report). United States Geological Survey. Retrieved 8 May 2017.
- Gulbinska, M. K. (2014). Lithium-ion Battery Materials and Engineering: Current Topics and Problems from the Manufacturing Perspective. Springer. p. 96. ISBN 978-1-4471-6548-4.
- Guruswamy, S. (2000). Engineering properties and applications of lead alloys. Marcel Dekker. ISBN 978-0-8247-8247-4.
- Hadlington, T. J. (2017). On the Catalytic Efficacy of Low-Oxidation State Group 14 Complexes. Springer. ISBN 978-3-319-51807-7.
- Harbison, R. D.; Bourgeois, M. M.; Johnson, G. T. (2015). Hamilton and Hardy's Industrial Toxicology. John Wiley & Sons. ISBN 978-0-470-92973-5.
- Hauser, P. C. (2017). "Analytical Methods for the Determination of Lead in the Environment". In Astrid, S.; Helmut, S.; Sigel, R. K. O. (eds.). Lead: Its Effects on Environment and Health (PDF). Metal Ions in Life Sciences. Vol. 17. de Gruyter. pp. 49–60. doi:10.1515/9783110434330-003. ISBN 9783110434330. PMID 28731296.
- Hernberg, S. (2000). "Lead Poisoning in a Historical Perspective" (PDF). American Journal of Industrial Medicine. 38 (3): 244–54. doi:10.1002/1097-0274(200009)38:3<244::AID-AJIM3>3.0.CO;2-F. PMID 10940962. Archived from the original (PDF) on 21 September 2017. Retrieved 1 March 2017.
- "A History of Cosmetics from Ancient Times". Cosmetics Info. Archived from the original on 14 July 2016. Retrieved 18 July 2016.
- Hodge, T. A. (1981). "Vitruvius, lead pipes and lead poisoning". American Journal of Archaeology. 85 (4): 486–91. doi:10.2307/504874. JSTOR 504874. S2CID 193094209.
- Hong, S.; Candelone, J.-P.; Patterson, C. C.; et al. (1994). "Greenland ice evidence of hemispheric lead pollution two millennia ago by Greek and Roman civilizations" (PDF). Science. 265 (5180): 1841–43. Bibcode:1994Sci...265.1841H. doi:10.1126/science.265.5180.1841. PMID 17797222. S2CID 45080402.
- Hunt, A. (2014). Dictionary of Chemistry. Routledge. ISBN 978-1-135-94178-9.
- IAEA - Nuclear Data Section (2017). "Livechart - Table of Nuclides - Nuclear structure and decay data". www-nds.iaea.org. International Atomic Energy Agency. Retrieved 31 March 2017.
- Insight Explorer; IPEN (2016). New Study Finds Lead Levels in a Majority of Paints Exceed Chinese Regulation and Should Not be on Store Shelves (PDF) (Report). Retrieved 3 May 2018.
- Ismawati, Yuyun; Primanti, Andita; Brosché, Sara; Clark, Scott; Weinberg, Jack; Denney, Valerie (2013). Timbal dalam Cat Enamel Rumah Tangga di Indonesia (PDF) (Report) (in Indonesian). BaliFokus & IPEN. Retrieved 26 December 2018.
- Jensen, C. F. (2013). Online Location of Faults on AC Cables in Underground Transmission. Springer. ISBN 978-3-319-05397-4.
- Jones, P. A. (2014). Jedburgh Justice and Kentish Fire: The Origins of English in Ten Phrases and Expressions. Constable. ISBN 978-1-47211-389-4.
- Kaupp, M. (2014). "Chemical bonding of main-group elements" (PDF). In Frenking, G.; Shaik, S. (eds.). The Chemical Bond: Chemical Bonding Across the Periodic Table. John Wiley & Sons. pp. 1–24. doi:10.1002/9783527664658.ch1. ISBN 9783527664658. S2CID 17979350.
- Kellett, C. (2012). Poison and Poisoning: A Compendium of Cases, Catastrophes and Crimes. Accent Press. ISBN 978-1-909335-05-9. Archived from the original on 9 June 2019.
- King, R. B. (1995). Inorganic Chemistry of Main Group Elements. VCH Publishers. ISBN 978-1-56081-679-9.
- Konu, J.; Chivers, T. (2011). "Stable Radicals of the Heavy p-Block Elements". In Hicks, R. G. (ed.). Stable Radicals: Fundamentals and Applied Aspects of Odd-Electron Compounds. John Wiley & Sons. doi:10.1002/9780470666975.ch10. ISBN 978-0-470-77083-2.
- Kosnett, M. J. (2006). "Lead". In Olson, K. R. (ed.). Poisoning and Drug Overdose (5th ed.). McGraw-Hill Professional. p. 238. ISBN 978-0-07-144333-3.
- Krestovnikoff, M.; Halls, M. (2006). Scuba Diving. Dorling Kindersley. ISBN 978-0-7566-4063-7.
- Kroonen, G. (2013). Etymological Dictionary of Proto-Germanic. Leiden Indo-European Etymological Dictionary Series. Vol. 11. Brill. ISBN 978-90-04-18340-7.
- Langmuir, C. H.; Broecker, W. S. (2012). How to Build a Habitable Planet: The Story of Earth from the Big Bang to Humankind. Princeton University Press. ISBN 978-0-691-14006-3.
- Lauwerys, R. R.; Hoet, P. (2001). Industrial Chemical Exposure: Guidelines for Biological Monitoring, Third Edition. CRC Press. ISBN 978-1-4822-9383-8.
- Layton, M. (2017). "Lead faces threat of new Euro ban". shootinguk.co.uk. Retrieved 30 May 2018.
- "Lead sling bullet; almond shape; a winged thunderbolt on one side and on the other, in high relief, the inscription DEXAI "Catch!"". The British Museum. Archived from the original on 14 February 2012. Retrieved 30 April 2012.
- "Lead garden ornaments". H. Crowther Ltd. 2016. Retrieved 20 February 2017.
- "Lead in Waste Disposal". United States Environmental Protection Agency. 2016. Retrieved 28 February 2017.
- "Lead mining". The Northern Echo. Retrieved 16 February 2016.
- Levin, H. L. (2009). The Earth Through Time. John Wiley & Sons. ISBN 978-0-470-38774-0.
- Levin, R.; Brown, M. J.; Kashtock, M. E.; et al. (2008). "Lead exposures in U.S. children, 2008: Implications for prevention". Environmental Health Perspectives. 116 (10): 1285–93. doi:10.1289/ehp.11241. PMC 2569084. PMID 18941567.
- Lewis, J. (1985). "Lead Poisoning: A Historical Perspective". EPA Journal. 11 (4): 15–18. Retrieved 31 January 2017.
- Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (85th ed.). CRC Press. ISBN 978-0-8493-0484-2.
- Liu, J.; Liu, X.; Pak, V.; et al. (2015). "Early blood lead levels and sleep disturbance in preadolescence". Sleep. 38 (12): 1869–74. doi:10.5665/sleep.5230. PMC 4667382. PMID 26194570.
- Lochner, J. C.; Rohrbach, G.; Cochrane, K. (2005). "What is Your Cosmic Connection to the Elements?" (PDF). Goddard Space Flight Center. Archived from the original (PDF) on 29 December 2016. Retrieved 2 July 2017.
- Lodders, K. (2003). "Solar System abundances and condensation temperatures of the elements" (PDF). The Astrophysical Journal. 591 (2): 1220–47. Bibcode:2003ApJ...591.1220L. doi:10.1086/375492. ISSN 0004-637X. S2CID 42498829.
- Luckey, T. D.; Venugopal, B. (1979). Physiologic and Chemical Basis for Metal Toxicity. Plenum Press. ISBN 978-1-4684-2952-7.
- Macintyre, J. E. (1992). Dictionary of Inorganic Compounds. CRC Press. ISBN 978-0-412-30120-9.
- Marino, P. E.; Landrigan, P. J.; Graef, J.; et al. (1990). "A case report of lead paint poisoning during renovation of a Victorian farmhouse". American Journal of Public Health. 80 (10): 1183–85. doi:10.2105/AJPH.80.10.1183. PMC 1404824. PMID 2119148.
- Markowitz, G.; Rosner, D. (2000). ""Cater to the children": the role of the lead industry in a public health tragedy, 1900–55". American Journal of Public Health. 90 (1): 36–46. doi:10.2105/ajph.90.1.36. PMC 1446124. PMID 10630135.
- Masters, S. B.; Trevor, A. J.; Katzung, B. G. (2008). Katzung & Trevor's Pharmacology: Examination & Board Review (8th ed.). McGraw-Hill Medical. ISBN 978-0-07-148869-3.
- McCoy, S. (2017). "The End of Lead? Federal Gov't Order Bans Sinkers, Ammo". GearJunkie. Archived from the original on 8 March 2020. Retrieved 30 May 2018.
- Meija, Juris; et al. (2016). "Atomic weights of the elements 2013 (IUPAC Technical Report)". Pure and Applied Chemistry. 88 (3): 265–91. doi:10.1515/pac-2015-0305.
- Merriam-Webster. "Definition of LEAD". www.merriam-webster.com. Retrieved 12 August 2016.
- Moore, M. R. (1977). "Lead in drinking water in soft water areas—health hazards". Science of the Total Environment. 7 (2): 109–15. Bibcode:1977ScTEn...7..109M. doi:10.1016/0048-9697(77)90002-X. PMID 841299.
- More, A. F.; Spaulding, N. E.; Bohleber, P.; et al. (2017). "Next-generation ice core technology reveals true minimum natural levels of lead (Pb) in the atmosphere: Insights from the Black Death" (PDF). GeoHealth. 1 (4): 211–219. doi:10.1002/2017GH000064. ISSN 2471-1403. PMC 7007106. PMID 32158988. Archived from the original (PDF) on 18 April 2020. Retrieved 28 August 2019.
- Mosseri, S.; Henglein, A.; Janata, E. (1990). "Trivalent lead as an intermediate in the oxidation of lead(II) and the reduction of lead(IV) species". Journal of Physical Chemistry. 94 (6): 2722–26. doi:10.1021/j100369a089.
- Mycyk, M.; Hryhorczuk, D.; Amitai, Y.; et al. (2005). "Lead". In Erickson, T. B.; Ahrens, W. R.; Aks, S. (eds.). Pediatric Toxicology: Diagnosis and Management of the Poisoned Child. McGraw-Hill Professional. ISBN 978-0-07-141736-5.
- Nakashima, T.; Hayashi, H.; Tashiro, H.; et al. (1998). "Gender and hierarchical differences in lead-contaminated Japanese bone from the Edo period". Journal of Occupational Health. 40 (1): 55–60. doi:10.1539/joh.40.55.
- National Council on Radiation Protection and Measurements (2004). Structural Shielding Design for Medical X-ray Imaging Facilities. ISBN 978-0-929600-83-3.
- National Institute for Occupational Safety and Health. "NIOSH Pocket Guide to Chemical Hazards — Lead". www.cdc.gov. Retrieved 18 November 2016.
- Navas-Acien, A. (2007). "Lead Exposure and Cardiovascular Disease—A Systematic Review". Environmental Health Perspectives. 115 (3): 472–482. doi:10.1289/ehp.9785. PMC 1849948. PMID 17431501.
- Nikolayev, S., ed. (2012). "*lAudh-". Indo-European Etymology. Retrieved 21 August 2016.
- Norman, N. C. (1996). Periodicity and the s- and p-Block Elements. Oxford University Press. ISBN 978-0-19-855961-0.
- Nriagu, J. O. (1983). "Saturnine gout among Roman aristocrats — Did lead poisoning contribute to the fall of the Empire?". The New England Journal of Medicine. 308 (11): 660–63. doi:10.1056/NEJM198303173081123. PMID 6338384.
- Nriagu, J. O.; Kim, M-J. (2000). "Emissions of lead and zinc from candles with metal-core wicks". Science of the Total Environment. 250 (1–3): 37–41. Bibcode:2000ScTEn.250...37N. doi:10.1016/S0048-9697(00)00359-4. PMID 10811249.
- Occupational Safety and Health Administration. "Substance data sheet for occupational exposure to lead". www.osha.gov. Archived from the original on 16 March 2018. Retrieved 1 July 2017.
- Olinsky-Paul, T. (2013). "East Penn and Ecoult battery installation case study webinar" (PDF). Clean Energy States Alliance. Retrieved 28 February 2017.
- Palmieri, R., ed. (2006). The Organ. Psychology Press. ISBN 978-0-415-94174-7.
- "surma". Oxford English Dictionary (2nd ed.). Oxford University Press. 2009.
- Park, J. H.; Bolan, N.; Meghara, M.; et al. (2011). "Bacterial-assisted immobilization of lead in soils: Implications for remediation" (PDF). Pedologist: 162–74. Archived from the original (PDF) on 26 November 2015.
- Parker, R. B. (2005). The New Cold-Molded Boatbuilding: From Lofting to Launching. WoodenBoat Books. ISBN 978-0-937822-89-0.
- Parthé, E. (1964). Crystal Chemistry of Tetrahedral Structures. CRC Press. ISBN 978-0-677-00700-7.
- Pauling, L. (1947). General Chemistry. W. H. Freeman and Company. ISBN 978-0-486-65622-9.
- Peneva, S. K.; Djuneva, K. D.; Tsukeva, E. A. (1981). "RHEED study of the initial stages of crystallization and oxidation of lead and tin". Journal of Crystal Growth. 53 (2): 382–396. Bibcode:1981JCrGr..53..382P. doi:10.1016/0022-0248(81)90088-9. ISSN 0022-0248.
- Petzel, S.; Juuti, M.; Sugimoto, Yu. (2004). "Environmental Stewardship with Regional Perspectives and Drivers of the Lead-free Issue". In Puttlitz, K. J.; Stalter, K. A. (eds.). Handbook of Lead-Free Solder Technology for Microelectronic Assemblies. CRC Press. ISBN 978-0-8247-5249-1.
- Polyanskiy, N. G. (1986). Fillipova, N. A (ed.). Аналитическая химия элементов: Свинец [Analytical Chemistry of the Elements: Lead] (in Russian). Nauka.
- Prasad, P. J. (2010). Conceptual Pharmacology. Universities Press. ISBN 978-81-7371-679-9. Retrieved 21 June 2012.
- "Primary Lead Refining Technical Notes". LDA International. Archived from the original on 22 March 2007. Retrieved 7 April 2007.
- Progressive Dynamics, Inc. "How Lead Acid Batteries Work: Battery Basics". progressivedyn.com. Archived from the original on 19 November 2018. Retrieved 3 July 2016.
- Putnam, B. (2003). The Sculptor's Way: A Guide to Modelling and Sculpture. Dover Publications. ISBN 978-0-486-42313-5.
- Pyykkö, P. (1988). "Relativistic effects in structural chemistry". Chemical Reviews. 88 (3): 563–94. doi:10.1021/cr00085a006.
- Rabinowitz, M. B. (1995). "Imputing lead sources from blood lead isotope ratios". In Beard, M. E.; Allen Iske, S. D. (eds.). Lead in Paint, Soil, and Dust: Health Risks, Exposure Studies, Control Measures, Measurement Methods, and Quality Assurance. ASTM. pp. 63–75. doi:10.1520/stp12967s. ISBN 978-0-8031-1884-3.
- "Radioactive Decay Series" (PDF). Nuclear Systematics. MIT OpenCourseWare. 2012. Retrieved 28 April 2018.
- Ramage, C. K., ed. (1980). Lyman Cast Bullet Handbook (3rd ed.). Lyman Products Corporation.
- Randerson, J. (2002). "Candle pollution". New Scientist (2348). Retrieved 7 April 2007.
- Reddy, A.; Braun, C. L. (2010). "Lead and the Romans". Journal of Chemical Education. 87 (10): 1052–55. Bibcode:2010JChEd..87.1052R. doi:10.1021/ed100631y.
- Renfrew, Daniel (2019). Life without lead: contamination, crisis, and hope in Uruguay. Oakland, California: University of California Press. ISBN 978-0-520-96824-0. OCLC 1102765674.
- Retief, F.; Cilliers, L. P. (2006). "Lead poisoning in ancient Rome". Acta Theologica. 26 (2): 147–64 (149–51). doi:10.4314/actat.v26i2.52570.
- Rich, V. (1994). The International Lead Trade. Woodhead Publishing. ISBN 978-0-85709-994-5.
- Rieuwerts, J. (2015). The Elements of Environmental Pollution. Routledge. ISBN 978-0-415-85919-6.
- Riva, M. A.; Lafranconi, A.; d'Orso, M. I.; et al. (2012). "Lead poisoning: Historical aspects of a paradigmatic "occupational and environmental disease"". Safety and Health at Work. 3 (1): 11–16. doi:10.5491/SHAW.2012.3.1.11. PMC 3430923. PMID 22953225.
- Roederer, I. U.; Kratz, K.-L.; Frebel, A.; et al. (2009). "The end of nucleosynthesis: Production of lead and thorium in the early galaxy". The Astrophysical Journal. 698 (2): 1963–80. arXiv:0904.3105. Bibcode:2009ApJ...698.1963R. doi:10.1088/0004-637X/698/2/1963. S2CID 14814446.
- Rogalski, A. (2010). Infrared Detectors (2nd ed.). CRC Press. ISBN 978-1-4200-7671-4. Retrieved 19 November 2016.
- Röhr, C. (2017). "Binare Zintl-Phasen" [Binary Zintl Phases]. Intermetallische Phasen [Intermettallic Phases] (in German). Universitat Freiburg. Retrieved 18 February 2017.
- Rudolph, A. M.; Rudolph, C. D.; Hostetter, M. K.; et al. (2003). "Lead". Rudolph's Pediatrics (21st ed.). McGraw-Hill Professional. p. 369. ISBN 978-0-8385-8285-5.
- Samson, G. W. (1885). The divine law as to wines. J. B. Lippincott & Co.
- Scarborough, J. (1984). "The myth of lead poisoning among the Romans: An essay review". Journal of the History of Medicine and Allied Sciences. 39 (4): 469–475. doi:10.1093/jhmas/39.4.469. PMID 6389691.
- Schoch, R. M. (1996). Case Studies in Environmental Science. West Publishing. ISBN 978-0-314-20397-7.
- Schoeters, G.; Den Hond, E.; Dhooge, W.; et al. (2008). "Endocrine disruptors and abnormalities of pubertal development" (PDF). Basic & Clinical Pharmacology & Toxicology. 102 (2): 168–175. doi:10.1111/j.1742-7843.2007.00180.x. hdl:1854/LU-391408. PMID 18226071.
- Sharma, H. R.; Nozawa, K.; Smerdon, J. A.; et al. (2013). "Templated three-dimensional growth of quasicrystalline lead". Nature Communications. 4: 2715. Bibcode:2013NatCo...4.2715S. doi:10.1038/ncomms3715. PMID 24185350.
- Sharma, H. R.; Smerdon, J. A.; Nugent, P. J.; et al. (2014). "Crystalline and quasicrystalline allotropes of Pb formed on the fivefold surface of icosahedral Ag-In-Yb". The Journal of Chemical Physics. 140 (17): 174710. Bibcode:2014JChPh.140q4710S. doi:10.1063/1.4873596. PMID 24811658.
- Silverman, M. S. (1966). "High-pressure (70-k) synthesis of new crystalline lead dichalcogenides". Inorganic Chemistry. 5 (11): 2067–69. doi:10.1021/ic50045a056.
- Singh, P. (2017). "Over 73% of paints found to have excessive lead: Study". Times of India. Retrieved 3 May 2018.
- Sinha, S. P.; Shelly; Sharma, V.; et al. (1993). "Neurotoxic effects of lead exposure among printing press workers". Bulletin of Environmental Contamination and Toxicology. 51 (4): 490–93. doi:10.1007/BF00192162. PMID 8400649. S2CID 26631583.
- Slater, J. C. (1964). "Atomic Radii in Crystals". The Journal of Chemical Physics. 41 (10): 3199–3204. Bibcode:1964JChPh..41.3199S. doi:10.1063/1.1725697. ISSN 0021-9606.
- Smirnov, A. Yu.; Borisevich, V. D.; Sulaberidze, A. (2012). "Evaluation of specific cost of obtainment of lead-208 isotope by gas centrifuges using various raw materials". Theoretical Foundations of Chemical Engineering. 46 (4): 373–78. doi:10.1134/s0040579512040161. S2CID 98821122.
- Sokol, R. C. (2005). "Lead exposure and its effects on the reproductive system". In Golub, M. S. (ed.). Metals, Fertility, and Reproductive Toxicity. CRC Press. pp. 117–53. doi:10.1201/9781420023282.ch6. ISBN 978-0-415-70040-5.
- Stabenow, F.; Saak, W.; Weidenbruch, M. (2003). "Tris(triphenylplumbyl)plumbate: An anion with three stretched lead–lead bonds". Chemical Communications (18): 2342–2343. doi:10.1039/B305217F. PMID 14518905.
- Stone, R. (1997). "An Element of Stability". Science. 278 (5338): 571–572. Bibcode:1997Sci...278..571S. doi:10.1126/science.278.5338.571. S2CID 117946028.
- Street, A.; Alexander, W. (1998). Metals in the Service of Man (11th ed.). Penguin Books. ISBN 978-0-14-025776-2.
- Szczepanowska, H. M. (2013). Conservation of Cultural Heritage: Key Principles and Approaches. Routledge. ISBN 978-0-415-67474-4.
- Takahashi, K.; Boyd, R. N.; Mathews, G. J.; et al. (1987). "Bound-state beta decay of highly ionized atoms" (PDF). Physical Review C. 36 (4): 1522–1528. Bibcode:1987PhRvC..36.1522T. doi:10.1103/physrevc.36.1522. OCLC 1639677. PMID 9954244. Archived from the original (PDF) on 21 October 2014. Retrieved 27 August 2013.
- Tarragó, A. (2012). "Case Studies in Environmental Medicine (CSEM) Lead Toxicity" (PDF). Agency for Toxic Substances and Disease Registry.
- Tétreault, J.; Sirois, J.; Stamatopoulou, E. (1998). "Studies of lead corrosion in acetic acid environments". Studies in Conservation. 43 (1): 17–32. doi:10.2307/1506633. JSTOR 1506633.
- Theodore Low De Vinne (1899). The Practice of Typography: A Treatise on the Processes of Type-making, the Point System, the Names, Sizes, Styles, and Prices of Plain Printing Types. Century Company.
- "Think Lead research summary" (PDF). The Lead Sheet Association. Archived from the original (PDF) on 20 February 2017. Retrieved 20 February 2017.
- Thomson, T. (1830). The History of Chemistry. Henry Colburn and Richard Bentley (publishers). ISBN 9780405066238.
- Thornton, I.; Rautiu, R.; Brush, S. M. (2001). Lead: The Facts (PDF). International Lead Association. ISBN 978-0-9542496-0-1. Archived from the original (PDF) on 26 July 2020. Retrieved 5 February 2017.
- Thürmer, K.; Williams, E.; Reutt-Robey, J. (2002). "Autocatalytic oxidation of lead crystallite surfaces". Science. 297 (5589): 2033–35. Bibcode:2002Sci...297.2033T. doi:10.1126/science.297.5589.2033. PMID 12242437. S2CID 6166273.
- Tolliday, B. (2014). "Significant growth in lead usage underlines its importance to the global economy". International Lead Association. Archived from the original on 28 February 2017. Retrieved 28 February 2017.
Global demand for lead has more than doubled since the early 1990s and almost 90% of use is now in lead–acid batteries
- "Toronto museum explores history of contraceptives". ABC News. 2003. Retrieved 13 February 2016.
- "Toxic Substances Portal – Lead". Agency for Toxic Substances and Disease Registry. Archived from the original on 6 June 2011.
- "Toxicological Profile for Lead" (PDF). Agency for Toxic Substances and Disease Registry/Division of Toxicology and Environmental Medicine. 2007. Archived from the original (PDF) on 1 July 2017.
- "Trace element emission from coal". IEA Clean Coal Centre. 2012. Archived from the original on 11 March 2020. Retrieved 1 March 2017.
- Tuček, K.; Carlsson, J.; Wider, H. (2006). "Comparison of sodium and lead-cooled fast reactors regarding reactor physics aspects, severe safety and economical issues" (PDF). Nuclear Engineering and Design. 236 (14–16): 1589–98. doi:10.1016/j.nucengdes.2006.04.019.
- Tungate, M. (2011). Branded Beauty: How Marketing Changed the Way We Look. Kogan Page Publishers. ISBN 978-0-7494-6182-9.
- UK Marine SACs Project (1999). "Lead". Water Quality (Report). Archived from the original on 17 February 2020. Retrieved 10 June 2018.
- United Nations Environment Programme (2010). Final review of scientific information on lead (PDF). Chemicals Branch, Division of Technology, Industry and Economics. Retrieved 31 January 2017.
- United States Environmental Protection Agency (2010). "Metallurgical Industry:Secondary Lead Processing". AP 42 Compilation of Air Pollutant Emission Factors (5th ed.). Retrieved 20 May 2018.
- United States Environmental Protection Agency (2000). "Regulatory Status of Waste Generated by Contractors and Residents from Lead-Based Paint Activities Conducted in Households (August 2000)". Retrieved 28 February 2017.
- United States Environmental Protection Agency (2005). "Best Management Practices for Lead at Outdoor Shooting Ranges" (PDF). Retrieved 12 June 2018.
- United States Food and Drug Administration (2015). Q3D Elemental Impurities Guidance for Industry (PDF) (Report). United States Department of Health and Human Services. p. 41. Retrieved 15 February 2017.
- United States Geological Survey (1973). Geological Survey Professional Paper. United States Government Publishing Office. p. 314.
- United States Geological Survey (2005). Lead (PDF) (Report). Retrieved 20 February 2016.
- United States Geological Survey (2017). "Lead" (PDF). Mineral Commodities Summaries. Retrieved 8 May 2017.
- University of California Nuclear Forensic Search Project. "Decay Chains". Nuclear Forensics: A Scientific Search Problem. Retrieved 23 November 2015.
- Vasmer, M. (1986–1987) [1950–1958]. Trubachyov, O. N.; Larin, B. O. (eds.). Этимологический словарь русского языка [Russisches etymologisches Worterbuch] (in Russian) (2nd ed.). Progress. Retrieved 4 March 2017.
- Vogel, N. A.; Achilles, R. (2013). The Preservation and Repair of Historic Stained and Leaded Glass (PDF) (Report). United States Department of the Interior. Retrieved 30 October 2016.
- Waldron, H. A. (1985). "Lead and lead poisoning in antiquity". Medical History. 29 (1): 107–08. doi:10.1017/S0025727300043878. PMC 1139494.
- Wani, A. L.; Ara, A.; Usman, J. A. (2015). "Lead toxicity: A review". Interdisciplinary Toxicology. 8 (2): 55–64. doi:10.1515/intox-2015-0009. PMC 4961898. PMID 27486361.
- Weast, R. C.; Astle, M. J.; Beyer, W. H. (1983). CRC Handbook of Chemistry and Physics: A Ready-reference Book of Chemical and Physical Data. CRC Press. ISBN 978-0-8493-0464-4.
- "Weatherings to Parapets and Cornices". The Lead Sheet Association. Archived from the original on 20 February 2017. Retrieved 20 February 2017.
- Webb, G. A. (2000). Nuclear Magnetic Resonance. Royal Society of Chemistry. ISBN 978-0-85404-327-9.
- Webb, G. W.; Marsiglio, F.; Hirsch, J. E. (2015). "Superconductivity in the elements, alloys and simple compounds". Physica C: Superconductivity and Its Applications. 514: 17–27. arXiv:1502.04724. Bibcode:2015PhyC..514...17W. doi:10.1016/j.physc.2015.02.037. S2CID 119290828.
- Whitten, K. W.; Gailey, K. D.; David, R. E. (1996). General chemistry with qualitative analysis (3rd ed.). Saunders College. ISBN 978-0-03-012864-6.
- Wiberg, E.; Wiberg, N.; Holleman, A. F. (2001). Inorganic Chemistry. Academic Press. ISBN 978-0-12-352651-9.
- Wilkes, C. E.; Summers, J. W.; Daniels, C. A.; et al. (2005). PVC Handbook. Hanser. ISBN 978-1-56990-379-7.
- Willey, D. G. (1999). "The physics behind four amazing demonstrations — CSI". Skeptical Inquirer. 23 (6). Retrieved 6 September 2016.
- Winder, C. (1993a). "The history of lead — Part 1". LEAD Action News. 2 (1). ISSN 1324-6011. Archived from the original on 31 August 2007. Retrieved 5 February 2016.
- Winder, C. (1993b). "The history of lead — Part 3". LEAD Action News. 2 (3). ISSN 1324-6011. Archived from the original on 31 August 2007. Retrieved 12 February 2016.
- Windholz, M. (1976). Merck Index of Chemicals and Drugs (9th ed.). Merck & Co. ISBN 978-0-911910-26-1. Monograph 8393.
- Wood, J. R.; Hsu, Y-T.; Bell, C. (2021). "Sending Laurion Back to the Future: Bronze Age Silver and the Source of Confusion" (PDF). Internet Archaeology. 56 (9). doi:10.11141/ia.56.9. S2CID 236973111.
- World Health Organization (1995). Environmental Health Criteria 165: Inorganic Lead (Report). Retrieved 10 June 2018.
- World Health Organization (2000). "Lead" (PDF). Air quality guidelines for Europe. Regional Office for Europe. pp. 149–53. ISBN 978-92-890-1358-1. OCLC 475274390.
- World Health Organization (2018). "Lead poisoning and health". Retrieved 17 February 2019.
- World Nuclear Association (2015). "Nuclear Radiation and Health Effects". Archived from the original on 24 December 2015. Retrieved 12 November 2015.
- Wrackmeyer, B.; Horchler, K. (1990). "207Pb-NMR Parameters". Annual Reports on NMR Spectroscopy. Vol. 22. Academic Press. pp. 249–303. doi:10.1016/S0066-4103(08)60257-4. ISBN 978-0-08-058405-8.
- Yong, L.; Hoffmann, S. D.; Fässler, T. F. (2006). "A low-dimensional arrangement of [Pb9]4· clusters in [K(18-crown-6)]2K2Pb9·(en)1.5". Inorganica Chimica Acta. 359 (15): 4774–78. doi:10.1016/j.ica.2006.04.017.
- Young, S. (2012). "Battling lead contamination, one fish bone at a time". Compass. United States Coast Guard. Archived from the original on 14 June 2013. Retrieved 11 February 2017.
- Yu, L.; Yu, H. (2004). Chinese Coins: Money in History and Society. Long River Press. ISBN 978-1-59265-017-0.
- Zhang, X.; Yang, L.; Li, Y.; et al. (2012). "Impacts of lead/zinc mining and smelting on the environment and human health in China". Environmental Monitoring and Assessment. 184 (4): 2261–73. doi:10.1007/s10661-011-2115-6. PMID 21573711. S2CID 20372810.
- Zhao, F. (2008). Information Technology Entrepreneurship and Innovation. IGI Global. p. 440. ISBN 978-1-59904-902-1.
- Zuckerman, J. J.; Hagen, A. P. (1989). Inorganic Reactions and Methods, the Formation of Bonds to Halogens. John Wiley & Sons. ISBN 978-0-471-18656-4.
- Zweifel, H. (2009). Plastics Additives Handbook. Hanser. ISBN 978-3-446-40801-2.
- Zýka, J. (1966). "Analytical study of the basic properties of lead tetraacetate as oxidizing agent". Pure and Applied Chemistry. 13 (4): 569–81. doi:10.1351/pac196613040569. S2CID 96821219. Retrieved 2 March 2017.
추가열람
- Astrid, S.; Helmut, S.; Sigel, R. K. O., eds. (2017). Lead: Its Effects on Environment and Health. Metal Ions in Life Sciences. Vol. 17. De Gruyter. ISBN 978-3-11-044107-9. 목차.
- Casas, J. S.; Sordo, J., eds. (2006). Lead Chemistry, Analytical Aspects. Environmental Impacts and Health Effects. Elsevier. ISBN 978-0-444-52945-9.
- Hunt, A.; Abraham, J. L.; Judson, B.; Berry, C. L. (2003). "Toxicologic and epidemiologic clues from the characterization of the 1952 London smog fine particulate matter in archival autopsy lung tissues". Environmental Health Perspectives. 111 (9): 1209–1214. doi:10.1289/ehp.6114. PMC 1241576. PMID 12842775.
- Zhang, Hao; Wei, Kai; Zhang, Mengyu; Liu, Rutao; Chen, Yadong (2014). "Assessing the mechanism of DNA damage induced by lead through direct and indirect interactions". Journal of Photochemistry and Photobiology B: Biology. 136: 46–53. doi:10.1016/j.jphotobiol.2014.04.020. PMID 24844619.





