유기금속화학
Organometallic chemistry
유기금속 화학은 유기 분자의 탄소 원자와 금속 사이에 알칼리, 알칼리 토, 전이 금속을 포함한 적어도 하나의 화학적 결합을 포함하는 화학적 화합물을 연구하는 것으로, 때때로 붕소, 실리콘, 셀레늄과 같은 메탈로이드를 포함하기도 합니다.[1][2] 유기질 조각이나 분자에 대한 결합 이외에도 일산화탄소(금속 카르보닐), 시안화물 또는 탄화물과 같은 '무기' 탄소에 대한 결합도 일반적으로 유기금속으로 간주됩니다. 전이 금속 수소화물 및 금속 포스핀 착물과 같은 일부 관련 화합물은 유기 금속 화합물에 대한 논의에 종종 포함되지만 엄밀히 말하면 반드시 유기 금속은 아닙니다. 이와 관련되지만 구별되는 용어인 "금속 유기 화합물"은 직접적인 금속-탄소 결합이 없지만 유기 리간드를 포함하는 금속-함유 화합물을 의미합니다. 금속 β-디케토네이트, 알콕사이드, 디알킬아미드 및 금속 포스핀 복합체가 이 부류의 대표적인 구성체입니다. 유기 금속 화학 분야는 전통적인 무기 화학과 유기 화학의 측면을 결합합니다.[3]
유기금속 화합물은 화학양론적으로 연구 및 산업 화학 반응뿐만 아니라 이러한 반응의 속도를 증가시키는 촉매의 역할에도 널리 사용되며, 여기서 표적 분자에는 폴리머, 의약품 및 기타 많은 유형의 실용적인 제품이 포함됩니다.
유기금속 화합물

유기금속 화합물은 접두사 "organo-"(예를 들어, 유기팔라듐 화합물)로 구별되며, 금속 원자와 유기기의 탄소 원자 사이의 결합을 포함하는 모든 화합물을 포함합니다.[2] 전통적인 금속(알칼리 금속, 알칼리 토금속, 전이 금속, 전이 후 금속) 외에도 란타니드, 악티니드, 반금속, 붕소, 규소, 비소, 셀레늄 원소 등이 유기금속 화합물을 형성하는 것으로 간주됩니다.[2] 유기금속 화합물의 예로는 리튬과 구리가 함유된 길만 시약, 마그네슘이 함유된 그리나르 시약 등이 있습니다. 붕소를 함유한 유기금속 화합물은 종종 수소화붕소와 탄소화붕소 반응의 결과입니다. 전이 금속을 포함하는 유기 금속 화합물의 예로는 테트라카르보닐 니켈과 페로센이 있습니다. 유기금속 화합물의 다른 예는 n-부틸리튬(n-BuLi)과 같은 유기리튬 화합물, 디에틸아연(EtZn2)과 같은 유기아연 화합물, 트리부틸주석 하이드라이드(BuSnH3)와 같은 유기아연 화합물, 트리에틸보란(EtB3)과 같은 유기아연 화합물 및 트리메틸알루미늄(MeAl3)과 같은 유기알루미늄 화합물을 포함합니다.[3]
자연적으로 존재하는 유기금속 복합체는 코발트-메틸 결합을 포함하는 메틸코발라민(비타민 B의12 한 형태)입니다. 이 복합체는 생물학적으로 관련된 다른 복합체와 함께 생물 유기금속 화학의 하위 분야에서 종종 논의됩니다.[4]
- 대표적인 유기금속 화합물
- 페로센은 전형적인 유기 철 복합체입니다. 공기에 안정적이고 승화 가능한 화합물입니다.
- 코발트세는 페로센의 구조적 유사체이지만 공기에 반응성이 높습니다.
- 트리스(트리페닐포스핀)로듐 카르보닐 하이드라이드는 많은 알데히드 기반 향의 상업적 생산에 사용됩니다.
- Zeise의 염은 전이금속 알켄 복합체의 한 예입니다.
- 디메틸아연은 선형 배위를 가지고 있습니다. 반도체 필름 제조에 사용되는 휘발성 파이로포릭 액체입니다.
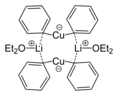
- 길만 시약은 유기 합성에 많이 사용되는 유기 구리 착체의 일종으로, 리튬 디페닐큐프레이트 비스(디에틸에테르산염)를 예로 들 수 있습니다.
- 철(0) 펜타카보닐은 압력 하에서 미세하게 분할된 철과 일산화탄소 가스의 결합으로부터 직접 제조된 적색-주황색 액체입니다.
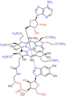
- 테크네튬[99mTc] 세스타미비는 핵의학에서 심장 근육을 이미지화하는 데 사용됩니다.
유기 리간드와의 배위 화합물과의 구별
많은 복합체는 금속과 유기 리간드 사이의 배위 결합을 특징으로 합니다. 유기 리간드가 산소 또는 질소와 같은 헤테로 원자를 통해 금속에 결합하는 복합체(예를 들어, 헴 A 및 Fe(acac))3는 배위 화합물로 간주됩니다. 그러나 리간드 중 하나라도 직접적인 금속-탄소(M-C) 결합을 형성하면 복합체는 유기금속으로 간주됩니다. IUPAC가 이 용어를 공식적으로 정의하지는 않았지만, 일부 화학자들은 직접적인 M-C 결합의 존재 여부와 관계없이 유기 리간드를 포함하는 배위 화합물을 설명하기 위해 "금속 유기"라는 용어를 사용합니다.[5]
표준 음이온이 탄소 원자와 탄소보다 더 전기적으로 음성인 원자(예를 들어, 에놀레이트) 사이에 공유되는 음전하를 갖는 화합물의 상태는 음이온 부분, 금속 이온 및 아마도 매질의 특성에 따라 달라질 수 있습니다. 탄소-금속 결합에 대한 직접적인 구조적 증거가 없는 경우, 이러한 화합물은 유기금속으로 간주되지 않습니다.[2] 예를 들어, 리튬 에놀레이트는 종종 Li-O 결합만을 포함하고 유기금속이 아닌 반면, 아연 에놀레이트(Reformatsky 시약)는 Zn-O 및 Zn-C 결합을 모두 포함하고, 본질적으로 유기금속입니다.[3]
구조 및 특성
유기금속 화합물의 금속-탄소 결합은 일반적으로 공유성이 높습니다.[1] 리튬이나 나트륨과 같은 전기 양극성이 높은 원소의 경우, 탄소 리간드는 카르바니온성을 나타내지만, 유리 탄소 기반 음이온은 극히 드물며, 예를 들어 시안화물 등이 있습니다.

대부분의 유기금속 화합물은 실온에서 고체이지만 일부는 메틸시클로펜타디엔일 망간 트리카르보닐과 같은 액체이거나 니켈 테트라카르보닐과 같은 휘발성 액체입니다.[1] 많은 유기금속 화합물은 공기에 민감하기 때문에(산소와 수분에 반응) 불활성 분위기에서 취급해야 합니다.[1] 트리에틸알루미늄과 같은 일부 유기금속 화합물은 발열성이며 공기와 접촉하면 점화됩니다.[6]
개념과 기법
화학의 다른 분야와 마찬가지로 전자 계산은 유기금속 화학을 정리하는 데 유용합니다. 18-전자 규칙은 금속 카르보닐 및 금속 수소화물과 같은 유기금속 복합체의 안정성을 예측하는 데 도움이 됩니다. 18e 규칙에는 두 개의 대표적인 전자 계수 모델, 이온 및 중성 리간드 모델(공유 리간드 모델이라고도 함)이 있습니다.[7] 금속-리간드 복합체의 햅틱은 전자 수에 영향을 미칠 수 있습니다.[7] 햅틱(hapticity, η, 소문자 그리스식 에타)은 금속에 배위된 연속 리간드의 수를 설명합니다. 예를 들어, 페로센, [(η-CH)Fe]는 5의 햅틱을 제공하는 2개의 사이클로펜타디엔일 리간드를 가지고 있으며, 여기서 CH 리간드의 5개의 탄소 원자는 모두 동일하게 결합하고 1개의 전자를 철 중심에 기여합니다. 연속되지 않는 원자를 결합하는 리간드는 그리스 문자 카파, κ로 표시됩니다. κ2-아세테이트를 킬레이트화하는 것이 그 예입니다. 공유결합 분류법은 리간드의 전자 공여 상호작용에 기초한 세 종류의 리간드, X, L, Z를 식별합니다. 많은 유기금속 화합물은 18e 규칙을 따르지 않습니다. 유기금속 화합물의 금속 원자는 흔히 d전자 수와 산화 상태로 설명됩니다. 이러한 개념을 사용하여 반응성과 선호 기하학을 예측할 수 있습니다. 유기금속 화합물에서의 화학적 결합과 반응성은 종종 이소발 원리의 관점에서 논의됩니다.
유기금속 화합물의 구조, 구성 및 특성을 결정하기 위해 매우 다양한 물리적 기술이 사용됩니다. X선 회절은 고체 화합물 내에서 원자의 위치를 파악할 수 있는 특히 중요한 기술로, 구조에 대한 자세한 설명을 제공합니다.[1][8] 또한, 적외선 분광법, 핵자기공명분광법 등의 방법을 이용하여 유기금속 화합물의 구조 및 결합에 관한 정보를 얻는 경우가 많습니다.[1][8] 자외선 가시 분광법은 유기금속 화합물의 전자 구조에 대한 정보를 얻기 위해 사용되는 일반적인 기술입니다. 또한 유기 금속 반응의 진행 상황을 모니터링하고 동역학을 결정하는 데 사용됩니다.[8] 유기금속 화합물의 역학은 동적 NMR 분광법을 사용하여 연구할 수 있습니다.[1] 다른 주목할 만한 기술로는 X선 흡수 분광법,[9] 전자 상자 공명 분광법, 원소 분석법 등이 있습니다.[1][8]
산소 및 수분에 대한 반응성이 높기 때문에 유기금속 화합물은 종종 공기가 없는 기술을 사용하여 처리해야 합니다. 유기금속 화합물을 공기 없이 처리하려면 일반적으로 글로브박스 또는 슐렌크 라인과 같은 실험 장치를 사용해야 합니다.[1]
역사
유기금속 화학의 초기 발전은 루이 클로드 카데의 카코딜 관련 메틸 비소 화합물 합성, 윌리엄 크리스토퍼 차이즈의 백금-에틸렌 복합체[10],[11] 에드워드 프랭크랜드의 디에틸- 및 디메틸아연 발견, 루드비히 몬드의 Ni(CO) 발견,4[1] 빅토르 그리냐르의 유기마그네슘 화합물 등입니다. (항상 유기금속 화합물로 인정되는 것은 아니지만, 혼합가 철-시아나이드 복합체인 프러시안 블루는 1706년에 최초의 배위 중합체이자 금속-탄소 결합을 포함하는 합성 물질로서 페인트 제조업자 요한 제이콥 디즈바흐에 의해 처음으로 제조되었습니다.)[12] 석탄과 석유에서 나오는 풍부하고 다양한 제품은 지글러-나타, 피셔-트롭쉬, CO, H2 및 알켄을 공급원료 및 리간드로 사용하는 하이드로포밀화 촉매작용으로 이어졌습니다.
유기금속 화학을 별개의 하위 분야로 인정한 것은 금속 유전체에 대한 연구로 에른스트 피셔와 제프리 윌킨슨에게 노벨상을 주는 것으로 절정에 이르렀습니다. 2005년 Yves Chauvin, Robert H. Grubbs, Richard R. 슈록은 금속 촉매 올레핀 메타테시스로 노벨상을 공동 수상했습니다.[13]
유기금속화학 연대표
- 1760 Louis Claude Cadet de Gasicourt 유기아렌계 화합물 카코딜 분리
- 1827 William Christopher Zeise가 Zeise의 소금을 생산합니다; 최초의 백금/올레핀 복합체
- 1848 에드워드 프랭크랜드가 디에틸아진크를 발견합니다.
- 1890 루드비히 몬드, 니켈 카르보닐 발견
- 1899 존 울릭 네프는 아세틸화나트륨을 사용하여 알키닐화를 발견합니다.
- 1909 Paul Ehrlich는 초기 비소 기반 유기금속 화합물인 매독 치료를 위해 Salvarsan을 소개합니다.
- 1912년 노벨상 수상자 빅토르 그리냐르와 폴 사바티에
- 1930 Henry Gilman 은 리튬 컵레이트를 발명했습니다, Gilman 시약을 참조하세요.
- 1940 유진 G Rochow와 Richard Müller는 유기 실리콘 화합물을 제조하는 직접적인 과정을 발견합니다.
- 1930년대와 1940년대의 오토 로엘렌과 월터 레페는 금속 촉매 하이드로포밀화와 아세틸렌 화학을 개발합니다.
- 1951년 월터 히버(Walter Hieber)는 금속 카르보닐 화학에 대한 연구로 알프레드 스톡 상(Alfred Stock Prize)을 수상했습니다.
- 1951년 페로센 발견
- 1956 Dorothy Crawfoot Hodgkin은 금속-탄소 결합을 포함하는 것으로 발견된 최초의 생체분자인 비타민 B의12 구조를 결정합니다, 생물유기금속 화학을 참조하세요.
- 1963년 노벨상 카를 지글러와 줄리오 나타, 지글러-나타 촉매제
- 1973년 샌드위치 화합물에 관한 노벨상 제프리 윌킨슨과 에른스트 오토 피셔
- 1981년 우드워드-호프만 규칙을 만든 공로로 노벨상을 수상한 로알드 호프만과 후쿠이 켄이치
- 2001년 노벨상 W.S. 놀스, R. 비대칭 수소화를 위한 노요리와 칼 배리 샤프리스
- 2005년 노벨상 Yves Chauvin, Robert Grubbs, Richard Schrock, 금속 촉매 알켄 메타테시스
- 2010년 노벨상 리차드 F. Heck, Ei-ichi Negishi, Akira Akira Paladium 촉매 교차 커플링 반응
범위
유기금속 화학의 하위 전문 분야는 다음과 같습니다.
- 기간 2 원소: 유기리소화학, 유기보란화학, 유기보란화학
- 3기 원소 : 유기나트륨화학, 유기마그네슘화학, 유기알루미늄화학, 유기실리콘화학
- 4교시 요소: 유기칼슘화학, 유기칸듐화학, 유기티타늄화학, 유기바나듐화학, 유기크로뮴화학, 유기망간화학, 유기철화학, 유기코발트화학, 유기니켈화학, 유기구리화학, 유기아연화학, 유기아연화학, 유기아연화학, 유기갈륨화학, 유기게르마늄화학, 유기노광화학, 유기레늄화학
- 제5기 원소: 오가노이트륨화학, 오가노지르코늄화학, 오가노비움화학, 오가노몰리브덴화학, 오가노테늄화학, 오가노루테늄화학, 오가노듐화학, 오가노팔라듐화학, 오가노실버화학, 오가노카드뮴화학, 오가노인듐화학, 오가노틴화학, 오가노 안티몬화학, 유기 루륨 화학
- 제6기 원소 : 유기란탄화물화학, 유기세라늄화학, 유기안탈륨화학, 유기오가늄화학, 유기오가늄화학, 유기오가늄화학, 유기우라늄화학, 유기플라티늄화학, 유기금화학, 유기수은화학, 유기탈륨화학, 유기납화학, 유기오가비스무트화학, 유기 폴로늄 화학
- 제7기 원소: 오가노액티니드 화학, 오가노토륨 화학, 오가노우라늄 화학, 오가노펜투늄 화학
산업용 애플리케이션
유기금속 화합물은 균질 촉매 및 화학량론 시약으로 상업적 반응에서 널리 사용됩니다. 예를 들어, 유기리튬, 유기마그네슘, 유기알루미늄 화합물은 화학양론적으로 유용하지만, 많은 중합반응을 촉매하기도 합니다.[14]
일산화탄소와 관련된 거의 모든 공정은 촉매에 의존하며, 주목할 만한 예로는 카르보닐화를 들 수 있습니다.[15] 메탄올과 일산화탄소로부터 아세트산의 생성은 몬산토 공정과 Cativa 공정에서 금속 카르보닐 복합체를 통해 촉매됩니다. 대부분의 합성 알데히드는 하이드로포밀화를 통해 생성됩니다. 적어도 에탄올보다 큰 합성 알코올의 대부분은 하이드로포밀화 유래 알데히드의 수소화에 의해 생성됩니다. 마찬가지로, 웨커 공정은 에틸렌을 아세트알데히드로 산화시키는 데 사용됩니다.[16]

알켄 유래 폴리머를 포함하는 거의 모든 산업 공정은 유기 금속 촉매에 의존합니다. 세계 폴리에틸렌과 폴리프로필렌은 지글러-나타 촉매 작용을 통해 이질적으로, 예를 들어 제한된 기하학 촉매 작용을 통해 균질하게 생산됩니다.[17]
수소와 관련된 대부분의 공정은 금속 기반 촉매에 의존합니다. 대량 수소화(예: 마가린 생산)는 이질적인 촉매에 의존하는 반면, 미세한 화학 물질의 생산을 위해 수소화는 가용성(균질) 유기금속 복합체에 의존하거나 유기금속 중간체를 포함합니다.[18] 유기금속 복합체는 이러한 수소화가 비대칭적으로 작용할 수 있도록 합니다.
많은 반도체는 트리메틸갈륨, 트리메틸인듐, 트리메틸알루미늄, 트리메틸안티몬으로 생산됩니다. 이러한 휘발성 화합물은 발광 다이오드(LED)의 생산에서 금속유기기상 에피택시(MOVPE) 공정을 통해 가열된 기판 상에서 암모니아, 아르신, 포스핀 및 관련 수소화물과 함께 분해됩니다.
유기금속 반응
유기금속 화합물은 몇 가지 중요한 반응을 거칩니다.
- 결합 및 해리 치환
- 산화적 첨가 및 환원적 제거
- 금속 횡단
- 이동 삽입
- β-수소 제거
- 전자 전달
- 탄소-hydrogen 결합 활성화
- 카보메탈화
- 하이드로메탈화
- 사이클로메탈화
- 친핵성 추상화
많은 유기 분자의 합성은 유기 금속 복합체에 의해 촉진됩니다. 시그마 결합 메타테시스는 새로운 탄소-탄소 시그마 결합을 형성하기 위한 합성 방법입니다. 시그마-결합 메타시스는 일반적으로 가장 높은 산화 상태에 있는 초기 전이-금속 복합체와 함께 사용됩니다.[19] 산화 상태가 가장 높은 전이 금속을 사용하면 산화 첨가와 같은 다른 반응이 일어나지 않습니다. 시그마 결합 메타테시스 외에도 올레핀 메타테시스를 이용하여 다양한 탄소-탄소 파이 결합을 합성하고 있습니다. 시그마 결합 메타시스나 올레핀 메타시스 모두 금속의 산화 상태를 변경하지 않습니다.[20][21] 베타 수소 제거 및 삽입 반응을 포함한 많은 다른 방법들이 새로운 탄소-탄소 결합을 형성하는 데 사용됩니다.
촉매 작용
유기금속 복합체는 촉매 작용에 일반적으로 사용됩니다. 주요 산업 공정으로는 수소화, 하이드로실릴화, 하이드로시안화, 올레핀 메타테시스, 알켄 중합, 알켄 올리고머화, 탄화수소화, 메탄올 카르보닐화, 하이드로포밀화 등이 있습니다.[16] 유기금속 중간체는 또한 위에 나열된 것과 유사한 많은 이종 촉매 과정에서 호출됩니다. 또한 Fischer-Tropsch 공정에서는 유기금속 중간체가 가정됩니다.
유기금속 복합체는 소규모 미세 화학 합성에도 일반적으로 사용되며, 특히 스즈키-미야우라 커플링,[23] 아릴할라이드로부터 아릴아민을 생성하기 위한 부흐발트-하트위그 커플링 [24]등과 같은 탄소-탄소 결합을 형성하는 교차 커플링 반응에도[22] 사용됩니다.
환경문제

천연 및 오염된 유기 금속 화합물이 환경에서 발견됩니다. 유기 납 및 유기수은 화합물과 같이 인간이 사용한 잔재물 중 일부는 독성 위험 요소입니다. 테트라에틸 납은 휘발유 첨가제로 사용하기 위해 준비되었지만 납의 독성 때문에 사용되지 않게 되었습니다. 그 대체물은 페로센 및 메틸시클로펜타디엔일 망간 트리카르보닐(MMT)과 같은 다른 유기 금속 화합물입니다.[25] 유기 비소 화합물 록사손은 논란이 많은 동물 사료 첨가제입니다. 2006년에는 미국에서만 약 백만 킬로그램이 생산되었습니다.[26] 오가노틴 화합물은 한때 방오 페인트에 널리 사용되었지만 환경 문제로 인해 금지되었습니다.[27]
참고 항목
참고문헌
- ^ a b c d e f g h i j 크랩트리 2009, p.
- ^ a b c d IUPAC, 화학 용어 해설서, 2ded. ("Gold Book") (1997). 온라인 수정 버전: (2006–) "유기금속 화합물". doi:10.1351/goldbook.O04328
- ^ a b c C. Elschenbroich (2006). Organometallics. VCH. ISBN 978-3-527-29390-2.
- ^ Lippard & Berg 1994, p.
- ^ Rodríguez-Reyes, J.C.F.; Silva-Quiñones, D. (2018). "Metalorganic Functionalization in Vacuum". Encyclopedia of Interfacial Chemistry. pp. 761–768. doi:10.1016/B978-0-12-409547-2.13135-X. ISBN 978-0-12-809894-3.
- ^ "Triethylaluminium – SDS" (PDF). chemBlink. 24 May 2016. Retrieved 3 January 2021.
- ^ a b c d Crabtree, Robert H. (2014). The organometallic chemistry of the transition metals (6 ed.). Hoboken, New Jersey. pp. 43, 44, 205. ISBN 978-1-118-78824-0. OCLC 863383849.
{{cite book}}: CS1 maint: 위치 누락 게시자(링크) - ^ a b c d Shriver et al. 2014, p.
- ^ Nelson, Ryan C.; Miller, Jeffrey T. (2012). "An introduction to X-ray absorption spectroscopy and its in situ application to organometallic compounds and homogeneous catalysts". Catal. Sci. Technol. 2 (3): 461–470. doi:10.1039/C2CY00343K.
- ^ Hunt, L. B. (1 April 1984). "The First Organometallic Compounds". Platinum Metals Review. 28 (2): 76–83. CiteSeerX 10.1.1.693.9965.
- ^ Zeise, W. C. (1831). "Von der Wirkung zwischen Platinchlorid und Alkohol, und von den dabei entstehenden neuen Substanzen" [About the effect between platinum chloride and alcohol, and about the new substances that are created in the process]. Annalen der Physik und Chemie (in German). 97 (4): 497–541. Bibcode:1831AnP....97..497Z. doi:10.1002/andp.18310970402.
- ^ 크랩트리 2009, 페이지 98.
- ^ Dragutan, V.; Dragutan, I.; Balaban, A. T. (1 January 2006). "2005 Nobel Prize in Chemistry". Platinum Metals Review. 50 (1): 35–37. doi:10.1595/147106706X94140.
- ^ 엘첸브로이치 2016, p.
- ^ W. Bertleff; M. Roeper; X. Sava. "Carbonylation". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a05_217. ISBN 978-3527306732.
- ^ a b Leeuwen 2005, p.
- ^ Klosin, Jerzy; Fontaine, Philip P.; Figueroa, Ruth (21 July 2015). "Development of Group IV Molecular Catalysts for High Temperature Ethylene-α-Olefin Copolymerization Reactions". Accounts of Chemical Research. 48 (7): 2004–2016. doi:10.1021/acs.accounts.5b00065. PMID 26151395.
- ^ Rylander, Paul N. "Hydrogenation and Dehydrogenation". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a13_487. ISBN 978-3527306732.
- ^ Waterman, Rory (23 December 2013). "σ-Bond Metathesis: A 30-Year Retrospective". Organometallics. 32 (24): 7249–7263. doi:10.1021/om400760k.
- ^ "Olefin Metathesis". The Organometallic HyperTextBook.
- ^ "Sigma Bond Metathesis". Organometallic HyperTextBook.
- ^ Jana, Ranjan; Pathak, Tejas P.; Sigman, Matthew S. (9 March 2011). "Advances in Transition Metal (Pd,Ni,Fe)-Catalyzed Cross-Coupling Reactions Using Alkyl-organometallics as Reaction Partners". Chemical Reviews. 111 (3): 1417–1492. doi:10.1021/cr100327p. PMC 3075866. PMID 21319862.
- ^ Maluenda, Irene; Navarro, Oscar (24 April 2015). "Recent Developments in the Suzuki-Miyaura Reaction: 2010–2014". Molecules. 20 (5): 7528–7557. doi:10.3390/molecules20057528. PMC 6272665. PMID 25919276.
- ^ Magano, Javier; Dunetz, Joshua R. (9 March 2011). "Large-Scale Applications of Transition Metal-Catalyzed Couplings for the Synthesis of Pharmaceuticals". Chemical Reviews. 111 (3): 2177–2250. doi:10.1021/cr100346g. PMID 21391570.
- ^ Seyferth, D. (2003). "The Rise and Fall of Tetraethyllead. 2". Organometallics. 22 (25): 5154–5178. doi:10.1021/om030621b.
- ^ Hileman, Bette (9 April 2007). "Arsenic In Chicken Production". Chemical & Engineering News. 85 (15): 34–35. doi:10.1021/cen-v085n015.p034.
- ^ Lagerström, Maria; Strand, Jakob; Eklund, Britta; Ytreberg, Erik (January 2017). "Total tin and organotin speciation in historic layers of antifouling paint on leisure boat hulls". Environmental Pollution. 220 (Pt B): 1333–1341. doi:10.1016/j.envpol.2016.11.001. PMID 27836476.
원천
- Clayden, Jonathan; Greeves, Nick; Warren, Stuart (2012). Organic Chemistry. OUP Oxford. ISBN 978-0-19-927029-3.
- Crabtree, Robert H. (2009). The Organometallic Chemistry of the Transition Metals. John Wiley & Sons. ISBN 978-0-470-25762-3.
- Elschenbroich, Christoph (2016). Organometallics. John Wiley & Sons. ISBN 978-3-527-80514-3.
- Gupta, B. D; Elias, A J (2013). Basic Organometallic Chemistry: Concepts, Syntheses, and Applications of Transition Metals. Hyderabad: Universities Press. ISBN 978-81-7371-709-3. OCLC 903314566.
- Jenkins, Paul R. (1992). Organometallic Reagents in Synthesis. Oxford University Press. ISBN 978-0-19-855666-4.
- Leeuwen, Piet W. N. M. van (2005). Homogeneous Catalysis: Understanding the Art. Springer Science & Business Media. ISBN 978-1-4020-3176-2.
- Lippard, Stephen J.; Berg, Jeremy Mark (1994). Principles of Bioinorganic Chemistry. University Science Books. ISBN 978-0-935702-73-6.
- Pearson, Anthony J (1985). Metallo-organic chemistry. Wiley. OCLC 1200566627.
- Shriver, Duward; Weller, Mark; Overton, Tina; Armstrong, Fraser; Rourke, Jonathan (2014). Inorganic Chemistry. W. H. Freeman. ISBN 978-1-4292-9906-0.







![Technetium[99mTc] sestamibi is used to image the heart muscle in nuclear medicine.](http://upload.wikimedia.org/wikipedia/commons/thumb/1/17/Tc99_sestamibi_2D_structure.svg/100px-Tc99_sestamibi_2D_structure.svg.png)

