질산납(II)
Lead(II) nitrate| | |||
| 식별자 | |||
|---|---|---|---|
3D 모델(JSmol) | |||
| 켐스파이더 | |||
| ECHA 정보 카드 | 100.030.210 | ||
| EC 번호 |
| ||
PubChem CID | |||
| RTECS 번호 |
| ||
| 유니 | |||
| UN 번호 | 1469 | ||
CompTox 대시보드 (EPA ) | |||
| |||
| |||
| 특성. | |||
| Pb(NO3)2 | |||
| 몰 질량 | 331.2 g/g | ||
| 외모 | 무채색 또는 백색 | ||
| 밀도 | 4.53g/cm3 | ||
| 녹는점 | 470°C(878°F, 743K)[2] 분해 | ||
| 376.5g/L(0°C) 597g/L(25°C) 1270g/L(100°C) | |||
자화율(δ) | - 74 · 10−6 cm3 / 세로[1] | ||
굴절률(nD) | 1.782[2] | ||
| 열화학 | |||
표준 엔탈피/ 형성 (δHf⦵298) | -451.9kJ/mol−1[1] | ||
| 위험 요소 | |||
| GHS [4]라벨링: | |||
    | |||
| 위험. | |||
| H302, , , , , , , | |||
| P201, , , , , , , , , , , , , , , , , , , , , , , , , , , , ,, | |||
| NFPA 704(파이어 다이아몬드) | |||
| 치사량 또는 농도(LD, LC): | |||
LDLo(최저 공개) | 500 mg/kg (돼지, [3]구강) | ||
| 안전 데이터 시트(SDS) | ICSC 1000 | ||
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |||
질산납(II)은 화학식이 Pb(NO)2인3 무기화합물이다.보통 무색 결정 또는 백색 분말로서 발생하며, 다른 납과는 달리,II) 소금, 물에 녹는다.
중세부터 납의 생산이라는 이름으로 알려져 있다.II) 질산의 금속납 또는 산화납 중 하나로부터의 질산염은 다른 납 화합물 제조에 직접 사용하기 위해 소규모였다.19세기의 납.Ⅱ) 질산염은 유럽과 미국에서 상업적으로 생산되기 시작했다.역사적으로 납 도료용 안료 생산에 주로 사용되었지만, 이러한 도료는 이산화티타늄을 기반으로 하는 독성이 적은 도료로 대체되었습니다.다른 산업 용도는 나일론 및 폴리에스터의 열 안정화, 그리고 포토 서모그래피 용지의 코팅에 포함되었습니다.2000년 경부터 리드(Lead)II) 금 시안화에 질산염이 사용되기 시작했다.
질산납(II)은 독성이 있으므로 흡입, 섭취 및 피부 접촉을 방지하기 위해 주의하여 취급해야 합니다.납의 위험성 때문에, 납의 사용이 한정되어 있습니다.II) 질산염은 지속적인 정밀 조사를 받고 있다.
역사
질산납은 1597년 연금술사 안드레아스 리바비우스에 의해 처음 발견되었는데, 그는 그 [5]맛 때문에 이 물질을 "달콤한 납"이라는 뜻의 플럼덤 덜스라고 불렀다.금속 납과 용해성이 [6][7]희박한 농축 질산을 반응시켜 상업적으로 생산된다.크롬 옐로우(납) 등의 안료 원료로 생산되고 있습니다.II) 크롬산염, PbCrO4 및 크롬오렌지(기본납)II) 크롬산염, PbCrO25) 및 나폴리 황색.이 안료들은 칼리코와 다른 [8]직물들을 염색하고 인쇄하는 데 사용되었다.흑색 분말에서는 산화제로, 특수 [9]폭발물에서는 납 아지드와 함께 사용되어 왔습니다.
생산.
질산납은 납의 반응에 의해 생산된다.II) 질산이 [10]농축된 산화물:
- PbO + 2 HNO3 (농축)→ Pb(NO3)2↓ + HO2
금속납과 희석질산을 [11]반응시켜 얻은 용액의 증발을 얻을 수도 있다.
- Pb + 4 HNO3 → Pb(NO3)2 + 2 NO2 + 2 HO2
납 용액 및 결정(II) 납 [12]정제소에서 나오는 납-비스무트 폐기물의 처리 과정에서 질산염이 형성된다.
구조.
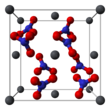
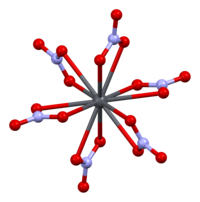
고체 납의 결정 구조(II) 중성자 [13][14]회절에 의해 질산염이 측정되었다.이 화합물은 면 중심의 입방정계에서 납 원자와 함께 입방정계에서 결정화된다.공간군은 Pa3Z=4(브라우바 격자 표기)이며, 입방체의 각 변은 길이가 784피코메트이다.
검은색 점은 납 원자를 나타내고, 질산염 그룹은 납 원자의 평면보다 27피코미터 위에 있으며, 파란색 점은 질산염 그룹이 이 평면보다 아래 같은 거리에 있음을 나타냅니다.이 구성에서는 모든 납 원자가 12개의 산소 원자(결합 길이: 281pm)에 결합됩니다.모든 N-O 결합 길이는 127피코미터로 동일합니다.[15]
납의 결정 구조에 대한 연구 관심(II) 질산염은 높은 온도에서 결정 격자 내에서 질산염 그룹의 자유 내부 회전 가능성에 부분적으로 기초했지만, 실현되지는 [14]않았다.
화학적 특성 및 반응
질산납은 가열 시 분해되는데, 이는 폭약 기술에 [9]사용된 특성입니다.그것은 물에 녹고 질산을 희석한다.
염기성 질산염은 용액에 알칼리를 첨가하면 형성된다.Pb(OH)(2NO3)2는2 낮은 pH에서 형성되는 주요 종이다.pH가 높을6 때는 Pb(OH)(5NO3)가 [17]형성된다.양이온 [PbO6(OH)]64+은 3개의 면 공유4 PbO 사면체 [18]클러스터 내에 산화물 이온이 있는 것은 이례적이다.pH 12 이하 수용액에서 수산화물 Pb(OH)2가 형성된다는 증거는 없다.
질산납 용액을 사용하여 배위 복합체를 형성할 수 있다.납(II)은 단단한 수용체이며 질소 및 산소 전자 기증 리간드와 더 강한 복합체를 형성합니다.예를 들어 아세토니트릴과 메탄올 용액에 질산납과 펜타에틸렌 글리콜(EO5)을 혼합한 후 천천히 증발시키면 화합물이 생성되었다[Pb(NO3)(2EO5)].[19]이5 화합물의 결정구조는 EO사슬이 크라운에테르와 같은 적도면에서 납이온을 감싸고 있다.2개의 이원 질산염 배위자는 트랜스 구성으로 되어 있습니다.총 배위 번호는 10이며, 이중 사각 반프리즘 분자 형상의 납 이온입니다.
그 단지 리드 질산에 의한bithiazolebidentate N-donor 리간드를 가지고 형성되 이핵의 있다.그 결정 구조는 질산 그룹은 2납 원자 사이의 다리를 이루고 있음을 보여 준다.[20]조정 영역에 육체적 격차의 단지들의 이 타입의 한가지 흥미로운 점은 존재, 즉, ligands 대칭인 금속 이온에 놓이지 않는.이 잠재적으로 전자 연구를 주도한 고립 전자 쌍, 또한 납 단지에 있는 이미다졸 리간드와 함께 발견될 예정이다.[21]
적용들
질산납은 나일론 및 폴리에스터의 열안정제, 포토 서모그래피 페이퍼의 코팅 및 설치류 [10]살충제의 코팅으로 사용되어 왔습니다.
질산납을 가열하는 것은 이산화질소를 만드는 편리한 수단이다.
금 시안화 공정에서 납을 첨가한다.II) 질산염 용액은 침출 공정을 개선한다.제한된 양(kg당 10~100mg의 질산납)만 필요합니다.[22][23]
유기화학에서는 디티오카르바메이트로부터 [24]이소티오시아네이트를 제조하는 데 사용할 수 있다.S1N 치환 시 브롬화물 스캐빈저로 사용되는 것으로 [25]보고되었다.
안전.
질산납(II)은 독성이 있으며, 모든 가용성 납 [26]화합물에 적용되는 것처럼 섭취 시 급성 납 중독을 초래할 수 있습니다.모든 무기납 화합물은 국제암연구기구(IARC)에 의해 사람에게 발암성 물질로 분류된다(카테고리 2A).[27]납에 노출된 근로자에 대한 연구는 종종 [28]비소에 동시에 노출되어 복잡하지만, 그것들은 실험 동물의 신장암과 교종, 인간의 신장암, 뇌암과 관련이 있다.납은 혈생합성 경로의 γ-아미노레불린산탈수효소(포르포빌리노겐합성효소)와 피리미딘-5γ-뉴클레오티다아제를 포함한 많은 효소에서 아연을 대체하는 것으로 알려져 있어 DNA의 정확한 대사에 중요하므로 태아 [29]손상을 일으킬 수 있다.
레퍼런스
- ^ a b CRC handbook of chemistry and physics : a ready-reference book of chemical and physical data. William M. Haynes, David R. Lide, Thomas J. Bruno (2016-2017, 97th ed.). Boca Raton, Florida. 2016. ISBN 978-1-4987-5428-6. OCLC 930681942.
{{cite book}}: CS1 유지보수: 기타 (링크) - ^ a b Patnaik, Pradyot (2003). Handbook of inorganic chemicals. New York: McGraw-Hill. p. 475. ISBN 0-07-049439-8. OCLC 50252041.
- ^ "Lead compounds (as Pb)". Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ "Lead nitrate". pubchem.ncbi.nlm.nih.gov. Retrieved 19 December 2021.
- ^ Libavius, Andreas (1595). Alchemia Andreæ Libavii. Francofurti: Iohannes Saurius.
- ^ Chisholm, Hugh, ed. (1911). . Encyclopædia Britannica. Vol. 16 (11th ed.). Cambridge University Press. pp. 314–320.
- ^ Macgregor, John (1847). Progress of America to year 1846. London: Whittaker & Co. ISBN 0-665-51791-2.
- ^ Partington, James Riddick (1950). A Text-book of Inorganic Chemistry. MacMillan. p. 838.
- ^ a b Barkley, J. B. (October 1978). "Lead nitrate as an oxidizer in blackpowder". Pyrotechnica. Post Falls, Idaho: Pyrotechnica Publications. 4: 16–18.
- ^ a b Greenwood, Norman N.; Earnshaw, A. (1997). Chemistry of the Elements (2nd ed.). Oxford: Butterworth-Heinemann. pp. 388, 456. ISBN 0-7506-3365-4.
- ^ Othmer, D. F. (1967). Kirk-Othmer Encyclopedia of Chemical Technology. Vol. 12 (Iron to Manganese) (second completely revised ed.). New York: John Wiley & Sons. p. 272. ISBN 0-471-02040-0.
- ^ "Product catalog; other products". Tilly, Belgium: Sidech. Archived from the original on 2007-07-01. Retrieved 2008-01-05.
- ^ Hamilton, W. C. (1957). "A neutron crystallographic study of lead nitrate". Acta Crystallogr. 10 (2): 103–107. doi:10.1107/S0365110X57000304.
- ^ a b Nowotny, H.; G. Heger (1986). "Structure refinement of lead nitrate". Acta Crystallogr. C. 42 (2): 133–35. doi:10.1107/S0108270186097032.
- ^ "Cấu trúc của chì nitrat". Retrieved 15 July 2019.
- ^ Ferris, L. M. (1959). "Lead nitrate—Nitric acid—Water system". Journal of Chemical & Engineering Data. 5 (3): 242. doi:10.1021/je60007a002.
- ^ Pauley, J. L.; M. K. Testerman (1954). "Basic Salts of Lead Nitrate Formed in Aqueous Media". Journal of the American Chemical Society. 76 (16): 4220–4222. doi:10.1021/ja01645a062.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8. 페이지 395
- ^ Rogers, Robin D.; Andrew H. Bond; Debra M. Roden (1996). "Structural Chemistry of Poly (ethylene glycol). Complexes of Lead(II) Nitrate and Lead(II) Bromide". Inorg. Chem. 35 (24): 6964–6973. doi:10.1021/ic960587b. PMID 11666874.
- ^ Mahjoub, Ali Reza; Ali Morsali (2001). "A Dimeric Mixed-Anions Lead(II) Complex: Synthesis and Structural Characterization of [Pb2(BTZ)4(NO3)(H2O)](ClO4)3 {BTZ = 4,4'-Bithiazole}". Chemistry Letters. 30 (12): 1234. doi:10.1246/cl.2001.1234.
- ^ Shuang-Yi Wan; Jian Fan; Taka-aki Okamura; Hui-Fang Zhu; Xing-Mei Ouyang; Wei-Yin Sun & Norikazu Ueyama (2002). "2D 4.82 Network with threefold parallel interpenetration from nanometre-sized tripodal ligand and lead(II) nitrate". Chem. Commun. (21): 2520–2521. doi:10.1039/b207568g.
- ^ Habashi, Fathi (1998). "Recent advances in gold metallurgy". Revisa de la Facultad de Ingeniera, Universidad Central de Venezuela. 13 (2): 43–54.
- ^ "Auxiliary agents in gold cyanidation". Gold Prospecting and Gold Mining. Retrieved 2008-01-05.
- ^ Dains, F. B.; Brewster, R. Q.; Olander, C. P. "Phenyl isothiocyanate". Organic Syntheses.; Collective Volume, vol. 1, p. 447
- ^ Rapoport, H.; Jamison, T. (1998). "(S)-N-(9-Phenylfluoren-9-yl)alanine and (S)-Dimethyl-N-(9-phenylfluoren-9-yl)aspartate". Organic Syntheses.; Collective Volume, vol. 9, p. 344
- ^ "Lead nitrate, Chemical Safety Card 1000". International Labour Organization, International Occupational Safety and Health Information Centre. March 1999. Retrieved 2008-01-19.
- ^ "Inorganic and Organic Lead Compounds" (PDF). IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. International Agency for Research on Cancer. Suppl. 7: 239. 1987. Archived from the original (PDF) on 2008-03-06. Retrieved 2008-01-19.
- ^ World Health Organization, International Agency for Research on Cancer (2006). "Inorganic and Organic Lead Compounds" (PDF). IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. International Agency for Research on Cancer. 87. ISBN 92-832-1287-8. Archived from the original (PDF) on 2007-10-21. Retrieved 2008-01-01.
- ^ Mohammed-Brahim, B.; Buchet, J.P.; Lauwerys, R. (1985). "Erythrocyte pyrimidine 5'-nucleotidase activity in workers exposed to lead, mercury or cadmium". Int Arch Occup Environ Health. 55 (3): 247–52. doi:10.1007/BF00383757. PMID 2987134. S2CID 40092031.
외부 링크
- Woodbury, William D. (1982). "Lead". Mineral Yearbook Metals and Minerals. Bureau of Mines: 515–42. Retrieved 2008-01-18.
- "Lead". NIOSH Pocket Guide to Chemical Hazards. National Institute for Occupational Safety and Health. September 2005. NIOSH 2005-149. Retrieved 2008-01-19.
- "Lead and Lead Compounds Fact Sheet". National Pollutant Inventory. Australian Government, Department of the Environment and Water Resources. July 2007. Archived from the original on January 11, 2008. Retrieved 2008-01-19.
- "Lead". A Healthy Home Environment, Health Hazards. US Alliance for healthy homes. Archived from the original on 2008-02-20. Retrieved 2008-01-19.
- 물질 안전 데이터 시트
| HNO3 | 그 | ||||||||||||||||
| LiNO3 | Be(NO3)2 | B(NO 3)− 4 | 로노2 | 아니요− 3 NH4NO3 | 훈오2 | FNO3 | 네 | ||||||||||
| NaNO3 | Mg(NO3)2 | 알(NO3)3 | 시 | P | S | 클로노2 | 아르 | ||||||||||
| 키보드3 | Ca(NO3)2 | Sc(NO3)3 | Ti(NO3)4 | VO(NO3)3 | Cr(NO3)3 | Mn(NO3)2 | Fe(NO3)2 Fe(NO3)3 | Co(NO3)2 Co(NO3)3 | Ni(NO3)2 | CuNO3 Cu(NO3)2 | Zn(NO3)2 | Ga(NO3)3 | ge | ~하듯이 | 세 | BrNO3 | Kr |
| RbNO3 | Sr(NO3)2 | Y(NO3)3 | Zr(NO3)4 | Nb | 모 | Tc | Ru(NO3)3 | Rh(NO3)3 | PD(NO3)2 PD(NO3)4 | 아그노3 Ag(NO3)2 | CD(NO3)2 | 입력3(NO)3 | Sn(NO3)4 | Sb(NO3)3 | 테 | 이노3 | Xe(NO3)2 |
| CsNO3 | Ba(NO3)2 | Hf(NO3)4 | 타 | W | 레 | OS | Ir | Pt(NO3)2 Pt(NO3)4 | AU(NO3)3 | Hg2(NO3)2 Hg(NO3)2 | TLNO3 TL(NO3)3 | Pb(NO3)2 | Bi(NO3)3 BiO(NO3) | Po(NO3)4 | 앳 | Rn | |
| 프루노3 | Ra(NO3)2 | Rf | 데이터베이스 | Sg | Bh | Hs | 산 | Ds | Rg | Cn | Nh | 플 | 맥 | Lv | Ts | 오그 | |
| ↓ | |||||||||||||||||
| La(NO3)3 | Ce(NO3)3 Ce(NO3)4 | Pr(NO3)3 | Nd(NO3)3 | PM(NO3)3 | SM(NO3)3 | Eu(NO3)3 | Gd(NO3)3 | Tb(NO3)3 | Dy(NO3)3 | 호(NO3)3 | Er(NO3)3 | Tm(NO3)3 | Yb(NO3)3 | 루(NO3)3 | |||
| AC(NO3)3 | Th(NO3)4 | PaO2(NO3)3 | UO2(NO3)2 | Np(NO3)4 | Pu(NO3)4 | AM(NO3)3 | Cm(NO3)3 | Bk(NO3)3 | Cf | Es | Fm | Md | 아니요. | Lr | |||



![{\displaystyle {\ce {2 Pb(NO_3)_2->[\Delta]2PbO + 4NO_2 +O_2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/06f64696eaa883432008d7e6af4c5af9b60a6b85)