트라보프로스트
Travoprost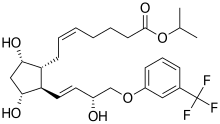 | |
| 임상자료 | |
|---|---|
| 상명 | 트라바탄, 이즈바 등 |
| AHFS/Drugs.com | 모노그래프 |
| 메드라인플러스 | a602027 |
| 라이센스 데이터 | |
| 임신 범주 |
|
| 경로: 행정 | 주제어 안약 |
| ATC 코드 | |
| 법적현황 | |
| 법적현황 | |
| 약동학 데이터 | |
| 신진대사 | 에스테르 가수분해에 의한 활성화, 베타 산화에 의한 비활성화, OH-산화, 이중 결합 감소 |
| 행동 개시 | 2시간 |
| 제거 반감기 | 1.5시간(수유량) 45분(시간) |
| 작용기간 | ≥ 24시간 |
| 배설 | 주로 신장을 경유함 |
| 식별자 | |
| CAS 번호 | |
| 펍켐 CID | |
| IUPHAR/BPS | |
| 드러그뱅크 | |
| 켐스파이더 | |
| 유니 | |
| 케그 | |
| 체비 | |
| 켐벨 | |
| CompTox 대시보드 (EPA) | |
| ECHA InfoCard | 100.207.141 |
| 화학 및 물리적 데이터 | |
| 공식 | C26H35F3O6 |
| 어금질량 | 500.555 g·190−1 |
| 3D 모델(JSmol) | |
| | |
트라바탄이라는 브랜드명으로 판매되는 트라보프로스트(Travoprost)는 녹내장을 비롯한 눈 안쪽의 고압 치료에 쓰이는 약이다.[3] 특히 다른 제제가 충분하지 않을 때 개방각 녹내장에 사용한다.[4][3] 그것은 안약으로 사용된다.[3] 효과는 일반적으로 2시간 이내에 발생한다.[3]
흔히 볼 수 있는 부작용으로는 붉은 눈, 흐릿한 시야, 눈의 통증, 건조한 눈, 눈의 색 변화 등이 있다.[3][4] 다른 유의미한 부작용으로는 백내장이 있을 수 있다.[4] 임신이나 모유 수유 중에는 일반적으로 사용하지 않는 것이 좋다.[4] 프로스타글란딘 아날로그로 눈에서 수액 유출을 증가시켜 작용한다.[3]
트라보프로스트(Travoprost)는 2001년 미국과 유럽연합(EU)에서 의료용으로 승인됐다.[3][2] 그것은 영국에서 일반 의약품으로 이용 가능하다.[4] 2017년에는 미국에서 가장 흔하게 처방된 212번째로 200만 개 이상의 처방전이 있었다.[5][6]
의학적 용법
트라보프로스트(Travoprost)는 녹내장을 포함한 눈 내부의 고압 치료에 쓰인다.[3] 특히 다른 제제가 충분하지 않을 때 개방각 녹내장에 사용한다.[4][3]
부작용
가능한 부작용은 다음과 같다.[7]
- 흐릿한 시야
- 눈꺼풀이 붉어짐
- 속눈썹의 영구적인 검게 그을림
- 눈의 불편함
- 홍채에서 갈색으로 영구적으로 검게 변함(heterochochrom)
- 사용 중 타는 듯한 느낌
- 속눈썹의 굵어짐
- 전립선 염증, 소변 흐름 제한(BPH)[citation needed]
안약을 투여한 뒤 흡수성 패드로 눈을 닦으면 과다한 수분을 닦아내지 않는 것에 비해 속눈썹이 짧아지고 눈꺼풀에 과립이 생길 가능성이 적다는 연구결과가 나왔다.[8]
약리학
작용기전
합성 프로스타글란딘 아날로그(또는 보다 구체적으로 말하면 프로스타글란딘F의2α 아날로그)[9][10]로 눈에서 수액 유출을 증가시켜 작용한다.[11]
타플루프로스트, 라타노프로스트 등 다른 프로스타글란딘 F의2α 아날로그처럼 트라보프로스트도 프리산의 에스테르 프로드러그로서 프로스타글란딘 F 수용체에서 작용제 역할을 하여 눈에서 수액의 유출을 증가시켜 안압을 낮춘다.[7]
약동학
트라보프로스트(Travoprost)는 각막을 통해 흡수되며, 각막은 자유 트라보프로스트산에 가수분해된다. 눈 속의 산의 최고 농도는 도포 1~2시간 후에 도달하며, 수액에서의 반감기는 1.5시간이다. 일단 혈류에 도달하면 빠르게 대사되어 시스템의 농도가 25 pg/ml를 초과하지 않도록 한다(눈의 20 ng/ml에 비해 거의 1000배 높다).[7]
대사물은 산성 체인의 베타 산화(Compare Tafluprost#Pharmacocietics), 다른 쪽 체인의 OH 그룹의 산화, 이 OH 그룹 옆에 있는 이중 결합의 감소에 의해 형성된다. 트라보프로스트산과 그 대사물은 주로 신장을[7] 통해 배설되며 말기 반감기가 45분이다.[12]
다양한 제품들이 임상시험을 거쳐 지속적인 꾸준한 릴리즈를 선사하고 있다. OTX-TP(Oocular Therapeutics)는 위약 분비가 12주로 종료되는 우수한 결과를 보여 주는 3단계 실험을 완료했다.[13]
참조
- ^ "Travoprost ophthalmic Use During Pregnancy". Drugs.com. 8 October 2019. Retrieved 16 May 2020.
- ^ Jump up to: a b "Travatan EPAR". European Medicines Agency (EMA). Retrieved 3 January 2021.
- ^ Jump up to: a b c d e f g h i "Travoprost Monograph for Professionals". Drugs.com. American Society of Health-System Pharmacists. Retrieved 26 March 2019.
- ^ Jump up to: a b c d e f British national formulary : BNF 76 (76 ed.). Pharmaceutical Press. 2018. p. 1152. ISBN 9780857113382.
- ^ "The Top 300 of 2020". ClinCalc. Retrieved 11 April 2020.
- ^ "Travoprost - Drug Usage Statistics". ClinCalc. Retrieved 11 April 2020.
- ^ Jump up to: a b c d Haberfeld, H, ed. (2015). Austria-Codex (in German). Vienna: Österreichischer Apothekerverlag. Travatan 40 Mikrogramm/ml Augentropfen.
- ^ Xu L, Wang X, Wu M (February 2017). "Topical medication instillation techniques for glaucoma". The Cochrane Database of Systematic Reviews. 2: CD010520. doi:10.1002/14651858.CD010520.pub2. PMC 5419432. PMID 28218404.
- ^ Alcon Laboratories, Inc. (September 2011). "Travatan - travoprost solution". DailyMed. Bethesda, MD: U.S. National Library of Medicine. Retrieved 2011-09-30.
- ^ Alcon Laboratories, Inc. (September 2011). "Travatan Z (travoprost) solution". DailyMed. Bethesda, MD: U.S. National Library of Medicine. Retrieved 2011-09-30.
- ^ AHFS Consumer Medication Information (2011-01-01). "Travoprost Ophthalmic". MedlinePlus. Bethesda, MD: U.S. National Library of Medicine. Retrieved 2011-09-30.
- ^ Drugs.com: 트라보프로스트 모노그래프.
- ^ "Deliver Us from Noncompliance".
외부 링크
- "Travoprost". Drug Information Portal. U.S. National Library of Medicine.



