묘신
Myosin미오신(/mamaəsnn, -o--/)[1][2]은 진핵생물에서 근육 수축 및 광범위한 다른 운동성 과정에서의 역할로 가장 잘 알려진 운동 단백질의 슈퍼 패밀리이다.그들은 ATP에 의존하며 액틴 기반의 운동성을 담당한다.
최초로 발견된 미오신은 1864년 빌헬름 퀴네에 의해 발견되었다.Kühne는 근육의 긴장 상태를 유지하는 데 책임이 있는 골격근에서 점성이 있는 단백질을 추출했다.그는 이 단백질을 [3][4]미오신이라고 불렀다.이 용어는 줄무늬 근육 조직과 평활근 조직의 세포에서 발견되는 유사한 ATPase 그룹을 포함하도록 확장되었습니다.
1973년 Acanthamoeba castellani에서 미오신 유사 기능을 가진 효소의 발견에 이어 진핵생물 [5]영역 전체에서 다양한 미오신 유전자가 발견되었다.
미오신은 원래 근육 세포에 제한되는 것으로 생각되었지만, 단일 "미오신"은 없다; 대신에 단백질 생성물이 액틴 결합, ATP 가수분해 효소 활성, 그리고 힘 전달의 기본 특성을 공유하는 매우 큰 유전자의 슈퍼 패밀리이다.사실상 모든 진핵세포는 미오신 아이소폼을 포함하고 있다.어떤 등소 형태는 특정 세포 유형(근육 등)에 특화된 기능을 가지고 있는 반면, 다른 등소 형태는 어디에나 있습니다.미오신의 구조와 기능은 토끼 근육 미오신II가 [6]아메바에서 액틴과 결합할 정도로 여러 종에 걸쳐 전 세계적으로 보존된다.
구조 및 기능
도메인
대부분의 미오신 분자는 머리, 목, 그리고 꼬리 영역으로 구성되어 있다.
- 두부 도메인은 필라멘트 액틴을 결합하고 ATP 가수분해를 사용하여 힘을 생성하고 가시철(+) 끝을 향해 필라멘트를 따라 걷는다(미오신 VI는 뾰족한(-) 끝을 향해 이동한다.
- 넥 도메인은 링커 및 촉매 모터 도메인에 의해 생성된 힘을 변환하는 레버 암 역할을 합니다.목 도메인은 또한 고분자 복합체의 일부를 형성하고 일반적으로 조절 기능을 가진 별개의 단백질인 미오신 경쇄의 결합 부위의 역할을 할 수 있다.
- 꼬리 도메인은 일반적으로 화물 분자 및/또는 다른 미오신 서브유닛과의 상호작용을 매개한다.경우에 따라 꼬리 도메인이 운동 활동을 조절하는 역할을 할 수 있습니다.
파워 스트로크
다중 미오신 II 분자는 ATP [7]가수분해에서 방출되는 에너지에 의해 연료 공급되는 파워 스트로크 메커니즘을 통해 골격근에 힘을 발생시킨다.파워 스트로크는 미오신이 액틴에 단단히 결합되어 있는 동안 ATP 가수분해 후 미오신 분자로부터 인산염이 방출될 때 발생합니다.이 방출의 효과는 액틴을 끌어당기는 분자의 구조 변화이다.ADP 분자의 방출은 소위 미오신의 [8]경직 상태로 이어진다.새로운 ATP 분자의 결합은 액틴으로부터 미오신을 방출할 것이다.미오신 내 ATP 가수분해는 미오신이 다시 액틴과 결합해 순환을 반복하게 할 것이다.무수한 파워 스트로크의 복합적인 효과는 근육을 수축시킨다.
명명법, 진화 및 가계도

진핵생물 세포 전체에서 발견되는 다양한 미오신 유전자들은 그들이 발견되었을 때 다른 체계에 따라 이름이 붙여졌다.따라서 명명법은 유기체 내 및 유기체 간에 미오신 단백질의 기능을 비교하려고 시도할 때 다소 혼란스러울 수 있다.
근섬유가 풍부해 미오신 슈퍼패밀리 중 가장 눈에 띄는 골격근 미오신이 가장 먼저 발견됐다.이 단백질은 육질의 일부를 구성하고 여러 개의 미오신 서브유닛으로 구성된 고분자 필라멘트를 형성합니다.유사한 필라멘트를 형성하는 미오신 단백질이 심근, 평활근, 비근육 세포에서 발견되었다.그러나 1970년대부터 연구자들은 단량체 역할을 하는 단백질을 코드하는 단순한 진핵생물에서[5] 새로운 미오신 유전자를 발견하기 시작했다. 따라서 클래스 I 미오신이라고 명명되었다.이 새로운 미오신들은 집합적으로 "비재래식 미오신"[9]이라고 불렸고 근육 이외의 많은 조직들에서 발견되었다.이들 새로운 슈퍼패밀리는 머리 도메인의 아미노산 배열 비교에서 파생된 계통발생 관계에 따라 그룹화되며, 각 분류에는 로마 숫자가[10][11][12][13] 할당된다( 계통발생학적 나무 참조).특이한 미오신들은 또한 다른 [14]꼬리 영역을 가지고 있어 독특한 기능을 암시한다.현재 다양한 미오신 배열은 선조들의 전구체로부터 진화한 것으로 보인다(그림 참조).
서로 다른 미오신들의 아미노산 배열의 분석은 꼬리 도메인들 간의 큰 변화를 보여주지만, 머리 도메인 배열의 강한 보존을 보여준다.아마도 이것은 미오신이 꼬리를 통해 많은 다른 화물과 상호작용할 수 있는 반면, 각각의 경우 - 액틴 필라멘트를 따라 이동하는 - 목적은 동일하므로 모터에 동일한 기계를 필요로 합니다.예를 들어, 인간 게놈은 40개 이상의 다른 미오신 유전자를 가지고 있다.
이러한 형태의 차이는 또한 미오신이 액틴 필라멘트를 따라 움직일 수 있는 속도를 결정합니다.ATP의 가수분해와 그에 따른 인산기 방출은 "파워 스트로크"를 유발하며, 여기서 중쇄의 "레버 암" 또는 "목" 영역은 앞으로 끌어당긴다.파워 스트로크는 항상 레버 암을 동일한 각도로 이동시키므로 레버 암의 길이에 따라 액틴 필라멘트에 대한 카고의 변위가 결정됩니다.레버 암이 길면 레버 암이 동일한 각도 변위를 받더라도 화물이 더 먼 거리를 이동할 수 있습니다. 이는 다리가 긴 사람이 각 단계를 밟을 때마다 더 멀리 이동할 수 있는 것과 같습니다.미오신 모터의 속도는 ADP의 방출에 대한 ATP 결합의 완전한 운동 사이클을 통과하는 속도에 따라 달라집니다.
묘신 클래스
묘신 1세
유비쿼터스 세포단백질인 마이오신I는 단량체로서 기능하며 소포수송에서 [15]기능한다.스텝 사이즈는 10 nm이며 [16]내이에 있는 입체실리아의 적응 반응을 담당하는 것으로 알려져 있습니다.
미오신 2세
미오신 II는 대부분의 동물 세포에서 근육 수축을 일으키는 미오신 타입이다.그것은 또한 스트레스 [17]섬유라고 불리는 수축성 다발의 비근육 세포에서 발견됩니다.
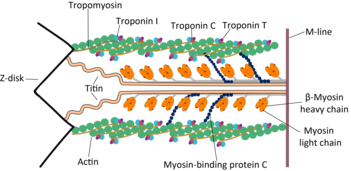
- 미오신II는 머리와 꼬리 도메인을 구성하는 각각 약 2000개의 아미노산 길이의 두 개의 무거운 사슬을 포함하고 있습니다.이들 중쇄 각각은 N 말단 머리 도메인을 포함하고, C 말단 꼬리는 코일 코일 형태를 취하며, 두 개의 중쇄를 함께 고정한다(카듀서스와 같이 서로 감싼 두 마리의 뱀을 상상한다).따라서 미오신II는 두 개의 머리를 가지고 있다.중간 목 도메인은 머리와 [18]꼬리 사이의 각도를 생성하는 영역입니다.평활근에서, 단일 유전자(MYH11)[19]는 중쇄 미오신 II를 코드하지만, 이 유전자의 스플라이스 변이체는 4개의 다른 동질 형태를 [18]낳는다.
- 또한 4개의 Myosin Light Chain(MLC; 묘신 경량 체인)을 포함하고 있어 헤드당 2개, 무게 20(MLC20) 및 17([18]MLC17) kDa가 됩니다.이것들은 머리와 꼬리 사이의 "목" 부분의 무거운 쇠사슬을 묶습니다.
근육 세포에서, 각각의 미오신 분자의 긴 코일 꼬리가 함께 결합되어 육체의 두꺼운 필라멘트를 형성합니다.힘을 생성하는 헤드 도메인은 두꺼운 필라멘트의 측면에서 튀어나와 적절한 화학 신호에 반응하여 인접한 액틴 기반의 얇은 필라멘트를 따라 걸을 준비가 되어 있습니다.
미오신 3세
미오신 III는 미오신 계열의 잘 알려지지 않은 구성원이다.그것은 드로소필라의 눈에서 체내로 연구되어 [20]광전달을 위해 역할을 하는 것으로 생각된다.미오신III의 인간 상동 유전자 MYO3A가 인간 게놈 프로젝트를 통해 발견되어 망막과 달팽이관에 [21]발현되었다.
미오신 4세
마이오신 IV는 IQ 모티브가 1개이고 꼬리는 코일형성 배열을 가지고 있지 않다.그것은 묘신 7세와 [22]15세의 꼬리 도메인과 유사한 상동성을 가지고 있다.
묘신 V
마이오신V는 다이머로서 가공성이 높고 스텝 사이즈가 36 nm인 [23]파격적인 마이오신 모터입니다.그것은 필라멘트의 가시 돋친 끝(+ 끝)을 향해 이동하는 액틴 필라멘트를 따라 이동한다.미오신 V는 세포의 중심에서 주변으로 화물(예: RNA, 소낭, 소기관, 미토콘드리아)을 운반하는 데 관여하지만, 활동성이 풍부한 세포의 [24][25]주변부에 소낭과 소기관들을 고정하는 동적 사슬과 같은 역할을 더 많이 하는 것으로 나타났다.액틴 필라멘트의 조립에 관한 최근의 단일 분자 시험관내 재구성 연구는 마이오신 V가 새로운 조립(ADP-Pi 리치) F-actin에서 더 멀리 이동하는 반면, 오래된(ADP 리치) F-actin에서는 [26]처리 런렝스가 더 짧다는 것을 시사한다.
묘신 VI
마이오신 VI는 이합체로서 주로 가공적이면서도 비프로세시브 단량체로서 기능하는 파격적인 마이오신 모터입니다.그것은 필라멘트의 [28]뾰족한 끝(-끝)을 향해 액틴 필라멘트를 따라 걷습니다.미오신 VI는 세포 [29]내 소포를 운반하는 것으로 생각된다.
묘신 7세
미오신VII는 꼬리 부분에 두 개의 FERM 도메인을 가진 특이한 미오신이다.5개의 칼모듈린 결합 IQ 모티브로 구성된 확장된 레버 암을 가지고 있으며, 그 다음에 단일 알파 나선(SAH)[30] Myosin VII는 Dictyostelium discideum의 식세포증, C. elegants의 정자형성, 생쥐와 [31]제브라피쉬의 스테레오실리아 형성에 필요합니다.
묘신 8세
미오신 VII는 세포 [32]분열과 연결된 식물 특이적 미오신이다; 구체적으로는, 세포 사이의[33] 세포질 흐름과 소포의 포구체 [34]위치 결정과 관련이 있다.
묘신 IX
마이오신 IX는 단두 운동 단백질의 그룹이다.그것은 처음에는 마이너스 [35]방향인 것으로 나타났지만, 이후 연구에 따르면 플러스 [36]방향인 것으로 나타났다.이 미오신의 이동 메커니즘은 잘 알려져 있지 않다.
묘신 X
마이오신X는 다이머로서 기능하는 파격적인 마이오신 모터입니다.미오신 X의 이량화는 [37]반평행성으로 생각된다.이 동작은 다른 미오신에서는 관찰되지 않았습니다.포유류의 세포에서는 모터가 필로포디아에 국재하는 것으로 밝혀졌다.마이오신 엑스는 가시 돋친 필라멘트의 끝을 향해 걸어간다.일부 연구에 따르면 단일 [38]필라멘트보다는 액틴 다발을 선호한다.이 동작을 보이는 미오신 모터가 발견된 것은 이번이 처음이다.
묘신 XI
미오신 XI는 식물 [39]세포에서 플라스티드와 미토콘드리아와 같은 세포소기관들의 움직임을 지시한다.그것은 빛의 강도에 따른 엽록체의 빛 방향 이동과 서로 다른 플라스티드를 연결하는 스트로뮬의 형성을 담당한다.미오신 XI는 또한 극성 뿌리 끝의 성장에 중요한 역할을 하며 적절한 뿌리 모발 [40]신장에 필요합니다.니코티아나 타바쿰에서 발견된 특정 마이오신 XI는 액틴 [41]필라멘트를 따라 35 nm 단계로 7 μm/s로 이동하는 것으로 알려진 가장 빠른 진행성 분자 모터로 밝혀졌다.
묘신 XII
묘신 XIII
묘신 XIV
이 미오신 그룹은 Apicomplexa [42]문에서 발견되었습니다.미오신은 세포 내 기생충의 혈장막에 위치하여 세포 침입 [43]과정에 관여할 수 있다.
이 미오신은 섬모 원생동물 테트라히메나 테르마필라에서도 발견된다.알려진 기능은 핵으로 파고솜을 운반하는 것과 결합 중에 발달적으로 조절된 마크롱핵의 제거를 교란하는 것을 포함한다.
묘신 15세
마이오신 XV는 내이에 위치한 비운동성 입체실리아의 액틴 코어 구조의 발달에 필요하다.그것은 단량체로서 기능하는 것으로 생각된다.
묘신 16세
묘신 17세
묘신 18세
MYO18A 액틴 기반 운동 분자를 ATP 효소 활성으로 코드하는 17q11.2 염색체의 유전자. 세포 간 접촉을 유지하는 데 필요한 간질 세포 발판을 유지하는 데 관여할 수 있다.
묘신 XIX
미오신 XIX(Myo19)는 미토콘드리아 관련 미오신 [44]모터이다.
인간의 유전자
이들 유전자가 모두 활성인 것은 아닙니다.
- 클래스 I: MYO1A, MYO1B, MYO1C, MYO1D, MYO1E, MYO1F, MYO1G, MYO1H
- 클래스 II: MYH1, MYH2, MYH3, MYH4, MYH6, MYH7, MYH7B, MYH8, MYH9, MYH10, MYH11, MYH13, MYH14, MYH1516, MYH
- 클래스 III: MYO3A, MYO3B
- 클래스 V: MYO5A, MYO5B, MYO5C
- 클래스 VI: MYO6
- 클래스 VII: MYO7A, MYO7B
- 클래스 IX: MYO9A, MYO9B
- 클래스 X: MYO10
- 클래스 XV: MYO15A
- 클래스 XVII: MYO18A, MYO18B
미오신 라이트 체인(myosin light chain)은 구별되고 고유한 특성을 가지고 있습니다.그들은 "미오신"으로 간주되지 않지만 기능적인 미오신 효소를 구성하는 고분자 복합체의 구성요소이다.
파라요신
Paramyosin은 93-115kDa의 큰 근육 단백질로 다양한 무척추동물 식물에서 [45]설명되었습니다.무척추동물의 두꺼운 필라멘트는 미오신에 둘러싸인 내부 파라미오신 핵으로 구성되어 있는 것으로 생각된다.미오신은 액틴과 상호작용하여 섬유수축을 [46]일으킨다.파라미오신은 많은 다른 무척추동물 종에서 발견되는데, 예를 들어, 완족동물, 시푼쿨리아, 선충류, 안넬리다, 몰루스카, 아라크니다,[45] 그리고 곤충류입니다.파라미오신은 매우 적은 에너지 소비로 근육의 지속적인 수축을 가능하게 하는 "잡기" 메커니즘에 책임이 있으며, 그래서 조개가 장기간 동안 닫혀 있을 수 있습니다.
레퍼런스
- ^ "Myosin". Merriam-Webster Dictionary.
- ^ "myosin - definition of myosin in English from the Oxford dictionary". OxfordDictionaries.com. Retrieved 20 January 2016.
- ^ Hartman, MA; Spudich, JA (1 April 2012). "The myosin superfamily at a glance". Journal of Cell Science. 125 (Pt 7): 1627–32. doi:10.1242/jcs.094300. PMC 3346823. PMID 22566666.
- ^ Szent-Györgyi, AG (June 2004). "The early history of the biochemistry of muscle contraction". The Journal of General Physiology. 123 (6): 631–41. doi:10.1085/jgp.200409091. PMC 2234565. PMID 15173217.
- ^ a b Pollard TD, Korn ED (July 1973). "Acanthamoeba myosin. I. Isolation from Acanthamoeba castellanii of an enzyme similar to muscle myosin". The Journal of Biological Chemistry. 248 (13): 4682–90. doi:10.1016/S0021-9258(19)43718-6. PMID 4268863. Archived from the original on 6 January 2016.
- ^ 맥마흔, T. A. 1984년근육, 반사 운동, 운동.초판프린스턴 대학 출판부ISBN 978-0-691-02376-2
- ^ Tyska MJ, Warshaw DM (January 2002). "The myosin power stroke". Cell Motility and the Cytoskeleton. 51 (1): 1–15. doi:10.1002/cm.10014. PMID 11810692.
- ^ von der Ecken J, Heissler SM, Pathan-Chhatbar S, Manstein DJ, Raunser S (June 2016). "Cryo-EM structure of a human cytoplasmic actomyosin complex at near-atomic resolution". Nature. 534 (7609): 724–8. Bibcode:2016Natur.534..724E. doi:10.1038/nature18295. PMID 27324845. S2CID 4472407.
- ^ Cheney RE, Mooseker MS (February 1992). "Unconventional myosins". Current Opinion in Cell Biology. 4 (1): 27–35. doi:10.1016/0955-0674(92)90055-H. PMID 1558751.
- ^ Cheney RE, Riley MA, Mooseker MS (1993). "Phylogenetic analysis of the myosin superfamily". Cell Motility and the Cytoskeleton. 24 (4): 215–23. doi:10.1002/cm.970240402. PMID 8477454.
- ^ Goodson HV (1994). "Molecular evolution of the myosin superfamily: application of phylogenetic techniques to cell biological questions". Society of General Physiologists Series. 49: 141–57. PMID 7939893.
- ^ Hodge T, Cope MJ (October 2000). "A myosin family tree". Journal of Cell Science. 113 Pt 19 (19): 3353–4. doi:10.1242/jcs.113.19.3353. PMID 10984423.
- ^ Berg JS, Powell BC, Cheney RE (April 2001). "A millennial myosin census". Molecular Biology of the Cell. 12 (4): 780–94. doi:10.1091/mbc.12.4.780. PMC 32266. PMID 11294886.
- ^ Oliver TN, Berg JS, Cheney RE (October 1999). "Tails of unconventional myosins". Cellular and Molecular Life Sciences. 56 (3–4): 243–57. doi:10.1007/s000180050426. PMID 11212352. S2CID 23407921.
- ^ Macive S (4 June 2003). "Myosin I". Archived from the original on 2 June 2007. Retrieved 23 May 2007.
- ^ Batters C, Arthur CP, Lin A, Porter J, Geeves MA, Milligan RA, Molloy JE, Coluccio LM (April 2004). "Myo1c is designed for the adaptation response in the inner ear". The EMBO Journal. 23 (7): 1433–40. doi:10.1038/sj.emboj.7600169. PMC 391074. PMID 15014434.
- ^ Vicente-Manzanares M, Ma X, Adelstein RS, Horwitz AR (November 2009). "Non-muscle myosin II takes centre stage in cell adhesion and migration". Nature Reviews. Molecular Cell Biology. 10 (11): 778–90. doi:10.1038/nrm2786. PMC 2834236. PMID 19851336.
- ^ a b c d e f g Aguilar HN, Mitchell BF (2010). "Physiological pathways and molecular mechanisms regulating uterine contractility". Human Reproduction Update. 16 (6): 725–44. doi:10.1093/humupd/dmq016. PMID 20551073.
- ^ Matsuoka R, Yoshida MC, Furutani Y, Imamura S, Kanda N, Yanagisawa M, Masaki T, Takao A (April 1993). "Human smooth muscle myosin heavy chain gene mapped to chromosomal region 16q12". American Journal of Medical Genetics. 46 (1): 61–7. doi:10.1002/ajmg.1320460110. PMID 7684189.
- ^ "New Page 2". Archived from the original on 7 July 2009. Retrieved 16 December 2015.
- ^ 엔트레스진 53904
- ^ Sellers JR (March 2000). "Myosins: a diverse superfamily". Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1496 (1): 3–22. doi:10.1016/S0167-4889(00)00005-7. PMID 10722873.
- ^ Warshaw, DM (February 2012). "Tilting and twirling as myosin V steps along actin filaments as detected by fluorescence polarization". The Journal of General Physiology. 139 (2): 97–100. doi:10.1085/jgp.201210769. PMC 3269787. PMID 22291143.
- ^ Lecuona E, Minin A, Trejo HE, Chen J, Comellas AP, Sun H, Grillo D, Nekrasova OE, Welch LC, Szleifer I, Gelfand VI, Sznajder JI (November 2009). "Myosin-Va restrains the trafficking of Na+/K+-ATPase-containing vesicles in alveolar epithelial cells". Journal of Cell Science. 122 (Pt 21): 3915–22. doi:10.1242/jcs.046953. PMC 2773192. PMID 19808891.
- ^ Hammer JA, Sellers JR (December 2011). "Walking to work: roles for class V myosins as cargo transporters". Nature Reviews. Molecular Cell Biology. 13 (1): 13–26. doi:10.1038/nrm3248. PMID 22146746. S2CID 11853457.
- ^ Zimmermann D, Santos A, Kovar DR, Rock RS (August 2015). "Actin age orchestrates myosin-5 and myosin-6 run lengths". Current Biology. 25 (15): 2057–62. doi:10.1016/j.cub.2015.06.033. PMC 4556227. PMID 26190073.
- ^ Ménétrey J, Llinas P, Mukherjea M, Sweeney HL, Houdusse A (October 2007). "The structural basis for the large powerstroke of myosin VI". Cell. 131 (2): 300–8. doi:10.1016/j.cell.2007.08.027. PMID 17956731. S2CID 14102005.
- ^ Buss F, Kendrick-Jones J (April 2008). "How are the cellular functions of myosin VI regulated within the cell?". Biochemical and Biophysical Research Communications. 369 (1): 165–75. doi:10.1016/j.bbrc.2007.11.150. PMC 2635068. PMID 18068125.
- ^ Buss F, Spudich G, Kendrick-Jones J (2004). "Myosin VI: cellular functions and motor properties". Annual Review of Cell and Developmental Biology. 20: 649–76. doi:10.1146/annurev.cellbio.20.012103.094243. PMC 1693462. PMID 15473855.
- ^ Li J, Chen Y, Deng Y, Unarta IC, Lu Q, Huang X, Zhang M (April 2017). "Ca2+-Induced Rigidity Change of the Myosin VIIa IQ Motif-Single α Helix Lever Arm Extension". Structure. 25 (4): 579–591.e4. doi:10.1016/j.str.2017.02.002. PMID 28262393.
- ^ Schliwa M, ed. (2003). Molecular Motors. Wiley-VCH. pp. 516, 518. ISBN 978-3-527-30594-0.
- ^ Reddy AS, Day IS (2001). "Analysis of the myosins encoded in the recently completed Arabidopsis thaliana genome sequence". Genome Biology. 2 (7): RESEARCH0024. doi:10.1186/gb-2001-2-7-research0024. PMC 55321. PMID 11516337.
- ^ Baluska F, Cvrcková F, Kendrick-Jones J, Volkmann D (May 2001). "Sink plasmodesmata as gateways for phloem unloading. Myosin VIII and calreticulin as molecular determinants of sink strength?". Plant Physiology. 126 (1): 39–46. doi:10.1104/pp.126.1.39. PMC 1540107. PMID 11351069.
- ^ Reichelt S, Knight AE, Hodge TP, Baluska F, Samaj J, Volkmann D, Kendrick-Jones J (September 1999). "Characterization of the unconventional myosin VIII in plant cells and its localization at the post-cytokinetic cell wall". The Plant Journal. 19 (5): 555–67. doi:10.1046/j.1365-313X.1999.00553.x. PMID 10504577.
- ^ Inoue A, Saito J, Ikebe R, Ikebe M (April 2002). "Myosin IXb is a single-headed minus-end-directed processive motor". Nature Cell Biology. 4 (4): 302–6. doi:10.1038/ncb774. PMID 11901422. S2CID 12158370.
- ^ O'Connell CB, Mooseker MS (February 2003). "Native Myosin-IXb is a plus-, not a minus-end-directed motor". Nature Cell Biology. 5 (2): 171–2. doi:10.1038/ncb924. PMID 12563277. S2CID 687308.
- ^ Lu Q, Ye F, Wei Z, Wen Z, Zhang M (October 2012). "Antiparallel coiled-coil-mediated dimerization of myosin X". Proceedings of the National Academy of Sciences of the United States of America. 109 (43): 17388–93. doi:10.1073/pnas.1208642109. PMC 3491486. PMID 23012428.
- ^ Ropars V, Yang Z, Isabet T, Blanc F, Zhou K, Lin T, Liu X, Hissier P, Samazan F, Amigues B, Yang ED, Park H, Pylypenko O, Cecchini M, Sindelar CV, Sweeney HL, Houdusse A (September 2016). "The myosin X motor is optimized for movement on actin bundles". Nature Communications. 7: 12456. Bibcode:2016NatCo...712456R. doi:10.1038/ncomms12456. PMC 5025751. PMID 27580874.
- ^ Sattarzadeh A, Krahmer J, Germain AD, Hanson MR (November 2009). "A myosin XI tail domain homologous to the yeast myosin vacuole-binding domain interacts with plastids and stromules in Nicotiana benthamiana". Molecular Plant. 2 (6): 1351–8. doi:10.1093/mp/ssp094. PMID 19995734.
- ^ Peremyslov VV, Prokhnevsky AI, Avisar D, Dolja VV (March 2008). "Two class XI myosins function in organelle trafficking and root hair development in Arabidopsis". Plant Physiology. 146 (3): 1109–16. doi:10.1104/pp.107.113654. PMC 2259062. PMID 18178669.
- ^ Tominaga M, Kojima H, Yokota E, Orii H, Nakamori R, Katayama E, et al. (March 2003). "Higher plant myosin XI moves processively on actin with 35 nm steps at high velocity". The EMBO Journal. 22 (6): 1263–72. doi:10.1093/emboj/cdg130. PMC 151065. PMID 12628919.
- ^ Delbac F, Sänger A, Neuhaus EM, Stratmann R, Ajioka JW, Toursel C, Herm-Götz A, Tomavo S, Soldati T, Soldati D (November 2001). "Toxoplasma gondii myosins B/C: one gene, two tails, two localizations, and a role in parasite division". The Journal of Cell Biology. 155 (4): 613–23. doi:10.1083/jcb.200012116. PMC 2198869. PMID 11706051.
- ^ Hettmann C, Herm A, Geiter A, Frank B, Schwarz E, Soldati T, Soldati D (April 2000). "A dibasic motif in the tail of a class XIV apicomplexan myosin is an essential determinant of plasma membrane localization". Molecular Biology of the Cell. 11 (4): 1385–400. doi:10.1091/mbc.11.4.1385. PMC 14854. PMID 10749937.
- ^ "MYO19 - Unconventional myosin-XIX - Homo sapiens (Human) - MYO19 gene & protein". www.uniprot.org. Retrieved 21 April 2022.
- ^ a b Winkelman L (1976). "Comparative studies of paramyosins". Comparative Biochemistry and Physiology B. 55 (3): 391–7. doi:10.1016/0305-0491(76)90310-2. PMID 987889.
- ^ Twarog BM (October 1976). "Aspects of smooth muscle function in molluscan catch muscle". Physiological Reviews. 56 (4): 829–38. doi:10.1152/physrev.1976.56.4.829. PMID 185635.
추가 정보
- Gavin RH (2001). "Myosins in protists". A Survey of Cell Biology. International Review of Cytology. Vol. 206. pp. 97–134. doi:10.1016/S0074-7696(01)06020-X. ISBN 978-0-12-364610-1. PMID 11407764.
- Mooseker MS, Cheney RE (1995). "Unconventional myosins". Annual Review of Cell and Developmental Biology. 11: 633–75. doi:10.1146/annurev.cb.11.110195.003221. PMID 8689571.
- Sellers JR (March 2000). "Myosins: a diverse superfamily". Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1496 (1): 3–22. doi:10.1016/S0167-4889(00)00005-7. PMID 10722873.
- Soldati T, Geissler H, Schwarz EC (1999). "How many is enough? Exploring the myosin repertoire in the model eukaryote Dictyostelium discoideum". Cell Biochemistry and Biophysics. 30 (3): 389–411. doi:10.1007/BF02738121. PMID 10403058. S2CID 13319819.
- 세포의 분자생물학.알버트, 존슨, 루이스, 래프, 로버츠, 월터.제4판949–952.
기타 이미지
외부 링크
- MBInfo – Myosin Isoforms
- MBInfo – Myosin 파워 스트로크
- 미오신 비디오 움직이는 미오신 운동 단백질의 비디오.
- 미국 국립 의학 도서관 의학 주제 제목(MeSH)의 미오신
- 묘신 홈페이지
- http://cellimages.ascb.org/cdm4/item_viewer.php?CISOROOT=/p4041coll12&CISOPTR=101&CISOBOX=1&REC[dead link]=2 움직이는 미오신 운동단백질 애니메이션
- EC 3.6.4.1
- EM Data Bank(EMDB)의 미오신 3D 고분자 구조