빈슐린
Vinculin| VCL | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| 식별자 | |||||||||||||||||||||||||
| 별칭 | VCL, CMD1W, CMH15, HEL114, MV, Mvinculin | ||||||||||||||||||||||||
| 외부 ID | OMIM: 193065 MGI: 98927 HomoloGene: 7594 GeneCard: VCL | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| 직교체 | |||||||||||||||||||||||||
| 종 | 인간 | 마우스 | |||||||||||||||||||||||
| 엔트레스 | |||||||||||||||||||||||||
| 앙상블 | |||||||||||||||||||||||||
| 유니프로트 | |||||||||||||||||||||||||
| RefSeq(mRNA) | |||||||||||||||||||||||||
| RefSeq(단백질) | |||||||||||||||||||||||||
| 위치(UCSC) | Chr 10: 74 – 74.12Mb | Cr 14: 20.93 – 21.03Mb | |||||||||||||||||||||||
| PubMed 검색 | [3] | [4] | |||||||||||||||||||||||
| 위키다타 | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
포유류 세포에서 빈쿨린은 액틴 시토스켈레톤과 통합 접착 분자의 연결에 관여하는 초점 접착 플라크의 막-시토스켈레톤 단백질이다. 빈쿨린은 세포와 세포 매트릭스 접합부와 연관된 세포골격계 단백질로, 이 단백질은 F-actin을 막에 고정시키는 데 관여하는 여러 상호작용 단백질 중 하나로 기능하는 것으로 생각된다.
베니 가이거와[5] 키스 버리지가 독자적으로 발견한 그것의 순서는 비슷한 기능을 하는 α-카테닌과 20%~30% 유사하다.[6]
탈린이나 α-actinin에 교대로 바인딩하면 빈슐린의 모양과 그 결과 바인딩 특성이 변경된다. 빈슐린 유전자는 단일 사본으로 발생하며, 빈슐린 유전자가 없을 때 기능을 인수할 수 있는 가까운 친척이 아닌 것으로 보인다. 스플라이스 변종 메타빈쿨린(아래 참조)도 이질화 및 종속적인 방식으로 작동하기 위해 빈쿨린이 필요하다.
구조
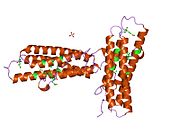
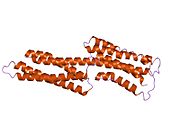
빈슐린은 1066개의 아미노산을 가진 117-kDa 세포골격계 단백질이다. 단백질은 산성 N단자 영역과 프롤라인이 풍부한 중간 세그먼트로 분리된 기본 C단자 영역을 포함한다. 빈쿨린은 탈린과 α-actinin의 결합 부위는 물론 티로신 인산화 부위가 포함된 구상체 헤드 영역으로 구성되며, 꼬리 부위는 F-actin, 팍실린, 지질의 결합 부위가 포함되어 있다.[7]
본질적으로 아미노산 N단자 헤드가 835개 있는데, 이 헤드는 네 개의 영역으로 나뉜다. 이것은 링커 영역과 함께 C-단자 꼬리와 연결된다.
최근 발견된 3D 구조는 이 단백질이 어떻게 모양을 변형해 다양한 기능을 수행하는지를 조명한다. 예를 들어 빈슐린은 단순히 세포의 형태를 활성에서 비활성 상태로 변경함으로써 세포의 운동성을 조절할 수 있다. '비활성' 상태일 때 빈쿨린의 순응은 머리 영역과 꼬리 영역 사이의 상호 작용으로 특징지어진다. 그리고 탈린이 결합을 유발하는 경우와 같이 '활성' 형태로 변환할 때 꼬리와 머리 사이의 근육 내 상호작용이 단절된다. 즉, 탈린의 α-헬리케스의 결합부위(VBS)가 빈슐린 헤드 영역의 헬리컬 번들 구조와 결합하면 '헬리컬 번들 변환'이 시작되어 α-헬리케스(α1-α-4)의 재편성으로 이어져 완전히 새로운 5헬리컬 번들 구조가 된다. 이 기능은 또한 암세포까지 확장되며, 암이 신체의 다른 부분으로 전이되고 확산되는 것을 조절한다.
메커니즘 및 기능
세포 확산과 움직임은 세포 표면 통합 수용체를 세포외 매트릭스 접착 분자에 결합하는 과정을 통해 발생한다. 빈슐린은 초점 접착 및 부속물 접합과 연관되어 있는데, 이것은 외부 매체, 플라즈마 멤브레인, 액틴 사이토스켈레톤 사이의 액틴 필라멘트와 교차링커를 핵화하는 복합체다.[8] 초점 접착제의 콤플렉스는 혈장 막의 세포내 표면에 빈슐린, α-actinin, 팍실린, 탈린 등의 여러 단백질로 구성되어 있다.
좀 더 구체적인 용어로 빈쿨린의 아미노-터미누스는 탈린에 결합하고, 이는 다시 β-integrins에 결합하며, 카복시-터미누스는 액틴, 인광섬유, 팍실린-형성 호모디머에 결합한다. 탈린과 액틴에 대한 빈슐린의 결합은 폴리인스포이노시티드(polyphosphoinsitide)에 의해 규제되고 산성인산화인산화물질에 의해 억제된다. 이 단지는 액틴 필라멘트를 막에 고정시키는 역할을 하므로 초점 접착제 내의 탈린에 대한 힘을 강화하는데 도움이 된다.[9]
빈슐린의 상실은 다양한 세포 기능에 영향을 미친다; 그것은 복합체의 형성을 방해하고 세포 유착과 확산을 방지한다. 단백질의 부재는 스트레스 섬유 형성 감소, 초점 접착 감소, 라멜리포디아 확장 억제와 함께 세포 확산의 감소를 나타낸다.[7] 빈슐린이 부족한 세포는 더 느리게 발전하는 성장 원추형, 야생형보다 안정성이 떨어지는 필로포디아, 라멜리포디아 등이 있는 것으로 나타났다. 연구에 따르면 빈슐린이 부족하면 초점 접착 어셈블리를 억제하고 액틴 중합화를 방지하여 세포 유착을 감소시킬 수 있다고 가정했다. 한편 빈슐린 과다압착은 집적 결합현장의 초점접착단지로 세포골격계 단백질의 모집을 촉진하여 접착력을 회복하고 확산될 수 있다.[9] 초점 접착에서 시토스켈레톤에 대한 통합체와 상호작용하는 빈쿨린의 능력은 시토스켈레톤 역학, 세포 확산, 라멜리포디아 형성의 제어에 중요한 것으로 보인다. 따라서 빈슐린은 초점 접착 구조와 기능을 조절하는 능력을 바탕으로 형상 제어에 핵심적인 역할을 하는 것으로 보인다.
활성화
빈슐린은 활성 상태와 비활성 상태 사이에 평형 상태에 있다.[10] 지정된 파트너에 바인딩할 때 활성 상태가 트리거됨. 이러한 변화는 빈슐린이 결합되는 초점 접착 지점과 상호작용할 때 발생한다. 빈슐린이 비활성 형태로 있을 때 단백질은 활성 상태에서 묶인 초점 접착 지점과 달리 세포질에 지정된 상태로 유지된다. 이 분자 탈린은 초점 콤플렉스에 존재하기 때문에 빈슐린 활성화의 주요 시작점이라고 생각된다. 빈쿨린의 결합모델은 α-액티닌 또는 탈린이 단독으로 또는 PIP2 또는 액틴의 도움으로 빈쿨린을 활성화할 수 있다고 명시한다. 이 활성화는 비활성 빈슐린 내에서 헤드테일 연결부의 분리에 의해 이루어진다.[10]
바인딩 사이트
| VBS | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 탈린의 빈슐린 결합 사이트 3과 함께 복합된 인간 빈슐린 헤드(1-258) (1944-1994) | |||||||||
| 식별자 | |||||||||
| 기호 | VBS | ||||||||
| Pfam | PF08913 | ||||||||
| 인터프로 | IPR015009 | ||||||||
| |||||||||
빈슐린 결합 부위는 주로 탈린과 탈린 유사 분자에서 발견되며, 탈린에 빈슐린을 결합할 수 있고, 통합 매개 세포 매트릭스 결합을 안정화한다. 탈린은 차례로 액틴 시토스켈레톤과 통합을 연결한다. 빈쿨린 결합 현장의 합의 순서는 LxxAAxVAxxVxxVxLIxA이며, 이차 구조 예측은 4암페타식 나선이다. VBS를 정의하는 소수성 잔류물은 그 자체로 '마스킹(masked)'되며 탈린 막대를 구성하는 일련의 헬리컬 다발의 핵심에 묻힌다.[11]
스플라이스 변형
잘 구분된 (계약형) 상태의 부드러운 근육과 골격근(그리고 아마도 심장근육에서 더 낮은 정도까지)은 3' 부호화 부위에서 엑손 하나를 추가로 운반하는 스플라이스 변형인 3' 부위의 스플라이스 변형인 즉, 약 150KD 분자 중량의 더 긴 이소폼 메타빈슐린(meta VCL)을 부호화한다.1980년대 이후로 [12]알려진 엑손 추가의 번역은 C-단자 꼬리 영역 내의 나선형 I과 II 사이에 68-아미노산 79-아미노산이 풍부한 삽입을 유발한다. 삽입 영역 내의 돌연변이는 유전적 특발성 확장 심장병증과 관련이 있다.[13]
메타빈쿨린의 삽입 길이는 포유류의 경우 68 AA, 개구리의 경우 79이다.[14] 돼지, 사람, 닭, 개구리의 메타빈슐린 시퀀스를 비교한 결과, 인서트가 양분적이라는 것을 발견했다: 첫 번째 부분 변수와 두 번째 부분 보존율이 높은 부분이었다. 두 빈쿨린 이소성형은 모두 부드러운 근육의 촘촘한 격자, 심장근육의 중간 디스크, 골격근의 코스타임과 같은 근육 접착제 구조에서 공동 국부화한다.[15] 메타빈쿨린 꼬리 영역은 빈쿨린 꼬리에 비해 머리에 대한 친화력이 낮다. 메타빈쿨린의 경우 68-아미노산 삽입물의 음전하로 인해 꼬리 영역의 C-단자 소수성 헤어핀 루프의 풀링이 손상되어 메타빈쿨린 분자를 완전히 활성화하기 위해서는 빈쿨린의 인광 활성 정규 이소형이 필요하다.
상호작용
Vinculin은 다음과 상호 작용하는 것으로 나타났다.
IBS 증상으로 제시된 '소내장 박테리아 과성장'의 경우 내장에 필요한 빈슐린 기능에 영향을 미치는 항CdtB 항체가 확인됐다.[22]
참조
- ^ a b c GRCh38: 앙상블 릴리스 89: ENSG00000035403 - 앙상블, 2017년 5월
- ^ a b c GRCm38: 앙상블 릴리스 89: ENSMUSG000021823 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Geiger B (September 1979). "A 130K protein from chicken gizzard: its localization at the termini of microfilament bundles in cultured chicken cells". Cell. 18 (1): 193–205. doi:10.1016/0092-8674(79)90368-4. PMID 574428. S2CID 33153559.
- ^ Burridge K, Feramisco JR (March 1980). "Microinjection and localization of a 130K protein in living fibroblasts: a relationship to actin and fibronectin". Cell. 19 (3): 587–95. doi:10.1016/s0092-8674(80)80035-3. PMID 6988083. S2CID 43087259.
- ^ a b Goldmann WH, Ingber DE (January 2002). "Intact vinculin protein is required for control of cell shape, cell mechanics, and rac-dependent lamellipodia formation". Biochemical and Biophysical Research Communications. 290 (2): 749–55. doi:10.1006/bbrc.2001.6243. PMID 11785963.
- ^ Xu W, Baribault H, Adamson ED (January 1998). "Vinculin knockout results in heart and brain defects during embryonic development". Development. 125 (2): 327–37. doi:10.1242/dev.125.2.327. PMID 9486805.
- ^ a b Ezzell RM, Goldmann WH, Wang N, Parashurama N, Parasharama N, Ingber DE (February 1997). "Vinculin promotes cell spreading by mechanically coupling integrins to the cytoskeleton". Experimental Cell Research. 231 (1): 14–26. doi:10.1006/excr.1996.3451. PMID 9056408.
- ^ a b Borgon RA, Vonrhein C, Bricogne G, Bois PR, Izard T (July 2004). "Crystal structure of human vinculin". Structure. 12 (7): 1189–97. doi:10.1016/j.str.2004.05.009. PMID 15242595.
- ^ Gingras AR, Vogel KP, Steinhoff HJ, Ziegler WH, Patel B, Emsley J, Critchley DR, Roberts GC, Barsukov IL (February 2006). "Structural and dynamic characterization of a vinculin binding site in the talin rod". Biochemistry. 45 (6): 1805–17. doi:10.1021/bi052136l. PMID 16460027.
- ^ Feramisco JR, Smart JE, Burridge K, Helfman DM, Thomas GP (September 1982). "Co-existence of vinculin and a vinculin-like protein of higher molecular weight in smooth muscle". The Journal of Biological Chemistry. 257 (18): 11024–31. doi:10.1016/S0021-9258(18)33927-9. PMID 6809764.
- ^ Witt S, Zieseniss A, Fock U, Jockusch BM, Illenberger S (July 2004). "Comparative biochemical analysis suggests that vinculin and metavinculin cooperate in muscular adhesion sites". The Journal of Biological Chemistry. 279 (30): 31533–43. doi:10.1074/jbc.M314245200. PMID 15159399.
- ^ Strasser P, Gimona M, Herzog M, Geiger B, Small JV (February 1993). "Variable and constant regions in the C-terminus of vinculin and metavinculin. Cloning and expression of fragments in E. coli". FEBS Letters. 317 (3): 189–94. doi:10.1016/0014-5793(93)81274-4. PMID 8425604. S2CID 39567003.
- ^ Belkin AM, Ornatsky OI, Glukhova MA, Koteliansky VE (August 1988). "Immunolocalization of meta-vinculin in human smooth and cardiac muscles". The Journal of Cell Biology. 107 (2): 545–53. doi:10.1083/jcb.107.2.545. PMC 2115213. PMID 3138246.
- ^ Hazan RB, Kang L, Roe S, Borgen PI, Rimm DL (December 1997). "Vinculin is associated with the E-cadherin adhesion complex". The Journal of Biological Chemistry. 272 (51): 32448–53. doi:10.1074/jbc.272.51.32448. PMID 9405455.
- ^ Hazan RB, Norton L (April 1998). "The epidermal growth factor receptor modulates the interaction of E-cadherin with the actin cytoskeleton". The Journal of Biological Chemistry. 273 (15): 9078–84. doi:10.1074/jbc.273.15.9078. PMID 9535896.
- ^ Turner CE, Brown MC, Perrotta JA, Riedy MC, Nikolopoulos SN, McDonald AR, Bagrodia S, Thomas S, Leventhal PS (May 1999). "Paxillin LD4 motif binds PAK and PIX through a novel 95-kD ankyrin repeat, ARF-GAP protein: A role in cytoskeletal remodeling". The Journal of Cell Biology. 145 (4): 851–63. doi:10.1083/jcb.145.4.851. PMC 2133183. PMID 10330411.
- ^ Mazaki Y, Hashimoto S, Sabe H (March 1997). "Monocyte cells and cancer cells express novel paxillin isoforms with different binding properties to focal adhesion proteins". The Journal of Biological Chemistry. 272 (11): 7437–44. doi:10.1074/jbc.272.11.7437. PMID 9054445.
- ^ Brown MC, Perrotta JA, Turner CE (November 1996). "Identification of LIM3 as the principal determinant of paxillin focal adhesion localization and characterization of a novel motif on paxillin directing vinculin and focal adhesion kinase binding". The Journal of Cell Biology. 135 (4): 1109–23. doi:10.1083/jcb.135.4.1109. PMC 2133378. PMID 8922390.
- ^ Mandai K, Nakanishi H, Satoh A, Takahashi K, Satoh K, Nishioka H, Mizoguchi A, Takai Y (March 1999). "Ponsin/SH3P12: an l-afadin- and vinculin-binding protein localized at cell-cell and cell-matrix adherens junctions". The Journal of Cell Biology. 144 (5): 1001–17. doi:10.1083/jcb.144.5.1001. PMC 2148189. PMID 10085297.
- ^ Pimentel M, Morales W, Pokkunuri V, Brikos C, Kim SM, Kim SE, Triantafyllou K, Weitsman S, Marsh Z, Marsh E, Chua KS, Srinivasan S, Barlow GM, Chang C (May 2015). "Autoimmunity Links Vinculin to the Pathophysiology of Chronic Functional Bowel Changes Following Campylobacter jejuni Infection in a Rat Model". Digestive Diseases and Sciences. 60 (5): 1195–205. doi:10.1007/s10620-014-3435-5. PMID 25424202. S2CID 22408999.
추가 읽기
- Critchley DR (November 2004). "Cytoskeletal proteins talin and vinculin in integrin-mediated adhesion". Biochemical Society Transactions. 32 (Pt 5): 831–6. doi:10.1042/BST0320831. PMID 15494027.
- Koteliansky VE, Ogryzko EP, Zhidkova NI, Weller PA, Critchley DR, Vancompernolle K, Vandekerckhove J, Strasser P, Way M, Gimona M (March 1992). "An additional exon in the human vinculin gene specifically encodes meta-vinculin-specific difference peptide. Cross-species comparison reveals variable and conserved motifs in the meta-vinculin insert". European Journal of Biochemistry. 204 (2): 767–72. doi:10.1111/j.1432-1033.1992.tb16692.x. PMID 1339348.
- Mulligan LM, Gardner E, Telenius H, Ponder BA (August 1992). "Complementary physical and genetic techniques map the vinculin (VCL) gene on chromosome 10q". Genomics. 13 (4): 1347–9. doi:10.1016/0888-7543(92)90066-2. PMID 1505973.
- Weller PA, Ogryzko EP, Corben EB, Zhidkova NI, Patel B, Price GJ, Spurr NK, Koteliansky VE, Critchley DR (August 1990). "Complete sequence of human vinculin and assignment of the gene to chromosome 10". Proceedings of the National Academy of Sciences of the United States of America. 87 (15): 5667–71. doi:10.1073/pnas.87.15.5667. PMC 54388. PMID 2116004.
- Turner CE, Burridge K (June 1989). "Detection of metavinculin in human platelets using a modified talin overlay assay". European Journal of Cell Biology. 49 (1): 202–6. PMID 2503380.
- Turner CE, Miller JT (June 1994). "Primary sequence of paxillin contains putative SH2 and SH3 domain binding motifs and multiple LIM domains: identification of a vinculin and pp125Fak-binding region". Journal of Cell Science. 107 ( Pt 6) (6): 1583–91. doi:10.1242/jcs.107.6.1583. PMID 7525621.
- Salgia R, Li JL, Lo SH, Brunkhorst B, Kansas GS, Sobhany ES, Sun Y, Pisick E, Hallek M, Ernst T (March 1995). "Molecular cloning of human paxillin, a focal adhesion protein phosphorylated by P210BCR/ABL". The Journal of Biological Chemistry. 270 (10): 5039–47. doi:10.1074/jbc.270.10.5039. PMID 7534286.
- Adams MD, Kerlavage AR, Fleischmann RD, Fuldner RA, Bult CJ, Lee NH, Kirkness EF, Weinstock KG, Gocayne JD, White O (September 1995). "Initial assessment of human gene diversity and expression patterns based upon 83 million nucleotides of cDNA sequence" (PDF). Nature. 377 (6547 Suppl): 3–174. PMID 7566098.
- Hagmann J (April 1993). "Pattern formation and handedness in the cytoskeleton of human platelets". Proceedings of the National Academy of Sciences of the United States of America. 90 (8): 3280–3. doi:10.1073/pnas.90.8.3280. PMC 46283. PMID 7682697.
- Johnson RP, Craig SW (January 1995). "F-actin binding site masked by the intramolecular association of vinculin head and tail domains". Nature. 373 (6511): 261–4. doi:10.1038/373261a0. PMID 7816144. S2CID 4369795.
- Hirsch MS, Law LY, Trinkaus-Randall V, Svoboda KK (1995). "The intracellular distribution of vinculin and alpha 2 integrin in epithelial cells and chondrocytes". Scanning. 16 (5): 275–84. doi:10.1002/sca.4950160306. PMID 7994488.
- Fausser JL, Ungewickell E, Ruch JV, Lesot H (October 1993). "Interaction of vinculin with the clathrin heavy chain". Journal of Biochemistry. 114 (4): 498–503. doi:10.1093/oxfordjournals.jbchem.a124206. PMID 8276759.
- Moiseyeva EP, Weller PA, Zhidkova NI, Corben EB, Patel B, Jasinska I, Koteliansky VE, Critchley DR (February 1993). "Organization of the human gene encoding the cytoskeletal protein vinculin and the sequence of the vinculin promoter". The Journal of Biological Chemistry. 268 (6): 4318–25. doi:10.1016/S0021-9258(18)53612-7. PMID 8440716.
- Yoshida M, Westlin WF, Wang N, Ingber DE, Rosenzweig A, Resnick N, Gimbrone MA (April 1996). "Leukocyte adhesion to vascular endothelium induces E-selectin linkage to the actin cytoskeleton". The Journal of Cell Biology. 133 (2): 445–55. doi:10.1083/jcb.133.2.445. PMC 2120789. PMID 8609175.
- Scott GA, Liang H, Cassidy LL (August 1995). "Developmental regulation of focal contact protein expression in human melanocytes". Pigment Cell Research. 8 (4): 221–8. doi:10.1111/j.1600-0749.1995.tb00667.x. PMID 8610074.
- Deroanne CF, Colige AC, Nusgens BV, Lapiere CM (May 1996). "Modulation of expression and assembly of vinculin during in vitro fibrillar collagen-induced angiogenesis and its reversal". Experimental Cell Research. 224 (2): 215–23. doi:10.1006/excr.1996.0131. PMID 8612698.
- Maeda M, Holder E, Lowes B, Valent S, Bies RD (January 1997). "Dilated cardiomyopathy associated with deficiency of the cytoskeletal protein metavinculin". Circulation. 95 (1): 17–20. doi:10.1161/01.cir.95.1.17. PMID 8994410.
- Mazaki Y, Hashimoto S, Sabe H (March 1997). "Monocyte cells and cancer cells express novel paxillin isoforms with different binding properties to focal adhesion proteins". The Journal of Biological Chemistry. 272 (11): 7437–44. doi:10.1074/jbc.272.11.7437. PMID 9054445.
- Hazan RB, Kang L, Roe S, Borgen PI, Rimm DL (December 1997). "Vinculin is associated with the E-cadherin adhesion complex". The Journal of Biological Chemistry. 272 (51): 32448–53. doi:10.1074/jbc.272.51.32448. PMID 9405455.
- Hazan RB, Norton L (April 1998). "The epidermal growth factor receptor modulates the interaction of E-cadherin with the actin cytoskeleton". The Journal of Biological Chemistry. 273 (15): 9078–84. doi:10.1074/jbc.273.15.9078. PMID 9535896.