XIAP
XIAP세포사멸 억제제(X-linked inhibration protectors of apoptosis prote) 3(IAP3) 및 바쿨로바이러스 IAP 반복함유 단백질 4(BIRC4)은 세포사멸을 막는 단백질이다.인간에서 이 단백질(XIAP)은 X염색체에 위치한 XIAP 유전자에 의해 생성된다.[4][5]
XIAP는 단백질의 세포사멸 억제제(IAP)의 일원이다.IAP는 처음에 바쿨로바이러스에서 확인되었지만 XIAP는 포유류에서 발견되는 동질 단백질 중 하나이다.[6]X염색체의 273 염기쌍 사이트에 의해 처음 발견되었기 때문에 그렇게 불린다.[4]이 단백질은 인간의 IAP와 유사한 단백질(hILP)이라고도 불리는데, 이는 인간의 IAPS만큼 보존되지 않기 때문이다: hIAP-1과 hIAP-2.[4][7] XIAP는 현재 확인된 가장 강력한 인간 IAP 단백질이다.[8]
디스커버리
뉴런 사멸 억제제 단백질(NAIP)은 인간에게서 확인된 바쿨로바이러스 IAP에 대한 최초의 호몰로겐이었다.[4]NIAP의 시퀀싱 데이터와 함께, RING 아연 손가락 영역의 유전자 시퀀스가 Xq24-25 현장에서 발견되었다.[4]PCR과 복제를 이용하여 단백질에서 3개의 BIR 도메인과 RING 손가락이 발견되었는데, 이는 X-Linked Inhiberator of Apoptosis Protector로 알려지게 되었다.Xiap의 대본 크기는 9.0kb이며, 개방형 읽기 프레임은 1.8kb이다.[4]Xiap mRNA는 "말초혈구 백혈구"를 제외한 모든 인간 성인과 태아 조직에서 관찰되었다.[4]XIAP 시퀀스는 IAP 계열의 다른 구성원들을 발견하게 했다.
구조
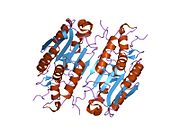
XIAP는 3가지 유형의 구조 요소(도메인)로 구성된다.첫째, 약 70개의 아미노산으로 구성된 BIR(Baculoviral IAP repeat) 도메인이 있으며, 이는 모든 IAP의 특성을 나타낸다.[8]둘째, UBA 도메인이 있어 XIAP가 유비쿼터스티틴에 바인딩할 수 있다.셋째, 아연 결합 도메인, 즉 "카복시-단자 RING 핑거"[7]가 있다.XIAP는 3개의 아미노-단자 BRY 도메인과 1개의 UBA 도메인, 그리고 마지막으로 1개의 RING 도메인으로 특징지어진다.[9]BIR-1과 BIR-2 도메인 사이에는 XIAP/Caspase-7 콤플렉스를 형성하기 위해 캐스파아제 분자와 접촉하는 유일한 요소가 포함된 것으로 생각되는 링커-BIR-2 영역이 있다.[10]XIAP의 전체 길이 형태는 약 114 kDa의 호모디머를 형성한다.[11]
함수
XIAP는 바이러스 감염이나 과도한 캐스퍼스 생산에 의해 유발되는 세포 사멸을 막는다.캐스파아제는 세포의 죽음에 주로 책임이 있는 효소들이다.[7]XIAP는 3, 7, 9번 가스와 결합하여 억제한다.[12]XIAP의 BIR2 도메인은 Caspase 3과 7을 억제하고, BIR3는 Caspase 9에 바인딩하여 억제한다.[8]RING 도메인은 E3 유비퀴틴 리가제 활동을 활용하며 프로테아솜 활동을 통한 분해에 의해 IAP가 자기, 캐스파제-3 또는 캐스파제-7의 유비쿼터스화를 촉매화할 수 있도록 한다.[13]단, RING 핑거에 영향을 미치는 돌연변이는 세포사멸에 유의미한 영향을 주지 않으며, 이는 BIR 영역이 단백질 기능에 충분함을 나타낸다.[7]Caspase-3와 Caspase-7 활동을 억제할 때 XIAP의 BIR2 도메인은 활성 사이트 기질 홈에 결합하여 사멸을 일으킬 수 있는 정상 단백질 기질 접근을 차단한다.[13][14]
캐스파아제는 시토크롬 c에 의해 활성화되는데, 이 c는 미토콘드리아 기능 장애에 의해 시토솔로 방출된다.[7]연구는 XIAP가 시토크롬 c에 직접적으로 영향을 미치지 않는다는 것을 보여준다.[7]
XIAP는 'TNF-α, 파스, 자외선, 유전독성 물질'[7]로 인해 세포사멸을 효과적으로 예방할 수 있기 때문에 다른 인간 IAP와 차별화된다.
XIAP 억제
XIAP는 미토콘드리아에 의해 세포질에 방출되는 두 개의 죽음의 신호 단백질인 디아블로(Smac)와 HTRA2(Omi)에 의해 억제된다.[9]XIAP의 미토콘드리아 단백질이자 음성 조절기인 스맥/디아블로(Smac/DIABROBO)는 XIAP에 결합하고 캐스퍼스에 결합하는 것을 방지하여 사멸을 높일 수 있다.이를 통해 정상적인 캐스파아제 활동을 진행할 수 있다.SMAC/DIABO를 XIAP에 바인딩하고 캐스파아제 릴리즈를 하려면 보존된 테트라피드 모티브가 필요하다.[13]
임상적 유의성
XIAP의 규제 완화는 "암, 신경퇴행 장애, 자가면역성"을 초래할 수 있다.[9]높은 비율의 XIAP는 종양 마커로 기능할 수 있다.[8]폐암 NCI-H460의 발달에서 XIAP의 과다압박은 캐스파제를 억제할 뿐만 아니라 시토크롬 c(Apoptosis)의 활동을 정지시킨다.전립선암 발병 시 XIAP는 전립선 상피에서 과다압축된 4개의 IAP 중 하나로, 효과적인 치료를 위해 모든 IAP를 억제하는 분자가 필요할 수 있음을 나타낸다.[15]"인간에서 드로소필라로 IAP를 보존하는 것"[4]에서 증명되었듯이, 사복제 규제는 매우 중요한 생물학적 기능이다.
XIAP 유전자의 돌연변이는 심각하고 희귀한 형태의 염증성 장질환을 유발할 수 있다.[16]또한 XIAP 유전자의 결함은 X-연계 림프구증후군 타입 2라고 불리는 극히 드문 상태를 초래할 수 있다.[16][17][18]
상호작용
XIAP는 다음과 상호 작용하는 것으로 나타났다.
참조
- ^ a b c GRCm38: 앙상블 릴리스 89: ENSMUSG000025860 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ a b c d e f g h Liston P, Roy N, Tamai K, Lefebvre C, Baird S, Cherton-Horvat G, Farahani R, McLean M, Ikeda JE, MacKenzie A, Korneluk RG (January 1996). "Suppression of apoptosis in mammalian cells by NAIP and a related family of IAP genes". Nature. 379 (6563): 349–53. Bibcode:1996Natur.379..349L. doi:10.1038/379349a0. PMID 8552191. S2CID 4305853.
- ^ Duckett CS, Nava VE, Gedrich RW, Clem RJ, Van Dongen JL, Gilfillan MC, Shiels H, Hardwick JM, Thompson CB (June 1996). "A conserved family of cellular genes related to the baculovirus iap gene and encoding apoptosis inhibitors". The EMBO Journal. 15 (11): 2685–94. doi:10.1002/j.1460-2075.1996.tb00629.x. PMC 450204. PMID 8654366.
- ^ Holcik M, Korneluk RG (July 2000). "Functional characterization of the X-linked inhibitor of apoptosis (XIAP) internal ribosome entry site element: role of La autoantigen in XIAP translation". Molecular and Cellular Biology. 20 (13): 4648–57. doi:10.1128/MCB.20.13.4648-4657.2000. PMC 85872. PMID 10848591.
- ^ a b c d e f g Duckett CS, Li F, Wang Y, Tomaselli KJ, Thompson CB, Armstrong RC (January 1998). "Human IAP-like protein regulates programmed cell death downstream of Bcl-xL and cytochrome c". Molecular and Cellular Biology. 18 (1): 608–15. doi:10.1128/MCB.18.1.608. PMC 121528. PMID 9418907.
- ^ a b c d Deveraux QL, Reed JC (February 1999). "IAP family proteins--suppressors of apoptosis". Genes & Development. 13 (3): 239–52. doi:10.1101/gad.13.3.239. PMID 9990849.
- ^ a b c Wilkinson JC, Cepero E, Boise LH, Duckett CS (August 2004). "Upstream regulatory role for XIAP in receptor-mediated apoptosis". Molecular and Cellular Biology. 24 (16): 7003–14. doi:10.1128/MCB.24.16.7003-7014.2004. PMC 479745. PMID 15282301.
- ^ Huang Y, Park YC, Rich RL, Segal D, Myszka DG, Wu H (March 2001). "Structural basis of caspase inhibition by XIAP: differential roles of the linker versus the BIR domain". Cell. 104 (5): 781–90. doi:10.1016/S0092-8674(01)00273-2. PMID 11257231. S2CID 14019346.
- ^ Polykretis P, Luchinat E, Bonucci A, Giachetti A, Graewert MA, Svergun DI, Banci L (September 2019). "Conformational characterization of full-length X-chromosome-linked inhibitor of apoptosis protein (XIAP) through an integrated approach". IUCrJ. 6 (Pt 5): 948–957. doi:10.1107/S205225251901073X. PMC 6760453. PMID 31576227.
- ^ a b c Deveraux QL, Takahashi R, Salvesen GS, Reed JC (July 1997). "X-linked IAP is a direct inhibitor of cell-death proteases". Nature. 388 (6639): 300–4. Bibcode:1997Natur.388..300D. doi:10.1038/40901. PMID 9230442. S2CID 4395885.
- ^ a b c Gewies A (2003). "Introduction to Apoptosis" (PDF). CellDeath.de. Retrieved 2008-08-12.
- ^ Eckelman BP, Salvesen GS, Scott FL (October 2006). "Human inhibitor of apoptosis proteins: why XIAP is the black sheep of the family". EMBO Reports. 7 (10): 988–94. doi:10.1038/sj.embor.7400795. PMC 1618369. PMID 17016456.
- ^ Watson RW, Fitzpatrick JM (December 2005). "Targeting apoptosis in prostate cancer: focus on caspases and inhibitors of apoptosis proteins". BJU International. 96 Suppl 2: 30–4. doi:10.1111/j.1464-410X.2005.05944.x. PMID 16359436. S2CID 46321121.
- ^ a b Worthey EA, Mayer AN, Syverson GD, Helbling D, Bonacci BB, Decker B, Serpe JM, Dasu T, Tschannen MR, Veith RL, Basehore MJ, Broeckel U, Tomita-Mitchell A, Arca MJ, Casper JT, Margolis DA, Bick DP, Hessner MJ, Routes JM, Verbsky JW, Jacob HJ, Dimmock DP (March 2011). "Making a definitive diagnosis: successful clinical application of whole exome sequencing in a child with intractable inflammatory bowel disease". Genetics in Medicine. 13 (3): 255–62. doi:10.1097/GIM.0b013e3182088158. PMID 21173700. Lay summary – Milwaukee Journal.
{{cite journal}}:Cite는 사용되지 않는 매개 변수를 사용한다.lay-url=(도움말) - ^ "OMIM Entry - # 300635 - LYMPHOPROLIFERATIVE SYNDROME, X-LINKED, 2; XLP2". omim.org. Retrieved 2021-07-17.
- ^ Rigaud S, Fondanèche MC, Lambert N, Pasquier B, Mateo V, Soulas P, et al. (November 2006). "XIAP deficiency in humans causes an X-linked lymphoproliferative syndrome". Nature. 444 (7115): 110–4. Bibcode:2006Natur.444..110R. doi:10.1038/nature05257. PMID 17080092. S2CID 4416976.
- ^ a b Sanna MG, da Silva Correia J, Luo Y, Chuang B, Paulson LM, Nguyen B, Deveraux QL, Ulevitch RJ (August 2002). "ILPIP, a novel anti-apoptotic protein that enhances XIAP-mediated activation of JNK1 and protection against apoptosis". The Journal of Biological Chemistry. 277 (34): 30454–62. doi:10.1074/jbc.M203312200. PMID 12048196.
- ^ a b Riedl SJ, Renatus M, Schwarzenbacher R, Zhou Q, Sun C, Fesik SW, Liddington RC, Salvesen GS (March 2001). "Structural basis for the inhibition of caspase-3 by XIAP". Cell. 104 (5): 791–800. doi:10.1016/S0092-8674(01)00274-4. PMID 11257232. S2CID 17915093.
- ^ a b Roy N, Deveraux QL, Takahashi R, Salvesen GS, Reed JC (December 1997). "The c-IAP-1 and c-IAP-2 proteins are direct inhibitors of specific caspases". The EMBO Journal. 16 (23): 6914–25. doi:10.1093/emboj/16.23.6914. PMC 1170295. PMID 9384571.
- ^ a b Suzuki Y, Nakabayashi Y, Nakata K, Reed JC, Takahashi R (July 2001). "X-linked inhibitor of apoptosis protein (XIAP) inhibits caspase-3 and -7 in distinct modes". The Journal of Biological Chemistry. 276 (29): 27058–63. doi:10.1074/jbc.M102415200. PMID 11359776.
- ^ Suzuki Y, Nakabayashi Y, Takahashi R (July 2001). "Ubiquitin-protein ligase activity of X-linked inhibitor of apoptosis protein promotes proteasomal degradation of caspase-3 and enhances its anti-apoptotic effect in Fas-induced cell death". Proceedings of the National Academy of Sciences of the United States of America. 98 (15): 8662–7. Bibcode:2001PNAS...98.8662S. doi:10.1073/pnas.161506698. PMC 37492. PMID 11447297.
- ^ Silke J, Hawkins CJ, Ekert PG, Chew J, Day CL, Pakusch M, Verhagen AM, Vaux DL (April 2002). "The anti-apoptotic activity of XIAP is retained upon mutation of both the caspase 3- and caspase 9-interacting sites". The Journal of Cell Biology. 157 (1): 115–24. doi:10.1083/jcb.200108085. PMC 2173256. PMID 11927604.
- ^ Rual JF, Venkatesan K, Hao T, Hirozane-Kishikawa T, Dricot A, Li N, Berriz GF, Gibbons FD, Dreze M, Ayivi-Guedehoussou N, Klitgord N, Simon C, Boxem M, Milstein S, Rosenberg J, Goldberg DS, Zhang LV, Wong SL, Franklin G, Li S, Albala JS, Lim J, Fraughton C, Llamosas E, Cevik S, Bex C, Lamesch P, Sikorski RS, Vandenhaute J, Zoghbi HY, Smolyar A, Bosak S, Sequerra R, Doucette-Stamm L, Cusick ME, Hill DE, Roth FP, Vidal M (October 2005). "Towards a proteome-scale map of the human protein-protein interaction network". Nature. 437 (7062): 1173–8. Bibcode:2005Natur.437.1173R. doi:10.1038/nature04209. PMID 16189514. S2CID 4427026.
- ^ a b Davoodi J, Lin L, Kelly J, Liston P, MacKenzie AE (September 2004). "Neuronal apoptosis-inhibitory protein does not interact with Smac and requires ATP to bind caspase-9". The Journal of Biological Chemistry. 279 (39): 40622–8. doi:10.1074/jbc.M405963200. PMID 15280366.
- ^ Deveraux QL, Roy N, Stennicke HR, Van Arsdale T, Zhou Q, Srinivasula SM, Alnemri ES, Salvesen GS, Reed JC (April 1998). "IAPs block apoptotic events induced by caspase-8 and cytochrome c by direct inhibition of distinct caspases". The EMBO Journal. 17 (8): 2215–23. doi:10.1093/emboj/17.8.2215. PMC 1170566. PMID 9545235.
- ^ Richter BW, Mir SS, Eiben LJ, Lewis J, Reffey SB, Frattini A, Tian L, Frank S, Youle RJ, Nelson DL, Notarangelo LD, Vezzoni P, Fearnhead HO, Duckett CS (July 2001). "Molecular cloning of ILP-2, a novel member of the inhibitor of apoptosis protein family". Molecular and Cellular Biology. 21 (13): 4292–301. doi:10.1128/MCB.21.13.4292-4301.2001. PMC 87089. PMID 11390657.
- ^ a b Verhagen AM, Silke J, Ekert PG, Pakusch M, Kaufmann H, Connolly LM, Day CL, Tikoo A, Burke R, Wrobel C, Moritz RL, Simpson RJ, Vaux DL (January 2002). "HtrA2 promotes cell death through its serine protease activity and its ability to antagonize inhibitor of apoptosis proteins". The Journal of Biological Chemistry. 277 (1): 445–54. doi:10.1074/jbc.M109891200. PMID 11604410.
- ^ Hunter AM, Kottachchi D, Lewis J, Duckett CS, Korneluk RG, Liston P (February 2003). "A novel ubiquitin fusion system bypasses the mitochondria and generates biologically active Smac/DIABLO". The Journal of Biological Chemistry. 278 (9): 7494–9. doi:10.1074/jbc.C200695200. PMID 12511567.
- ^ Song Z, Yao X, Wu M (June 2003). "Direct interaction between survivin and Smac/DIABLO is essential for the anti-apoptotic activity of survivin during taxol-induced apoptosis". The Journal of Biological Chemistry. 278 (25): 23130–40. doi:10.1074/jbc.M300957200. PMID 12660240.
- ^ Verhagen AM, Ekert PG, Pakusch M, Silke J, Connolly LM, Reid GE, Moritz RL, Simpson RJ, Vaux DL (July 2000). "Identification of DIABLO, a mammalian protein that promotes apoptosis by binding to and antagonizing IAP proteins". Cell. 102 (1): 43–53. doi:10.1016/S0092-8674(00)00009-X. PMID 10929712. S2CID 3192775.
- ^ Hegde R, Srinivasula SM, Datta P, Madesh M, Wassell R, Zhang Z, Cheong N, Nejmeh J, Fernandes-Alnemri T, Hoshino S, Alnemri ES (October 2003). "The polypeptide chain-releasing factor GSPT1/eRF3 is proteolytically processed into an IAP-binding protein". The Journal of Biological Chemistry. 278 (40): 38699–706. doi:10.1074/jbc.M303179200. PMID 12865429.
- ^ Jordan BW, Dinev D, LeMellay V, Troppmair J, Gotz R, Wixler L, Sendtner M, Ludwig S, Rapp UR (October 2001). "Neurotrophin receptor-interacting mage homologue is an inducible inhibitor of apoptosis protein-interacting protein that augments cell death". The Journal of Biological Chemistry. 276 (43): 39985–9. doi:10.1074/jbc.C100171200. PMID 11546791.
- ^ Winsauer G, Resch U, Hofer-Warbinek R, Schichl YM, de Martin R (November 2008). "XIAP regulates bi-phasic NF-kappaB induction involving physical interaction and ubiquitination of MEKK2". Cellular Signalling. 20 (11): 2107–12. doi:10.1016/j.cellsig.2008.08.004. PMID 18761086.
- ^ Yamaguchi K, Nagai S, Ninomiya-Tsuji J, Nishita M, Tamai K, Irie K, Ueno N, Nishida E, Shibuya H, Matsumoto K (January 1999). "XIAP, a cellular member of the inhibitor of apoptosis protein family, links the receptors to TAB1-TAK1 in the BMP signaling pathway". The EMBO Journal. 18 (1): 179–87. doi:10.1093/emboj/18.1.179. PMC 1171113. PMID 9878061.
- ^ Liston P, Fong WG, Kelly NL, Toji S, Miyazaki T, Conte D, Tamai K, Craig CG, McBurney MW, Korneluk RG (February 2001). "Identification of XAF1 as an antagonist of XIAP anti-Caspase activity". Nature Cell Biology. 3 (2): 128–33. doi:10.1038/35055027. PMID 11175744. S2CID 19731886.
추가 읽기
- Lacasse EC, Kandimalla ER, Winocour P, Sullivan T, Agrawal S, Gillard JW, Durkin J (November 2005). "Application of XIAP antisense to cancer and other proliferative disorders: development of AEG35156/ GEM640". Annals of the New York Academy of Sciences. 1058 (1): 215–34. Bibcode:2005NYASA1058..215L. doi:10.1196/annals.1359.032. PMID 16394139. S2CID 24615666.
- Eckelman BP, Salvesen GS, Scott FL (October 2006). "Human inhibitor of apoptosis proteins: why XIAP is the black sheep of the family". EMBO Reports. 7 (10): 988–94. doi:10.1038/sj.embor.7400795. PMC 1618369. PMID 17016456.