단당류
Monosaccharide단당류(그리스 모노로부터: 싱글, 사카르: 설탕)는 단당류라고도 하며, 탄수화물의 가장 단순한 형태와 가장 기본적인 단위(단백질)이다.[1]일반적인 공식은 CHO
n
2n
n, 즉 [Cn(HO2)n] 또는 {CHO2}n이지만 이 공식(예: 아세트산)에 맞는 모든 분자가 탄수화물인 것은 아니다.[2]그것들은 보통 무색, 수용성, 결정성의 고체들이다.이름(설거)과는 달리 단당류만 단맛이 난다.
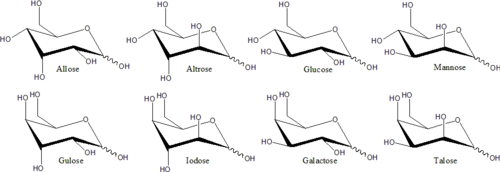
단당류의 예로는 포도당(덱스트로스), 과당(레불로스), 갈락토스 등이 있다.단당류는 이당류(자당류, 유당류 등)와 다당류(셀룰로오스, 전분 등)의 구성물이다.히드록실 그룹을 지지하는 각각의 탄소 원자는 체인의 끝에 있는 것을 제외하고 키랄이다.이것은 동일한 화학식을 가진 많은 이소성 형태를 만들어낸다.예를 들어 갈락토스와 포도당은 둘 다 알도헥소스에 해당하지만 물리적 구조와 화학적 특성이 다르다.
단당 포도당은 신진대사에 중추적인 역할을 하는데, 이때 글리콜리시스(glycolyis)와 구연산(citric acid cycle)을 통해 화학적 에너지를 추출하여 살아있는 유기체에 에너지를 공급한다.몇몇 다른 단당류는 포도당과 다른 단당들을 포함할 수 있다.
구조 및 명명법
거의 예외 없이(예: 디옥시리보스) 단당류는 (CHO2)x라는 화학식을 가지고 있으며, 여기서 일반적으로 x ≥ 3이다.단당류는 그들이 포함하는 탄소 원자의 수 x에 따라 분류될 수 있다: 삼합체(3), 사당체(4), 펜토스(5), 육중체(6), 헵토스(7), 등등.
에너지원으로서 그리고 녹말, 글리코겐, 셀룰로오스의 합성에 사용되는 포도당은 육각이다.리보스와 디옥시리보스(각각 RNA와 DNA에서)는 펜토오스 당이다.헵타의 예로는 케토스, 마노헵툴로스, 세도헵툴로스 등이 있다.탄소가 8개 이상 함유된 단당류는 상당히 불안정하기 때문에 거의 관찰되지 않는다.수용액에서 단당류는 4개 이상의 탄소를 가진 경우 링으로 존재한다.
선형 체인 단당류
단순 단당류는 탄소 골격을 선형 및 분쇄하지 않은 탄소 골격을 가지며, 카보닐(C=O) 기능군은 1개, 나머지 탄소 원자는 히드록실(OH) 그룹이 각각 1개씩이다.따라서 단순한 단당류의 분자구조는 H(CHOH)(nC=O)(CHOH)mH로 표기할 수 있으며, 여기서 n + 1 + m = x; 원소 공식은 CHO이다x2xx.
관례에 따라 탄소 원자는 C=O 그룹에 가장 가까운 끝에서 시작하여 등뼈를 따라 1부터 x까지 번호가 매겨진다.단당류는 탄수화물의 가장 간단한 단위와 가장 단순한 형태의 설탕이다.
카보닐이 위치 1(n 또는 m이 0)에 있는 경우 분자는 포밀 그룹 H(C=O)-로 시작하며 기술적으로 알데히드다.그 경우, 그 화합물은 알도스라고 불린다.그렇지 않으면, 이 분자는 두 개의 탄소 사이에 케톤 그룹인 카보닐 -(C=O)을 가지고 있다. 그리고 나서 정식으로 케톤이며, 케토스라고 불린다.생물학적 관심의 케토스는 보통 위치 2에 카보닐이 있다.
위의 다양한 분류들을 조합할 수 있어 "알도헥소스"와 "케토트리오스"와 같은 이름이 만들어진다.
오픈체인 단당류의 보다 일반적인 명칭은 그리스 접두사를 결합하여 탄소의 수(트리, 테트르, 펜트, 16진수 등)를 알도스의 경우 접미사 "-ose", 케토스의 경우 "-울로스"와 함께 나타낸다.[3]후자의 경우 카보닐이 위치 2에 있지 않으면 그 위치는 숫자 인픽스로 표시된다.그래서 예를 들어 H(C=O)H(CHOH)4H는 펜토오스, H(CHOH)3는 펜툴로스, H(CHOH)는 펜토오스, H(CHOH)=2O(CHOH)2H는 펜토오스(Pent-3-Ulose)이다.
오픈 체인 스테레오아오머
동일한 분자 그래프(동일한 체인 길이와 동일한 카보닐 위치)를 가진 두 개의 단당류는 여전히 분자가 공간 방향으로 다른 구별되는 스테레오아오머일 수 있다.이는 분자가 입체적인 중심, 특히 치랄인 탄소 원자(별도의 4개의 분자 하위 구조에 연결됨)를 포함하는 경우에만 발생한다.이 네 개의 결합은 손놀림으로 구별되는 공간에 두 개의 구성 중 하나를 가질 수 있다.단순한 오픈 체인 단당류에서는 사슬의 첫 번째 원자와 마지막 원자를 제외한 모든 탄소가 키랄이며, (케토스에) 케토 그룹과 함께 탄소를 (케토스에) 넣는다.
예를 들어, 트라이케토스 H(CHOH)(CHO=O)(CHOH)H(글리세론, 다이드록시아세톤)는 입체적인 중심이 없으므로 단일 스테레오소이머로 존재한다.다른 트리오스인 알도스 H(C=O)(CHOH)2H(글리세르알데히드)는 하나의 치랄탄소(중앙 1번, 2번)를 가지고 있으며, 이는 그룹 -H, -OH, -C(OH)H2 및 -(C=O)H에 결합된다.따라서 분자가 서로의 거울상(왼쪽 글러브와 오른쪽 글러브처럼)인 스테레오이오머 2대로 존재한다.4개 이상의 탄소가 있는 단당류는 여러 개의 치랄 탄소를 포함할 수 있으므로 일반적으로 2개 이상의 스테레오 아모이머를 가지고 있다.동일한 도표를 가진 구별되는 스테레오의 수는 2로c 제한된다. 여기서 c는 치랄 탄소의 총 수입니다.
피셔 투영법은 각 치랄탄소의 손길이 잘 명시되도록 1회성 단당체의 골격식을 체계적으로 그리는 방법이다.단순 오픈 체인 단당류의 각 스테레오아소머는 치랄 수산화물(치랄 카본에 부착된 히드록실)의 피셔 다이어그램에서 위치(오른쪽 또는 왼쪽)로 식별할 수 있다.
대부분의 스테레오이오머는 그 자체로 치랄이다.피셔 투영에서 두 개의 미러-이미지 이소머는 모든 치랄 수산화기의 위치를 오른쪽에서 왼쪽으로 반전시켜 다르게 한다.미러-이미지 이소머는 비-치랄 환경에서 화학적으로 동일하지만, 일반적으로 자연에서 일어나는 생화학적 특성과 발생이 매우 다르다.
대부분의 스테레오이오머는 거울-이미지 형태로 쌍으로 배열할 수 있지만, 치알 중심은 있지만 거울 이미지와 동일한 비치랄 스테레오이오머도 있다.이는 분자 그래프가 3-케토펜토스 H(CHOH)(2CO)(CHOH)2H에서와 같이 대칭적일 때마다 발생하며, 두 반쪽은 서로 거울상이다.그 경우에 미러링은 반 바퀴 회전과 같다.이 때문에 분자에는 치랄탄소가 2개 들어 있음에도 불구하고 뚜렷한 3케토펜토스 스테레오이오머는 3개밖에 없다.
서로 거울 이미지가 아닌 구별되는 스테레오이오모메터는 보통 비-치랄 환경에서도 화학적 성질이 다르다.따라서 각 미러 쌍과 비-치랄 스테레오아소머에는 특정 단당류 이름이 부여될 수 있다.예를 들어, 16개의 뚜렷한 알도헥소 스테레오아오머가 있지만, "글루코스"라는 이름은 거울-이미지 알도헥소스의 특정한 쌍을 의미한다.피셔 투영에서, 두 개의 포도당 이소머 중 하나는 C3의 왼쪽과 C4와 C5의 오른쪽에서 히드록실(hydroxyl)을 가지고 있고, 다른 이소머는 반대 패턴을 가지고 있다.이 특정한 단당류 이름들은 포도당의 경우 "글루"와 같은 전통적인 세 글자의 약어를 가지고 있다.
일반적으로 비대칭 탄소가 n개인 단당류는 2개의n 입체체를 가지고 있다.알도스 단당류의 오픈 체인 스테레오마이저 수는 같은 길이의 케토스 단당보다 1개 더 많다.모든 케토스는 2개의(n−3) 스테레오이오머를 가질 것이다. 여기서 n > 2는 탄소의 수이다.모든 알도스는 2개의(n−2) 스테레오이오머를 가질 것이다. 여기서 n > 2는 탄소의 수입니다.이를 비대칭 또는 키랄 탄소 원자에 -OH 및 -H 그룹의 배열이 다른 에피머라고도 한다(이것은 카보닐 기능 그룹을 가진 탄화수소에는 적용되지 않는다.
단당류 구성
많은 치랄 분자와 마찬가지로 글리세랄알데히드의 두 스테레오이오머는 용액에서도 그것을 통과할 때 선형 편광의 양극화 방향을 점차 회전시킬 것이다.두 개의 스테레오이오머는 회전의식에 따라 접두사 D-와 L-로 식별된다: D-글리세알데히드는 덱스트로토토리얼(양극축은 시계방향으로 회전)인 반면 L-글리세알데히드는 레보토리얼(시계 반대방향으로 회전)이다.
D- 접두사와 L- 접두사는 또한 다른 단당류와 함께 사용되어 서로 거울상인 두 개의 특정한 스테레오이오머를 구별한다.이를 위해 C=O군에서 가장 멀리 떨어져 있는 치랄탄소를 고려한다.그것의 4개의 결합은 -H, -OH, -C(OH)H와 나머지 분자에 연결되어야 한다.만약 분자가 D-글리세알데히드의 C2에 있는 아날로그 그룹의 방향과 일치하도록 우주에서 회전할 수 있다면, 이소체는 D- 접두사를 받는다.그렇지 않으면 L-접두사를 받는다.
Fischer 투영에서 D-와 L- 접두사는 탄소 원자의 구성을 아래에서 두 번째로 지정한다. 하이드록실(hydroxyl)은 오른쪽에, L-(왼쪽)은 왼쪽에 있다.
D-와 L- 접두사는 모든 치랄 중심에서 배열의 결합 효과인 편광의 회전 방향을 나타내지 않는다는 점에 유의한다.그러나 두 개의 항산화제는 항상 같은 양만큼 빛을 반대 방향으로 회전시킨다.D/L 시스템을 참조하십시오.
단당류의 사이클화(hemiacetal 형성
단당류는 종종 카보닐 그룹과 동일한 분자의 히드록실 중 하나 사이의 핵포함 반응을 통해 아크로순환(오픈 체인) 형태에서 순환형으로 전환된다.그 반응은 하나의 결합 산소 원자에 의해 닫힌 탄소 원자의 고리를 만들어낸다.결과 분자는 선형 형태가 알도스인지 케토스인지에 따라 헤미아세트 또는 헤미칼 그룹을 가진다.반응이 쉽게 역전되어 원래의 오픈 체인 형태를 양보한다.
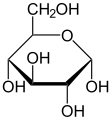
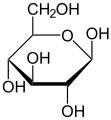
이러한 순환형식에서 고리에는 보통 대여섯 개의 원자가 있다.이러한 형태는 각각 후란과 피란이라고 불리는데, 이는 동일한 탄소-산소 고리를 가진 가장 단순한 화합물인 후란과 유사하다(이 두 분자의 이중 결합은 부족하지만).예를 들어, 알도헥소오스 포도당은 탄소 1의 알데히드 그룹과 탄소 4의 히드록실 사이에 헤미아세트 연계를 형성하여 글루코푸라오스라고 불리는 5-엠베드 링으로 분자를 산출할 수 있다.같은 반응이 탄소 1과 5 사이에 일어나 글루코피라노스라고 불리는 6엠베드 링으로 분자를 형성할 수 있다.거의 마주치지 않는 7원자 고리(옥세판과 동일)의 주기적인 형태를 헵토스라고 한다.
많은 단당류( 포도당 포함)의 경우, 고형 상태와 용액에서 순환이 우세하게 형성되므로, 일반적으로 동일한 이름이 오픈 체인 및 클로즈 체인 이소머에 사용된다.따라서 예를 들어, "글루코스"라는 용어는 글루코푸라노스, 글루코피라노스, 오픈체인 형태 또는 3개의 혼합물을 나타낼 수 있다.
사이클화는 카보닐을 함유한 탄소에 새로운 입체적인 중심을 만든다.카보닐의 산소를 대체하는 -OH 그룹은 링의 중간 평면에 상대적인 두 개의 뚜렷한 위치에 있을 수 있다.따라서 각 오픈 체인 단당류는 접두사 α-와 β-로 표시된 두 개의 순환 이소머(아노머)를 산출한다.이 분자는 돌연변이라고 불리는 과정에 의해 이 두 형태 사이에서 변화할 수 있는데, 이 과정은 링 형성 반응의 역전에 이어 또 다른 링 형성이 뒤따른다.[4]
하워스 투영법
주기적인 단당류의 입체화학 구조는 Haworth 프로젝트로 나타낼 수 있다.이 도표에서 D-aldohexose의 피라노오스 형태에 대한 α-이소머는 탄소 원자의 평면 아래에 있는 변이성 탄소의 -OH를 가지고 있는 반면, β-이소머는 평면 위에 있는 변이성 탄소의 -OH를 가지고 있다.피라노세스는 일반적으로 사이클로헥산 의자와 비슷한 의자의 순응을 채택한다.이 순응에서 α-이소머는 축방향 위치에 변이성 탄소의 -OH를 가지고 있는 반면, β-이소머는 적도 위치에 변이성 탄소의 -OH를 가지고 있다(D-알도헥소오스 당분 고려).[5]
파생상품
많은 수의 생물학적으로 중요한 수정된 단당류가 존재한다.
참고 항목
메모들
- ^ "Carbohydrates". Chemistry for Biologists. Royal Society of Chemistry. Retrieved 10 March 2017.
- ^ NCERT 텍스트 북 ClaSS-12
- ^ "Carbohydrates". Chemistry for Biologists. Royal Society of Chemistry. Retrieved 10 March 2017.
- ^ Pigman, William Ward; Anet, E. F. L. J. (1972). "Chapter 4: Mutarotations and Actions of Acids and Bases". In Pigman and Horton (ed.). The Carbohydrates: Chemistry and Biochemistry. Vol. 1A (2nd ed.). San Diego: Academic Press. pp. 165–194.
- ^ IUPAC, 화학용어 종합편찬, 제2편.("금책")(1997년).온라인 수정 버전: (2006–) "Haworth 표현". doi:10.1351/골드북.H02749
참조
- 맥머리, 존유기 화학7부.CA: Thomson Brooks/Cole, 2008.인쇄하다
외부 링크
| 무료 사전인 Wiktionary에서 단당류를 찾아 보십시오. |