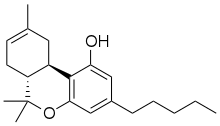
델타-8-테트라하이드로카나비놀
delta-8-Tetrahydrocannabinol
 | |
| 이름 | |
|---|---|
| IUPAC 이름 6,6,9-trim세틸-3-펜틸-6a,7,10,10a-tetrahydrobenzo[c]olen-1-ol | |
기타 이름
| |
| 식별자 | |
3D 모델(JSmol) | |
| 켐벨 | |
| 켐스파이더 | |
| ECHA InfoCard | 100.165.076 |
펍켐 CID | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| C21H30O2 | |
| 어금질량 | 314.5 g/190 |
| 밀도 | 1.0±0.1 g/cm3 |
| 비등점 | 383.5±42.0°C |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
델타-8-테트라하이드로카나비놀(delta-8-THC, Δ-THC8)은 대마초 식물에서 발견된 정신 활성 카나비노이드다.[1][2][3] 델타-9-테트라하이드로카나비놀(delta-9-THC, Δ-THC9)의 이소머로, 일반적으로 THC로 알려진 화합물은 생물학적 특성에 대한 예비 연구 중이다.8[4]
영향들
∆-8THC는 Δ-THC보다9 적당히 덜 강력하다(약력 인비보(in-vivo)로 약 50-66%이다.[5][6] 이 본질적으로 비록 물질의 밀리그램에 약한 정도로 소비되면, 성질 ∆9-THC의 전통을 가진 것을 의미한다.[7]∆8-THC 심장 박동수 상승·눈 등의 적화, 현기증, 입과 목의 건조, 손발이, 이명, 몸 인식, 근력 약화, 근육 긴장하거나 떨림, 감소된 모터 coordina를 일으킬 수 있다.션, 피로, 졸음, 시각적 지각의 변화, 변화된 시각적 이미지, 색상 또는 대비의 향상, 시간 왜곡, 청각적 지각의 변화, 행복, 평온, 이완, 경주 생각, 몽환적 자기성찰 상태 또는 사고, 말하기, 읽기 또는 기억의 어려움.[6]
개와 원숭이에 대한 ∆-8THC의 영향을 실험한 1973년 연구는 연구된 모든 개와 원숭이에서 체중의 킬로그램 당 9,000 밀리그램의 경구 투여량이 비살상이었다고 보고했다.[8][9] 같은 연구에서는 랫드에서 8--THC의 치사량이 9--THC의 치사량 중위수와 비교된다고 보고하였다.[8] THC의 두 등소체는 심혈관계계에 대한 캐나비노이드의 영향은 복잡하지만 쥐의 혈압의 일시적 증가를 유발하는 것으로 밝혀졌다.[10][11] 동물 연구 결과 8--THC는 대뇌피질, 탈라무스, 기저강글리아, 해마, 소뇌 등 뇌의 다양한 영역에서 발견되는 캐나비노이드 수용체에 결합함으로써 많은 중심적 효과를 발휘하고 있는 것으로 나타났다.[12][13]
약리학
약리역학
∆-8THC의 약동학적 프로파일은 ∆-9THC의 프로파일과 유사하다.[5][6] CB와1 CB 칸나비노이드 수용체의 부분작용제로서 생물학적 활성의 모든 척도는 아니지만 대부분의 측정에서 9th-TSC의 약 절반의 효력이 있다. [14][15][16]∆-8THC는 CB1 수용체에서는 44 ± 12nM, CB22 수용체에서는 44 ± 17nM의 K 값을i 갖는 것으로 보고되었다.[17] 이러한 값은 동일한 수용체에서 일반적으로 9reported-THC(CB1 Ki = 40.7nM)에 대해 보고되는 값보다 높으며, ∆-89THC보다 덜 효율적으로 cann-THC가 칸나비노이드 수용체에 결합한다는 것을 나타낸다.[18]
약동학
∆-8THC의 약동학적 프로파일은 ∆-9THC의 프로파일과도 유사하다.[5][6] 인간의 섭취 이후 CYP2C9과 CYP3A4를 포함한 간상 사이토크롬 P450 효소는 먼저 ∆-8THC를 11-hydroxy-Δ-tetrahydrocannabinol8(11-OH-Δ-THC8)로 변환한다.[19][20] 다음으로, 탈수소효소 효소는 11-OH-Δ-THC를8 11-nor Δ-tetrahydrocanabinol-9-carboxylic8 acid (11-nor-Δ-THC-9-COOH8, 일명 Δ-11-oic8 acid라고도 함)[20][21]로 변환한다. 마지막으로 Δ-THC-11-oic8 acid는 글루쿠로니다아제 효소에 의한 글루쿠로니화(glukuronidation)를 거치며 11-nor-tetrahydrocannabinol-9-carboxylic8 acid glucuronide(Δ-THC-COH-glu8)를 형성한다.[20][21] 그리고 나서 이 최종 산물은 소변으로 배설된다.[22][23]
물리적 및 화학적 특성
∆-8THC는 삼순환 테르페노이드다. ∆-9THC와 같은 화학식을 갖고 있지만 탄소-탄소 이중결합 중 하나는 다른 위치에 있다.[5] 이러한 구조 차이는 ∆-9THC에 비해 ∆-8THC의 화학적 안정성을 증가시켜 저장 수명을 연장하고 화합물이 시간이 지남에 따라 카나비놀에 대한 산화 작용을 견딜 수 있게 한다.[14] cann-THC는 다른 8카나비노이드와 마찬가지로 지방질이 매우 강하다(로그 P = 7.4[24]). 상온에서는 극도로 점성이 강하고 무색한 기름이다.[25]
∆-8THC는 대마초 속 식물에서 자연적으로 발견되는 반면, 이 화합물은 CBD를 산과 열에 노출시킴으로써 산업 또는 실험실 환경에서 생성될 수도 있다.[3][26][27][28] 이 과정에서 사용될 수 있는 용제는 염화메틸렌, 톨루엔, 헥산 등이다.[28] 사용될 수 있는 산은 토실산, 인듐(III) 삼불산, 트리메틸실릴 삼불산염, 염산, 황산을 포함한다.[28][29] CBD를 8Δ-THC10, 9-OH-HHC 등 side-THC로 전환하는 과정에서 화학오염물질이 발생할 수 있고, 제조 과정에서 사용되는 잠재 독성 화학물질 시약도 발생할 수 있어 미시험 또는 불순물 ∆-8THC 제품의 안전성에 대한 우려가 제기돼 왔다.[29][30]
∆-8THC는 8과 9로 표시된 탄소 원자들 사이에 이중 결합 ⑴이 있고, ∆-9THC는 9와 10으로 표시된 탄소 원자들 사이에 이중 결합 ⑴이 있다.
현재 진행 중인 미국 ∆-8THC의 법적 지위 논란. 는 화학적 명칭에 의해 복잡하다. 임상 독성학에서 발표한 2019년 문헌 검토에 따르면, "합성 카나비노이드"라는 용어는 일반적으로1 CB와 CB카나비노이드2 수용체의 완전한 작용제를 말한다.[31] 검토에 따르면 "합성 캐나비노이드 수용체 작용제의 정신 활성(그리고 아마도 독성) 효과는 완전 수용체 작용제로서의 작용과 CB1 수용체에서의 더 큰 효력 때문일 가능성이 높다"[31]고 한다. ∆-8THC와 ∆-9THC는 완전한 작용제가 아니라 [15]칸나비노이드 수용체의 부분작용제이기 때문에 이들 화합물은 많은 합성 카나비노이드에 비해 위력이 떨어지고 독성이 떨어진다.[32] 비록 델타-9-THC가 뇌의 해마 부분에 위치한 특정 CB1 수용체에 완전한 CB1 작용제 역할을 하는 것으로 나타났기 때문에 완전 작용제가 독성의 이유라면 확실히 입증되지는 않았다.[33] 그리고 합성 카나비노이드 EG-018은 부분작용제[34] 역할을 한다. THC를 포함하는 고전적인 카나비노이드 디벤조피란 구조 등급은 독성의 원인이 될 수 있는 나프토일린돌과 같은 관련 없는 화학 등급의 합성 카나비노이드 화합물과는 CB1 수용체 내부의 다른 지점과 상호작용한다.[35]
역사
∆-8THC의 부분합성은 1941년 로저 아담스와 일리노이 대학의 동료들에 의해 출판되었다.[36] 1942년, 같은 연구 단체가 인간 자원 봉사자들에게 구강 투약 후 생리학적, 정신 활동적 효과를 연구했다.[37] ∆-8THC의 합성은 1965년까지 달성되었다.[38] 1966년 대마초로부터 격리된 ∆-8THC의 화학구조는 리처드 L에 의해 현대적인 방법을 사용한 것이 특징이다. 흐흐흐흐흐흐흐흐흐흐흐흐흐, 윌리엄 A. 모셔, 그리고 델라웨어 대학의 프리드리히 W. 호프만.[39] A stereospecific synthesis of ∆8-THC from olivetol and verbenol was reported by Raphael Mechoulam and colleagues at the Weizmann Institute of Science in 1967.[40] ∆8-THC was often referred to as "Delta-6-THC" (Δ6-THC) in early scientific literature, but this name is no longer conventional among most authors.[41]
미국의 합법성
2018년 12월 미국 농장 법안이 법으로 제정된 이후, 규격 준수 소스(산업용 삼베 및 파생식 카나비디올 추출물 포함)에서 부분적으로 합성된 8--THC 제품은 다양한 디지털 판매업체와 헤드 숍을 포함한 보다 한정된 종류의 벽돌 및 모르타르 소매상들에 의해 판매되고 있다. 정제되지 않은 증류제의 대량 양에서부터 대마초에서 파생된 테르펜이 함유된 제조된 경화제와 분무기[42] 카트리지에 이르기까지, 그것들은 보통 9fed-THC 상대국에 대한 연방법적 대안으로 판매된다.[43] 그러나 연방 수준에서 8oct-THC의 법적 지위는 일부에서는 2020년 10월 DEA IFR이 팜 빌이 허용하는 델타-8과 기타 대마 파생상품에 적용되는 "합성물질"을 다룬다고 믿고 있다.[44][45]
2020년 말부터 시작된 ∆-8THC는 미국 전역의 많은 대마초 소비자들의 관심을 끌기 시작했다. 특히 대마초가 불법인 지역에서는 전통적인 대마초 사용의 대안으로 생각되어 ,-8THC의 뉴스가 통신사,[45] 대마초 출판물,[43] 블로그, 팟캐스트 등을 통해 빠르게 퍼지면서 소셜미디어의 주목을 받았다.
왜냐하면 ∆8-THC 제품 마케팅과 만약 그것이 훨씬∆9-THC 제품들은 대마초 경멸하다에 구입하는 것보다 더 싼다 평범한 판매 세보다 어떤 더 많은 세금 특별한 이용권 대여 또는 대부분의 주 화학 분석이 사실 이런 제품들 그리고 전국적으로 한 국가가 아니라 판매한 한번에 생산될 수 있는,에서 요구하지 않는다.페nsary. 그것들은 우편으로 보내질 수 있다; 연방 차원에서 여전히 불법인 ∆-9THC 제품은 보낼 수 없다. 2021년 현재 프랜차이즈를 포함한 규모 있는 신산업이 생겨나고 있거나 이미 생겨나고 있다.
2021년 초 현재, "Delta-8"/"8delta-THC"는 대마에서 파생된 제품 중 가장 빠르게 성장하는 부문 중 하나이다.[46]
안전 문제
∆-8THC는 일반적으로 대마에서 발견된 델타 8의 자연량이 적기 때문에 대마에서[47] 추출한 카나비디올에서 합성된다. 그 반응은 종종 다른 캐나비노이드와 알려지지 않은 반응 부산물을 포함하는 혼합물을 산출한다. 그 결과 ∆-8THC로 판매되는 대부분의 제품은 실제로 순수 ∆-8THC가 아니다.[47] 불순물의 정체성과 건강에 미치는 영향에 대해서는 거의 알려져 있지 않다.[47]
리서치
∆-8THC는 녹내장,[48][49] 각막손상,[50][51] 화학요법으로 인한 메스꺼움과 구토에 대한 잠재적 치료법으로 연구되어 왔다.[14]
∆-8THC는 의료용 대마초의 소성분이지만, 2021년 현재 어떠한 의학적 상태에 대해서도 ∆-8THC에만 대규모 임상연구가 발표되지는 않았다.
참고 항목
- 카나비노이드
- 대마초(마약)
- 7,8-디히드로카나비놀
- 11-히드록시-델타-8-THC
- 델타-3-테트라하이드로카나비놀
- 델타-4-테트라하이드로카나비놀
- 델타-7-테트라하이드로카나비놀(델타-5-테트라하이드로카나비놀)
- 델타-10-테트라하이드로카나비놀(델타-2-테트라하이드로카나비놀)
- 델타-6-카나비디올
- 헥사하이드로카나비놀
- 테트라하이드로카나비놀
- 테트라하이드로카나부톨
- 테트라하이드로카나비포롤
- TC-O-acetate
- TH-O-인산염
- 아줄레산
- 엔도카나비노이드계
참조
- ^ "NCI Drug Dictionary". National Cancer Institute. 2 February 2011. Retrieved 10 November 2020.
- ^ "Δ8-Tetrahydrocannabinol". webbook.nist.gov. U.S. Secretary of Commerce. Retrieved 10 November 2020.
- ^ a b Qamar S, Manrique YJ, Parekh HS, Falconer JR (May 2021). "Development and Optimization of Supercritical Fluid Extraction Setup Leading to Quantification of 11 Cannabinoids Derived from Medicinal Cannabis". Biology. 10 (6): 481. doi:10.3390/biology10060481. PMC 8227983. PMID 34071473.
- ^ PubChem. "delta8-THC". pubchem.ncbi.nlm.nih.gov. Retrieved 9 November 2020.
- ^ a b c d Razdan RK (1984). "Chemistry and Structure-Activity Relationships of Cannabinoids: An Overview". The Cannabinoids: Chemical, Pharmacologic, and Therapeutic Aspects. pp. 63–78. doi:10.1016/b978-0-12-044620-9.50009-9. ISBN 978-0-12-044620-9.
- ^ a b c d Hollister LE, Gillespie HK (May 1973). "Delta-8- and delta-9-tetrahydrocannabinol comparison in man by oral and intravenous administration". Clinical Pharmacology and Therapeutics. 14 (3): 353–7. doi:10.1002/cpt1973143353. PMID 4698563. S2CID 41556421.
- ^ "delta-8-tetrahydrocannabinol". www.cancer.gov. 2 February 2011. Retrieved 28 March 2021.
{{cite web}}: CS1 maint : url-status (링크) - ^ a b Thompson GR, Rosenkrantz H, Schaeppi UH, Braude MC (July 1973). "Comparison of acute oral toxicity of cannabinoids in rats, dogs and monkeys". Toxicology and Applied Pharmacology. 25 (3): 363–72. doi:10.1016/0041-008x(73)90310-4. PMID 4199474.
- ^ Chambers M. "ChemIDplus - 0005957755 - HCAWPGARWVBULJ-IAGOWNOFSA-N - delta-8-Tetrahydrocannabinol - Similar structures search, synonyms, formulas, resource links, and other chemical information". chem.nlm.nih.gov. Retrieved 13 June 2021.
- ^ Adams MD, Earnhardt JT, Dewey WL, Harris LS (March 1976). "Vasoconstrictor actions of delta8- and delta9-tetrahydrocannabinol in the rat". The Journal of Pharmacology and Experimental Therapeutics. 196 (3): 649–56. PMID 4606.
- ^ Richter JS, Quenardelle V, Rouyer O, Raul JS, Beaujeux R, Gény B, Wolff V (29 May 2018). "A Systematic Review of the Complex Effects of Cannabinoids on Cerebral and Peripheral Circulation in Animal Models". Frontiers in Physiology. 9: 622. doi:10.3389/fphys.2018.00622. PMC 5986896. PMID 29896112.
- ^ Charalambous A, Marciniak G, Shiue CY, Dewey SL, Schlyer DJ, Wolf AP, Makriyannis A (November 1991). "PET studies in the primate brain and biodistribution in mice using (-)-5'-18F-delta 8-THC". Pharmacology, Biochemistry, and Behavior. 40 (3): 503–7. doi:10.1016/0091-3057(91)90354-5. PMID 1666914. S2CID 140208679.
- ^ Tripathi HL, Vocci FJ, Brase DA, Dewey WL (1987). "Effects of cannabinoids on levels of acetylcholine and choline and on turnover rate of acetylcholine in various regions of the mouse brain". Alcohol and Drug Research. 7 (5–6): 525–32. PMID 3620017. INIST:7401152.
- ^ a b c Abrahamov A, Abrahamov A, Mechoulam R (May 1995). "An efficient new cannabinoid antiemetic in pediatric oncology". Life Sciences. 56 (23–24): 2097–102. doi:10.1016/0024-3205(95)00194-b. PMID 7776837.
- ^ a b Walter L, Stella N (March 2004). "Cannabinoids and neuroinflammation". British Journal of Pharmacology. 141 (5): 775–85. doi:10.1038/sj.bjp.0705667. PMC 1574256. PMID 14757702.
- ^ Morales P, Hurst DP, Reggio PH (2017). "Molecular Targets of the Phytocannabinoids: A Complex Picture". Phytocannabinoids. Progress in the Chemistry of Organic Natural Products. Vol. 103. pp. 103–131. doi:10.1007/978-3-319-45541-9_4. ISBN 978-3-319-45539-6. PMC 5345356. PMID 28120232.
- ^ Bow EW, Rimoldi JM (January 2016). "The Structure-Function Relationships of Classical Cannabinoids: CB1/CB2 Modulation". Perspectives in Medicinal Chemistry. 8: 17–39. doi:10.4137/PMC.S32171. PMC 4927043. PMID 27398024.
- ^ Pertwee RG (January 2008). "The diverse CB1 and CB2 receptor pharmacology of three plant cannabinoids: delta9-tetrahydrocannabinol, cannabidiol and delta9-tetrahydrocannabivarin". British Journal of Pharmacology. 153 (2): 199–215. doi:10.1038/sj.bjp.0707442. PMC 2219532. PMID 17828291.
- ^ Stout SM, Cimino NM (February 2014). "Exogenous cannabinoids as substrates, inhibitors, and inducers of human drug metabolizing enzymes: a systematic review". Drug Metabolism Reviews. 46 (1): 86–95. doi:10.3109/03602532.2013.849268. PMID 24160757. S2CID 29133059.
- ^ a b c Villamor JL, Bermejo AM, Tabernero MJ, Fernandez P, Sanchez I (December 1998). "GC/MS Determination of 11-Nor-9-Carboxy-Δ 8 -tetrahydrocannabinol in Urine from Cannabis Users". Analytical Letters. 31 (15): 2635–2643. doi:10.1080/00032719808005332.
- ^ a b Valiveti S, Hammell DC, Earles DC, Stinchcomb AL (June 2005). "LC-MS method for the estimation of delta8-THC and 11-nor-delta8-THC-9-COOH in plasma". Journal of Pharmaceutical and Biomedical Analysis. 38 (1): 112–8. doi:10.1016/j.jpba.2004.11.055. PMID 15907628.
- ^ Harvey DJ, Brown NK (November 1991). "Comparative in vitro metabolism of the cannabinoids". Pharmacology, Biochemistry, and Behavior. 40 (3): 533–40. doi:10.1016/0091-3057(91)90359-A. PMID 1806943. S2CID 25827210.
- ^ Mechoulam R, BenZvi Z, Agurell S, Nilsson IM, Nilsson JL, Edery H, Grunfeld Y (October 1973). "Delta 6-tetrahydrocannabinol-7-oic acid, a urinary delta 6-THC metabolite: isolation and synthesis". Experientia. 29 (10): 1193–5. doi:10.1007/BF01935065. PMID 4758913. S2CID 27021897.
- ^ Thomas BF, Compton DR, Martin BR (November 1990). "Characterization of the lipophilicity of natural and synthetic analogs of delta 9-tetrahydrocannabinol and its relationship to pharmacological potency". The Journal of Pharmacology and Experimental Therapeutics. 255 (2): 624–30. CiteSeerX 10.1.1.968.4912. PMID 2173751.
- ^ Rosenkrantz H, Thompson GR, Braude MC (July 1972). "Oral and parenteral formulations of marijuana constituents". Journal of Pharmaceutical Sciences. 61 (7): 1106–12. doi:10.1002/jps.2600610715. PMID 4625586.
- ^ Golombek P, Müller M, Barthlott I, Sproll C, Lachenmeier DW (June 2020). "Conversion of Cannabidiol (CBD) into Psychotropic Cannabinoids Including Tetrahydrocannabinol (THC): A Controversy in the Scientific Literature". Toxics. 8 (2): 41. doi:10.3390/toxics8020041. PMC 7357058. PMID 32503116.
- ^ Gaoni Y, Mechoulam R (January 1966). "Hashish—VII". Tetrahedron. 22 (4): 1481–1488. doi:10.1016/S0040-4020(01)99446-3.
- ^ a b c Marzullo P, Foschi F, Coppini DA, Fanchini F, Magnani L, Rusconi S, et al. (October 2020). "Cannabidiol as the Substrate in Acid-Catalyzed Intramolecular Cyclization". Journal of Natural Products. 83 (10): 2894–2901. doi:10.1021/acs.jnatprod.0c00436. PMC 8011986. PMID 32991167.
- ^ a b "Is delta-8 THC safe? Here's what the experts say". Leafly. 9 June 2021. Retrieved 12 June 2021.
- ^ Erickson BE (30 August 2021). "Delta-8-THC craze concerns chemists". Chemical & Engineering News. 99 (31).
- ^ a b Potts AJ, Cano C, Thomas SH, Hill SL (February 2020). "Synthetic cannabinoid receptor agonists: classification and nomenclature". Clinical Toxicology. 58 (2): 82–98. doi:10.1080/15563650.2019.1661425. PMID 31524007. S2CID 202581071.
- ^ Kelly BF, Nappe TM (2021). "Cannabinoid Toxicity". StatPearls. StatPearls Publishing.
- ^ Laaris N, Good CH, Lupica CR (2010). "Delta9-tetrahydrocannabinol is a full agonist at CB1 receptors on GABA neuron axon terminals in the hippocampus". Neuropharmacology. 59 (1–2): 121–7. doi:10.1016/j.neuropharm.2010.04.013. PMC 2882293. PMID 20417220.
- ^ Gamage TF, Barrus DG, Kevin RC, Finlay DB, Lefever TW, Patel PR, et al. (June 2020). "In vitro and in vivo pharmacological evaluation of the synthetic cannabinoid receptor agonist EG-018". Pharmacology, Biochemistry, and Behavior. 193: 172918. doi:10.1016/j.pbb.2020.172918. PMC 7239729. PMID 32247816.
- ^ Huffman JW, Padgett LW (31 May 2005). "Recent developments in the medicinal chemistry of cannabimimetic indoles, pyrroles and indenes". Current Medicinal Chemistry. 12 (12): 1395–411. doi:10.2174/0929867054020864. PMID 15974991.
- ^ Adams R, Cain CK, McPhee WD, Wearn RB (August 1941). "Structure of Cannabidiol. XII. Isomerization to Tetrahydrocannabinols 1". Journal of the American Chemical Society. 63 (8): 2209–2213. doi:10.1021/ja01853a052.
- ^ Adams R (November 1942). "Marihuana: Harvey Lecture, February 19, 1942". Bulletin of the New York Academy of Medicine. 18 (11): 705–30. PMC 1933888. PMID 19312292.
- ^ Mechoulam R (June 1970). "Marihuana chemistry". Science. 168 (3936): 1159–66. Bibcode:1970Sci...168.1159M. doi:10.1126/science.168.3936.1159. PMID 4910003.
- ^ Hively RL, Mosher WA, Hoffmann FW (April 1966). "Isolation of trans-delta-tetrahydrocannabinol from marijuana". Journal of the American Chemical Society. 88 (8): 1832–3. doi:10.1021/ja00960a056. PMID 5942992.
- ^ Mechoulam R, Braun P, Gaoni Y (August 1967). "A stereospecific synthesis of (-)-delta 1- and (-)-delta 1(6)-tetrahydrocannabinols". Journal of the American Chemical Society. 89 (17): 4552–4. doi:10.1021/ja00993a072. PMID 6046550.
- ^ Pertwee RG (January 2006). "Cannabinoid pharmacology: the first 66 years". British Journal of Pharmacology. 147 (Suppl 1): S163-71. doi:10.1038/sj.bjp.0706406. PMC 1760722. PMID 16402100.
- ^ iHemp. "What Is A Vape Pen?". iHemp. Retrieved 19 September 2021.
- ^ a b Farah T (23 September 2020). "Delta-8-THC Promises to Get You High Without the Paranoia or Anxiety". Discover Magazine. Retrieved 9 November 2020.
- ^ Levey L (23 October 2020). "DEA Tried Banning New Cannabis Product, Sellers Still Selling". Dope Magazine. Retrieved 10 November 2020.
- ^ a b King S (18 January 2021). "How Some THC Is Legal — For Now". Rolling Stone.
{{cite news}}: CS1 maint : url-status (링크) - ^ Richtel M (27 February 2021). "This Drug Gets You High, and Is Legal (Maybe) Across the Country". The New York Times. Archived from the original on 27 February 2021. Retrieved 28 March 2021.
- ^ a b c Britt E. Erickson (29 August 2021). "Delta-8-THC craze concerns chemists: Unidentified by-products and lack of regulatory oversight spell trouble for cannabis products synthesized from CBD". Chemical & Engineering News.
- ^ Punyamurthula NS, Adelli GR, Gul W, Repka MA, ElSohly MA, Majumdar S (August 2017). "Ocular Disposition of ∆8-Tetrahydrocannabinol from Various Topical Ophthalmic Formulations". AAPS PharmSciTech. 18 (6): 1936–1945. doi:10.1208/s12249-016-0672-2. PMC 5629008. PMID 27905004.
- ^ Muchtar S, Almog S, Torracca MT, Saettone MF, Benita S (1992). "A submicron emulsion as ocular vehicle for delta-8-tetrahydrocannabinol: effect on intraocular pressure in rabbits". Ophthalmic Research. 24 (3): 142–9. doi:10.1159/000267160. PMID 1328979.
- ^ Thapa D, Cairns EA, Szczesniak AM, Kulkarni PM, Straiker AJ, Thakur GA, Kelly ME (January 2020). "Allosteric Cannabinoid Receptor 1 (CB1) Ligands Reduce Ocular Pain and Inflammation". Molecules. 25 (2): 417. doi:10.3390/molecules25020417. PMC 7024337. PMID 31968549.
- ^ Thapa D, Cairns EA, Szczesniak AM, Toguri JT, Caldwell MD, Kelly ME (May 2018). "The Cannabinoids Δ8THC, CBD, and HU-308 Act via Distinct Receptors to Reduce Corneal Pain and Inflammation". Cannabis and Cannabinoid Research. 3 (1): 11–20. doi:10.1089/can.2017.0041. PMC 5812319. PMID 29450258.