메티오닌
Methionine 메티오닌 표준형태의 골격식 | |||
| | |||
| 이름 | |||
|---|---|---|---|
| IUPAC 이름 메티오닌 | |||
| 기타 이름 2-164-4-(메틸티오)부타노산 | |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 약어 | Met, M | ||
| 체비 | |||
| 켐벨 | |||
| 켐스파이더 | |||
| ECHA InfoCard | 100.000.393 | ||
| EC 번호 |
| ||
| 케그 | |||
펍켐 CID | |||
| 유니 |
| ||
CompTox 대시보드 (EPA) | |||
| |||
| |||
| 속성[2] | |||
| C5H11NO2S | |||
| 어금질량 | 149.21 g·18−1 | ||
| 외관 | 화이트 크리스탈 파우더 | ||
| 밀도 | 1.152g/cm3 | ||
| 녹는점 | 281 °C(538 °F, 554 K) 분해 | ||
| 수용성 | |||
| 산도(pKa) | 2.28(carboxyl), 9.21([1]amino) | ||
| 약리학 | |||
| V03AB26(WHO) QA05BA90(WHO), QG04BA90(WHO) | |||
| 부가자료페이지 | |||
| 메티오닌(데이터 페이지) | |||
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |||
| Infobox 참조 자료 | |||
메티오닌(methionine, Symbol Met 또는 M)[3] (/mɪθaɪniːn/)[4]은 인간에게 필수적인 아미노산이다.시스틴과 타우린과 같은 다른 아미노산, SAM-e와 같은 다용도 화합물, 그리고 중요한 항산화 글루타티온느의 전구체로서 메티오닌은 인간을 포함한 많은 종의 신진대사와 건강에 중요한 역할을 한다.그것은 8월에 코돈으로 암호화되어 있다.
메티오닌은 새로운 혈관의 성장인 혈관신생의 중요한 부분이다.보충제는 구리 중독으로 고통 받는 사람들에게 이로울 수 있다.[5]DNA 메틸화의 메틸 그룹 기증자인 메티오닌의 과소비는 여러 연구에서 암의 성장과 관련이 있다.[6][7]메티오닌은 1921년 존 하워드 뮬러에 의해 처음으로 고립되었다.[8]
생화학적 디테일
메티오닌(Met 또는 M으로 약칭, 코돈 AUG로 부호화)은 단백질의 생합성에 사용되는 α-아미노산이다.α-아미노 그룹(생물학적 조건에서 양성 -NH3+ 형태), 카르복실 그룹(생물학적 조건에서 감응 -COO− 형태), S-메틸 티오에더 사이드 체인을 함유하고 있어 비극성 아미노산으로 분류된다.
eukaryotes의 핵유전자와 아르케아에서 메티오닌은 시작 코돈에 의해 코딩되어 있는데, 이는 코딩 영역의 시작을 나타내며 mRNA 변환 중 초기 폴리펩타이드에서 생성된 최초의 아미노산이다.[9]
단백질 생성 아미노산
메티오닌은 시스틴과 함께 황 함유 단백질 유발 아미노산 2종 중 하나이다.메티오닌이 리독스 센서(예:[10] 메티오닌 잔류물)로 작용할 수 있는 몇 가지 예외를 제외하고, 메티오닌은 촉매 역할을 하지 않는다.[11]이는 티올 그룹이 많은 단백질에서 촉매 역할을 하는 시스틴 잔류물과 대조적이다.[11]그러나 티오에더는 알려진 모든 단백질 구조의 3분의 1에서 사이드 체인 황 원자와 방향족 아미노산 사이의 S/11 상호작용의 안정성 효과 때문에 작은 구조적 역할을 한다.[11]이러한 강한 역할의 부족은 메티오닌이 티오에더가 부족한 직선 탄화수소 사이드체인 아미노산으로 대체되는 단백질에서 거의 효과가 나타나지 않는 실험에 반영된다.[12]유전자 코드의 초기 버전에는 노르레우신이 존재했을 것으로 추측되어 왔지만, 메티오닌이 공동 인자 S-adenosyl 메티오닌(SAM-e)에 사용되기 때문에 최종 버전의 유전 코드에 침입했다.[13]이 상황은 독특하지 않고 오르니틴과 아르기닌과 함께 일어났을 수도 있다.[14]
인코딩
메티오닌은 표준 유전자 코드에 단일 코돈(AUG)으로 인코딩된 두 개의 아미노산 중 하나이다(UGG가 인코딩한 트립토판은 다른 것이다).다른 AUN 코돈들은 그것의 코돈의 진화적 기원을 반영하여 이솔레우신(isoleucine)을 암호화하는데, 이 역시 소수성 아미노산이다.메타조아, 효모를 포함한 여러 유기체의 미토콘드리아 게놈에서 코돈 AUA는 메티오닌을 위한 암호도 한다.이솔레우신 및 각각의 tRNA(Escherichia colya의 ileX)에 대한 표준 유전자 코드 AUA에서 AUA는 AUG를 구별하기 위해 특이한 염기 리시딘(박테리아) 또는 아그마티딘(아카이아)을 사용한다.[15][16]
메티오닌 코돈 AUG 또한 가장 흔한 시작 코돈이다."시작" 코돈은 AUG 코돈이 코작 컨센서스 시퀀스에 있을 때 mRNA로부터 단백질 번역의 시작을 알리는 리보솜에 대한 메시지다.그 결과, 메티오닌은 종종 진핵생물 및 번역 중 단백질의 N단자 위치에 통합되지만, 변환 후 수정으로 제거될 수 있다.박테리아에서는 N-포르밀메티오닌이 초기 아미노산으로 사용된다.
파생상품
S-아데노실메티오닌
메티오닌-파생 S-adenosyl 메티오닌(SAM-e)은 주로 메틸 공여자의 역할을 하는 공작용제다.SAM-e는 메티오닌의 유황에 부착된 아데노실 분자(5'탄소를 통해)로 구성되므로, 이를 황산화물(즉, 3개의 대체물과 양전하)으로 만든다.유황은 부드러운 루이스 산(즉, 기증자/전기생성)의 역할을 하며, 코발라민(인간 내 비타민 B12)과 같은 다른 공작용제의 도움을 받아 S-메틸 그룹을 산소, 질소 또는 방향계통에 전달하게 한다.일부 효소는 과격한 반응을 일으키기 위해 SAM-e를 사용한다; 이것들은 과격한 SAM-e 효소라고 불린다.메틸군 전이 결과 S-adenosyl-homocysteine이 얻어진다.박테리아에서 이것은 메틸화에 의해 재생되거나 아데닌과 호모시스테인을 제거하여 살생되어 화합물인 디히드로옥시펜탄디온을 자연적으로 자동유도기-2로 변환하게 되며, 이는 폐품/정족수 신호로 배설된다.
생합성
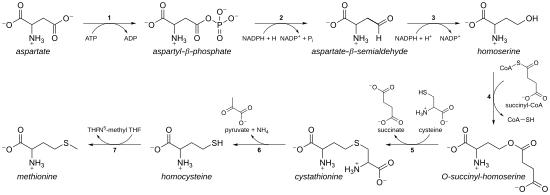
필수 아미노산으로서 메티오닌은 인간과 다른 동물에서 합성되지 않으며 메티오닌이나 메티오닌 함유 단백질을 섭취해야 한다.식물과 미생물의 경우 메티오닌 생합성성은 테레오닌, 라이신(다이아미노피메이트를 경유하되 α-아미노아디페이트를 경유하지 않음)과 함께 아스파테이트 계열에 속한다.주 등뼈는 아스파르트산에서 파생되는 반면, 유황은 시스틴, 메탄에티올 또는 황화수소로부터 나올 수 있다.[11]
- 첫째, 아스파르트산은 β-aspartyl-세미알데히드를 통해 단자 카복실 그룹의 두 가지 감소 단계에 의해 호모세린으로 전환된다(따라서 호모세린은 β-hydroxyl을 가지고 있으며, 따라서 호모 시리즈가 있다).중간 아스파르테이트-세미알데히드는 리신 생합성 경로로 분기점을 말하며, 대신 피루베이트와 응축된다.호모세린(Homoserine)은 트레오닌 경로의 분기점으로서, 대신 인산염으로 단자 히드록실(Hydroxyl)을 활성화한 후 이소질화된다(식물의 메티오닌 생합성에도 사용된다).[11]
- 그런 다음 호모세린은 히드록실 위에 인산염, 숙시닐 또는 아세틸 그룹으로 활성화된다.
- 식물이나 일부 박테리아에서는 인산염이 사용된다.[11]이 단계는 세레오닌 생합성과 공유된다.[11]
- 대부분의 유기체에서 아세틸 그룹은 호모세린을 활성화하는데 사용된다.이것은 메트X나 메타(동맥이 아닌)로 인코딩된 효소에 의해 박테리아에 강직될 수 있다.[11]
- 엔토박테리아와 제한된 수의 다른 유기체에서는 굴복제를 사용한다.반응을 촉진하는 효소는 MetA이고 아세틸-CoA와 숙시닐-CoA의 특이성은 단일 잔류물로 지시된다.[11]아세틸-CoA 또는 수시닐-CoA의 선호에 대한 생리학적 근거는 알 수 없지만, 그러한 대체 경로가 일부 다른 경로(예: 리신 생합성 및 아르기닌 생합성)에 존재한다.
- 그런 다음 히드록실 활성화 그룹은 시스틴, 메탄네티올 또는 황화수소로 대체된다.대체 반응은 기술적으로 마이클 추가의 변종이 뒤따르는 γ-제거다.관련된 효소는 모두 호몰로게이션과 PLP 의존 효소 계열의 구성원으로 PLP 의존성 폴드 타입 I 클라드의 일부분이다.그들은 카르바니온 중간체를 안정화함으로써 기능하는 공동 인자 PLP(피리독살 인산염)를 이용한다.[11]
- 시스테인(cysteine)과 반응하면, 호모시스틴(homocysteine)을 산출하기 위해 갈라진 세포이온을 생성한다.관련 효소는 시스타티오닌-합성효소(세균의 메트B에 의해 인코딩됨)와 시스타티오닌-β-합성효소(metC)이다.시스타티오닌은 두 효소에서 다르게 결합되어 β 또는 γ 반응이 일어나게 한다.[11]
- 황화수소와 반응하면 호모시스테인을 생성한다.이것은 O-acetylhomoserine aminocarboxyl transferase (이전에는 O-acetylhomoserine (thiol)-lyase로 알려져 있음)에 의해 촉매로 작용한다.그것은 박테리아에서 MetY나 MetZ로 암호화된다.[11]
- 메타네티올과 반응하면 메티오닌을 직접 생산한다.메타네티올은 특정 화합물의 캐타볼릭 경로의 부산물이라 이 경로가 더 흔치 않다.[11]
- 호모시스테인이 생성되면 티올군은 메틸화돼 메티오닌이 분비된다.두 개의 메티오닌 시네시스가 알려져 있는데, 하나는 코발라민(비타민B12) 의존형이고 하나는 독립형이다.[11]
시스틴을 이용한 경로를 '변황 경로'라고 하고, 황화수소(또는 메탄에티올)를 이용한 경로를 '직접황화 경로'라고 한다.
Cysteine is similarly produced, namely it can be made from an activated serine and either from homocysteine ("reverse trans-sulfurylation route") or from hydrogen sulfide ("direct sulfurylation route"); the activated serine is generally O-acetyl-serine (via CysK or CysM in E. coli), but in Aeropyrum pernix and some other archaea O-phosphoserine is사용.[17] CysK와 CysM은 동음이의어지만 PLP 폴드 타입 III 클래드에 속한다.
트랜스설퓨릴레이션 경로
메티오닌 생합성의 대장균 트랜스설황화 경로에 관여하는 효소:
- 아스파르토키나아제
- 아스파르타이트-세미알데히드 탈수소효소
- 호모세린탈수소효소
- 호모세린오트렌수치닐라아제
- 시스타티오닌시싱타아제
- 시스타티오닌-β-릴레이아제
- 메티오닌 싱타아제(포유류의 경우 이 단계는 호모시스테인 메틸트랜스퍼레이제 또는 베테인-호모시스테인 S-메틸트랜스퍼레이제)에 의해 수행된다.
기타 생화학적 경로
포유류는 메티오닌을 합성할 수 없지만, 여전히 다양한 생화학적 경로에서 메티오닌을 사용할 수 있다.
카타볼리즘
메티오닌은 (1) 메티오닌 아데노실전달효소에 의해 S-adenosylmetionine (SAM-e)로 변환된다.
SAM-e는 많은 (2)메틸전달효소 반응에서 메틸도너 역할을 하며, S-adenosylhomosysteine(SAH)으로 전환된다.
(3) 아데노실호모시스테인아제 시스테인.
재생
메티오닌은 공동 인자로서12 비타민 B를 필요로 하는 반응으로 호모시스테인으로부터 (4)메티오닌 신타아제를 통해 재생될 수 있다.
Homocysteine can also be remethylated using glycine betaine (NNN-trimethyl glycine, TMG) to methionine via the enzyme betaine-homocysteine methyltransferase (E.C.2.1.1.5, BHMT). BHMT makes up to 1.5% of all the soluble protein of the liver, and recent evidence suggests that it may have a greater influence on methionine and homocysteine homeostasis메티오닌 싱타아제보다 더 많이 말이야
역투황화 경로: 시스틴으로의 전환
호모시스테인은 시스테인으로 전환될 수 있다.
- (5) 시스타티오닌-β-신타아제(비타민 B6, 피리독살 인산염의 활성 형태를 필요로 하는 효소)는 호모시스테인과 세린을 결합하여 시스타티오닌을 생성한다.생합성 경로에서처럼 시스타티오닌-β-랴제를 통해 시스타티오닌을 분해하는 대신, 시스타티오닌-β-랴제를 통해 시스틴과 α-케토부티레이트(α-ketobutyrate)로 분해한다.
- (7) 효소 α-케토아시드 탈수소효소는 α-케토부티레이트를 프로피오닐-CoA로 변환하여 3단계 공정에서 숙시닐-CoA로 대사한다(경로는 프로피오닐-CoA 참조).
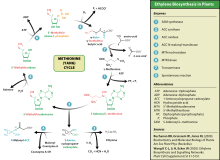
에틸렌 합성
이 아미노산은 식물이 에틸렌 합성을 위해 사용하기도 한다.이 과정은 양 사이클 또는 메티오닌 사이클로 알려져 있다.
화학합성
산업합성은 아크로아린, 메타네티올, 시안화합물을 합친 것으로 하이드란토를 함유하고 있다.[18]경혈성 메티오닌은 또한 클로로에틸메틸설황화물(ClCHCHCH223)을 사용한 알킬화에 의해 디에틸 나트륨 프탈리미달로네이트로부터 합성될 수 있다.[19]
인간영양
요구 사항들
미국 의학연구소 식품영양위원회는 2002년 필수 아미노산에 대한 권장 식이 허용량(RDA)을 설정했다.메티오닌과 시스틴을 결합한 경우, 19세 이상 성인의 경우 체중/일 19mg/kg을 섭취한다.[20]
이것은 70킬로그램의 개인이 하루에 약 1.33그램으로 해석된다.
식재료
| 음식 | g/100g |
|---|---|
| 계란, 흰색, 건조, 분말, 포도당 감소 | 3.204 |
| 참깨가루(저지방) | 1.656 |
| 브라질 견과류 | 1.124 |
| 치즈, 파르메산, 잘게 썬 | 1.114 |
| 굵은 삼베씨. | 0.933 |
| 콩 단백질 농축액 | 0.814 |
| 닭고기, 그릴러 또는 튀김 요리, 구운 요리 | 0.801 |
| 생선, 참치, 빛, 물에 통조림, 고형물 배출 | 0.755 |
| 쇠고기, 경화, 건조 | 0.749 |
| 베이컨 | 0.593 |
| 치아씨 | 0.588 |
| 쇠고기, 갈아놓은 것, 살코기 95% / 지방 5% 날것 | 0.565 |
| 돼지고기, 접지, 96% 희박 / 4% 지방, 생지 | 0.564 |
| 콩 | 0.547 |
| 밀 배아 | 0.456 |
| 계란, 통째로 익힌, 완숙 | 0.392 |
| 귀리 | 0.312 |
| 땅콩 | 0.309 |
| 칙페아 | 0.253 |
| 옥수수, 노랑 | 0.197 |
| 아몬드 | 0.151 |
| 콩, 핀토, 조리 | 0.117 |
| 렌틸스, 조리 | 0.077 |
| 현미, 갈색, 중회색, 조리 | 0.052 |
높은 수준의 메티오닌은 달걀, 고기, 생선, 참깨, 브라질 견과류, 그리고 다른 식물 씨앗, 그리고 곡물에서 발견될 수 있다.대부분의 과일과 야채는 아주 적은 양을 함유하고 있다.대부분의 콩기름은 단백질이 밀도가 높지만 메티오닌 함량이 낮다.적절한 메티오닌이 없는 단백질은 완전한 단백질로 간주되지 않는다.[22]이러한 이유로, 경마 메티오닌은 애완동물 사료에 재료로 첨가되기도 한다.[23]
제한
일부 과학적인 증거는 메티오닌 섭취를 제한하는 것이 초파리의 수명을 증가시킬 수 있다는 것을 보여준다.[24]
2005년 한 연구는 에너지 제한이 없는 메티오닌 제한이 생쥐의 수명을 연장한다는 것을 보여주었다.[25]이 연장은 온전한 성장 호르몬 신호를 필요로 하는데, 이는 온전한 성장 호르몬 신호-호르몬 신호는 메티오닌이 제한했을 때 수명을 더 이상 증가시키지 않기 때문이다.[26]메티오닌 제한에 대한 대사 반응은 돌연변이를 신호하는 생쥐 성장 호르몬에서도 변화한다.[27]
네이처에 발표된 한 연구는 필수 아미노산(EAs)의 제한 등 식생활 제한에 따른 과일 파리의 식단에 필수 아미노산 메티오닌을 첨가하고, 식생활 제한의 전형인 긴 수명을 줄이지 않고 생식력을 회복시켜, 연구자들이 메티오닌이 "작용을 한다"고 결정하도록 이끌었다.n 하나 이상의 다른 EAA와 결합하여 수명을 단축한다."[24][28][29]식이 제한 식이요법에 대한 생쥐의 식단에 메티오닌을 복원하는 것은 식이 제한의 많은 급성 이점을 차단하는데, 이 과정은 황화수소의 증산에 의해 매개될 수 있다.[30]
메티오닌 제한은 쥐에서 순환하는 간호르몬 FGF21을 5배에서 10배까지 증가시킬 수 있다.[31]메티오닌 제제는 생쥐의[32][33] 노화 관련 질병 과정을 억제하고 쥐의 대장 발암도 억제한다는 여러 연구결과가 나왔다.[34]인간의 경우 식이요법 개조를 통한 메티오닌 제약을 식물성 식이요법을 통해 달성할 수 있었다.[35]
식이성 메티오닌의 제한은 카타볼라이트 S-adenosylmetionine(SAM-e)의 수치를 감소시켜 히스톤 메틸화의 후속 손실이다.[36]H3K9의 특정 보존 메틸화에 의해 매개되는 활성 프로세스는 원래 메틸화 프로파일의 기억을 보존하여 식이성 메티오닌 수치가 반환될 때 후생유전자를 복원할 수 있다.[36]
쥐에 대한 2009년 연구는 "식단에서 메티오닌 보충제가 특히 랫드 간 미토콘드리아의 미토콘드리아 ROS 생산과 미토콘드리아 DNA 산화 손상을 증가시켜 간독성에 대한 그럴듯한 메커니즘을 제공한다"[37]고 밝혔다.
그러나 메티오닌은 필수 아미노산이기 때문에 시간이 지남에 따라 질병이나 사망이 발생하지 않는 한 동물의 식단에서 완전히 제거될 수는 없다.[citation needed]예를 들어 쥐는 메티오닌을 넣지 않은 채 식이요법을 했고 콜린은 스테아토헤패틴(지방간)과 빈혈에 걸렸고 5주 동안 체중의 3분의 2를 감량했다.메티오닌의 투여는 메티오닌 박탈의 병리학적 결과를 개선시켰다.[38]식단에서 메티오닌만 단기간 제거하면 식이요법에 의한 비만을 역전시킬 수 있고 쥐의 인슐린 민감성을 촉진시킬 수 있으며,[39] 메티오닌 제한도 자연발생적 다세대 비만과 당뇨병의 생쥐 모델을 보호해 준다.[40]
건강
메티오닌의 상실은 노망한 머리카락의 녹색화와 관련이 있다.이것의 부족은 모낭에 과산화수소가 축적되고, 티로시나아제 효과가 감소하며, 모발색을 점진적으로 감소시키는 결과를 초래한다.[41]메티오닌은 GSH의 세포내 농도를 높여 항산화 매개 세포 방어와 리독스 조절을 촉진한다.또한 산화 대사물을 결합시켜 도파민 유도 흑색세포 손실로부터 세포를 보호한다.[42]
메티오닌은 시스테인, 카르니틴, 타우린, 레시틴, 인산염, 그리고 다른 인산염의 생합성성의 중간이다.메티오닌의 부적절한 전환은 호모시스테인 축적으로 인한 아테롬성[43] 경화증을 초래할 수 있다.
기타 용도
DL-메시오닌은 개에 대한 보충물로 제공되기도 한다.이것은 개에게 신장결석이 생길 가능성을 줄이는데 도움을 준다.메티오닌은 또한 소변을 산성화하여 퀴니딘의 소변 배설을 증가시키는 것으로 알려져 있다.요로감염 치료에 사용되는 아미노글리코사이드 항생제는 알칼리성 질환에 가장 효과가 좋으며, 메티오닌을 사용함으로써 생기는 요로산화가 효과를 떨어뜨릴 수 있다.개가 오줌을 산성화하는 식이요법을 하고 있다면 메티오닌을 사용해서는 안 된다.[44]
메티오닌은 미국 인증 유기농 프로그램에 따라 유기농 가금 사료에 대한 보충제로서 허용된다.[45]
메티오닌은 오렌지 작물의 심각한 해충인 거대 제비꼬리 애벌레에 대한 무독성 농약 옵션으로 사용될 수 있다.[46]
참고 항목
참조
- ^ Dawson RM, Elliott DC, Elliott WH, Jones KM (1959). Data for Biochemical Research. Oxford: Clarendon Press.
- ^ Weast, Robert C., ed. (1981). CRC Handbook of Chemistry and Physics (62nd ed.). Boca Raton, FL: CRC Press. p. C-374. ISBN 0-8493-0462-8..
- ^ "Nomenclature and Symbolism for Amino Acids and Peptides". IUPAC-IUB Joint Commission on Biochemical Nomenclature. 1983. Archived from the original on 9 October 2008. Retrieved 5 March 2018.
- ^ "Methionine". Oxford University Press.
- ^ "Methionine". WebMD.
- ^ Cavuoto P, Fenech MF (2012). "A review of methionine dependency and the role of methionine restriction in cancer growth control and life-span extension". Cancer Treatment Reviews. 38 (6): 726–36. doi:10.1016/j.ctrv.2012.01.004. PMID 22342103.
- ^ Cellarier E, Durando X, Vasson MP, Farges MC, Demiden A, Maurizis JC, Madelmont JC, Chollet P (2003). "Methionine dependency and cancer treatment". Cancer Treatment Reviews. 29 (6): 489–99. doi:10.1016/S0305-7372(03)00118-X. PMID 14585259.
- ^ Pappenheimer AM (1987). "A Biographical Memoir of John Howard Mueller" (PDF). Washington D.C.: National Academy of Sciences.
- ^ Guedes RL, Prosdocimi F, Fernandes GR, Moura LK, Ribeiro HA, Ortega JM (December 2011). "Amino acids biosynthesis and nitrogen assimilation pathways: a great genomic deletion during eukaryotes evolution". BMC Genomics. 12 Suppl 4: S2. doi:10.1186/1471-2164-12-S4-S2. PMC 3287585. PMID 22369087.
- ^ Bigelow DJ, Squier TC (January 2005). "Redox modulation of cellular signaling and metabolism through reversible oxidation of methionine sensors in calcium regulatory proteins". Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics (Submitted manuscript). 1703 (2): 121–34. doi:10.1016/j.bbapap.2004.09.012. PMID 15680220.
- ^ a b c d e f g h i j k l m n Ferla MP, Patrick WM (August 2014). "Bacterial methionine biosynthesis". Microbiology. 160 (Pt 8): 1571–84. doi:10.1099/mic.0.077826-0. PMID 24939187.
- ^ Cirino PC, Tang Y, Takahashi K, Tirrell DA, Arnold FH (September 2003). "Global incorporation of norleucine in place of methionine in cytochrome P450 BM-3 heme domain increases peroxygenase activity". Biotechnology and Bioengineering. 83 (6): 729–34. doi:10.1002/bit.10718. PMID 12889037. S2CID 11380413.
- ^ Alvarez-Carreño C, Becerra A, Lazcano A (October 2013). "Norvaline and norleucine may have been more abundant protein components during early stages of cell evolution". Origins of Life and Evolution of the Biosphere. 43 (4–5): 363–75. Bibcode:2013OLEB...43..363A. doi:10.1007/s11084-013-9344-3. PMID 24013929. S2CID 17224537.
- ^ Jukes TH (August 1973). "Arginine as an evolutionary intruder into protein synthesis". Biochemical and Biophysical Research Communications. 53 (3): 709–14. doi:10.1016/0006-291x(73)90151-4. PMID 4731949.
- ^ Ikeuchi Y, Kimura S, Numata T, Nakamura D, Yokogawa T, Ogata T, Wada T, Suzuki T, Suzuki T (April 2010). "Agmatine-conjugated cytidine in a tRNA anticodon is essential for AUA decoding in archaea". Nature Chemical Biology. 6 (4): 277–82. doi:10.1038/nchembio.323. PMID 20139989.
- ^ Muramatsu T, Nishikawa K, Nemoto F, Kuchino Y, Nishimura S, Miyazawa T, Yokoyama S (November 1988). "Codon and amino-acid specificities of a transfer RNA are both converted by a single post-transcriptional modification". Nature. 336 (6195): 179–81. Bibcode:1988Natur.336..179M. doi:10.1038/336179a0. PMID 3054566. S2CID 4371485.
- ^ Mino K, Ishikawa K (September 2003). "A novel O-phospho-L-serine sulfhydrylation reaction catalyzed by O-acetylserine sulfhydrylase from Aeropyrum pernix K1". FEBS Letters. 551 (1–3): 133–8. doi:10.1016/S0014-5793(03)00913-X. PMID 12965218. S2CID 28360765.
- ^ Karlheinz Drauz, Ian Grayson, Axel Kleemann, Hans-Peter Krimmer, Wolfgang Leuchtenberger, Christoph Weckbecker (2006). Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a02_057.pub2.
{{cite encyclopedia}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ Barger G, Weichselbaum TE (1934). "dl-Methionine". Organic Syntheses. 14: 58.; Collective Volume, vol. 2, p. 384
- ^ Institute of Medicine (2002). "Protein and Amino Acids". Dietary Reference Intakes for Energy, Carbohydrates, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids. Washington, DC: The National Academies Press. pp. 589–768. doi:10.17226/10490. ISBN 978-0-309-08525-0.
- ^ "National Nutrient Database for Standard Reference". U.S. Department of Agriculture. Archived from the original on 2015-03-03. Retrieved 2009-09-07.
{{cite journal}}:Cite 저널은 필요로 한다.journal=(도움말) - ^ Finkelstein JD (May 1990). "Methionine metabolism in mammals". The Journal of Nutritional Biochemistry. 1 (5): 228–37. doi:10.1016/0955-2863(90)90070-2. PMID 15539209.
- ^ Palika L (1996). The Consumer's Guide to Dog Food: What's in Dog Food, Why It's There and How to Choose the Best Food for Your Dog. New York: Howell Book House. ISBN 978-0-87605-467-3.
- ^ a b Grandison RC, Piper MD, Partridge L (December 2009). "Amino-acid imbalance explains extension of lifespan by dietary restriction in Drosophila". Nature. 462 (7276): 1061–4. Bibcode:2009Natur.462.1061G. doi:10.1038/nature08619. PMC 2798000. PMID 19956092. Lay summary.
{{cite journal}}:Cite는 사용되지 않는 매개 변수를 사용한다.lay-url=(도움말) - ^ 밀러 RA, Buehner G, ChangY, 하퍼 JM, Sigler R, Smith-Wheelock M(2005년 6월)."Methionine-deficient 다이어트, 그리고 렌즈 면역 노화를 늦추고, 포도당, T4로서, 인슐린 양성 장인자 I과 인슐린 수치를 변화시키고 간 세포 유주 저지 인자 수준과 스트레스 저항을 증가시키 마우스 수명 확장되".고령화 세포. 4(3):119–25. doi:10.1111/j.1474-9726.2005.00152.x. PMC 7159399.PMID 15924568..
- ^ Brown-Borg HM, Rakoczy SG, Wonderlich JA, Rojanathammanee L, Kopchick JJ, Armstrong V, Raasakka D (December 2014). "Growth hormone signaling is necessary for lifespan extension by dietary methionine". Aging Cell. 13 (6): 1019–27. doi:10.1111/acel.12269. PMC 4244257. PMID 25234161.
- ^ Brown-Borg HM, Rakoczy S, Wonderlich JA, Borg KE, Rojanathammanee L (April 2018). "Metabolic adaptation of short-living growth hormone transgenic mice to methionine restriction and supplementation". Annals of the New York Academy of Sciences. 1418 (1): 118–136. Bibcode:2018NYASA1418..118B. doi:10.1111/nyas.13687. PMC 7025433. PMID 29722030.
- ^ Grandison RC, Piper MD, Partridge L (December 2009). "Amino-acid imbalance explains extension of lifespan by dietary restriction in Drosophila". Nature. 462 (7276): 1061–4. Bibcode:2009Natur.462.1061G. doi:10.1038/nature08619. PMC 2798000. PMID 19956092.
- ^ "Amino acid recipe could be right for long life". Science News. December 2, 2009.
- ^ Hine C, Harputlugil E, Zhang Y, Ruckenstuhl C, Lee BC, Brace L, Longchamp A, Treviño-Villarreal JH, Mejia P, Ozaki CK, Wang R, Gladyshev VN, Madeo F, Mair WB, Mitchell JR (January 2015). "Endogenous hydrogen sulfide production is essential for dietary restriction benefits". Cell. 160 (1–2): 132–44. doi:10.1016/j.cell.2014.11.048. PMC 4297538. PMID 25542313.
- ^ Fang H, Stone KP, Forney LA, Wanders D, Gettys TW (2021). "Nutritional Regulation of Hepatic FGF21 by Dietary Restriction of Methionine". Frontiers in Endocrinology. 12: 773975. doi:10.3389/fendo.2021.773975. PMC 8669746. PMID 34917032.
- ^ Richie JP, Leutzinger Y, Parthasarathy S, Malloy V, Orentreich N, Zimmerman JA (December 1994). "Methionine restriction increases blood glutathione and longevity in F344 rats". FASEB Journal. 8 (15): 1302–7. doi:10.1096/fasebj.8.15.8001743. PMID 8001743. S2CID 25198679.
- ^ Sun L, Sadighi Akha AA, Miller RA, Harper JM (July 2009). "Life-span extension in mice by preweaning food restriction and by methionine restriction in middle age". The Journals of Gerontology. Series A, Biological Sciences and Medical Sciences. 64 (7): 711–22. doi:10.1093/gerona/glp051. PMC 2691799. PMID 19414512.
- ^ Komninou D, Leutzinger Y, Reddy BS, Richie JP (2006). "Methionine restriction inhibits colon carcinogenesis". Nutrition and Cancer. 54 (2): 202–8. doi:10.1207/s15327914nc5402_6. PMID 16898864. S2CID 27492544.
- ^ Cavuoto P, Fenech MF (October 2012). "A review of methionine dependency and the role of methionine restriction in cancer growth control and life-span extension". Cancer Treatment Reviews. 38 (6): 726–36. doi:10.1016/j.ctrv.2012.01.004. PMID 22342103.
- ^ a b Haws, Spencer A.; Yu, Deyang; Ye, Cunqi; Wille, Coral K.; Nguyen, Long C.; Krautkramer, Kimberly A.; Tomasiewicz, Jay L.; Yang, Shany E.; Miller, Blake R.; Liu, Wallace H.; Igarashi, Kazuhiko (2020-03-13). "Methyl-Metabolite Depletion Elicits Adaptive Responses to Support Heterochromatin Stability and Epigenetic Persistence". Molecular Cell. 78 (2): 210–223.e8. doi:10.1016/j.molcel.2020.03.004. ISSN 1097-4164. PMC 7191556. PMID 32208170.
- ^ Gomez J, Caro P, Sanchez I, Naudi A, Jove M, Portero-Otin M, Lopez-Torres M, Pamplona R, Barja G (June 2009). "Effect of methionine dietary supplementation on mitochondrial oxygen radical generation and oxidative DNA damage in rat liver and heart". Journal of Bioenergetics and Biomembranes. 41 (3): 309–21. doi:10.1007/s10863-009-9229-3. PMID 19633937. S2CID 24106490.
- ^ Oz HS, Chen TS, Neuman M (March 2008). "Methionine deficiency and hepatic injury in a dietary steatohepatitis model". Digestive Diseases and Sciences. 53 (3): 767–76. doi:10.1007/s10620-007-9900-7. PMC 2271115. PMID 17710550.
- ^ Yu D, Yang SE, Miller BR, Wisinski JA, Sherman DS, Brinkman JA, Tomasiewicz JL, Cummings NE, Kimple ME, Cryns VL, Lamming DW (January 2018). "Short-term methionine deprivation improves metabolic health via sexually dimorphic, mTORC1-independent mechanisms". FASEB Journal. 32 (6): 3471–3482. doi:10.1096/fj.201701211R. PMC 5956241. PMID 29401631.
- ^ Castaño-Martinez, Teresa; Schumacher, Fabian; Schumacher, Silke; Kochlik, Bastian; Weber, Daniela; Grune, Tilman; Biemann, Ronald; McCann, Adrian; Abraham, Klaus (2019-03-06). "Methionine restriction prevents onset of type 2 diabetes in NZO mice". The FASEB Journal. 33 (6): 7092–7102. doi:10.1096/fj.201900150R. ISSN 1530-6860. PMC 6529347. PMID 30841758.
- ^ Wood JM, Decker H, Hartmann H, Chavan B, Rokos H, Spencer JD, et al. (July 2009). "Senile hair graying: H2O2-mediated oxidative stress affects human hair color by blunting methionine sulfoxide repair". FASEB Journal. 23 (7): 2065–75. arXiv:0706.4406. doi:10.1096/fj.08-125435. hdl:10454/6241. PMID 19237503. S2CID 16069417.
- ^ Pinnen F, et al. (2009). "Codrugs linking L-dopa and sulfur-containing antioxidants: new pharmacological tools against Parkinson's disease". Journal of Medicinal Chemistry. 52 (2): 559–63. doi:10.1021/jm801266x. PMID 19093882.
- ^ Refsum H, Ueland PM, Nygård O, Vollset SE (1998). "Homocysteine and cardiovascular disease". Annual Review of Medicine. 49 (1): 31–62. doi:10.1146/annurev.med.49.1.31. PMID 9509248.
- ^ 그림쇼, 제인(2011년 7월 25일) 개용 메티오닌과 부작용. critters360.com
- ^ "Rules and Regulations". Federal Register. 76 (49): 13501–13504. March 14, 2011.
- ^ Lewis DS, Cuda JP, Stevens BR (December 2011). "A novel biorational pesticide: efficacy of methionine against Heraclides (Papilio) cresphontes, a surrogate of the invasive Princeps (Papilio) demoleus (Lepidoptera: Papilionidae)". Journal of Economic Entomology. 104 (6): 1986–90. doi:10.1603/ec11132. PMID 22299361. S2CID 45255198.
외부 링크
- Rudra MN, Chowdhury LM (30 September 1950). "Methionine Content of Cereals and Legumes". Nature. 166 (568): 568. Bibcode:1950Natur.166..568R. doi:10.1038/166568a0. PMID 14780151. S2CID 3026278.