간섭 감마
Interferon gammaInterferon 타입 II를 이 기사에 통합하는 것이 제안되었다. (논의) 2022년 1월부터 제안되었다. |
| 간섭 감마 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 인간인터페론 감마 생물학적 활성 단일사슬 돌연변이의 결정 구조 | |||||||||
| 식별자 | |||||||||
| 기호. | IFN 감마 | ||||||||
| 팜 | PF00714 | ||||||||
| 빠맘 클랜 | CL0053 | ||||||||
| 인터프로 | IPR002069 | ||||||||
| SCOP2 | 1rfb / SCOPe / SUPFAM | ||||||||
| |||||||||
| 임상 데이터 | |
|---|---|
| 상호 | 액티무네 |
| AHFS/Drugs.com | 모노그래프 |
| Medline Plus | a601152 |
| ATC 코드 | |
| 식별자 | |
| |
| CAS 번호 | |
| 드러그뱅크 | |
| 켐스파이더 |
|
| 유니 | |
| 첸블 | |
| 화학 및 물리 데이터 | |
| 공식 | C761H1206N214O225S6 |
| 몰 질량 | 17145.65g/120−1 |
| | |
인터페론 감마(IFN-γ)는 2종류의 인터페론 [5]중 유일한 구성원인 이량화 수용성 사이토카인이다.역사 초기에 면역 간섭체로 알려진 이 간섭자의 존재는 E. F.에 의해 설명되었습니다.피토헤마글루티닌에 의해 자극된 인간 백혈구의 산물로서의 휠록 및 항원 자극 림프구의 [6]산물로서의 타인에 의한 휠록.그것은 또한 사람의 [7]림프구에서도 생성되는 것으로 나타났다.또는 투베르쿨린 감응 마우스 복막 림프구[8](PPD)가 만톡스 테스트(PPD)로 인해 발생하는 상등분자는 소포성 구내염 바이러스의 성장을 억제하는 것으로 나타났다.이들 보고서에는 결핵 검사에 사용되는 현재 널리 사용되는 IFN-γ 방출 분석의 기초가 되는 기본적인 관찰도 포함되어 있다.사람의 경우 IFN-α 단백질은 IFNG [9][10]유전자에 의해 암호화된다.
기능.
IFN-γ 또는 타입 II 간섭자는 바이러스, 박테리아 및 원생동물 감염에 대한 선천적이고 적응적인 면역에 중요한 사이토카인이다.IFN-γ는 대식세포의 중요한 활성제이며 주요 조직적합성 복합 클래스 II 분자 발현 유도제이다.이상 IFN-γ 발현은 많은 자가염증 및 자가면역질환과 관련이 있다.면역 체계에서 IFN-γ의 중요성은 부분적으로 바이러스 복제를 직접적으로 억제하는 능력, 그리고 가장 중요한 면역 자극 및 면역 조절 효과에서 비롯됩니다.IFN-γ는 선천적 면역반응의 일부로서 주로 천연 킬러 세포(NK)와 천연 킬러 T 세포(NKT)에 의해 생성되며, 항원 특이 면역이[11][12] 적응적 면역반응의 일부로서 발달하면 CD4 Th1 및 CD8 세포독성 T림프구(CTL) 이펙터 T세포에 의해 생성된다.IFN-γ는 또한 2010년대 [13]초에 처음 발견된 면역 세포 계열인 비세포독성 선천 림프세포(ILC)에 의해 생성된다.
구조.
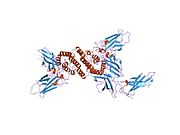
IFN-γ 단량체는 6개의 α-헬리체의 핵심과 C-말단 [14][15]영역에서 확장된 전개 배열로 구성됩니다.이는 아래 구조 모델에 나와 있습니다.구조물의 핵심부에 있는 α-헬리쉬의 번호는 1~6이다.
생물학적으로 활성화된 이합체는 아래와 같이 두 모노머의 반병렬 인터록에 의해 형성됩니다.만화 모형에서는 단량체 하나는 빨간색으로, 다른 하나는 파란색으로 표시되어 있습니다.
수용체 결합
IFN-γ에 대한 세포반응은 Interferon gamma receptor 1(IFNGR1) 및 Interferon gamma receptor 2(IFNGR2)로 이루어진 헤테로다이머 리셉터와의 상호작용을 통해 활성화된다.수용체에 대한 IFN-γ 결합은 JAK-STAT 경로를 활성화한다.JAK-STAT 경로의 활성화는 MHC [16]II를 포함한 간섭자 자극유전자(ISG)의 상향조절을 유도한다.IFN-γ도 세포표면의 글리코사미노글리칸 헤파란 황산염(HS)에 결합한다.그러나 결합이 생물학적 활성을 촉진하는 다른 많은 헤파란 황산염 결합 단백질과는 대조적으로 IFN-γ의 HS 결합은 그 생물학적 [17]활성을 억제한다.
IFN-γ에[15] 대한 그림 1-3의 구조 모델은 모두 C-termini에서 17개의 아미노산만큼 단축됩니다.풀렝스 IFN-γ는 143 아미노산 길이, 모델은 126 아미노산 길이입니다.헤파란 황산염에 대한 친화력은 오직 17개의 아미노산의 [18]결실 배열 내에 존재한다.이 17개의 아미노산 배열 내에는 각각 D1과 D2라고 불리는 두 개의 염기성 아미노산 클러스터가 있다.헤파란 황산염은 이 [19]두 클러스터와 상호작용합니다.황산 헤파란이 없는 경우 D1 배열의 존재는 IFN-γ-수용체 복합체의 형성 [17]속도를 증가시킨다.아미노산의 D1 클러스터와 수용체 사이의 상호작용은 복합 형성의 첫 번째 단계일 수 있다.D1에 결합함으로써 HS는 수용체와 경쟁할 수 있으며 활성 수용체 복합체가 형성되는 것을 방지할 수 있다.
헤파란황산염과 IFN-γ의 상호작용의 생물학적 의미는 명확하지 않지만, D1 클러스터가 HS에 결합하는 것은 H1 [19]클러스터를 단백질 분해 분열로부터 보호할 수 있다.
생물학적 활동
IFN-γ는 T 도우미 세포(구체적으로는 T1h 세포), 세포독성 T 세포(TC 세포), 대식세포, 점막상피세포 및 NK 세포에서 분비된다.IFN-γ는 초기 선천성 면역 반응에서 전문적 APC에 대한 중요한 자가분비 신호이며 적응 면역 반응에서 중요한 파라크린 신호이다.IFN-γ의 발현은 사이토카인 IL-12, IL-15, IL-18 및 I형 IFN에 [20]의해 유도된다. IFN-γ는 II형 간섭자이며 혈청학적으로 I형 간섭자와는 구별되며, I형 변이체는 산성이며, I형 변이체는 산성이 있다.
IFN-γ는 항바이러스성, 면역조절성, 항종양성을 [21]가지고 있다.그것은 다양한 생리적, 세포적 반응을 생성하는 최대 30개의 유전자의 전사를 변화시킨다.효과는 다음과 같습니다.
- NK세포 활동[22] 촉진
- 대식세포의 항원 제시 및 리소좀 활성을 증가시킨다.
- 유도성산화질소합성효소(iNOS) 활성화
- 활성화된 혈장 B 세포에서 IgG2a 및 IgG3 생성을 유도합니다.
- 항원 제시 세포에서 등급 II MHC뿐만 아니라 등급 II MHC 분자의 발현을 증가시킨다. MHC뿐만 아니라 면역단백질(MECL1, LMP2, LMP7)의 서브유닛을 포함한 항원 처리 유전자의 유도를 통해 MHC의 높은 직접 조절과 더불어 TAP 및 ERAAP를 통해 특이하게 한다.로글로불린 자체
- 백혈구 이동에 필요한 접착 및 결합 촉진
- 고유 방어 인자의 발현을 유도한다. 예를 들어 레트로바이러스와 관련하여 관련 유전자는 직접 항바이러스 효과를 나타내는 TRIM5alpha, APOBEC 및 테데린을 포함한다.
- 2차 세균 [23][24]감염에 대한 치경 대식세포의 소수점.
는 Th1 세포를 정의합니다 IFN-γ은 기본 작용하는 사이토카인:.Th1 세포의 분비를 IFN-γ고, 차례로 이것 더 구분되지 않는 CD4+ 세포들이 Th1 세포로 Th2 세포 분화 억제 loop—while에 대해 긍정적인 의견을 나타내는 ,[25]을 차별화하는 것.(Th0 세포)(등가 정의하는 생화학제를 위해 다른 세포 포함한다 IL-4에 Th2 세포와 IL-17에 Th17 ce.lls)
NK세포 및 CD8+ 세포독성 T세포도 IFN-γ를 생성하며, IFN-γ는 RANK-LANKL 시그널링 경로에서 RANK 어댑터 단백질 TRAF6를 급속히 분해하여 골세포 형성을 억제하고, 그렇지 않으면 NF-γB 생성을 촉진한다.
육아종 형성 활성
육아종은 제거하거나 살균할 수 없는 물질을 다루는 신체의 방법이다.육아종의 감염 원인에는 결핵, 나병, 히스토플라스마증, 크립토코커스증, 콕시디오이드균증, 배반균증, 톡소플라스마증 등이 있습니다.비감염성 육아종 질환의 예로는 육종증, 크론병, 베릴리증, 거세포동맥염, 다발성 혈관염 육아종증, 다발성 혈관염이 있는 호산성 육아종증, 폐 류마티스 결절, 음식물 등의 미립자 물질의 [26]폐내 흡인 등이 있다.육아종의 감염성 병태생리학은 주로 여기에서 논의된다.
IFN-γ와 육아종 사이의 주요 연관성은 IFN-γ가 대식세포를 활성화하여 세포 내 [27]유기체를 죽이는데 있어 대식세포가 더 강력해 진다는 것이다.마이코박테리아 감염의 T1h 도우미 세포로부터의 IFN-γ에 의한 대식세포의 활성화에 의해 마이코박테리아에 의한(대식세포 [28][29]내에서의 존속) 식중독 성숙의 억제를 극복할 수 있다.IFN 유도 육아종 형성의 첫 단계는 세포 내 병원체의 존재 하에서 대식세포가 IL-1과 IL-12를 방출함으로써 T1h 도우미 세포를 활성화하고 이러한 병원체로부터 항원을 제시하는 것이다.다음으로 T1h 도우미 셀은 대식세포 주위에 집결하여 대식세포를 활성화하는 IFN-ll을 방출합니다.대식세포의 추가 활성화는 세포내 세균의 추가 살처분 사이클을 야기하고 IFN-γ의 추가 방출과 함께 T1h 도우미 세포에 대한 항원의 제시를 촉진한다.마지막으로 대식세포는 T1h 도우미 세포를 둘러싸고 감염을 막는 섬유아세포와 같은 세포가 된다.
임신 중 활동
자궁내추럴킬러세포(NK)는 생쥐에서 IFN-γ와 같은 높은 수준의 화학 유인제를 분비합니다.IFN-α는 모체 나선 동맥의 벽을 확장 및 박아 이식 부위로의 혈류를 향상시킵니다.이 리모델링은 태반이 영양분을 찾는 과정에서 자궁에 침입하면서 태반의 발달을 돕는다.IFN-γ 녹아웃 마우스는 십이지장 동맥의 정상적인 임신 유도 수정을 시작하지 못한다.이 모델들은 비정상적으로 적은 양의 세포나 데시두아의 [30]괴사를 보여준다.
인간의 경우 IFN-li의 수치가 높아지면 유산 위험이 높아집니다.상관관계 연구는 [31]자연유산이력이 없는 여성에 비해 자연유산이력이 있는 여성에게서 높은 IFN-γ 수치를 관찰했다.또한, 낮은 IFN-γ 수치는 성공적으로 임기를 채운 여성들과 관련이 있다.IFN-γ는 영양아세포에 세포독성이 있어 [32]유산으로 이어질 수 있다.그러나 IFN-α와 유산의 관계에 대한 인과관계 연구는 윤리적 제약으로 인해 수행되지 않았다.
생산.
고가의 바이오 의약품인 재조합 인간 IFN-ll은 원핵생물, 원생동물, 곰팡이(효모), 식물, 곤충 및 포유동물 세포를 포함한 다른 발현 체계로 발현되어 왔다.인간 IFN은 일반적으로 ACTIMMUNE®로 판매되는 대장균에서 발현되지만, 원핵발현 시스템의 결과물은 주입 후 혈류에서 짧은 반감기로 글리코실화되지 않으며, 세균발현 시스템으로부터의 정제 과정도 매우 비용이 많이 든다.Pichia pastoris와 같은 다른 표현 체계는 생산량 [33][34]면에서 만족스러운 결과를 나타내지 못했다.
치료용 사용
Interferon- 1 1b는 미국 식품의약국에 의해 만성 육아종[35](CGD) 및 골페트로시스 [36]치료에 대해 승인되었습니다.IFN-γ가 CGD에 도움이 되는 메커니즘은 환자의 산화대사를 [37]교정함으로써 카탈라아제 양성균에 대한 호중구의 효과를 높이는 것이다.
특발성 폐섬유증(IPF) 치료에는 승인되지 않았다.2002년 제조사 InterMune은 3단계 데이터가 IPF에서 생존 이익을 보여주고 경증에서 중등도 질환 환자의 사망률을 70% 줄였다는 보도 자료를 발표했다.미 법무부는 그 석방에는 거짓되고 오해의 소지가 있는 진술들이 포함되어 있다고 비난했다.인터무네의 최고경영자인 스콧 하코넨은 재판 자료를 조작한 혐의로 기소됐으며 2009년 통신사기 혐의로 유죄 판결을 받아 벌금과 사회봉사형을 선고받았다.하코넨은 미국 제9순회항소법원에 유죄판결을 항소했으나 [38]패소했다.하코넨은 2021년 [39]1월 20일 완전한 사면을 받았다.
필라델피아 소아병원이 실시한 프리드라이히 운동실조증(FA) 치료에서 IFN-γ의 역할에 대한 예비 연구는 단기(<[40][41][42] 6개월) 치료에서 유익한 효과를 발견하지 못했다.하지만, 터키의 연구원들은 6개월의 [43]치료 후에 환자들의 걸음걸이와 자세가 크게 개선되었다는 것을 발견했다.
공식적으로 승인되지는 않았지만, 중간 정도에서 심각한 아토피 피부염 [44][45][46]환자를 치료하는데도 효과가 있는 것으로 나타났습니다.구체적으로는 단순 헤르페스 바이러스 성향을 가진 환자나 소아과 [47]환자 등 IFN-γ 발현이 낮은 환자에서 재조합 IFN-γ 치료가 유망하다는 것을 보여주었다.
면역요법에서의 잠재적 사용
IFN-γ는 암세포의 항증식 상태를 증가시키고, MHC I 및 MHC II 발현을 상향 조절하여 면역 인지 및 병원성 [48]세포의 제거를 증가시킨다.IFN-γ는 또한 종양 [49]구조에 부정적인 영향을 미치는 피브로넥틴을 상향 조절하여 종양의 전이를 감소시킨다.
IFN-γ는 어떤 암 면역 치료에서도 아직 치료에 대해 승인되지 않았습니다.그러나 방광암과 흑색종암 환자에게 IFN-γ를 투여했을 때 생존율이 개선되었다.가장 유망한 결과는 난소암 2기와 3기 환자에게서 나왔다.반면 CD8 양성 림프구에서 분비되는 인터페론-γ는 난소암세포의 PD-L1을 상향 조절해 종양 [50]성장을 촉진한다고 강조했다.암세포에서 IFN-γ에 대한 시험관내 연구는 보다 광범위하며, 결과는 IFN-γ의 항증식 활성이 성장 억제 또는 세포 사멸로 이어지고, 일반적으로 아포토시스에 의해 유도되지만 때로는 자가 파지에 [33]의해 유도된다는 것을 보여준다.또한 HEK293에서 발현되는 재조합 인간 IFN-γ의 포유동물 글리코실화는 [51]대장균에서 발현되는 비당화 형태에 비해 치료 효과를 향상시키는 것으로 보고되었다.
상호 작용
인터페론-γ는 인터페론 감마 수용체 1 및 인터페론 감마 수용체 [52][53]2와 상호작용하는 것으로 나타났다.
질병.
인터페론-γ는 샤가스병을 [54]포함한 일부 세포 내 병원균에 대한 면역 반응에 중요한 역할을 하는 것으로 나타났다.또한 지루성 [55]피부염에 관여하는 것으로 확인되었다.
IFN-γ는 헤르페스 단순 바이러스 I(HSV) 감염에서 항바이러스 효과가 크다.IFN-ll은 HSV가 감염된 세포의 핵으로 전송하기 위해 의존하는 미세관을 손상시켜 HSV의 [56][57]복제 능력을 억제합니다.생쥐를 대상으로 한 아시클로빌 내성 헤르페스에 대한 연구는 IFN-γ 치료가 헤르페스 바이러스 부하를 크게 줄일 수 있다는 것을 보여주었다.IFN-γ가 헤르페스 번식을 억제하는 메커니즘은 T세포와 독립적이며, 이는 IFN-γ가 T세포가 [58][59][60]낮은 개인에게 효과적인 치료법이 될 수 있음을 의미한다.
클라미디아 감염은 숙주 세포의 IFN-γ에 의해 영향을 받는다.인간 상피세포에서 IFN-γ는 인돌아민 2,3-디옥시게나아제의 발현을 상향조정하여 숙주의 트립토판을 감소시켜 클라미디아 [61][62]번식을 저해한다.또한 설치류 상피세포에서 IFNγ는 클라미디아 [63]증식을 억제하는 GTPase를 상향 조절한다.인간과 설치류 시스템 모두에서 클라미디아는 숙주 세포 [64]행동의 부정적인 영향을 피하기 위한 메커니즘을 진화시켰다.
규정
5' [65]UTR의 의사 노트 원소에 의해 간섭-감마 표현이 조절된다는 증거가 있다.또한 간섭성 감마는 마이크로RNA인 miR-29에 [66]의해 직간접적으로 조절된다는 증거가 있다.또한 T세포에서 GAPDH를 통해 간섭 감마의 발현을 조절한다는 증거가 있다.이 상호작용은 3'에 발생합니다.UTR. GAPDH 결합으로 mRNA [67]시퀀스의 변환이 방해됩니다.
레퍼런스
- ^ a b c GRCh38: 앙상블 릴리즈 89: ENSG00000111537 - 앙상블, 2017년 5월
- ^ a b c GRCm38: 앙상블 릴리즈 89: ENSMUSG000055170 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Gray PW, Goeddel DV (August 1982). "Structure of the human immune interferon gene". Nature. 298 (5877): 859–863. Bibcode:1982Natur.298..859G. doi:10.1038/298859a0. PMID 6180322. S2CID 4275528.
- ^ Wheelock EF (July 1965). "Interferon-Like Virus-Inhibitor Induced in Human Leukocytes by Phytohemagglutinin". Science. 149 (3681): 310–311. Bibcode:1965Sci...149..310W. doi:10.1126/science.149.3681.310. PMID 17838106. S2CID 1366348.
- ^ Green JA, Cooperband SR, Kibrick S (June 1969). "Immune specific induction of interferon production in cultures of human blood lymphocytes". Science. 164 (3886): 1415–1417. Bibcode:1969Sci...164.1415G. doi:10.1126/science.164.3886.1415. PMID 5783715. S2CID 32651832.
- ^ Milstone LM, Waksman BH (November 1970). "Release of virus inhibitor from tuberculin-sensitized peritoneal cells stimulated by antigen". Journal of Immunology. 105 (5): 1068–1071. PMID 4321289.
- ^ Naylor SL, Sakaguchi AY, Shows TB, Law ML, Goeddel DV, Gray PW (March 1983). "Human immune interferon gene is located on chromosome 12". The Journal of Experimental Medicine. 157 (3): 1020–1027. doi:10.1084/jem.157.3.1020. PMC 2186972. PMID 6403645.
- ^ "Entrez Gene: IFNGR2".
- ^ "Entrez Gene: INFG".
- ^ Schoenborn JR, Wilson CB (2007). "Regulation of Interferon‐γ During Innate and Adaptive Immune Responses". Regulation of interferon-gamma during innate and adaptive immune responses. Advances in Immunology. Vol. 96. pp. 41–101. doi:10.1016/S0065-2776(07)96002-2. ISBN 978-0-12-373709-0. PMID 17981204.
- ^ Artis D, Spits H (January 2015). "The biology of innate lymphoid cells". Nature. 517 (7534): 293–301. Bibcode:2015Natur.517..293A. doi:10.1038/nature14189. PMID 25592534. S2CID 4386692.
- ^ Ealick SE, Cook WJ, Vijay-Kumar S, Carson M, Nagabhushan TL, Trotta PP, Bugg CE (May 1991). "Three-dimensional structure of recombinant human interferon-gamma". Science. 252 (5006): 698–702. Bibcode:1991Sci...252..698E. doi:10.1126/science.1902591. PMID 1902591.
- ^ a b c d e PDB: 1FG9; Thiel DJ, le Du MH, Walter RL, D'Arcy A, Chène C, Fountoulakis M, et al. (September 2000). "Observation of an unexpected third receptor molecule in the crystal structure of human interferon-gamma receptor complex". Structure. 8 (9): 927–936. doi:10.1016/S0969-2126(00)00184-2. PMID 10986460.
- ^ Hu X, Ivashkiv LB (October 2009). "Cross-regulation of signaling pathways by interferon-gamma: implications for immune responses and autoimmune diseases". Immunity. 31 (4): 539–550. doi:10.1016/j.immuni.2009.09.002. PMC 2774226. PMID 19833085.
- ^ a b Sadir R, Forest E, Lortat-Jacob H (May 1998). "The heparan sulfate binding sequence of interferon-gamma increased the on rate of the interferon-gamma-interferon-gamma receptor complex formation". The Journal of Biological Chemistry. 273 (18): 10919–10925. doi:10.1074/jbc.273.18.10919. PMID 9556569.
- ^ Vanhaverbeke C, Simorre JP, Sadir R, Gans P, Lortat-Jacob H (November 2004). "NMR characterization of the interaction between the C-terminal domain of interferon-gamma and heparin-derived oligosaccharides". The Biochemical Journal. 384 (Pt 1): 93–99. doi:10.1042/BJ20040757. PMC 1134092. PMID 15270718.
- ^ a b Lortat-Jacob H, Grimaud JA (March 1991). "Interferon-gamma binds to heparan sulfate by a cluster of amino acids located in the C-terminal part of the molecule". FEBS Letters. 280 (1): 152–154. doi:10.1016/0014-5793(91)80225-R. PMID 1901275. S2CID 45942972.
- ^ Castro F, Cardoso AP, Gonçalves RM, Serre K, Oliveira MJ (2018). "Interferon-Gamma at the Crossroads of Tumor Immune Surveillance or Evasion". Frontiers in Immunology. 9: 847. doi:10.3389/fimmu.2018.00847. PMC 5945880. PMID 29780381.
- ^ Schroder K, Hertzog PJ, Ravasi T, Hume DA (February 2004). "Interferon-gamma: an overview of signals, mechanisms and functions". Journal of Leukocyte Biology. 75 (2): 163–189. doi:10.1189/jlb.0603252. PMID 14525967. S2CID 15862242.
- ^ Konjević GM, Vuletić AM, Mirjačić Martinović KM, Larsen AK, Jurišić VB (May 2019). "The role of cytokines in the regulation of NK cells in the tumor environment". Cytokine. 117: 30–40. doi:10.1016/j.cyto.2019.02.001. PMID 30784898. S2CID 73482632.
- ^ Hoyer FF, Naxerova K, Schloss MJ, Hulsmans M, Nair AV, Dutta P, et al. (November 2019). "Tissue-Specific Macrophage Responses to Remote Injury Impact the Outcome of Subsequent Local Immune Challenge". Immunity. 51 (5): 899–914.e7. doi:10.1016/j.immuni.2019.10.010. PMC 6892583. PMID 31732166.
- ^ Yao Y, Jeyanathan M, Haddadi S, Barra NG, Vaseghi-Shanjani M, Damjanovic D, et al. (November 2018). "Induction of Autonomous Memory Alveolar Macrophages Requires T Cell Help and Is Critical to Trained Immunity". Cell. 175 (6): 1634–1650.e17. doi:10.1016/j.cell.2018.09.042. PMID 30433869.
- ^ Luckheeram RV, Zhou R, Verma AD, Xia B (2012). "CD4⁺T cells: differentiation and functions". Clinical & Developmental Immunology. 2012: 925135. doi:10.1155/2012/925135. PMC 3312336. PMID 22474485.
- ^ Mukhopadhyay S, Farver CF, Vaszar LT, Dempsey OJ, Popper HH, Mani H, et al. (January 2012). "Causes of pulmonary granulomas: a retrospective study of 500 cases from seven countries". Journal of Clinical Pathology. 65 (1): 51–57. doi:10.1136/jclinpath-2011-200336. PMID 22011444. S2CID 28504428.
- ^ Wu C, Xue Y, Wang P, Lin L, Liu Q, Li N, et al. (September 2014). "IFN-γ primes macrophage activation by increasing phosphatase and tensin homolog via downregulation of miR-3473b". Journal of Immunology. 193 (6): 3036–3044. doi:10.4049/jimmunol.1302379. PMID 25092892. S2CID 90897269.
- ^ Herbst S, Schaible UE, Schneider BE (May 2011). "Interferon gamma activated macrophages kill mycobacteria by nitric oxide induced apoptosis". PLOS ONE. 6 (5): e19105. Bibcode:2011PLoSO...619105H. doi:10.1371/journal.pone.0019105. PMC 3085516. PMID 21559306.
- ^ Harris J, Master SS, De Haro SA, Delgado M, Roberts EA, Hope JC, et al. (March 2009). "Th1-Th2 polarisation and autophagy in the control of intracellular mycobacteria by macrophages". Veterinary Immunology and Immunopathology. 128 (1–3): 37–43. doi:10.1016/j.vetimm.2008.10.293. PMC 2789833. PMID 19026454.
- ^ Ashkar AA, Di Santo JP, Croy BA (July 2000). "Interferon gamma contributes to initiation of uterine vascular modification, decidual integrity, and uterine natural killer cell maturation during normal murine pregnancy". The Journal of Experimental Medicine. 192 (2): 259–270. doi:10.1084/jem.192.2.259. PMC 2193246. PMID 10899912.
- ^ Micallef A, Grech N, Farrugia F, Schembri-Wismayer P, Calleja-Agius J (January 2014). "The role of interferons in early pregnancy". Gynecological Endocrinology. 30 (1): 1–6. doi:10.3109/09513590.2012.743011. PMID 24188446. S2CID 207489059.
- ^ Berkowitz RS, Hill JA, Kurtz CB, Anderson DJ (January 1988). "Effects of products of activated leukocytes (lymphokines and monokines) on the growth of malignant trophoblast cells in vitro". American Journal of Obstetrics and Gynecology. 158 (1): 199–203. doi:10.1016/0002-9378(88)90810-1. PMID 2447775.
- ^ a b Razaghi A, Owens L, Heimann K (December 2016). "Review of the recombinant human interferon gamma as an immunotherapeutic: Impacts of production platforms and glycosylation". Journal of Biotechnology. 240: 48–60. doi:10.1016/j.jbiotec.2016.10.022. PMID 27794496.
- ^ Razaghi A, Tan E, Lua LH, Owens L, Karthikeyan OP, Heimann K (January 2017). "Is Pichia pastoris a realistic platform for industrial production of recombinant human interferon gamma?". Biologicals. 45: 52–60. doi:10.1016/j.biologicals.2016.09.015. PMID 27810255. S2CID 28204059.
- ^ Todd PA, Goa KL (January 1992). "Interferon gamma-1b. A review of its pharmacology and therapeutic potential in chronic granulomatous disease". Drugs. 43 (1): 111–122. doi:10.2165/00003495-199243010-00008. PMID 1372855. S2CID 46986837.
- ^ Key LL, Ries WL, Rodriguiz RM, Hatcher HC (July 1992). "Recombinant human interferon gamma therapy for osteopetrosis". The Journal of Pediatrics. 121 (1): 119–124. doi:10.1016/s0022-3476(05)82557-0. PMID 1320672.
- ^ Errante PR, Frazão JB, Condino-Neto A (November 2008). "The use of interferon-gamma therapy in chronic granulomatous disease". Recent Patents on Anti-Infective Drug Discovery. 3 (3): 225–230. doi:10.2174/157489108786242378. PMID 18991804.
- ^ Silverman E (September 2013). "Drug Marketing. The line between scientific uncertainty and promotion of snake oil". BMJ. 347: f5687. doi:10.1136/bmj.f5687. PMID 24055923. S2CID 27716008.
- ^ "Statement from the Press Secretary Regarding Executive Grants of Clemency". whitehouse.gov. January 20, 2021 – via National Archives.
- ^ Wells M, Seyer L, Schadt K, Lynch DR (December 2015). "IFN-γ for Friedreich ataxia: present evidence". Neurodegenerative Disease Management. 5 (6): 497–504. doi:10.2217/nmt.15.52. PMID 26634868.
- ^ Seyer L, Greeley N, Foerster D, Strawser C, Gelbard S, Dong Y, et al. (July 2015). "Open-label pilot study of interferon gamma-1b in Friedreich ataxia". Acta Neurologica Scandinavica. 132 (1): 7–15. doi:10.1111/ane.12337. PMID 25335475. S2CID 207014054.
- ^ Lynch DR, Hauser L, McCormick A, Wells M, Dong YN, McCormack S, et al. (March 2019). "Randomized, double-blind, placebo-controlled study of interferon-γ 1b in Friedreich Ataxia". Annals of Clinical and Translational Neurology. 6 (3): 546–553. doi:10.1002/acn3.731. PMC 6414489. PMID 30911578.
- ^ Yetkİn MF, GÜltekİn M (December 2020). "Efficacy and Tolerability of Interferon Gamma in Treatment of Friedreich's Ataxia: Retrospective Study". Noro Psikiyatri Arsivi. 57 (4): 270–273. doi:10.29399/npa.25047. PMC 7735154. PMID 33354116.
- ^ Akhavan A, Rudikoff D (June 2008). "Atopic dermatitis: systemic immunosuppressive therapy". Seminars in Cutaneous Medicine and Surgery. 27 (2): 151–155. doi:10.1016/j.sder.2008.04.004. PMID 18620137.
- ^ Schneider LC, Baz Z, Zarcone C, Zurakowski D (March 1998). "Long-term therapy with recombinant interferon-gamma (rIFN-gamma) for atopic dermatitis". Annals of Allergy, Asthma & Immunology. 80 (3): 263–268. doi:10.1016/S1081-1206(10)62968-7. PMID 9532976.
- ^ Hanifin JM, Schneider LC, Leung DY, Ellis CN, Jaffe HS, Izu AE, et al. (February 1993). "Recombinant interferon gamma therapy for atopic dermatitis". Journal of the American Academy of Dermatology. 28 (2 Pt 1): 189–197. doi:10.1016/0190-9622(93)70026-p. PMID 8432915.
- ^ Brar K, Leung DY (2016). "Recent considerations in the use of recombinant interferon gamma for biological therapy of atopic dermatitis". Expert Opinion on Biological Therapy. 16 (4): 507–514. doi:10.1517/14712598.2016.1135898. PMC 4985031. PMID 26694988.
- ^ Kak G, Raza M, Tiwari BK (May 2018). "Interferon-gamma (IFN-γ): Exploring its implications in infectious diseases". Biomolecular Concepts. 9 (1): 64–79. doi:10.1515/bmc-2018-0007. PMID 29856726. S2CID 46922378.
- ^ Jorgovanovic D, Song M, Wang L, Zhang Y (2020-09-29). "Roles of IFN-γ in tumor progression and regression: a review". Biomarker Research. 8 (1): 49. doi:10.1186/s40364-020-00228-x. PMC 7526126. PMID 33005420.
- ^ Abiko K, Matsumura N, Hamanishi J, Horikawa N, Murakami R, Yamaguchi K, et al. (April 2015). "IFN-γ from lymphocytes induces PD-L1 expression and promotes progression of ovarian cancer". British Journal of Cancer. 112 (9): 1501–1509. doi:10.1038/bjc.2015.101. PMC 4453666. PMID 25867264.
- ^ Razaghi A, Villacrés C, Jung V, Mashkour N, Butler M, Owens L, Heimann K (October 2017). "Improved therapeutic efficacy of mammalian expressed-recombinant interferon gamma against ovarian cancer cells". Experimental Cell Research. 359 (1): 20–29. doi:10.1016/j.yexcr.2017.08.014. PMID 28803068. S2CID 12800448.
- ^ Thiel DJ, le Du MH, Walter RL, D'Arcy A, Chène C, Fountoulakis M, et al. (September 2000). "Observation of an unexpected third receptor molecule in the crystal structure of human interferon-gamma receptor complex". Structure. 8 (9): 927–936. doi:10.1016/S0969-2126(00)00184-2. PMID 10986460.
- ^ Kotenko SV, Izotova LS, Pollack BP, Mariano TM, Donnelly RJ, Muthukumaran G, et al. (September 1995). "Interaction between the components of the interferon gamma receptor complex". The Journal of Biological Chemistry. 270 (36): 20915–20921. doi:10.1074/jbc.270.36.20915. PMID 7673114.
- ^ Leon Rodriguez DA, Carmona FD, Echeverría LE, González CI, Martin J (March 2016). "IL18 Gene Variants Influence the Susceptibility to Chagas Disease". PLOS Neglected Tropical Diseases. 10 (3): e0004583. doi:10.1371/journal.pntd.0004583. PMC 4814063. PMID 27027876.
- ^ Trznadel-Grodzka E, Błaszkowski M, Rotsztejn H (November 2012). "Investigations of seborrheic dermatitis. Part I. The role of selected cytokines in the pathogenesis of seborrheic dermatitis". Postepy Higieny I Medycyny Doswiadczalnej. 66: 843–847. doi:10.5604/17322693.1019642. PMID 23175340.
- ^ Bigley NJ (2014-02-06). "Complexity of Interferon-γ Interactions with HSV-1". Frontiers in Immunology. 5: 15. doi:10.3389/fimmu.2014.00015. PMC 3915238. PMID 24567732.
- ^ Sodeik B, Ebersold MW, Helenius A (March 1997). "Microtubule-mediated transport of incoming herpes simplex virus 1 capsids to the nucleus". The Journal of Cell Biology. 136 (5): 1007–1021. doi:10.1083/jcb.136.5.1007. PMC 2132479. PMID 9060466.
- ^ Huang WY, Su YH, Yao HW, Ling P, Tung YY, Chen SH, et al. (March 2010). "Beta interferon plus gamma interferon efficiently reduces acyclovir-resistant herpes simplex virus infection in mice in a T-cell-independent manner". The Journal of General Virology. 91 (Pt 3): 591–598. doi:10.1099/vir.0.016964-0. PMID 19906941.
- ^ Sainz B, Halford WP (November 2002). "Alpha/Beta interferon and gamma interferon synergize to inhibit the replication of herpes simplex virus type 1". Journal of Virology. 76 (22): 11541–11550. doi:10.1128/JVI.76.22.11541-11550.2002. PMC 136787. PMID 12388715.
- ^ Khanna KM, Lepisto AJ, Decman V, Hendricks RL (August 2004). "Immune control of herpes simplex virus during latency". Current Opinion in Immunology. 16 (4): 463–469. doi:10.1016/j.coi.2004.05.003. PMID 15245740.
- ^ Rottenberg ME, Gigliotti-Rothfuchs A, Wigzell H (August 2002). "The role of IFN-gamma in the outcome of chlamydial infection". Current Opinion in Immunology. 14 (4): 444–451. doi:10.1016/s0952-7915(02)00361-8. PMID 12088678.
- ^ Taylor MW, Feng GS (August 1991). "Relationship between interferon-gamma, indoleamine 2,3-dioxygenase, and tryptophan catabolism". FASEB Journal. 5 (11): 2516–2522. doi:10.1096/fasebj.5.11.1907934. PMID 1907934. S2CID 25298471.
- ^ Bernstein-Hanley I, Coers J, Balsara ZR, Taylor GA, Starnbach MN, Dietrich WF (September 2006). "The p47 GTPases Igtp and Irgb10 map to the Chlamydia trachomatis susceptibility locus Ctrq-3 and mediate cellular resistance in mice". Proceedings of the National Academy of Sciences of the United States of America. 103 (38): 14092–14097. Bibcode:2006PNAS..10314092B. doi:10.1073/pnas.0603338103. PMC 1599917. PMID 16959883.
- ^ Nelson DE, Virok DP, Wood H, Roshick C, Johnson RM, Whitmire WM, et al. (July 2005). "Chlamydial IFN-gamma immune evasion is linked to host infection tropism". Proceedings of the National Academy of Sciences of the United States of America. 102 (30): 10658–10663. Bibcode:2005PNAS..10210658N. doi:10.1073/pnas.0504198102. PMC 1180788. PMID 16020528.
- ^ Ben-Asouli Y, Banai Y, Pel-Or Y, Shir A, Kaempfer R (January 2002). "Human interferon-gamma mRNA autoregulates its translation through a pseudoknot that activates the interferon-inducible protein kinase PKR". Cell. 108 (2): 221–232. doi:10.1016/S0092-8674(02)00616-5. PMID 11832212. S2CID 14722737.
- ^ Asirvatham AJ, Gregorie CJ, Hu Z, Magner WJ, Tomasi TB (April 2008). "MicroRNA targets in immune genes and the Dicer/Argonaute and ARE machinery components". Molecular Immunology. 45 (7): 1995–2006. doi:10.1016/j.molimm.2007.10.035. PMC 2678893. PMID 18061676.
- ^ Chang CH, Curtis JD, Maggi LB, Faubert B, Villarino AV, O'Sullivan D, et al. (June 2013). "Posttranscriptional control of T cell effector function by aerobic glycolysis". Cell. 153 (6): 1239–1251. doi:10.1016/j.cell.2013.05.016. PMC 3804311. PMID 23746840.
추가 정보
- Hall SK (1997). A commotion in the blood: life, death, and the immune system. New York: Henry Holt. ISBN 978-0-8050-5841-3.
- Ikeda H, Old LJ, Schreiber RD (April 2002). "The roles of IFN gamma in protection against tumor development and cancer immunoediting". Cytokine & Growth Factor Reviews. 13 (2): 95–109. doi:10.1016/S1359-6101(01)00038-7. PMID 11900986.
- Chesler DA, Reiss CS (December 2002). "The role of IFN-gamma in immune responses to viral infections of the central nervous system". Cytokine & Growth Factor Reviews. 13 (6): 441–454. doi:10.1016/S1359-6101(02)00044-8. PMID 12401479.
- Dessein A, Kouriba B, Eboumbou C, Dessein H, Argiro L, Marquet S, et al. (October 2004). "Interleukin-13 in the skin and interferon-gamma in the liver are key players in immune protection in human schistosomiasis". Immunological Reviews. 201: 180–190. doi:10.1111/j.0105-2896.2004.00195.x. PMID 15361241. S2CID 25378236.
- Joseph AM, Kumar M, Mitra D (January 2005). "Nef: "necessary and enforcing factor" in HIV infection". Current HIV Research. 3 (1): 87–94. doi:10.2174/1570162052773013. PMID 15638726.
- Copeland KF (December 2005). "Modulation of HIV-1 transcription by cytokines and chemokines". Mini Reviews in Medicinal Chemistry. 5 (12): 1093–1101. doi:10.2174/138955705774933383. PMID 16375755.
- Chiba H, Kojima T, Osanai M, Sawada N (January 2006). "The significance of interferon-gamma-triggered internalization of tight-junction proteins in inflammatory bowel disease". Science's STKE. 2006 (316): pe1. doi:10.1126/stke.3162006pe1. PMID 16391178. S2CID 85320208.
- Tellides G, Pober JS (March 2007). "Interferon-gamma axis in graft arteriosclerosis". Circulation Research. 100 (5): 622–632. CiteSeerX 10.1.1.495.2743. doi:10.1161/01.RES.0000258861.72279.29. PMID 17363708. S2CID 254247.