시도포비르
Cidofovir | |
| 임상자료 | |
|---|---|
| 상명 | 비스티드 |
| AHFS/Drugs.com | 모노그래프 |
| 라이센스 데이터 | |
| 임신 범주 |
|
| 경로: 행정 | IV |
| ATC 코드 | |
| 법적현황 | |
| 법적현황 | |
| 약동학 데이터 | |
| 생체이용가능성 | 완성의 |
| 단백질 결합 | <6% |
| 제거 반감기 | 2.6시간(활성 대사물: 15~65시간) |
| 배설 | 신장 위의 약동학 매개변수는 프로벤시드와 함께 사용되는 cidofovir에 대해 측정된다.[1] |
| 식별자 | |
| |
| CAS 번호 | |
| 펍켐 CID | |
| 드러그뱅크 | |
| 켐스파이더 | |
| 유니 | |
| 체비 | |
| 켐벨 | |
| NIAID 화학DB | |
| CompTox 대시보드 (EPA) | |
| ECHA InfoCard | 100.166.433 |
| 화학 및 물리적 데이터 | |
| 공식 | C8H14N3O6P |
| 어금질량 | 279.1987 g·190−1 |
| 3D 모델(JSmol) | |
| 특정회전 | -97.3 |
| 녹는점 | 260°C(500°F) |
| |
| |
| (iii) | |
시도포비르(Cidofovir, 브랜드명 비스티데)는 에이즈 환자에서 주로 시토메갈로바이러스(CMV) 망막염(눈망막염) 치료제로 사용되는 주사형 항바이러스제다.[2][3]
Cidofovir는 1996년에 의료용으로 승인되었다.[4]
의료용
DNA바이러스
세계적으로 규제 승인을 받은 유일한 지표는 시토메갈로바이러스 망막염이다.[2][3] 시도포비르는 또한 아세클로비르 내성 HSV 감염의 치료에도 효능을 보였다.[5] 시도포비르는 또한 그것의 사용에 대한 성공적인 사례 보고와 함께 진행성 다초점 백혈병 치료법으로 조사되어 왔다.[6] 그럼에도 불구하고, 그 약은 통제된 연구에서 어떤 효능도 보여주지 못했다.[7] 시도포비르는 반소수 효능이 있을 수 있으며 천연두 사례와 관련된 바이오테러 사건이 발생할 경우 제한적으로 사용할 수 있다.[8] 천연두에 대해 경구적으로 복용할 수 있는 훨씬 높은 활성도를 가진 시도포비르 파생상품인 브린키도포비르가 개발됐다.[9] 현재까지 임상실험이 이뤄지지 않았지만, 아세클로비르 등 안전한 대안이 풍부해 시험관내 바리셀라-조스터 바이러스 복제에 대한 억제 효과가 있다.[10] Cidofovir는 이식수혜자의 하위그룹에서 항-BK 바이러스 활동을 보여준다.[11] 시도포비르는 HPV에 의한 유두종양에 대한 보완적 자궁내 요법으로 조사되고 있다.[12][13]
1996년 6월 26일 FDA 승인,[14] 1998년[3] 4월 30일 TGA 승인, 1997년 4월 23일 EMA 승인을 처음 받았다.[15]
그것은 사마귀 치료에 국부적으로 사용되어 왔다.[16]
기타
그것은 FGF2에 대한 억제 때문에 항독점제로서 제안되어 왔다.[17][18]
관리
Cidofovir는 정맥주사로만 이용 가능하다. 시도포비르는 신장에 대한 부작용을 감소시키는 프로벤시드를 투여한다.[19] 프로벤시드는 신장의 근위부 관상피세포의 유기 음이온 이동을 억제하여 신독성을 완화시킨다.[20] 또한 cidofovir를 받는 환자에게 수화를 투여해야 한다. 각 cidofovir 용량과 함께 1리터의 일반 식염수를 권장한다.[19]
부작용
cidofovir의 주요 용량 제한 부작용은 신독성(즉, 신장 손상)이다.[21] 그 밖의 일반적인 부작용(약물로 치료받은 사람의 >1%에서 발생)은 다음과 같다.[2][21]
흔치 않은 부작용으로는 빈혈과 높아진 간 효소, 희귀한 부작용으로는 빈맥과 판코니 증후군이 있다.[21] 프로벤시드(요독성 약물)와 정맥 식염수는 항상 각 치도포비르 주입과 함께 투여하여 이러한 신독성을 방지해야 한다.[22]
콘트라인커뮤니케이션
cidofovir 또는 proenecid에 대한 과민성(신독성을 피하려면 프로벤시드로서 동시에 투여해야 함).[2]
상호작용
신독성 물질(암포테리신 B, 포스카르넷, IV 아미노글리코사이드, IV 펜타미드, 반코마이신, 타크로리무스, 비스테로이드 항염증제 등)과 상호작용하여 신독성 잠재력을 높이는 것으로 알려져 있다.[2][3] 프로벤시드와 동시에 투여해야 하므로 프로벤시드와 상호작용하는 것으로 알려진 약물(예: 프로벤시드가 파라세타몰, 아세클로비르, 아미노살리실산 등 신관 분비를 방해하는 약물)도 억제하는 것이 좋다.[3]
작용기전
활성대사물인 cidofovir diphosphate는 바이러스성 DNA 중합체를 선택적으로 억제하여 바이러스 복제를 억제한다.[3] 그것은 또한 인간 중합체를 억제하지만, 이 작용은 바이러스성 DNA 중합체에 대한 작용보다 8~600배 더 약하다.[3] 그것은 또한 바이러스성 DNA로 통합되어 재생산 중에 바이러스성 DNA 합성을 억제한다.[3]
다음과 같은 바이러스에 대한 체외 활동을 가지고 있다.[23]
- 헤르페스바이루스
- 아데노비루스
- 인간 수두증(천두 바이러스 포함)
- 인간 파필로마바이러스
역사
시도포비르는 안토닌 홀리에 의해 프라하의 유기화학 및 생화학 연구소에서 발견되어 길리어드 사이언스가[24] 개발하였으며, 미국의 길리어드사가 Vistide라는 브랜드명을, 다른 곳에서는 화이저가 Vistide라는 브랜드명으로 마케팅하고 있다.
합성
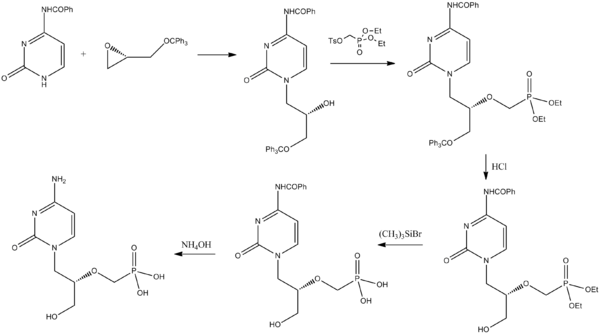
시도포비르는 피리미돈 파생상품과 글리시돌의 보호 파생상품에서 합성할 수 있다.[25]
참고 항목
- 브린치도포비르(Brincidofovir)는 구술로 취할 수 있는 cidofovir의 소설 프로드러다.
참조
- ^ 쿤디, 케네스 C. "항바이러스 뉴클레오티드 아날로그의 임상 약동학 시도포비르와 아데포비르" 임상 약동학 36.2 (1999): 127-43.
- ^ a b c d e "Vistide (cidofovir) dosing, indications, interactions, adverse effects, and more". Medscape Reference. WebMD. Retrieved 4 February 2014.
- ^ a b c d e f g h "Product Information VISTIDE®". TGA eBusiness Services. Gilead Sciences Pty Ltd. 3 September 2013. Retrieved 5 February 2014.
- ^ Long, Sarah S.; Pickering, Larry K.; Prober, Charles G. (2012). Principles and Practice of Pediatric Infectious Disease. Elsevier Health Sciences. p. 1502. ISBN 978-1437727029.
- ^ Chilukuri, S; Rosen, T (Apr 2003). "Management of acyclovir-resistant herpes simplex virus". Dermatologic Clinics. 21 (2): 311–20. doi:10.1016/S0733-8635(02)00093-1. PMID 12757254.
- ^ Segarra-Newnham M, Vodolo KM (June 2001). "Use of cidofovir in progressive multifocal leukoencephalopathy". Ann Pharmacother. 35 (6): 741–4. doi:10.1345/aph.10338. PMID 11408993. S2CID 32026770.[영구적 데드링크]
- ^ De Gascun, C. F.; Carr, M. J. (2013). "Human polyomavirus reactivation: Disease pathogenesis and treatment approaches". Clinical and Developmental Immunology. 2013: 1–27. doi:10.1155/2013/373579. PMC 3659475. PMID 23737811.
- ^ De Clercq E (July 2002). "Cidofovir in the treatment of poxvirus infections". Antiviral Res. 55 (1): 1–13. doi:10.1016/S0166-3542(02)00008-6. PMID 12076747.
- ^ Bradbury, J (March 2002). "Orally available cidofovir derivative active against smallpox". Lancet. 359 (9311): 1041. doi:10.1016/S0140-6736(02)08115-1. PMID 11937193. S2CID 22903225.
- ^ Magee, WC; Hostetler, KY; Evans, DH (August 2005). "Mechanism of Inhibition of Vaccinia Virus DNA Polymerase by Cidofovir Diphosphate". Antimicrobial Agents and Chemotherapy. 49 (8): 3153–3162. doi:10.1128/AAC.49.8.3153-3162.2005. PMC 1196213. PMID 16048917.
- ^ Araya CE, Lew JF, Fennell RS, Neiberger RE, Dharnidharka VR (February 2006). "Intermediate-dose cidofovir without probenecid in the treatment of BK virus allograft nephropathy". Pediatr Transplant. 10 (1): 32–7. doi:10.1111/j.1399-3046.2005.00391.x. PMID 16499584. S2CID 24131709.
- ^ Broekema FI, Dikkers FG (August 2008). "Side-effects of cidofovir in the treatment of recurrent respiratory papillomatosis". Eur Arch Otorhinolaryngol. 265 (8): 871–9. doi:10.1007/s00405-008-0658-0. PMC 2441494. PMID 18458927.
- ^ Soma MA, Albert DM (February 2008). "Cidofovir: to use or not to use?". Curr Opin Otolaryngol Head Neck Surg. 16 (1): 86–90. doi:10.1097/MOO.0b013e3282f43408. PMID 18197029. S2CID 22895067.
- ^ "Cidofovir Monograph for Professionals - Drugs.com". Drugs.com. American Society of Health-System Pharmacists. Retrieved 5 February 2014.
- ^ "Vistide : EPAR -Product Information" (PDF). European Medicines Agency. Gilead Sciences International Ltd. 7 November 2013. Retrieved 5 February 2014.
- ^ Fernández-Morano, T; del Boz J; González-Carrascosa M (2011). "Topical cidofovir for viral warts in children". J Eur Acad Dermatol Venereol. 25 (12): 1487–9. doi:10.1111/j.1468-3083.2010.03961.x. PMID 21261749. S2CID 32295082.
- ^ Liekens S, Gijsbers S, Vanstreels E, Daelemans D, De Clercq E, Hatse S (March 2007). "The nucleotide analog cidofovir suppresses basic fibroblast growth factor (FGF2) expression and signaling and induces apoptosis in FGF2-overexpressing endothelial cells". Mol. Pharmacol. 71 (3): 695–703. doi:10.1124/mol.106.026559. PMID 17158200. S2CID 42400272.
- ^ Liekens S (2008). "Regulation of cancer progression by inhibition of angiogenesis and induction of apoptosis". Verh. K. Acad. Geneeskd. Belg. 70 (3): 175–91. PMID 18669159.
- ^ a b "Details" (PDF). www.gilead.com. Retrieved 2019-06-05.
- ^ 레이시, S. "경구 프로벤시드 공동행정이 키노몰구스 원숭이의 정맥내 치도포비르의 만성 독성과 약동학에 미치는 영향
- ^ a b c Rossi, S, ed. (2013). Australian Medicines Handbook (2013 ed.). Adelaide: The Australian Medicines Handbook Unit Trust. ISBN 978-0-9805790-9-3.
- ^ "Vistide (cidofovir)" (PDF) (package insert). Gilead Sciences. September 2010. DOSAGE AND ADMINISTRATION: Dosage.
- ^ Safrin, S; Cherrington, J; Jaffe, HS (September 1997). "Clinical uses of cidofovir". Reviews in Medical Virology. 7 (3): 145–156. doi:10.1002/(SICI)1099-1654(199709)7:3<145::AID-RMV196>3.0.CO;2-0. PMID 10398479.
- ^ "Press Releases: Gilead". Archived from the original on 2013-02-08. Retrieved 2007-12-05.
- ^ Brodfuehrer, P; Howell, Henry G.; Sapino, Chester; Vemishetti, Purushotham (1994). "A practical synthesis of (S)-HPMPC". Tetrahedron Letters. 35 (20): 3243. doi:10.1016/S0040-4039(00)76875-4.