알칼리 금속
Alkali metal| 알칼리 금속 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||
| ↓ 기간 | |||||||||||
| 2 | 리튬(리튬) 3 | ||||||||||
| 3 | 나트륨(Na) 11 | ||||||||||
| 4 | 칼륨(K) 19 | ||||||||||
| 5 | 루비듐(Rb) 37 | ||||||||||
| 6 | 세슘(Cs) 55 | ||||||||||
| 7 | 프랑슘(Fr) 87 | ||||||||||
| 레전설
| |||||||||||
알칼리 금속은 화학 원소 리튬(Li), 나트륨(Na), 칼륨(K),[note 1] 루비듐(Rb), 세슘(Cs),[note 2] 프랑슘(Fr)으로 구성되어 있다.수소와 함께 그들은 주기율표의 s-블록에 있는 그룹 1을 구성한다.[note 3]모든 알칼리 금속은 그들의 가장 바깥쪽 전자를 s-오르비탈에 가지고 있다: 이 공유 전자 구성은 그들의 매우 유사한 특성 특성을 가지고 있다.[note 4]실제로 알칼리 금속은 주기율표에서 집단 성질의 경향에 대한 최상의 예를 제공하며, 원소들은 잘 특성화된 동음이의 행동을 나타낸다.[editorialising]이 원소 계열은 주성분에서 따온 리튬 계열로도 알려져 있다.
알칼리 금속은 모두 표준 온도와 압력에서 광택이 나고 부드럽고 반응성이 높은 금속이며 전하를 +1로 하여 양이온을 형성하기 위해 가장 바깥쪽 전자를 쉽게 잃는다.모두 부드러움 때문에 칼로 쉽게 자를 수 있어 대기 수분과 산소(그리고 리튬, 질소)에 의한 산화 작용으로 공기 중에 빠르게 변색되는 빛나는 표면을 노출시킨다.반응성이 높기 때문에 공기와의 반응을 막기 위해 기름 밑에 저장해야 하며, 염분에서만 자연적으로 발견되며 절대 자유 원소로서는 발견되지 않는다.다섯 번째 알칼리 금속인 세슘은 모든 금속 중에서 가장 반응성이 높다.모든 알칼리 금속은 물과 반응하며, 무거운 알칼리 금속은 가벼운 금속보다 더 격렬하게 반응한다.
발견된 모든 알칼리 금속은 자연에서 그 화합물로서 자연에서 발생하는데, 풍요의 순서로 나트륨이 가장 풍부하고, 그 다음으로 칼륨, 리튬, 루비듐, 세슘, 그리고 마지막으로 프랑슘이 그 방사능이 극히 높기 때문에 매우 드물다; 프랑슘은 자연에서 어떤 애매한 쪽의 중간 단계로서 미세한 흔적에서만 발생한다.천연 부패 사슬의 가지그룹의 다음 멤버가 될 것 같은 유니네늄(Uue) 합성을 시도하기 위한 실험이 진행되어 왔으나, 성공한 것은 없었다.그러나 우니늄은 상대론적 영향으로 알칼리 금속이 아닐 수 있는데, 이는 초중량 원소의 화학적 성질에 큰 영향을 미칠 것으로 예측되며, 알칼리 금속으로 판명되더라도 가벼운 호몰로그램과는 물리적, 화학적 성질에 어느 정도 차이가 있을 것으로 예측된다.
대부분의 알칼리 금속은 많은 다른 용도를 가지고 있다.순수 원소의 가장 잘 알려진 응용 중 하나는 원자 시계에서 루비듐과 세슘의 사용인데, 그 중 세슘 원자 시계가 두 번째의 기초를 이룬다.나트륨의 화합물의 일반적인 적용은 빛을 매우 효율적으로 방출하는 나트륨-바푸어 램프다.식탁용 소금, 즉 염화나트륨은 옛날부터 사용되어 왔다.리튬은 정신의학적 약물과 리튬배터리에서 양극으로 사용된다.나트륨과 칼륨도 필수 원소로 전해질로서 주요한 생물학적 역할을 하고 있으며, 다른 알칼리 금속은 필수적이지는 않지만, 몸에 유익하기도 하고 해롭기도 한 다양한 영향을 끼친다.
역사

나트륨 화합물은 고대부터 알려져 왔다; 소금(염화수소)은 소금 구입을 위해 로마 병사들에게 지불하는 돈인 살라리움을 가리키는 영어 단어의 급여에 의해 증언된 바와 같이, 인간의 활동에 있어 중요한 상품이었다.[5][better source needed]고대로부터 포타쉬가 사용되어 왔지만, 대부분의 역사에서 나트륨 미네랄 솔트와 근본적으로 다른 물질이라는 것은 이해되지 않았다.게오르크 에른스트 슈타울은 1702년에 나트륨과 칼륨 염의 근본적인 차이를 제시하도록 하는 실험적인 증거를 얻었고,[6] 1736년에는 앙리 루이스 뒤하멜 뒤 몽소가 이 차이를 증명할 수 있었다.[7]당시 칼륨과 나트륨 화합물의 정확한 화학적 성분, 그리고 칼륨과 나트륨의 화학적 성분으로서의 상태는 알려지지 않았으며, 따라서 앙투안 라부아지에가 1789년 그의 화학적 원소 목록에 알칼리 중 어느 것도 포함시키지 않았다.[8][9]
순수 칼륨은 1807년 영국에서 험프리 데이비에 의해 처음 격리되었는데, 그는 새로 발명된 볼타이 더미로 녹은 소금을 전기분해하여 가성포타시(KOH, 수산화칼륨)에서 유래했다.이전의 수성 소금의 전기분해 시도는 칼륨의 극한 반응성으로 인해 성공하지 못했다.[10]: 68 칼륨은 전기분해에 의해 격리된 최초의 금속이었다.[11]같은 해 말, 데이비 교수는 유사한 기술에 의해 유사한 물질 가성소다(NaOH, yye)에서 나트륨을 추출하는 것을 보고했고, 원소, 즉 염분이 다르다는 것을 증명했다.[8][9][12][13]

페탈라이트(Li Al SiO410)는 1800년 브라질의 화학자 호세 보니파시오 데 안드라다에 의해 스웨덴 우투 섬의 광산에서 발견되었다.[14][15][16]그러나 당시 화학자 욘스 야콥 베르젤리우스의 실험실에서 일하던 요한 아우구스트 아르프웨드슨이 페탈라이트 광석을 분석하면서 새로운 원소의 존재를 감지한 것은 1817년이 되어서였다.[17][18]이 새로운 원소는 탄산염과 수산화물은 다른 알칼리 금속보다 물에 덜 녹고 알칼리성이 강하지만 나트륨과 칼륨과 유사한 화합물을 형성하기 위해 그가 주목한 것이다.[19]베르젤리우스는 식물의 재에서 발견된 칼륨과 동물의 피가 부분적으로 풍부하다는 것으로 알려진 나트륨과는 반대로 단단한 광물에서 발견되는 것을 반영하기 위해 그리스어 ooo ((리톤/리티나)에서 나온 미지의 물질 이름을 "리션/리티나"라고 명명했다.그는 그 물질 안에 있는 금속의 이름을 "리튬"[20][15][18]이라고 지었다.리튬, 나트륨, 칼륨은 1850년 요한 볼프강 두베레이너가 비슷한 성질을 지녔다고 지적한 같은 그룹의 일련의 원소들 중 하나이기 때문에 주기성 발견의 일부였다.[21]

루비듐과 세슘은 1859년 로버트 분센과 구스타프 키르쇼프가 발명한 분광기를 이용해 발견한 최초의 원소였다.[22]다음 해, 그들은 독일 배드 뒤크하임의 광천수에서 세슘을 발견했다.그들이 루비듐을 발견한 것은 이듬해 독일 하이델베르크에서 광물 레피돌라이트에서 발견되었다.[23]루비듐과 세슘의 이름은 방출 스펙트럼에서 가장 두드러진 선으로 루비듐을 위한 밝은 빨간색 선( 라틴어 루비두스로부터, 진한 빨간색 또는 밝은 빨간색이라는 의미)과 세슘을 위한 하늘색 선(Sky-blue라는 뜻의 라틴어 cesius에서 유래)[24][25]에서 유래한다.
1865년경 존 뉴랜드는 일련의 논문을 발표했는데, 원자량을 증가시키고 8의 간격으로 재발하는 유사한 물리적 화학적 성질을 가진 원소들을 나열했다; 그는 그러한 주기성을 한 옥타브 음계가 비슷한 음악적 기능을 갖는 음악의 옥타브에 비유했다.[26][27]그의 버전은 당시 알려진 모든 알칼리 금속(리튬에서 세슘까지), 구리, 은, 탈륨(알칼리 금속의 +1 산화 상태 특성을 보여준다)을 한 그룹으로 묶었다.그의 테이블에는 할로겐과 함께 수소가 놓여 있었다.[21]

1869년 이후 드미트리 멘델레예프는 리튬을 나트륨, 칼륨, 루비듐, 세슘, 탈륨을 가진 그룹의 맨 위에 배치하는 주기율표를 제안했다.[28]2년 후 멘델레예프는 자신의 테이블을 수정하여 리튬 위 1그룹에 수소를 배치하고 탈륨도 붕소그룹으로 이동시켰다.이 1871년판에서는 구리, 은, 금을 두 번 배치하였는데, 한 번은 그룹 IB의 일부로, 한 번은 오늘날의 그룹 8~11을 아우르는 '그룹 8'의 일부로 배치하였다.[29][note 5]18단 테이블 도입 후 그룹 IB 원소는 d블록에서 현재 위치로 이동했고, 그룹 IA에서는 알칼리 금속이 남아 있었다.이후 1988년 그룹 이름이 그룹 1로 바뀌었다.[4]사소한 이름인 "알칼리 금속"은 그룹 1 원소의 수산화물이 모두 물에 용해되었을 때 강한 알칼리라는 사실에서 유래한다.[30]
프랑스 파리의 퀴리 연구소의 마르그리트 페리가 1939년 붕괴에너지가 220 keV인 것으로 보고된 액티늄-227의 샘플을 정화해 프랑슘을 발견하기 전까지 적어도 네 번의 오류와 불완전한 발견이[31][32][33][34] 있었다.그러나 페리는 에너지 수준이 80 keV 미만인 붕괴 입자를 발견했다.페레이는 이러한 부패 활동이 이전에 확인되지 않았던 부패 제품에 의해 일어났을지도 모른다고 생각했는데, 정화 과정에서 분리되었지만 다시 순수한 액티늄-227에서 나왔다.다양한 테스트로 알 수 없는 원소가 토륨, 라듐, 납, 비스무트 또는 탈륨일 가능성을 없앴다.이번 신제품은 알칼리 금속(세슘염으로 교화시키는 등)의 화학적 특성을 보여 페레이는 액티늄-227의 알파 붕괴로 인해 원소 87이라고 믿게 되었다.[35]페리는 그 후 액티늄-227에서 베타 붕괴 대 알파 붕괴의 비율을 결정하려고 시도했다.그녀의 첫 번째 테스트는 알파 분기를 0.6%로 만들었고, 이 수치는 나중에 1%[36]로 수정했다.
- 227
89Ac
223
87FR
223
88라
219
86Rn
주기율표에서 프랑슘(eka-francium) 이하의 다음 원소는 Ununennium(Uue), 원소 119가 될 것이다.[37]: 1729–1730 우네늄 합성은 1985년 초계기에 칼슘-48 이온을 넣은 아인슈타인륨-254의 표적을 폭격함으로써 처음 시도되었다.캘리포니아 버클리의 HILAC 액셀러레이터.원자가 확인되지 않아 300nb의 제한 수율을 나타냈다.[38][39]
그것은 이 반응은 가까운 미래에 ununennium의 어떤 원자를 만들기 einsteinium-254의ultraheavy 요소의 생산을 위한 큰 질량 270일의 비교적 긴 반감기으며, 상당한에서 가용성 때문에 사람들이 선호하는 충분한 양, 만들기의 아주 어려운 일 수 있을 것이다 unlikely[38]. amou몇 마이크로그램의 nts는 [40]실험의 민감도를 요구되는 수준으로 증가시킬 수 있는 충분히 큰 목표치를 만든다; 아인슈타인륨은 자연에서 발견되지 않았고 단지 실험실에서만 생산되었을 뿐이며, 초중량 원소의 효과적인 합성에 필요한 양보다 적은 양이다.그러나, 유니니엄이 연장된 주기율표의 1주기 8 원소에 불과하다는 점에서, 가까운 장래에 다른 반응을 통해 충분히 발견될 수 있으며, 실제로 그것을 합성하려는 시도는 현재 일본에서 진행 중이다.[41]현재 8주기 원소는 아직 발견되지 않았으며, 낙하 불안으로 인해 128기 내외의 저주기 8기 원소만 물리적으로 가능한 것도 가능하다.[42][43]더 무거운 알칼리 금속을 합성하려는 어떤 시도도 없었다: 그들의 극도로 높은 원자 번호 때문에, 그것들은 만들기 위해 새롭고 더 강력한 방법과 기술을 필요로 할 것이다.[37]: 1737–1739
발생
태양계에서
Oddo-Harkins 규칙은 원자 번호가 짝수인 원소는 수소를 제외하고 원자 번호가 홀수인 원소보다 더 흔하다는 것을 고수한다.이 규칙은 원자 번호가 홀수인 원소는 한 개의 비장애인 양성자를 가지고 있고 다른 원소를 포획할 가능성이 더 높기 때문에 그들의 원자 수가 증가한다고 주장한다.원자 번호가 짝수인 원소에서는 양성자가 짝을 이루는데, 쌍의 각 구성원이 다른 원소의 스핀을 상쇄하여 안정성을 높인다.[45][46][47]모든 알칼리 금속은 홀수 원자 번호를 가지고 있으며 태양계에서 원자 번호(고귀한 기체와 알칼리성 지구 금속)가 인접한 원소만큼 흔하지 않다.루비듐에서 나오는 알칼리 금속은 초신성에서만 합성할 수 있고 별 핵합성에서는 합성할 수 없기 때문에 무거운 알칼리 금속도 가벼운 알칼리 금속보다 풍부하지 않다.리튬은 또한 빅뱅 핵합성술과 별에서 모두 잘 합성되지 않기 때문에 나트륨과 칼륨에 비해 훨씬 덜 풍부하다: 빅뱅은 5~8개의 핵으로 안정된 핵이 없기 때문에 리튬, 베릴륨, 붕소의 미량만을 생산할 수 있었고, 항성 핵합성술은 여행에 의해서만 이 병목현상을 통과할 수 있었다.세 개의 헬륨 핵들을 결합하여 탄소를 형성하고, 그 세 가지 원소를 건너뛰는 과정.[44]
지구상의, 지상의, 이 세상에

지구는 태양을 형성한 같은 물질의 구름으로부터 형성되었지만, 행성들은 태양계의 형성과 진화 과정에서 서로 다른 구성을 얻었다.결국, 지구의 자연사는 이 행성의 일부에 다른 원소들의 농도를 갖게 했다.지구의 질량은 약 5.98×1024 kg이다.대부분 철(32.1%), 산소(30.1%), 실리콘(15.1%), 마그네슘(13.9%), 황(2.9%), 니켈(1.8%), 칼슘(1.5%), 알루미늄(1.4%)으로 구성됐으며 나머지 1.2%는 다른 원소의 미량 등으로 구성됐다.행성의 분화로 인해 핵심부위는 주로 철(88.8%)으로 구성되며, 니켈 함량이 적고(5.8%), 유황(4.5%), 미량원소 1% 미만으로 파악된다.[48]
알칼리 금속은 높은 반응성으로 인해 자연적으로 순수한 형태로 발생하지 않는다.이들은 석판성 물질이며 따라서 산소와 쉽게 결합되어 실리카와 강하게 연관되기 때문에 지구 표면과 가깝게 남아 지구의 중심부로 가라앉지 않는 비교적 저밀도 광물을 형성한다.칼륨, 루비듐, 세슘도 큰 이온성 반지름 때문에 양립할 수 없는 원소다.[49]
나트륨과 칼륨은 지구 표면에서 가장 흔한 10가지 원소에 속하며,[50][51] 나트륨은 지구 표면의 약 2.6%를 무게로 측정하여 전체적으로[52] 6번째로 풍부한 원소와 가장 풍부한 알칼리 금속으로 구성된다.칼륨은 지구 표면의 약 1.5%를 차지하며 7번째로 풍부한 원소다.[52]나트륨은 많은 다른 미네랄에서 발견되는데, 그 중 가장 흔한 것은 바닷물에 용해된 방대한 양의 보통염(염화수소)이다.다른 고체 침전물로는 할라이트, 양서류, 크라이올라이트, 니트라틴, 제올라이트 등이 있다.[52]이러한 고체 퇴적물의 대부분은 고대 바다가 증발하면서 발생하는데, 그것은 지금도 유타주의 그레이트 솔트 호수나 사해와 같은 곳에서 발생한다.[10]: 69 지구의 지각에서 거의 동등한 풍부함에도 불구하고, 나트륨은 바다에서 칼륨보다 훨씬 더 흔하다. 칼륨의 크기가 크면 염분이 덜 용해되기 때문이며, 칼륨은 토양에서 규산염에 의해 묶여 있고 칼륨수소는 나트륨보다 식물 생명에 의해 훨씬 더 쉽게 흡수되기 때문이다.[10]: 69
리튬은 화학적 유사성에도 불구하고 크기가 작아 일반적으로 나트륨이나 칼륨과 함께 발생하지 않는다.[10]: 69 반응도가 상대적으로 낮기 때문에 바닷물에서 다량으로 발견될 수 있는데, 바닷물은 약 0.14~0.25ppm(ppm)[53][54] 또는 25마이크로몰라로 추정된다.[55]마그네슘과의 대각선 관계는 종종 마그네슘을 대신할 수 있게 하는데, 이 광물의 지각 농도는 갈륨과 니오비움에 견줄 정도로 약 18ppm이다.상업적으로 가장 중요한 리튬 광물은 전세계적으로 많은 매장량에서 발생하는 스포두메네다.[10]: 69
루비듐은 대략 아연만큼 풍부하고 구리보다 풍부하다.광물인 류카이트, 폴루카이트, 카르날라이트, 진왈다이트, 레피돌라이트 등에서 자연적으로 발생하지만,[56] 이들 중 루비듐만 함유하고 있고 다른 알칼리 금속은 함유하고 있지 않다.[10]: 70 세슘은 안티몬, 카드뮴, 주석, 텅스텐과 같이 일반적으로 알려진 몇몇 원소보다 풍부하지만 루비듐보다 훨씬 덜 풍부하다.[57]
프랑슘의 유일한 자연발생 동위원소인 프랑슘-223은 [58][59]액티늄-227의 알파 붕괴의 산물로 우라늄 광물에서 미량에서 찾을 수 있다.[60]주어진 우라늄 샘플에서, 10개의18 우라늄 원자당 1프랑의 원자가 있을 것으로 추정된다.[61][62]지구 표면에는 22분의 극히 짧은 반감기 때문에 언제든지 30그램의 프랑슘이 있는 것으로 계산되었다.[63][64]
특성.
물리 및 화학
알칼리 금속의 물리적 및 화학적 특성은 ns1 발란스 전자 구성으로 쉽게 설명할 수 있으며, 이는 약한 금속 결합을 초래한다.따라서 모든 알칼리 금속은 부드럽고 밀도가 낮고 [30]녹고[30] 끓는점이 있으며 [30]승화, 기화, 분화의 가열도 있다.[10]: 74 그것들은 모두 체중 중심의 입방결정 구조에서 결정되며,[10]: 73 그들의 바깥쪽 s 전자가 매우 쉽게 흥분하기 때문에 독특한 불꽃색을 가지고 있다.[10]: 75 ns1 구성은 또한 알칼리 금속이 매우 큰 원자 및 이온 방사선과 더불어 매우 높은 열 및 전기 전도성을 갖는 결과를 낳는다.[10]: 75 그들의 화학은 이온화가 용이하고 매우 높은 두 번째 이온화 에너지로 인해 가장 바깥쪽 s-오르비탈에서 그들의 유일한 발란스 전자가 손실되어 +1 산화 상태를 형성하는 것에 의해 지배된다.[10]: 76 대부분의 화학 작용은 그 그룹의 처음 5명의 멤버들에게만 관찰되었다.프랑슘의 화학성분은 극도의 방사능 때문에 잘 확립되어 있지 않기 때문에 여기서 프랑슘의 성질을 나타내는 것은 제한적이다.[30]프랑슘에 대해 거의 알려지지 않은 것은 예상한 대로 세슘과 행동 면에서 매우 가깝다는 것을 보여준다.프랑슘의 물리적 성질은 벌크 요소가 관찰된 적이 없기 때문에 훨씬 더 스케치된다. 따라서 문헌에서 찾을 수 있는 모든 데이터는 확실히 추측성 외삽이다.[65]
| 이름 | 리튬 | 나트륨 | 칼륨 | 루비듐 | 세슘 | 프랑슘 |
|---|---|---|---|---|---|---|
| 원자번호 | 3 | 11 | 19 | 37 | 55 | 87 |
| 표준 원자량(u)[note 7][58][59] | 6.94(1)[note 8] | 22.98976928(2) | 39.0983(1) | 85.4678(3) | 132.9054519(2) | [223][note 9] |
| 전자 구성 | [He] 2s1 | [Ne] 3s1 | [Ar] 4s1 | [Kr] 5s1 | [Xe] 6s1 | [Rn] 7초1 |
| 용해점(°C) | 180.54 | 97.72 | 63.38 | 39.31 | 28.44 | ? |
| 비등점(°C) | 1342 | 883 | 759 | 688 | 671 | ? |
| 밀도(g·cm−3) | 0.534 | 0.968 | 0.89 | 1.532 | 1.93 | ? |
| 융해열(kJ·mol−1) | 3.00 | 2.60 | 2.321 | 2.19 | 2.09 | ? |
| 기화열(kJ·mol−1) | 136 | 97.42 | 79.1 | 69 | 66.1 | ? |
| 단원자 기체 형성열(kJ·mol−1) | 162 | 108 | 89.6 | 82.0 | 78.2 | ? |
| 25°C(NΩ·cm)에서의 전기 저항도 | 94.7 | 48.8 | 73.9 | 131 | 208 | ? |
| 원자 반지름(pm) | 152 | 186 | 227 | 248 | 265 | ? |
| 헥사코르덴산 M 이온의+ 이온 반지름(pm) | 76 | 102 | 138 | 152 | 167 | ? |
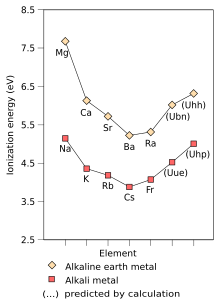
| 첫 번째 이온화 에너지(kJ·mol−1) | 520.2 | 495.8 | 418.8 | 403.0 | 375.7 | 392.8[68] |
| 전자 친화력(kJ·mol−1) | 59.62 | 52.87 | 48.38 | 46.89 | 45.51 | ? |
| M2(kJ·mol−1) 분리의 엔탈피 | 106.5 | 73.6 | 57.3 | 45.6 | 44.77 | ? |
| 폴링 전기성 | 0.98 | 0.93 | 0.82 | 0.82 | 0.79 | ?[note 10] |
| 앨런 전기성 | 0.91 | 0.87 | 0.73 | 0.71 | 0.66 | 0.67 |
| 표준 전극 전위(E°(M+→M0); V)[71] | −3.04 | −2.71 | −2.93 | −2.98 | −3.03 | ? |
| 불꽃 테스트 색상 주 방출/흡수 파장(nm) | 크림슨 670.8 | 노란색 589.2 | 바이올렛 766.5 | 적색-보랏빛 780.0 | 파랑 455.5 | ? |
알칼리 금속은 다른 그룹의 원소들이 서로 더 유사하다.[30]실제로 유사성이 너무 커서 이온 라디움이 비슷하기 때문에 칼륨, 루비듐, 세슘을 분리하기가 상당히 어렵다. 리튬과 나트륨은 더 구별된다.예를 들어, 표 아래로 이동할 때, 알려진 모든 알칼리 금속은 핵 반지름이 증가하고,[72] 전기성이 감소하고,[72] 반응성이 증가하며,[30] 용융점과 비등점이[72] 감소하고, 융기와 기화의 가열도 감소하는 것을 보여준다.[10]: 75 일반적으로 칼륨이 나트륨보다 밀도가 낮다는 점을 제외하고는 테이블 아래로 이동하면 밀도가 높아진다.[72]아주 부드러운 추세를 보이지 않는 알칼리 금속의 극소수의 특성 중 하나는 그것의 감소 가능성이다: 리튬의 값은 변칙적이고 다른 것들보다 더 부정적이다.[10]: 75 이는+ 리튬 이온이 기체 단계에서 매우 높은 수화 에너지를 가지고 있기 때문이다: 리튬 이온이 물의 구조를 현저하게 방해하여 엔트로피에 더 높은 변화를 일으키지만, 이 높은 수화 에너지는 이온화의 어려움에도 불구하고 감소 전위를 가장 전기적인 알칼리 금속으로 나타내기에 충분하다.가스 단계에서 [10]: 75 말이야
안정된 알칼리 금속은 옅은 황금빛 틴트를 가진 세슘을 제외한 모든 은색 금속이다:[73] 그것은 뚜렷하게 색칠된 세 가지 금속 중 하나이다(다른 두 가지는 구리와 금이다).[10]: 74 또한 중알칼리성 토금속인 칼슘, 스트론튬, 바륨은 물론, 이염 란타니데스 유로피움과 이터비움도 세슘에 비해 색채가 훨씬 덜 두드러지지만 옅은 노란색이다.[10]: 74 그들의 광채는 산화 작용으로 인해 공기 중에 빠르게 변색된다.[30]그것들은 모두 체중 중심의 입방결정 구조에서 결정되며,[10]: 73 그들의 바깥쪽 s 전자가 매우 쉽게 흥분하기 때문에 독특한 불꽃색을 가지고 있다.실제로, 이 불꽃 테스트 색상은 공통 이온을 포함한 모든 염분이 용해되기 때문에 가장 일반적인 식별 방법이다.[10]: 75
모든 알칼리 금속은 반응성이 매우 높으며 자연에서 원소 형태로는 결코 발견되지 않는다.[20]이 때문에 보통 광유나 등유(파라핀유)에 저장된다.[74]그들은 할로겐과 공격적으로 반응하여 알칼리 금속 할로겐을 형성하는데, 백색 이온 결정 화합물로서 불화 리튬(LiF)을 제외하고 모두 물에 녹는다.[30]알칼리 금속도 물과 반응하여 강한 알칼리성 수산화물을 형성하므로 매우 주의하여 취급해야 한다.무거운 알칼리 금속은 가벼운 금속보다 더 격렬하게 반응한다. 예를 들어, 물에 빠졌을 때, 세슘은 각 금속의 동일한 수의 점을 사용할 경우 칼륨보다 더 큰 폭발을 일으킨다.[30][75][57]알칼리 금속은 유효 핵전하가[30] 낮고 전자 1개만 손실해도 고귀한 가스 구성을 얻을 수 있기 때문에 주기율표의[65] 각 기간 중 첫 번째 이온화 에너지가 가장 낮다.[30]알칼리 금속은 물과 반응할 뿐만 아니라 알코올과 페놀, 기체 암모니아, 알킨스와 같은 양성자 기증자에게도 반응성의 경이로운 정도를 마지막으로 보여 준다.환원제로서의 그들의 큰 힘은 그들이 산화물이나 할로겐화물로부터 다른 금속들을 해방시키는데 매우 유용하게 만든다.[10]: 76
모든 알칼리 금속의 두 번째 이온화 에너지는 핵에 가까운 완전한 껍질 안에 있기 때문에 매우 높다[30][65].[30] 따라서 그들은 거의 항상 단 하나의 전자를 잃고 양이온을 형성한다.[10]: 28 알칼리드는 예외로, 알칼리드가 -1 산화 상태의 알칼리 금속을 함유하고 있는 불안정한 화합물로, 알칼리드가 발견되기 이전과 같이 매우 이례적인 것으로, 알칼리 금속은 음이온을 형성할 수 없을 것으로 예상되었고, 염류에서만 양이온으로 나타날 수 있다고 생각되었다.알칼리드 음이온이 s-subshell을 채웠기 때문에 s-subshell은 존재하기에 충분한 안정성을 제공한다.리튬을 제외한 모든 안정된 알칼리 금속은 알칼리드를 형성할 수 있는 것으로 알려져 있으며 [76][77][78]알칼리드는 특이하게 스토이치측정법과 낮은 이온화 잠재력 때문에 이론적 관심이 많다.알칼리드는 화학적으로 전기체와 유사하며, 이는 갇힌 전자가 음이온 역할을 하는 염류다.[79]일상적인 수소화 나트륨에 반대하지만 여러 파생 상품 준안정 것으로 전망된다는 alkalide의 특히 놀라운 예를 들어, H+Na−(둘 다 이온시키는 것), Na+H−:[80] 격리에, 그것의 높은 에너지 수소 나트륨에에서 두개의 전자의 변위 결과로 때문에 불안정한 상태 또는"역원 수소화 나트륨" 있다.안정적인..[80][81]
수용액에서 알칼리 금속 이온은 [M(HO2)]n+라는 공식의 아쿠아 이온을 형성하며, 여기서 n은 용해수이다.그들의 조정 번호와 모양은 그들의 이온 반도에서 기대되는 것과 잘 일치한다.수용액에서 금속 이온에 직접 부착된 물 분자는 첫 번째 조정 영역에 속하며, 첫 번째 또는 일차 용해 쉘이라고도 한다.물 분자와 금속 이온 사이의 결합은 데이터 공동 결합이며 산소 원자가 결합에 두 전자를 모두 기증한다.각각의 조정된 물 분자는 수소 결합에 의해 다른 물 분자에 부착될 수 있다.후자는 제2차 조정권에 상주한다고 한다.그러나 알칼리 금속 양이온의 경우 양이온의 +1 전하량이 1차 용해 껍질의 물 분자를 분극화시킬 만큼 높지 않아 제2차 조정 영역은 잘 정의되지 않아 제2차 조정 영역과 강한 수소 결합을 형성하여 보다 안정된 실체를 만들어낸다.[82][83]: 25 반면에 6solvation 숫자 리튬 아쿠아 이온에 발견되었다 Li+의solvation 수 실험적으로 400, 정사면체[Li(H2O)4]+ 형성:결정한solvation 번호 접촉 이온 쌍의 형성의 4그 결과, 그리고 더 높은solvation 숫자들 물 분자의 용어로 해석될 수 있다. 를분자 동적 시뮬레이션이 팔면 육각 이온의 존재를 나타낼 수 있지만, t는 사면체 표면을 통해 [Li(HO2)]4+에 접근한다.또한 나트륨 이온의 1차 용해구에는 아마도 6개의 물 분자가 있어, 팔면체[Na(HO2)]6+ 이온을 형성하고 있다.[66][83]: 126–127 이전에는 보다 무거운 알칼리 금속이 옥타헤드 헥사콰 이온도 형성되었다고 생각되었지만, 그 이후로는 칼륨과 루비듐이 정사각형 항정신병 구조를 가진 [K(HO2)]8+와 [Rb(HO2)]8+ 이온을 형성하고, 세슘이 12 좌표[Cs(HO2)]12+ 이온을 형성하고 있는 것으로 밝혀졌다.[84]
리튬
리튬의 화학은 작은 Li+ cation이 음이온을 편광시키고 그것의 화합물에 더 많은 공동의 특성을 주기 때문에 그룹의 다른 화학과는 몇 가지 차이점을 보여준다.[30]리튬과 마그네슘은 유사한 원자 반지름 때문에 대각선 관계를 가지기 때문에 어느 정도 유사성을 보인다.[30]예를 들어 리튬은 모든 알칼리성 토양 금속(마그네슘의 집단) 중에서 공통적이지만 알칼리성 금속들 사이에서 독특한 성질인 질화물을 형성한다.[85]또한, 각각의 그룹 중 리튬과 마그네슘만이 유의미한 공발효성(예: LiMe와 MgMe2)을 가진 유기농 화합물을 형성한다.[86]
플루오르화 리튬은 알칼리 금속 할로겐화물로 물에 잘 녹지 않는 [30]알칼리 금속 수산화물은 수산화 리튬이 유일하다.[30]반대로 편광할 수 없는 큰 음이온이 있는 리튬 과염소산염과 기타 리튬염은 다른 알칼리 금속의 유사 화합물보다 훨씬 안정되어 있는데, 이는 리의+ 용해 에너지가 높기 때문일 것이다.[10]: 76 이 효과는 또한 대부분의 간단한 리튬 염분이 일반적으로 수화 형태로 발견된다는 것을 의미하는데, 무수 형태는 매우 저습하기 때문이다: 이것은 제습기와 에어컨에 염화 리튬과 브로마이드 리튬과 같은 염분을 사용할 수 있게 해준다.[10]: 76
프랑슘
프랑슘은 또한 높은 원자량으로 인해 약간의 차이를 보일 것으로 예측되어, 그것의 전자가 빛의 속도의 상당한 분율로 이동하게 하고, 따라서 상대론적 효과를 더욱 두드러지게 한다.알칼리 금속의 전기 성분과 이온화 에너지가 감소하는 추세와 대조적으로, 프랑슘의 전기와 이온화 에너지는 7s 전자의 상대론적 안정화로 인해 세슘보다 높을 것으로 예측되며, 또한 원자 반경이 비정상적으로 낮을 것으로 예상된다.따라서 예상과 달리 세슘은 프랑슘이 아닌 알칼리 금속 중에서 가장 반응성이 높다.[68][37]: 1729 [87]프랑슘의 알려진 모든 물리적 특성들 또한 첫 번째 이온화 에너지, 전자 친화력, 음이온 편광성과 같은 리튬에서 세슘으로 가는 분명한 경향에서 벗어나지만, 프랑슘에 대한 알려진 데이터의 빈도 때문에 많은 선원들이 리튬에서 세슘으로 추세를 만든다는 사실을 무시한 채 외삽된 값을 제공한다.세슘은 프랑슘에 적용되지 않는다.[87]상대성을 고려해 예측된 프랑슘의 몇 안 되는 특성으로는 전자 친화력(47.2 kJ/mol)[88]과 Fr2 분자의 분열 엔탈피(42.1 kJ/mol)가 있다.[89]CsFr 분자는 CsFr로+− 분극화되어 있어, 프랑슘의 7s 하위 껍질이 세슘의 6s 하위 껍질보다 상대론적 효과에 훨씬 더 강하게 영향을 받는다는 것을 보여준다.[87]또한, 프랑슘 6p 전자로부터의 결합 기여 때문에 다른 알칼리 금속 슈퍼옥시드와 달리, 프랑슘 과산화 프랑슘(Francium superoxide, FrO2)은 유의미한 공밸런스 특성을 가질 것으로 예상된다.[87]
핵
| Z | 알칼리 금속 | 안정적 | 데케이즈 | 불안정: 기울임꼴 홀수치 동위 원소 색상 핑크 | ||
|---|---|---|---|---|---|---|
| 3 | 리튬 | 2 | — | 7 리 | 6 리 | |
| 11 | 나트륨 | 1 | — | 23 나 | ||
| 19 | 칼륨 | 2 | 1 | 39 K | 41 K | 40 K |
| 37 | 루비듐 | 1 | 1 | 85 Rb | 87 Rb | |
| 55 | 세슘 | 1 | — | 133 Cs | ||
| 87 | 프랑슘 | — | — | 원시 동위 원소 없음 (223 Fr은 방사성 핵종이다) | ||
| 방사능: K, t1/2 1.25 × 10년9; Rb, t1/2 4.9 × 10년10; Fr, t 221/2.0분. | ||||||
모든 알칼리 금속은 홀수 원자 번호를 가지고 있으므로, 동위원소는 홀수-오드(양자와 중성자 번호는 모두 홀수) 또는 홀수- 짝수(양자 번호는 홀수지만 중성자 번호는 짝수)여야 한다.홀수-이상형 핵은 짝수 질량을 갖는 반면 홀수-짝수 핵은 홀수 질량 수를 갖는다.홀수-이상 원핵종은 드물다. 왜냐하면 대부분의 홀수-이상핵은 베타 붕괴와 관련하여 매우 불안정하기 때문이다. 왜냐하면 붕괴 산물은 핵 결합 효과로 인해 균등하며, 따라서 더 강하게 결합되기 때문이다.[90]
홀수-이상핵의 희귀성 때문에 알칼리 금속의 거의 모든 원시 동위원소는 홀수-짝수(경량 안정 동위원소 리튬-6과 장수 방사성 이소토프 칼륨-40은 예외)이다.주어진 홀수 질량 숫자의 경우 짝수 질량과 짝수 및 홀수 사이의 결합 에너지에는 차이가 없기 때문에 단일 베타-안정성 핵종이 있을 수 있다. 짝수 질량과 홀수 사이의 결합 에너지에는 차이가 없기 때문에 동일한 질량 수(이소바)의 다른 핵종이 가장 낮은 질량 핵종을 향해 베타 붕괴가 자유롭다.두 종류의 핵 중 홀수 수가 불안정하다는 효과는 알칼리 금속과 같은 홀수 원소가 짝수 원소보다 안정 동위원소를 적게 갖는 경향이 있다는 것이다.안정 동위원소 하나만 가지고 있는 26개의 단일 원소 중 1개를 제외한 모든 원소는 홀수 원자수를 가지고 있으며, 1개를 제외한 모든 원소는 균일한 수의 중성자를 가지고 있다.베릴륨은 원자 번호가 낮기 때문에 두 규칙의 유일한 예외다.[90]
리튬과 세슘을 제외한 모든 알칼리 금속은 자연적으로 발생하는 방사성 동위원소가 적어도 하나 있는데, 나트륨-22와 나트륨-24는 우주적으로 생성된 미량 방사성동위원소, [91]칼륨-40과 루비듐-87은 매우 긴 반감기를 가지고 있어 자연적으로 발생하며,[92] 프랑슘의 모든 동위원소는 방사능이다.[92]세슘은 자연적으로 발생하는 방사성 동위원소는 없지만 [93][94]20세기 초에도 방사성 물질로 생각되었다.[92] (당시 프랑슘은 아직 발견되지 않았다.)칼륨의 자연 장수 방사성 동위원소인 칼륨-40은 천연 칼륨의 약 0.012%를 차지하며,[95] 따라서 천연 칼륨은 약하게 방사성을 띤다.이러한 자연 방사능은 1925년 원소 87(세슘 다음 알칼리 금속)의 발견에 대한 잘못된 주장을 뒷받침하는 근거가 되었다.[31][32]천연 루비듐은 유사하게 약간 방사능이 있으며, 27.83%가 장수 방사성 이소토프 루비듐-87이다.[10]: 74
반감기가 30.17년인 세슘-137은 스트론튬-90과 함께 사용 후 최대 수백년까지 사용후 핵연료의 방사능 대부분을 담당하는 두 가지 주요 중생 핵분열 생성물 중 하나이다.체르노빌 사고에서 아직 남아 있는 방사능의 대부분을 구성하고 있다.세슘-137은 고에너지 베타 붕괴를 겪으며 결국 안정적인 바륨-137이 된다.그것은 감마선의 강한 방출체다.세슘-137은 중성자 포획률이 매우 낮으며 이러한 방식으로 폐기할 수는 없지만 붕괴될 수 있도록 허용해야 한다.[96]세슘-137은 삼중수소의 사용과 유사한 수문학적 연구에서 추적자로 사용되어 왔다.[97]거의 모든 핵무기 실험과 일부 핵 사고, 특히 고이아니아 사고와 체르노빌 참사 때 소량의 세슘-137이 환경으로 방출되었다.2005년 현재 세슘-137은 체르노빌 원전 주변 소외지역의 주요 방사선원이다.[98]알칼리 금속의 하나로서의 화학적 성질은 염분의 높은 용해성으로 인해 자연에서 쉽게 움직이고 퍼져나가며, 인체에 의해 차지되기 때문에 단에서 중생의 핵분열 생성물 중 가장 문제가 되는 물질 중 하나로서, 본질적인 착향료인 나트륨과 칼륨으로 착각하고 있다.[99]: 114
주기적 추세
알칼리 금속은 다른 그룹의 원소들이 서로 더 유사하다.[30]예를 들어, 표 아래로 이동할 때, 알려진 모든 알칼리 금속은 핵 반지름이 증가하고,[72] 전기성이 감소하고,[72] 반응성이 증가하며,[30] 용융점과 비등점이[72] 감소하고, 융기와 기화의 가열도 감소하는 것을 보여준다.[10]: 75 일반적으로 칼륨이 나트륨보다 밀도가 낮다는 점을 제외하고는 테이블 아래로 이동하면 밀도가 높아진다.[72]
원자성 및 이온성 반지름
알칼리 금속의 원자 방사선은 그룹을 따라 증가한다.[72]차폐 효과 때문에 원자가 둘 이상의 전자껍질을 가질 때, 각 전자는 핵에서 나오는 전기적 끌림뿐만 아니라 다른 전자로부터도 전기적 저항을 느낀다.[100]알칼리 금속에서 가장 바깥쪽 전자는 내전자에 의해 일부 핵 전하(원자 숫자와 동일)가 취소되기 때문에 순 전하 +1만 느낀다; 알칼리 금속의 내전자의 수는 항상 핵 전하보다 한 개 적다.따라서 알칼리 금속의 원자 반경에 영향을 미치는 유일한 요인은 전자 껍질의 수입니다.이 숫자는 집단을 내려가면 증가하기 때문에, 원자 반지름도 집단을 내려가야 한다.[72]
알칼리 금속의 이온성 반지름은 원자 반지름보다 훨씬 작다.알칼리 금속의 가장 바깥쪽 전자가 내부 전자와는 다른 전자 껍질 안에 있기 때문에 이를 제거하면 결과 원자가 전자 껍질이 1개 적고 크기가 작기 때문이다.또한 유효핵전하가 증가하여 전자가 핵 쪽으로 더욱 강하게 끌어당겨 이온반경이 감소한다.[30]
첫 번째 이온화 에너지

원소 또는 분자의 첫 번째 이온화 에너지는 원소 또는 분자의 기체 원자의 한 몰에서 가장 느슨하게 유지되는 전자를 이동하여 전하를 +1로 기체 이온의 한 몰을 형성하는데 필요한 에너지다.첫 번째 이온화 에너지에 영향을 미치는 요인은 핵전하, 내전자에 의한 차폐량, 핵으로부터 가장 느슨하게 잡히는 전자로부터의 거리 등이다. 핵은 항상 주요 그룹 원소의 외부 전자다.처음 두 요인은 가장 느슨하게 유지되는 전자의 느낌을 변화시킨다.알칼리 금속의 가장 바깥쪽 전자는 항상 같은 유효 핵 전하(+1)를 느끼기 때문에, 첫 번째 이온화 에너지에 영향을 미치는 유일한 요인은 가장 바깥쪽 전자에서 핵까지의 거리뿐이다.이 거리는 집단을 따라 내려가기 때문에 가장 바깥쪽 전자는 핵으로부터의 흡인력을 덜 느끼고 따라서 첫 번째 이온화 에너지가 감소한다.[72](7s 궤도상의 상대론적 안정과 수축으로 인해 이러한 경향은 프랑슘에서 깨져 프랑슘의 발란스 전자가 비상대론적 계산에서 예상할 수 있는 것보다 핵에 더 가깝게 된다.이것은 프랑슘의 가장 바깥쪽 전자가 핵으로부터 더 많은 매력을 느끼게 하며, 세슘보다 약간 높은 최초의 이온화 에너지를 증가시킨다.)[37]: 1729
알칼리 금속의 두 번째 이온화 에너지는 두 번째로 느슨하게 고정된 전자가 완전히 채워진 전자 껍질의 일부여서 제거하기 어렵기 때문에 첫 번째 것보다 훨씬 높다.[30]
반응도
알칼리 금속의 반응성은 그룹을 따라 증가한다.이는 알칼리 금속의 첫 번째 이온화 에너지와 분무화 에너지라는 두 가지 요인이 복합적으로 작용한 결과다.알칼리 금속의 첫 번째 이온화 에너지가 집단을 내려가기 때문에 가장 바깥쪽 전자가 원자로부터 제거되고 화학 반응에 참여하기 쉬워 집단을 따라 반응성이 높아진다.원자화 에너지는 원소의 금속 결합 강도를 측정하는데, 이는 원자가 반지름에서 증가함에 따라 그룹 아래로 떨어져야 하며 따라서 금속 결합은 길이가 증가해야 하므로 중량의 알칼리 금속의 핵의 끌어당김으로부터 탈색 전자가 더 멀어지게 된다.원자화와 첫 번째 이온화 에너지를 추가하면 다른 물질과의 알칼리 금속의 반응의 활성화 에너지와 밀접하게 관련되는 양을 얻을 수 있다(그러나 같지 않다).이 양은 집단을 따라 감소하고 활성 에너지도 감소한다. 따라서 화학 반응이 더 빨리 일어날 수 있고 반응성이 집단을 따라 증가한다.[101]
전기성
전기자극성은 원자나 기능집단이 자기 자신을 향해 전자(또는 전자 밀도)를 끌어당기는 경향을 설명하는 화학적 성질이다.[102]염화나트륨에서 나트륨과 염소의 결합이 공밸런트라면, 외부 전자의 유효 핵전하가 염소에서는 +7이지만 나트륨에서는 +1에 불과하기 때문에 공유 전자의 쌍은 염소에 끌릴 것이다.전자쌍은 염소원자에 너무 가까이 끌려서 사실상 염소원자(이온 결합)로 옮겨진다.그러나 나트륨 원자를 리튬 원자로 대체했다면 리튬 원자가 작아 전자 쌍이 리튬에서 더 가까운 유효 핵 전하로 더 강하게 끌어당겨지기 때문에 전자는 이전처럼 염소 원자에 가깝게 끌어당기지 않을 것이다.따라서, 더 큰 알칼리 금속 원자(더 멀리 그룹 아래)는 결합 쌍이 자신들에게 강하게 끌리지 않기 때문에 덜 전기적일 것이다.앞서 언급했듯이 프랑슘은 예외일 것으로 예상된다.[72]
리튬의 전기율이 더 높기 때문에, 그것의 화합물들 중 일부는 더 공동의 특성을 가지고 있다.예를 들어, 요오드화리튬(Li I)은 대부분의 공동효용 화합물의 특성인 유기용매에 용해된다.[72]물에 녹지 않는 알칼리 할리드는 리튬불화수소(LiF)가 유일하고,[30] 수산화리튬(LiOH)은 델리케이트가 없는 알칼리 금속 수산화물 중 유일하게 알칼리 금속은 리튬불화수소(LiOH)가 유일하다.[30]
용융점 및 비등점
물질의 녹는점은 고체에서 액체로 상태가 변하는 지점이고, 물질의 비등점(액체 상태)은 액체의 증기 압력이 액체를[103][104] 둘러싼 환경 압력과 같으며 모든 액체가 기체로 상태가 변하는 지점이다.금속이 용해점까지 가열되면서 원자를 제자리에 유지시키는 금속결합이 약해져 원자가 움직일 수 있게 되고, 금속결합은 결국 금속의 비등점에서 완전히 깨지게 된다.[72][105]따라서 알칼리 금속의 떨어지는 용융점과 비등점은 알칼리 금속의 금속 결합 강도가 그룹 아래로 감소함을 나타낸다.[72]이는 금속 원자가 양극 이온에서 탈초전자에 이르는 전자기적 끌어당김에 의해 결합되기 때문이다.[72][105]원자들이 그룹을 내려가면서 크기가 증가하면(원자 반경이 증가하기 때문에), 이온의 핵은 분해된 전자로부터 더 멀리 이동하게 되고, 따라서 금속 결합이 약해져 금속이 더 쉽게 녹고 끓을 수 있게 되어 용융점과 비등점이 낮아진다.[72](차폐 효과로 인해 증가된 원자력은 관련 요소가 아니다.)[72]
밀도
알칼리 금속은 모두 동일한 결정 구조(체 중심 입방체)[10]를 가지고 있으므로 밀도는 단위 부피당 질량으로 정의되기 때문에 관련 인자는 특정 부피에 들어갈 수 있는 원자의 수와 원자 중 하나의 질량뿐이다.첫 번째 요인은 원자의 부피와 따라서 원자 반경에 따라 달라지는데, 이는 그룹을 내려가면 증가하기 때문에 알칼리 금속 원자의 부피는 그룹을 내려가면 증가한다.알칼리 금속 원자의 질량 또한 그룹을 따라 증가한다.따라서 알칼리 금속의 밀도에 대한 추세는 원자 무게와 원자 반지름에 따라 달라진다. 만약 이 두 요인에 대한 수치가 알려지면 알칼리 금속의 밀도 사이의 비율을 계산할 수 있다.결과적으로 나타나는 경향은 칼륨을 제외하고 알칼리 금속의 밀도가 테이블 아래로 증가하는 것이다.알칼리 금속은 그 시대 모든 원소 중 가장 낮은 원자량과 가장 큰 원자 반경을 가지고 있기 때문에 주기율표에서 알칼리 금속은 가장 조밀한 금속이다.[72]리튬, 나트륨, 칼륨은 주기율표에서 물보다 밀도가 낮은 유일한 3개의 금속이다:[30] 사실 리튬은 상온에서 가장 밀도가 낮은 것으로 알려져 있다.[10]: 75
화합물
알칼리 금속은 모두 보통 음이온과 마주치는 완전한 일련의 화합물을 형성하는데, 이것은 집단 추세를 잘 보여준다.이러한 화합물은 알칼리 금속이 수용자 종에 전자를 잃고 단면 이온을 형성하는 것과 관련이 있다고 설명할 수 있다.[10]: 79 이 설명은 알칼리 할로겐화물에 대해 가장 정확하며 양이온과 음이온 전하가 증가함에 따라 정확도가 점점 낮아지고 음이온이 커지고 극성이 높아질수록 정확도가 떨어진다.예를 들어, 이온 본딩은 시리즈 NaCl, NaO2, NaS2, NaP3, NaAs3, NaSb3, NaBi3, Na를 따라 금속 접합에 영향을 준다.[10]: 81
수산화물
| 외부 영상 | |
|---|---|

모든 알칼리 금속은 찬물과 격렬하게 또는 폭발적으로 반응하여 강력한 기초 알칼리 금속 수산화물의 수용액을 생성하여 수소 가스를 방출한다.[101]이 반응은 집단을 따라 내려가면서 더욱 활발해진다: 리튬은 발광과 함께 꾸준히 반응하지만 나트륨과 칼륨은 발화할 수 있고 루비듐과 세슘은 물에 가라앉아 수소 가스를 빠르게 발생시켜 유리 용기를 산산조각 낼 수 있다.[30]알칼리 금속을 물에 떨어뜨리면 폭발이 일어나는데, 이 중 두 단계가 따로 있다.금속은 먼저 물과 반응하여 물 속의 수소 결합을 깨뜨리고 수소 가스를 생산한다; 이것은 보다 반응성이 높은 중량의 알칼리 금속에서 더 빨리 일어난다.둘째, 반응의 첫 번째 부분에서 발생하는 열은 수소 가스에 불을 붙이는 경우가 많아 수소 가스가 주변 공기로 폭발적으로 연소하는 원인이 된다.이 2차 수소 가스 폭발은 물과 금속의 초기 반응(대부분 물 아래에서 일어나는 경향이 있음)이 아닌 물, 호수 또는 다른 물체 위에 가시적인 불꽃을 생성한다.[75]알칼리 금속 수산화물은 가장 기본적인 것으로 알려진 수산화물이다.[10]: 87
최근의 연구는 물 속에서 알칼리 금속의 폭발적 행동은 수소 자체의 급속한 생성에 의해서가 아니라 쿨롱 폭발에 의해 추진된다는 것을 시사했다.[106]모든 알칼리 금속은 물과의 반응의 일부로 녹는다.물 분자는 액체 금속의 맨 금속 표면을 이온화하여 양전하를 띤 금속 표면과 음전하를 띤 물 이온을 남긴다.충전된 금속과 물 이온 사이의 매력은 표면적을 급격히 증가시켜 기하급수적으로 이온화가 증가하게 될 것이다.액체 금속 표면 내의 반발력이 표면 장력의 힘을 초과하면 힘차게 폭발한다.[106]
수산화물 자체는 알려진 가장 기본적인 수산화물로서, 산과 반응하여 염분을 주고 알코올과 반응하여 과두 알코시드를 준다.그들은 탄산이나 중탄산염을 형성하기 위해 이산화탄소와 쉽게 반응하거나 황화수소나 비황화물을 형성하기 위해 황화수소와 반응하며, 티올을 석유에서 분리하기 위해 사용될 수 있다.그들은 원형 산화물과 반응한다: 예를 들어, 알루미늄, 아연, 주석, 납의 산화물은 알칼리 금속 수산화물과 반응하여 알루미늄, 아연산염, 스탠나이트, 플럼베이트를 만든다.이산화규소는 산성이므로 알칼리 금속 수산화물도 규산염 유리를 공격할 수 있다.[10]: 87
금속간 화합물
알칼리 금속은 NaHg와58 NaHg를3 포함하여 수은을 포함한 나트륨 아말감과 [10]: 81 같이 다양한 스토이치 측정의 주기율표에서 그룹 2에서 13까지의 원소들과 서로 많은 금속간 화합물을 형성한다.[107]이들 중 일부는 금속의 가장 전기적인 금속인 금으로 합금을 가져가는 이온적인 특징을 가지고 있는데, 예를 들어, NaAu와 KAu는 금속이지만 RbAu와 CsAu는 반도체다.[10]: 81 NaK는 나트륨과 칼륨의 합금으로 물과 공기에 대한 반응도가 매우 높아 주의해야 하지만 상온에서 액체여서 매우 유용하다.Eutectic 혼합물은 -12.6°C에서 녹는다.[108]41% 세슘, 47% 나트륨, 12% 칼륨의 합금은 금속 또는 합금 중 가장 낮은 것으로 알려진 용융점 -78°C를 가진다.[22]
그룹 13 원소가 있는 화합물
NaTl과 같이 더 무거운 그룹 13 원소(알루미늄, 갈륨, 인듐, 탈륨)를 가진 알칼리 금속의 금속간 화합물은 선행 원소를 가진 일반 합금과는 달리 전도체나 반도체가 불량하여 관련 알칼리 금속이 관련된 진틀 음이온에 전자를 잃었음을 암시한다.[109]그럼에도 불구하고 그룹 14 이상에 있는 원소들은 이산 음이온 성단을 형성하는 경향이 있는 반면, 그룹 13은 거대 이온 격자 사이에 위치한 알칼리 금속 양이온으로 고분자 이온을 형성하는 경향이 있다.예를 들어 NaTl은 음이온 격자 사이에 Na+ 이온이 위치한 공동 다이아몬드 입방 구조의 고분자 음이온(—Tl−—)n으로 구성된다.더 큰 알칼리 금속은 음이온 격자에 유사하게 들어갈 수 없으며 무거운 그룹 13 원소가 음이온 성단을 형성하도록 강제하는 경향이 있다.[110]
붕소는 그룹 13에서 유일하게 비금속인 특별한 경우다.알칼리 금속 붕소는 델타헤드 구조를 포함하는 상당한 붕소-보론 결합을 수반하는 붕소가 풍부한 경향이 있으며,[10]: 147–8 상승된 온도에서 매우 높은 증기 압력을 가지는 알칼리 금속으로 인해 열적으로 불안정하다.이것은 알칼리 금속이 700 °C 미만의 붕소와 반응하지 않기 때문에 직접 합성에 문제가 있으므로, 알칼리 금속이 과다한 밀봉된 용기에서 이를 수행해야 한다.더욱이 이 그룹에서 예외적으로 붕소와의 반응성은 그룹 아래로 감소한다. 리튬은 700 °C에서 완전히 반응하지만, 900 °C에서 나트륨과 칼륨은 1200 °C에서 반응하지 않으며, 반응은 리튬은 순간적이지만 칼륨은 몇 시간이 걸린다.루비듐과 세슘 붕산염은 특성화조차 되지 않았다.LiB10, NaB6, NaB15, KB6 등 다양한 단계가 알려져 있다.[111][112]고압에서 리튬 붕소 내 붕소-보론 결합은 Wade의 규칙을 따르는 것에서 그룹 13의 나머지 부분처럼 진틀 음이온을 형성하는 것으로 변화한다.[113]
그룹 14 원소가 포함된 화합물
리튬과 나트륨은 탄소와 반응하여 아세틸라이드, LiC22, NaC를22 형성하는데, 아세틸렌으로 금속의 반응으로도 얻을 수 있다.칼륨, 루비듐, 세슘은 흑연과 반응한다. 이들의 원자는 육각 흑연층 사이에 상호보정되어 공식 MC60(다크그레이, 거의 블랙), MC48(다크그레이, 거의 블랙), MC36(파란), MC24(철청), MC8(M = K, Rb, Cs)의 흑연 중간보정 화합물을 형성한다.이들 화합물은 순수 흑연보다 200배 이상의 전기 전도성이 있어 알칼리 금속의 발란스 전자가 흑연층(예: MC+
−
8)으로 전이된다는 것을 시사한다.[66]KC를8 가열하면 칼륨 원자가 제거되어 KC24, KC36, KC, KC48, 마지막으로 KC로60 순차적으로 변환된다.KC는8 매우 강한 환원제로 화포성이며 물과 접촉하면 폭발한다.[114][115]더 큰 알칼리 금속(K, Rb, C)이 초기에 MC를8 형성하는 반면, 더 작은 알칼리 금속은 초기에6 MC를 형성하며, 실제로 그들은 형성하기 위해 500 °C 정도의 고온에서 흑연으로 금속의 반응을 요구한다.[116]이 외에도 알칼리 금속은 버크민스터풀레렌을 줄여 고체 풀레라이드n60 MC를 만들 수 있을 정도로 강력한 환원제다. 나트륨, 칼륨, 루비듐, 세슘은 n = 2, 3, 4, 6, 그리고 루비듐과 세슘은 추가로 n = 1을 달성할 수 있는 풀레라이드를 형성할 수 있다.[10]: 285
알칼리 금속이 탄소군(실리콘, 게르마늄, 주석, 납)에서 무거운 원소와 반응하면 M과+ 사면체 Si4−
4 이온을 함유한 규산염 MSi44(M = K, Rb 또는 Cs)와 같이 케이지와 같은 구조를 가진 이온 물질이 형성된다.[66]게르마니드 이온 Ge와4− Ge2−
4, Ge4−
92−
9, Ge, [(Ge9)]26−와 같은 다른 군집(Zintl) 이온을 포함하는 알칼리 금속 게르마니드의 화학은 해당 규산염의 화학 물질과 대체로 유사하다.[10]: 393 알칼리 금속 스탠니드는 대부분 이온성이며, 때로는 스탠니드 이온(Sn4−)이온(Sn)이온과 함께,[110] 때로는 테트라포타칼륨(KSN49)에 나타나는 Sn과4−
9 같이 더욱 복잡한 진틀 이온을 가지고 있다.[117]단원자 플룸바이드 이온(Pb4−)은 알려져 있지 않으며, 실제로 그 형성은 정력적으로 불리할 것으로 예측된다; 알칼리 금속 플룸바이드에는 Pb와4−
9 같은 복잡한 진틀 이온이 있다.이러한 알칼리 금속 게르마늄, 스탠니드, 플럼비드는 액체 암모니아에 있는 나트륨 금속으로 게르마늄, 주석, 납을 감소시킴으로써 생산될 수 있다.[10]: 394
질화물 및 뇨제
알칼리 금속 중 가장 가벼운 리튬은 표준 조건에서 질소와 반응하는 유일한 알칼리 금속이며, 질화알칼리 금속은 유일하게 안정적인 알칼리 금속 질화염이다.질소는 이질소 분자(N2)에서 강한 삼중 결합을 깨는 데 많은 에너지가 필요하기 때문에 비활성 기체다.알칼리 금속 질화물이 형성되면 알칼리 금속(형성 M 이온)의 이온화+ 에너지, N의2 삼중 결합을 깨뜨리고3− N 이온의 형성에 필요한 에너지, 그리고 알칼리 금속 질화물의 형성에서 방출되는 모든 에너지는 알칼리 금속 질화물의 격자 에너지에서 나온다.격자 에너지는 작은 고충전 이온으로 최대화된다; 알칼리 금속은 고충전 이온을 형성하지 않고 +1의 전하만으로 이온을 형성하므로, 가장 작은 알칼리 금속인 리튬만이 질소 발열제로 반응을 일으키기에 충분한 격자 에너지를 방출하여 질화 리튬을 형성한다.질소를 포함한 다른 알칼리 금속의 반응은 충분한 격자 에너지를 방출하지 못하며 따라서 내열성이 있으므로 표준 조건에서 질화물을 형성하지 않는다.[85]질화 나트륨(NaN3)과 질화칼륨(KN3)은 존재하지만 극도로 불안정해 성분으로 분해되기 쉬우며, 표준 조건에서 원소를 서로 반응시켜 생산할 수 없다.[119][120]강직 장애물은 질화 세슘이나 루비듐의 존재를 금지한다.[10]: 417 그러나 나트륨과 칼륨은 선형−
3 N 음이온을 수반하는 무색 아지드 염을 형성한다. 알칼리 금속 양이 크기 때문에 분해하기 전에 녹을 수 있을 정도로 열적으로 안정적이다.[10]: 417
모든 알칼리 금속은 인과 비소로 쉽게 반응하여 MPn이라는3 공식으로 인산염과 비소를 형성한다(여기서 M은 알칼리 금속을 나타내고 Pn은 인, 비소, 안티몬, 비스무트 등 피닉토겐을 나타낸다).이는 P와3− As3− 이온의 크기가 크기 때문에 염분이 형성되려면 격자 에너지를 덜 방출해야 하기 때문이다.[66]이것들은 알칼리 금속의 유일한 인산염과 비소가 아니다. 예를 들어 칼륨은 공식 KP3, KP43, KP54, KP, KP4637, KP, KP, KP와 함께 알려진31110.315 9개의 인산염을 가지고 있다.[121]대부분의 금속이 비소를 형성하는 반면, 알칼리와 알칼리성 접지 금속만이 대부분 이온 비소를 형성한다.NaAs의3 구조는 나트륨 금속보다 짧은 328–330 pm의 비정상적으로 짧은 Na–Na 거리로 복잡하며, 이는 이러한 전기 금속을 사용하더라도 결합이 이온적일 수 없음을 나타낸다.[10]공식 MA에3 부합하지 않는 다른 알칼리 금속 비소는 LiAs와 같이 알려져 있다. LiAs는 금속 광택과 일부 금속 결합의 존재를 나타내는 전기 전도성을 가지고 있다.[10]Sb이온이3− 강한 환원제인 만큼 항이모니드는 불안정하고 반응성이 강하다. 산과 함께 반응하면 독성이 있고 불안정한 기체 스티빈(SbH3)이 형성된다.[122]실제로, 그것들은 약간의 금속 성질을 가지고 있고, 스토이치측정 MSb의 알칼리 금속 항이몬화물은 나선형 진틀 구조물에 결합된 안티몬 원자를 포함한다.[123]비스무티드는 완전히 이온적이지도 않다; 그것들은 부분적으로 금속과 이온 결합을 포함하는 금속간 화합물이다.[124]
산화물과 찰코제네이드
9
2 클러스터, 한 면으로 서로 연결된 두 개의 일반 옥타헤드라로 구성됨
모든 알칼리 금속은 표준 조건에서 산소와 격렬하게 반응한다.이들은 단순한 산화물(O이온2− 함유), 과산화물(O이온2−
2 함유), 과산화물(두 산소원자 사이에 단일 결합이 있는 O이온 함유), 슈퍼옥시드(O이온−
2 함유) 등 다양한 종류의 산화물을 형성한다.리튬은 공기 중에 연소해 산화리튬을 형성하지만 나트륨은 산소와 반응해 산화나트륨과 과산화나트륨이 혼합된다.칼륨은 과산화칼륨과 과산화칼륨의 혼합물을 형성하고, 루비듐과 세슘은 과산화칼륨만을 형성한다.리튬, 나트륨, 칼륨이 공기 중에만 연소하는 반면 루비듐과 세슘은 화로포린(자발적으로 공기 중에 불이 붙는다)[85]이다.
알칼리 금속이 작을수록 크기가 작기 때문에 음이온(과산화물과 과산화물)이 양극화되는 경향이 있다.이것은 산화물 이온과 산소 원자를 형성하면서, 보다 복잡한 음이온의 전자를 그것의 성분인 산소 원자로 끌어당긴다.이것은 리튬이 상온에서 산소와의 반응만으로 산화물을 형성하게 한다.이 효과는 나트륨과 칼륨이 클수록 급격히 약해져 안정적인 과산화물을 형성할 수 있다.그룹 하단에 있는 루비듐과 세슘은 가장 안정성이 낮은 슈퍼옥시드도 형성할 수 있을 정도로 규모가 크다.과산화수소는 형성될 때 가장 많은 에너지를 방출하기 때문에 더 복잡한 음이온이 양극화되지 않는 알칼리 금속의 경우 우선 과산화수소가 형성된다.(이 알칼리 금속의 산화물과 과산화물은 존재하지만, 표준 조건에서 산소와 금속의 직접적인 반응으로 형성되지는 않는다.)[85]또한 Li와+ O2− 이온의 작은 크기는 그들이 안정된 이온 격자 구조를 형성하는 데 기여한다.그러나 통제된 조건 하에서 프랑슘을 제외한 모든 알칼리 금속은 산화물, 과산화물, 슈퍼옥시드를 형성하는 것으로 알려져 있다.알칼리 금속 과산화물과 슈퍼옥시드는 강력한 산화제다.과산화나트륨과 과산화칼륨은 이산화탄소와 반응하여 알칼리 금속 탄산염과 산소 가스를 형성하여 잠수함 공기청정기에 사용할 수 있게 한다; 자연적으로 호흡 중에 존재하는 수증기의 존재는 과산화칼륨에 의한 이산화탄소 제거를 더욱 효율적으로 만든다.[66][125]리튬을 제외한 모든 안정적인 알칼리 금속은 오존과 함께 무수분해 수산화물의 저온 반응을 통해 적색 오조니드3(MO)를 형성할 수 있다: 오조니드는 액체 암모니아를 사용하여 추출할 수 있다.그것들은 표준 조건에서 슈퍼옥사이드와 산소로 천천히 분해되고, 물과 접촉하면 즉시 수산화물로 가수분해된다.[10]: 85 칼륨, 루비듐, 세슘도 세스키옥시드 MO를23 형성하는데, 이것은 과산화지질소 과산화수소, [(M+
)(
4O2−
2)(O−
2)]
2[10]: 85 로 더 잘 고려될 수 있다.
루비듐과 세슘은 +1 이하의 공식 산화 상태에서 금속과 함께 매우 다양한 아산화물을 형성할 수 있다.[10]: 85 Rubidium can form Rb6O and Rb9O2 (copper-coloured) upon oxidation in air, while caesium forms an immense variety of oxides, such as the ozonide CsO3[126][127] and several brightly coloured suboxides,[128] such as Cs7O (bronze), Cs4O (red-violet), Cs11O3 (violet), Cs3O (dark green),[129] CsO, Cs3O2,[130] as well as Cs7O2.[131][132]이 중 마지막은 진공 상태에서 가열하여 CsO를2 생성할 수 있다.[57]
알칼리 금속은 또한 더 무거운 찰코균(황, 셀레늄, 텔루륨, 폴로늄)과 유사하게 반응할 수 있으며, 모든 알칼리 금속 찰코제네이드(프랑슘을 제외한)가 알려져 있다.찰코겐의 과잉에 대한 반응은 유사하게 찰코겐화물이 낮아질 수 있으며, 찰코겐 이온에는 해당 찰코겐 원자의 체인이 포함되어 있다.예를 들어 나트륨은 황과 반응해 황화(NaaS2)를 형성할 수 있으며, S2−
x 이온을 함유한 NaS2x(2부터 6까지)라는 공식으로 다양한 폴리황화물을 형성할 수 있다.[66]SE와2−2−2−
x Te 이온의 기본성 때문에 알칼리 금속 셀렌화물과 텔루라이드는 용액상 알칼리성이며 셀레늄과 텔루륨과 직접 반응하면 셀레니드 및 텔루라이드와 함께2−
x 알칼리 금속 폴리셀렌화물과 폴리텔루라이드가 형성된다.[133]그것들은 액체 암모니아에 있는 원소로부터 직접 얻을 수도 있고 공기가 없을 때 셀레늄이나 텔루륨으로 빠르게 산화되는 무색의 수용성 화합물이다.[10]: 766 알칼리 금속 폴로니드는 모두 Po2− 이온을 함유한 이온 화합물로 화학적으로 매우 안정적이며 약 300~400°C에서 원소들의 직접 반응에 의해 생성될 수 있다.[10]: 766 [134][135]
할로겐화, 하이드리드, 가성화합물
알칼리 금속은 주기율표의 가장 전기적인 원소들 중 하나이므로 주기율표의 가장 전기적인 원소인 할로겐(플루오린, 염소, 브롬, 요오드, 아스타틴)에 이온적으로 결합하는 경향이 있어 알칼리 금속 할로겐이라고 알려진 염분을 형성한다.그 반응은 매우 활발하고 때때로 폭발을 일으킬 수 있다.[10]: 76 20개의 안정적인 알칼리 금속 할리드는 모두 알려져 있다; 불안정한 것들은 아스타틴과 프랑슘의 큰 불안정성과 희귀성 때문에 아스타티드 나트륨을 제외하고는 알려져 있지 않다.20개 중 가장 잘 알려진 것은 확실히 염화나트륨으로, 다른 것은 보통 소금으로 알려져 있다.모든 안정된 알칼리 금속 할리드는 MX라는 공식을 가지고 있다. 여기서 M은 알칼리 금속이고 X는 할로겐이다.모두 용해점이 높은 흰색 이온 결정체 고형분이다.[30][85]모든 알칼리 금속 할로겐화물은 리튬불화수소(LiF)를 제외한 물에 용해되며, 격자 엔탈피가 매우 높아 물에 용해되지 않는다.플루오르화 리튬의 높은 격자 엔탈피는 Li와+ F− 이온의 크기가 작기 때문에 그들 사이의 정전기 교호작용이 강하기 때문인데,[30] 이는 리튬과 마그네슘의 대각선 관계와 일치하는 불소화 마그네슘에도 유사한 효과가 발생한다.[10]: 76
알칼리 금속은 또한 수소와 유사하게 반응하여 이온 알칼리 금속 하이드리드(hydride anion)를 형성하는데, 여기서 하이드라이드 음이온이 유사하게 작용한다: 이것들은 종종 환원제로 사용되어 하이드리드, 복잡한 금속 하이드리드 또는 수소 가스를 생산한다.[10]: 83 [66]다른 가성질도 알려져 있는데, 특히 시안화물이 그러하다.이것들은 시안화 리튬을 제외한 각각의 할로겐화물에 대한 등축으로, 시안화 이온이 자유롭게 회전할 수 있음을 나타낸다.[10]: 322 또한 NaClO3, KBrO3(노란색), NaBrO42, NaIO42, KBrO42 등 3차 알칼리 금속 할로겐화물이 알려져 있다.[10]: 83 루비듐과 세슘은 매우 큰 양이온의 약한 편광력에 의해 크게 안정화되기는 하지만 폴리할리드는 다소 불안정하다.[10]: 835
조정 콤플렉스
알칼리 금속 양이온은 단지 +1의 낮은 전하와 비교적 큰 크기 때문에 보통 단순한 루이스 베이스와 조정 콤플렉스를 형성하지 않는다. 따라서 리이온은+ 대부분의 콤플렉스를 형성하고 무거운 알칼리 금속 이온은 점점 더 적게 형성된다(약한 콤플렉스에 대해서는 예외가 발생하지만).[10]: 90 특히 리튬은 팔면 육각화가 선호되는 모드지만 1부터 12까지의 조정 번호를 보여주는 매우 풍부한 조정 화학물질을 가지고 있다.[10]: 90–1 수용액에서 알칼리 금속 이온 팔면체 육수 화물 단지로([M(H2O)6)]+), 리튬 이온의 크기가 작양식 때문에 예외가 존재하며 4면이 있는 물의 단지([Li(H2O)4)]+). 그들의 이온은 극성 와트에게 느끼는 매력의 정전 부대에 의해서 매력을 느낍니다는 알칼리 금속 이 단지를 형성한다.mo은 후 그는분자이 때문에 알칼리 금속 양이온을 함유한 무수 염이 방습제로 쓰이는 경우가 많다.[66]알칼리 금속은 또한 왕관 에테르(예+: 리의 경우 12크라운-4, 나의+ 경우 15크라운-5, K의+ 경우 18크라운-6, Rb의+ 경우 21크라운-7)와 정전기 흡수로 인한 암호화된 복합체를 쉽게 형성한다.[66]
암모니아 용액
알칼리 금속은 액체 암모니아에서 천천히 용해되어 용해된 금속 양이온 M과+ 용해된 전자 e의− 암모니아액 용액을 형성하며, 수소 가스와 알칼리 금속 아미드(MNH2, 여기서 M은 알칼리 금속을 나타낸다): 이것은 1809년 험프리 데이비에 의해 처음 지적되었고 W에 의해 재발견되었다.1864년 웨일그 과정은 촉매에 의해 속도를 높일 수 있다.이와 유사한 용액은 중분할 알칼리성 지금속 칼슘, 스트론튬, 바륨뿐만 아니라 이분할 란타니데스, 유로피움, 이테르비움에 의해 형성된다.아미드 소금은 용액이 용해되지 않고 쉽게 침전되어 알칼리 금속의 색상이 강한 암모니아 용액을 남긴다.1907년 찰스 크라우스는 용해된 전자가 존재하기 때문에 색상이 있는 것으로 확인하였고, 이는 이러한 용액의 높은 전기 전도도에 기여한다.저농도(3M 이하)에서는 진한 청색이며 염화 나트륨의 전도성이 10배 높으며, 고농도(3M 이상)에서는 구리색이며 수은과 같은 액체 금속의 전도성이 대략적으로 있다.[10][66][137]이러한 암모니아 용액에는 알칼리 금속 아미드 소금과 용해된 전자 외에도 알칼리 금속 양이온(M+), 중성 알칼리 금속 원자(M), 이원자 알칼리 금속 분자(M2), 알칼리 금속 음이온(M−) 등이 함유되어 있다.이것들은 불안정하고 결국 열역학적으로 안정된 알칼리 금속 아미드와 수소 가스가 된다.솔버티드 전자는 강력한 환원제로 화학 합성에 자주 사용된다.[66]
유기농법
오르가늄
가장 작은 알칼리 금속인 리튬은 가장 다양하고 안정적인 유기농 화합물을 형성하며, 공밸리 방식으로 결합된다.오르가늄 화합물은 전기적으로 비전도성 휘발성 고형분이나 저온에서 녹는 액체로, R이 유기군인 구조(RLi)x로 과점체를 형성하는 경향이 있다.리튬의 전기적 성질이 결합의 전하 밀도의 대부분을 탄소 원자에 올려놓아 카르바니온을 효과적으로 만들어내듯이, 유기석소 화합물은 매우 강력한 염기와 핵물질이다.베이스로 사용하기 위해, 버터리튬은 종종 사용되고 상업적으로 이용 가능하다.유기석화합물의 예로는 테트라메트릭(x = 4, 사면체)x과 육면체(x = 6, 팔면체) 형태로 존재하는 메틸리튬(CHLi3)이 있다.[66][141]오르가늄 화합물, 특히 n-부틸리튬은 유기합성에 유용한 시약으로, 리튬과 마그네슘과의 대각선 관계를 고려할 때 그리냐드 반응에 중요한 역할을 한다.[10]: 102 예를 들어 알킬리튬과 아릴리튬은 금속 카보닐과의 반응에 의해 알데히드와 케톤을 합성하는데 사용될 수 있다.예를 들어 니켈 테트라카보닐과의 반응은 불안정한 아킬 니켈 카보닐 콤플렉스를 통해 진행되며, 이 콤플렉스는 원하는 알데히드(H를+ 전기로 사용) 또는 케톤(알킬 할라이드 사용) 제품을 공급하기 위해 전기적 대체를 거친다.[10]: 105
- LiR + [Ni(CO)]4 Li+[RCONi(CO)]3−
- Li+[RCONi(CO)]3− Li+ + RCHO + [(솔벤트)Ni(CO)]3
- Li+[RCONi(CO)]3− Li+ + R'COR + [(솔벤트)Ni(CO)]3
알킬리튬과 아릴리튬은 또한 알데히드와 케톤을 주기 위해 N, N-분산 아미드와 반응할 수 있으며 일산화탄소와 반응함으로써 대칭 케톤을 줄 수 있다.그들은 β-수소를 제거하기 위해 열분해하여 알케인과 리튬 하이드라이드를 생산한다. 또 다른 경로는 강력한 기초 역할을 하는 알킬과 아릴리튬을 가진 에테르들의 반응이다.[10]: 105 비극성 용매에서 아릴리튬은 효과적인 카바니온으로 반응하여 이산화탄소를 방향성 카르복실산(ArCOH2)으로, 아릴케톤을 3차 카르비놀(Ar'2C(Ar)로 변화시킨다.마지막으로, 그것들은 금속-할로겐 교환을 통해 다른 유기측정 화합물을 합성하는데 사용될 수 있다.[10]: 106
무거운 알칼리 금속
유기석화합물과 달리 무거운 알칼리 금속의 유기측정합물은 주로 이온화합물이다.화학에서 오르간오소듐 화합물의 적용은 부분적으로 상업적으로 이용할 수 있고 보다 편리한 반응성을 보이는 오가르늄 화합물과의 경쟁 때문에 제한적이다.상업적으로 중요한 주요 오가노소듐 화합물은 사이클로펜타디엔화 나트륨이다.테트라페닐보레이트 나트륨은 고체 상태에서는 아릴 그룹에 결합되기 때문에 오르간오소듐 화합물로도 분류할 수 있다.높은 알칼리 금속의 유기농계 화합물은 오르간오소듐 화합물보다 반응성이 더 높고 효용성이 제한적이다.주목할 만한 시약은 n-부틸리튬과 테르트-산화칼륨이 혼합된 슐로저의 베이스다.이 시약은 프로펜과 반응하여 복합 아릴로트칼륨(KCHCH22)을 형성한다. cis-2-Butene과 trans-2-Butene은 알칼리 금속과 접촉했을 때 평형된다.리튬과 나트륨의 경우 이소머라이징이 빠른 반면 알칼리 금속의 무게는 느리다.무거운 알칼리 금속은 또한 강직적으로 혼잡한 순응을 선호한다.[142]오르간소포칼륨 화합물의 여러 결정 구조가 보고되어 나트륨 화합물과 마찬가지로 중합체라는 사실이 밝혀졌다.[143]오르가노소듐, 오르가노포칼륨, 오르가노루비듐 및 오르가노카에슘 화합물은 모두 대부분 이온성이며 비극성 용매에서 불용성(혹은 거의 불용성)이다.[66]
나트륨과 칼륨의 알킬과 아릴 유도체는 공기와 반응하는 경향이 있다.그들은 에테르들의 갈라진 틈을 일으켜 알크산시드를 발생시킨다.알킬리튬 화합물과 달리 알킬소듐과 알킬포트칼륨은 우르츠 커플링이 발생하기 때문에 알킬 할리드(alkyl halides)로 금속을 반응시켜 만들 수 없다.[123]: 265
- RM + R'X → R–R' + MX
이와 같이 불활성 탄화수소 용매에 알킬머큐리 화합물과 나트륨 또는 칼륨 금속을 반응시켜 만들어져야 한다.메틸소듐이 메틸리튬과 같은 테트라머를 형성하는 반면 메틸포튬칼륨은 이온성이 더 높고 니켈비소 구조로 이산 메틸 음이온과 칼륨 양이온을 가지고 있다.[123]: 265
알칼리 금속과 그 하이드라이드는 예를 들어 사이클로펜타디엔과 말단 알키네스와 같은 산성 탄화수소와 반응하여 염분을 공급한다.액체 암모니아, 에테르 또는 탄화수소 용제가 사용되는데, 그 중 가장 흔한 것은 테트라하이드로푸란이다.이 화합물들 중 가장 중요한 것은 많은 전이 금속 시클로펜타디닐 유도체의 중요한 전구체인 시클로펜타디엔화 나트륨이다55.[123]: 265 마찬가지로, 알칼리 금속은 테트라하이드로푸란에서 사이클로크타테트라엔과 반응하여 알칼리 금속 사이클로크타테트라엔을 부여한다. 예를 들어288, 이포칼륨은 우라노센과 같은 많은 금속 사이클로크타테트라에닐 파생물의 중요한 전구체다.[123]: 266 크고 매우 약하게 편광하는 알칼리 금속 양이온을 안정시킬 수 있는데, 강한 환원제인 암녹색 나프탈레네이드 나트륨, Na+[CH108•]−과 같은 크고 향기롭고 편광성이 있는 급진 음이온을 안정시킬 수 있다.[123]: 266
알칼리 금속의 대표적인 반응
산소와의 반응
산소와 반응하면 알칼리 금속이 산화물과 과산화물, 슈퍼옥시드와 아산화물을 형성한다.그러나 처음 세 가지는 더 흔하다.아래[144] 표는 산소와 반응하여 형성된 화합물의 종류를 보여준다.괄호 안의 화합물은 연소의 작은 산물을 나타낸다.
| 알칼리 금속 | 산화물 | 과산화물 | 과산화질소 |
| 리 | 리오2 | (Li2O2) | |
| 나 | (Na2O) | Na2O2 | |
| K | KO2 | ||
| Rb | RBO2 | ||
| Cs | CsO2 |
알칼리 금속 과산화물은 물에 불안정한 이온 화합물이다.과산화 음이온은 양이온에 약하게 결합하고, 가수분해되어 더 강한 공밸런스 결합을 형성한다.
- Na2O2 + 2H2O → 2NaOH + H2O2
다른 산소 화합물들은 물에서도 불안정하다.
- 2KO2 + 2H2O → 2KOH + H2O2 + O2[145]
- Li2O + H2O → 2LiOH
유황 반응
유황으로 황화물과 폴리황화물을 형성한다.[146]
- 2Na + 1/8S8 → Na2S + 1/8S8 → Na2S2...나스27
알칼리 금속 황화물은 본질적으로 약한 산과 강한 기초의 염분이기 때문에 기본적인 용액을 형성한다.
- S2- + H2O → HS− + HO−
- HS− + H2O → H2S + HO−
질소 반응
리튬은 상온에서 질소와 직접 결합하는 유일한 금속이다.
- 3Li + 1/3N2 → Li3N
LiN은3 암모니아를 해방시키기 위해 물과 반응할 수 있다.
- Li3N + 3H2O → 3LiOH + NH3
수소와의 반응
수소로 알칼리 금속은 물에 가수분해하는 식염수분을 형성한다.
- Na2 + H → NaH (고온시)
- NaH + H2O → NaOH + H2
탄소와의 반응
리튬은 탄소와 직접 반응해 희석액 아세틸라이드를 주는 유일한 금속이다.Na와 K는 아세틸렌과 반응하여 아세틸라이드를 줄 수 있다.[147]
- 2Li + 2C → Li2C2
- Na + CH22 → NaCH2 + 1/2H2 (150C에서0)
- Na + NaCH2 → NaC22(220C0)
물과 반응
물과 반응하면 수산화 이온과 수소 가스를 발생시킨다.이 반응은 왕성하고 발열성이 높으며, 그 결과로 생긴 수소는 공기 중에 발화하거나 심지어 Rb와 Cs의 경우 폭발할 수도 있다.[144]
- Na + H2O → NaOH + 1/2H2
다른 소금과의 반응
알칼리 금속은 매우 좋은 환원제다.그들은 덜 전기적인 금속 양이온을 줄일 수 있다.티타늄은 400C0(van Arkel-de Boer 공정)에서 Na와 함께 테트라클로로이드 티타늄을 감소시킴으로써 산업적으로 생산된다.
- TiCl4 + 4Na → 4NaCl + Ti
오르가노할라이드 화합물과의 반응
알칼리 금속은 할로겐 유도체와 반응하여 우르츠 반응을 통해 탄화수소를 생성한다.
- 2CH3-Cl + 2Na → H3C-CH3 + 2NaCl
액체 암모니아 내 알칼리 금속
알칼리 금속은 액체 암모니아나 알리페타틱 아민이나 헥사메틸인스포로아미드와 같은 다른 기증 용매에서 용해되어 청색 용액을 준다.이 용액들은 자유 전자를 함유하고 있는 것으로 여겨진다.[144]
- Na + xNH3 → Na+ + e(NH3)x−
솔버티드 전자가 존재하기 때문에 이러한 용액은 유기합성에 사용되는 매우 강력한 환원제다.
반응 1) 버치 감소로 알려져 있다.이러한 해결책에 의해 수행될 수 있는 기타 감소는[144] 다음과 같다.
- S8 + 2e− → S82-
- Fe(CO)5 + 2e− → Fe(CO)42- + CO
확장
프랑슘은 발견된 가장 무거운 알칼리 금속이지만, 가상의 더 무거운 알칼리 금속의 물리적, 화학적 특성을 예측하는 이론적 연구가 있었다.제1주기 8원소인 미발견 원소 유니네늄(원소 119)은 프랑슘 다음 알칼리 금속으로, 가벼운 착향료처럼 행동할 것으로 예측되지만, 일부 특성에서는 가벼운 알칼리 금속과 차이가 있을 것으로 예측되기도 한다.[37]: 1729–1730 세슘이나 프랑슘 대신 칼륨이나[42] 루비듐에[37]: 1729–1730 가까운 화학물질이 나올 전망이다.이것은 주기적인 경향으로서, 상대론적 영향을 무시하는 것이 유니니엄이 세슘과 프랑슘보다 훨씬 더 반응적일 것이라고 예측하는 것은 이례적이다.이 낮은 반응성은 유넨늄의 발란스 전자의 상대론적 안정화에 기인하며, 유넨늄의 첫 이온화 에너지를 증가시키고 금속과 이온화 반경을 감소시킨다;[42] 이 효과는 이미 프랑슘에 대해 볼 수 있다.[37]: 1729–1730 이는 우니늄이 화학적으로 알칼리 금속으로 작용한다고 가정하는데, 이는 비록 가능성이 높기는 하지만 상대론적 효과로 인해 사실이 아닐 수도 있다.[149]8s 궤도상의 상대론적 안정화는 또한 우니늄의 전자 친화력을 세슘과 프랑슘의 전자 친화력 이상으로 증가시킨다. 실제로 우니늄은 그것보다 가벼운 모든 알칼리 금속보다 높은 전자 친화력을 가질 것으로 예상된다.상대론적 효과는 또한 유니니엄의 극성성에 매우 큰 하락을 야기한다.[37]: 1729–1730 반면 유니니엄은 그룹 내 녹는점이 감소하는 추세를 지속해 0℃~30℃의 녹는점이 있을 것으로 예상된다.[37]: 1724
우니늄의 발란스 전자의 안정화와 따라서 8s 궤도수축은 원자반경을 루비듐([37]: 1729–1730 247pm)에 매우 가까운 240pm으로 낮추게 하여 +1 산화상태의 우니늄 화학은 프랑슘보다 루비듐의 화학성분과 더 유사해야 한다.[30]한편+, 7p 궤도가 불안정하게 되고 따라서 하부 껍질의 p-궤도보다 크기 때문에 우에 이온의 이온 반경은 Rb보다+ 클 것으로 예측된다.우누넨늄 또한+3 산화 state,[37]:1729–1730 어떤 다른 알칼리 metal,[10]에 볼 수 없다:28은 다른 알칼리 금속의 모든 알려진 알칼리 금속의 주요 산화 상태 특성은+1산화 상태:이것이 destabilisation고7p3/2 spinor,의 확대로 인해 지금까지 외에 보여 줄 것이다. 가장 바깥에 당선된 원인그렇지 않을 경우 예상되는 것보다 낮은 이온화 에너지를 가져야 한다.[10]: 28 [37]: 1729–1730 실제로 많은 유니니늄 화합물은 본딩에 7p3/2 전자가 관여하기 때문에 큰 공밸런스 특성을 가질 것으로 예상된다.[87]
유네늄을 넘어 알칼리 금속의 성질을 예측하는 작업은 그리 많지 않았다.비록 그 주기율 표의 간단한 예상(그aufbau 원리에 의해)ununennium에 요소 169, unhexennium게 되, Dirac-Fock 계산은 전자 배치 5g18 6f14 7d10 8s2[옥] 할 것으로 예상된다는alkali-metal-like 속성을 가지고 ununennium 다음 요소일 수 있요소 165, unhexpentium하고 있다.8p1/22 9s1.[37]: 1729–1730 [148] 이 원소는 알칼리 금속과 그룹 11 원소 사이의 성질을 중간으로 하고, 그것의 물리적 성질과 원자적 성질은 전자에 더 가깝겠지만, 그것의 화학성은 후자의 그것과 더 가까울 수 있다.추가 계산에 따르면 언헥센튬은 세슘을 넘어 이온화 에너지를 증가시키는 추세를 따를 것이며, 나트륨에 버금가는 이온화 에너지를 가지고 있으며, 세슘을 넘어 원자 반경을 감소시키는 추세를 계속하여 칼륨에 버금가는 원자 반경을 가져야 한다.[37]: 1729–1730 단, 헥센튬 7d 전자도 9s 전자와 함께 화학 반응에 참여할 수 있으며, 헥센튬의 전환 금속 거동 시 +1 이상의 산화 상태가 발생할 수 있다.[37]: 1732–1733 [150]알칼리성 및 알칼리성 접지 금속은 모두 s-블록 원소이기 때문에, 우니늄과 우헥센튬의 경향과 성질에 대한 이러한 예측은 해당 알칼리성 토금속 우비닐륨(UBN)과 우헥산슘(Uhhh)에 대해서도 거의 비슷하게 유지된다.[37]: 1729–1733 원소 173인 운셉트리움은 훨씬 더 무거운 운니늄의 호몰로로그일 수 있다; [USb] 6g의1 예측 전자 구성으로 에너지에서 닫힌 p-셸 위로 쉽게 제거되는 하나의 전자를 갖는 알칼리 금속과 같은 상황으로 되돌아가며, 세슘보다 훨씬 더 반응할 것으로 예상된다.[151][152]
운석 너머의 알칼리 금속의 가능성 있는 성질은 2019년 현재 아직 탐사되지 않았으며, 존재할 수도 없을 수도 있다.[148]주기율표의 기간 8 이상에서는 상대론적 효과와 쉘 구조 효과가 매우 강해져서 가벼운 착향료로부터의 외삽은 완전히 부정확해진다.또한 상대론적 및 쉘 구조 효과(s-orbitals를 안정화하고 더 높은 쉘의 d-, f-, g-orbitals를 불안정하게 하고 확장하는 것)는 정반대의 효과를 가지며, 그러한 높은 원자수를 가진 원소의 속성에 대한 상대론적 계산과 비상대적 계산 사이에 훨씬 큰 차이를 야기한다.[37]: 1732–1733 유네늄, 유헥스펜튬, 운셉트리움의 화학적 특성에 대한 관심은 원소 122(306Ub)와 164(482Uhq)를 중심으로 안정의 섬이 기대되는 위치에 근접해 있다는 사실에서 비롯된다.[153][154][155]
사이비알칼리 금속
많은 다른 물질들은 알칼리 금속과 유사하다. 단면성 양이온을 형성하는 경향이 있다.유사할로겐과 유사하게, 그것들은 때때로 "가위-알칼리 금속"이라고 불려왔다.이 물질들은 일부 원소와 더 많은 다원자 이온을 포함한다; 다원자 이온은 특히 알칼리 금속의 큰 크기와 약한 편광력과 비슷하다.[156]
수소
원소 수소는 중성 원자당 1개의 전자를 갖는 것이 보통 편의상 주기율표 제1그룹 상위에 놓이지만, 수소는 통상 알칼리 금속으로 간주되지 않는다.[157] 알칼리 금속으로 간주될 때는 화학적 성질이 아니라 원자성 때문이다.[158]전형적인 조건에서 순수 수소는 분자(H2)[159]당 두 개의 원자로 구성된 이원자 기체로 존재하지만 알칼리 금속은 기체 상태에 있을 때 고온에서만 이원자 분자(딜리튬, 리 등2)를 형성한다.[160]
수소는 알칼리 금속과 마찬가지로 발란스 전자가[123] 1개 있고 할로겐과 쉽게 반응하지만 [123]알칼리 금속 양이온에 비해 맨 양성자 H의+ 크기가 작기 때문에 유사성은 대부분 거기서 끝난다.[123]리튬 위에 위치하는 것은 주로 전자 구성 때문이다.[157]비슷한 화학적 특성 때문에 불소 위에 놓이기도 하지만, 유사성이 절대적인 것은 아니다.[161]
수소(132.0 kJ/mol)의 1차 이온화 에너지(132.0 kJ/mol)는 알칼리 금속보다 훨씬 높다.[162][163]수소 원자의 가장 바깥쪽 껍질을 채우기 위해서는 오직 한 개의 추가 전자가 필요하기 때문에 수소는 종종 할로겐처럼 작용하여 음의 하이드라이드 이온을 형성하고 있으며, 그 근거로 매우 가끔 할로겐으로 간주된다.(알칼리 금속은 알칼리드로 알려진 음이온도 형성할 수 있지만, 이것들은 불안정한 실험실 호기심에 지나지 않는다.)[80][81]이 배치에 반대하는 주장은 할로겐에서 할로겐으로 부터 할로겐으로 부터 할로겐으로 부터 할로겐화물의 발열성형성과는 달리 수소로 부터 수분이 형성되는 것은 내열성이라는 것이다.H− 음이온의 반지름은 또한 할로겐을 내려가는 크기를 증가시키는 추세에 맞지 않는다. 실제로− H는 그것의 단일 양성자가 두 전자를 쉽게 제어하지 못하기 때문에 매우 확산되어 있다.[123]: 15–6 액체 수소는 한동안 금속성을 보일 것으로 예상되었다;[161] 이것은 목성과 토성의 중심부에서 발견되는 것과 같은 극도로 높은 압력에서는 그렇지 않지만, 수소가 금속성이 되어 알칼리 금속처럼 작용한다; 이 단계에서는, 수소로 알려져 있다.[164]3000K에서 액체 금속 수소의 전기 저항성은 비금속 전환 시 각각의 압력에서 2000K에서 액체 루비듐 및 세슘과 거의 동일하다.[165]
수소의 1s1 전자 구성은 알칼리 금속(ns1)의 전자 구성과 유사하지만 1p 하위 껍질이 없기 때문에 독특하다.따라서 그것은 수력 H를+ 형성하기 위해 전자를 잃을 수도 있고, 수력 이온− H를 형성하기 위해 전자를 얻을 수도 있다.[10]: 43 전자의 경우 피상적으로 알칼리 금속과 닮았다. 후자의 경우 할로겐이지만 1p 하위 껍질 부족으로 인한 차이는 두 그룹 모두 수소의 성질을 잘 맞추지 못할 정도로 중요하다.[10]: 43 그룹 14도 이온화 에너지, 전자 친화력 등 열역학적 특성 면에서는 잘 맞지만 수소는 사분오열할 수 없다.따라서 그룹 1이 가장 보편적인 배치(하나를 선택한 경우)임에도 불구하고 세 가지 배치 중 어느 것도 전적으로 만족스러운 것은 아니다. 왜냐하면 수자는 산-기초 화학의 기초가 되어 모든 단원자 수소 종 중에서 단연 가장 중요하기 때문이다.[161]특이한 전자 구성과 작은 크기에서 기인하는 수소의 비정형적인 성질의 예로서 수소 이온은 매우 작아서(다른 원자나 이온의 50~220mm 크기 대비 약 150fmm) 다른 원자나 분자와 연관되지 않는 한 응축된 시스템에는 존재하지 않는다.실제로 화학 물질 간 양성자 이전은 산성 기반 화학의 기본이다.[10]: 43 또한 독특한 것은 수소 결합을 형성하는 수소의 능력인데, 이것은 전하 전달, 정전기, 전자 상관 관계 기인 현상의 영향이다.[161]유사한 리튬 본드도 알려져 있지만 대부분 정전이다.[161]그럼에도 불구하고 수소는 일부 분자 결정에서 알칼리 금속과 같은 구조적 역할을 맡을 수 있으며, 가장 가벼운 알칼리 금속(특히 리튬)과 밀접한 관계를 맺고 있다.[166]
암모늄과 파생상품
암모늄 이온(NH+
4)은 더 무거운 알칼리 금속과 매우 유사한 성질을 가지고 있어 칼륨과 루비듐 사이의 알칼리 금속 중간 역할을 하며,[156][167] 종종 가까운 친척으로 간주된다.[168][169][170]예를 들어, 대부분의 알칼리 금속 염은 암모늄 염이 공유하는 특성인 물에 용해된다.[171]암모늄을 안정적으로 매우 높은 압력(비록은 전형적인 압력이 전환에서 절연에 금속 행동 발생하는 주변, 100GPa)에서 금속(delocalised 전자의 바다에서 NH+4 이온) 어떻고 얼음 거인 천왕성과 해왕성은,에 엄청난 영향을 끼칠 것 안에서 일어날 수 있을 것으로 예상된다.t열 [169][170]자장암모니아와 이수소 분자의 혼합물에서 금속 암모늄으로의 전환은 25 GPA 바로 아래의 압력에서 일어날 수 있다고 추정되었다.[169]표준 조건에서 암모늄은 수은과 함께 금속성 아말감을 형성할 수 있다.[172]
다른 "시료-알칼리 금속"은 암모늄 양이온의 수소 원자의 일부가 알킬 또는 아릴 그룹으로 대체되는 알킬아모늄 양이온을 포함한다.특히 2차 암모늄 양이온(NR+
4)은 영구적으로 충전되기 때문에 매우 유용하며, HI와−
2 같은 매우 크고 매우 쉽게 편극성 음이온을 안정시키기 위해 값비싼 Cs의+ 대안으로 자주 사용된다.[10]: 812–9 알칼리 금속 수산화물과 마찬가지로 테트라알킬아일람모늄 수산화물은 대기 중 이산화탄소와 반응하여 탄산염을 형성하는 매우 강한 염기들이다.[123]: 256 또한 질소 원자는 인, 비소 또는 안티몬 원자(더 무거운 비금속성 pnictogen)로 대체되어 유사하게 대체될 수 있는 인산염(PH+
4)이나 방화(AsH+
4) 계를 만들 수 있지만, 스티보늄(SbH+
4) 자체는 알려져 있지 않지만, 그 유기 유도체의 일부는 특성화된다.[156]
코발토센과 파생상품
코발토세, Co(CH55)2는 페로센의 코발트 아날로그인 메탈로세이다.그것은 짙은 자주색 고체다.코발토센은 19개의 발란스 전자를 가지고 있는데, 18 전자 법칙에 따라 매우 안정된 친척인 페로센과 같은 유기발산 금속 복합체에서 보통 발견되는 것보다 한 개가 더 많다.이 추가 전자는 Co-C 결합에 대해 항균되는 궤도선을 차지한다.결과적으로, Co(CH55)2의 많은 화학 반응은 코발토세늄으로 알려진 매우 안정적인 18 전자 양이온을 생산하면서 이 "추가" 전자를 잃는 경향으로 특징지어진다.많은 코발토세니움염은 세슘염과 함께 코페리피테이트하며, 코발토세니움 수산화물은 대기 중의 이산화탄소를 흡수하여 코발토세늄 탄산염을 형성하는 강력한 기반이다.[123]: 256 알칼리 금속과 마찬가지로 코발토센은 강력한 환원제로, 데카메틸코발토센은 10개의 메틸 그룹의 복합 귀납 효과로 인해 여전히 강해진다.[173]코발트는 훨씬 더 강한 환원제인 로도센을 주기 위해 그것의 더 무거운 착향료 로듐으로 대체될 수 있다.[174]이리도세네(이리듐을 주입하는 것)는 아마도 여전히 더 강력할 것으로 추정되지만, 그것의 불안정성 때문에 그리 잘 연구되지는 않는다.[175]
탈륨
탈륨은 주기율표의 그룹 13에서 가장 무거운 안정 원소다.주기율표 하단에서 불활성 쌍 효과는 상당히 강한데, 원자의 크기가 증가함에 따라 결합 에너지가 감소하고 두 개의 결합을 형성할 때 방출되는 에너지의 양이 6s 전자들의 높은 이온화 에너지의 가치가 없기 때문이다.[10]: 226–7 Tl+(164pm),[10]: 28 K(152pm), Ag++(129pm) 이온의 이온 반경이 비슷해 알려진 모든 알칼리 금속과 탈륨이 있는 탈륨 화합물이 해당 칼륨 또는 은 화합물과 계량적으로 매우 유사한 +1 산화 상태를[10]: 28 표시한다.[176][177]그것은 때때로 유럽 대륙( 아니지만 영국에서)에 있는 알칼리 금속 그 즉시 discovery,[177]에 이어년에 126와 세슘만 다음에 위치로 간주되었고 드미트리 멘델레 예프의 1869년 주기율 표 6의 알칼리 금속과 줄리우스 로타 마이어의 1868년 주기율 표로.[21](러시아의 화학자 멘델레 예프가 1871년 주기율 표와 마이어의 1870년 주기 tabl.e는 탈륨을 붕소 그룹에서 현재 위치에 놓고 세슘 아래의 공간을 비워두었다.)[21]그러나 탈륨은 알려진 알칼리 금속 디스플레이가[10]: 28 없는 [10]: 28 산화 상태 +3도 표시한다(미발견된 7번째 알칼리 금속인 유니네늄이 +3 산화 상태를 나타낼 가능성이 있다고 예측됨).[37]: 1729–1730 여섯 번째 알칼리 금속은 현재 프랑슘으로 간주된다.[178]Tl은+ 불활성 쌍 효과에 의해 안정화되지만, 이 불활성 쌍의 6s 전자는 여전히 화학적으로 참여할 수 있기 때문에 이들 전자는 수용액에서 입체 화학적으로 활성한다.덧붙여 탈륨 할로겐화물(TlF 제외)은 물에서 상당히 불용성이며, 탈륨에서 입체화학적으로 활성하는 비활성 쌍이 존재하기 때문에 TlI는 특이한 구조를 가지고 있다.[179]
구리, 은, 금
그룹 11 금속(또는 동전 금속), 구리, 은, 금은 일반적으로 불완전한 d-셸로 이온을 형성할 수 있다는 점에서 전이 금속으로 분류된다.물리적으로 그들은 상대적으로 낮은 용해점과 높은 전기율 값을 가지고 있다."Cu, Ag, Au의 채워진 d 하위 껍질과 자유 s 전자들은 높은 전기 및 열 전도도에 기여한다.그룹 11의 왼쪽으로 전이 금속은 전자 이동성을 낮추는 s 전자와 부분적으로 채워진 d 하위 쉘 사이의 상호작용을 경험한다."[180]화학적으로 그룹 11 금속은 +1 발란스 상태에서 주군 금속과 같이 작용하며, 따라서 알칼리 금속과 어느 정도 관련이 있다. 이는 이전에 그들이 알칼리 금속의 "군 IA"와 유사하게 "그룹 IB"라고 라벨을 붙인 이유 중 하나이다.그것들은 때때로 전환 후 금속으로 분류된다.[181]그들의 스펙트럼은 알칼리 금속과 유사하다.[29]그들의 단구 이온은 파라마그네틱이며 알칼리 금속처럼 염분에 아무런 색도 주지 않는다.[182]
멘델레예프의 1871년 주기율표에는 구리, 은, 금이 두 번 나열되어 있는데, 한 번은 그룹 VIII(철삼합금 및 백금류 그룹 금속 포함), 한 번은 그룹 IB 아래에 나열되어 있다.그럼에도 불구하고 그룹 IB는 그것이 잠정적이라는 것을 강조하였다.멘델레예프의 그룹 할당에 대한 주요 기준은 원소의 최대 산화 상태였다: 그 근거로 그룹 11 원소는 구리의 존재 때문에 그룹 IB에 분류될 수 없었다().당시 알려진 II) 및 금(III)[29] 화합물.그러나, 그룹 IB를 제거하면 그룹 I이 A-B의 분리가 결여된 유일한 주요 그룹(그룹 III는 인수그룹으로 분류되었다)이 될 것이다.[29]곧이어 대다수의 화학자들이 그룹 IB에서 이러한 원소를 분류하고 그 결과의 대칭을 위해 그룹 8에서 제거하기로 선택했는데, 이는 알칼리 금속과 그룹 11 금속을 분리하는 현대의 중간 길이 18기둥 주기율표가 등장하기 전까지는 지배적인 분류였다.[29]
코인지 금속은 알칼리 금속의 특징적인 s 전자1 구성(그룹 1: ps; 그룹 11:ds61101)을 공유하기 때문에 전통적으로 알칼리 금속 그룹의 하위 분할로 간주되었다.그러나 유사성은 크게 두 그룹의 +1 화합물의 확률에 국한되며 화학적 성질은 아니다.[10]: 1177 이는 채워진 d 하위 쉘에서 유래한 것으로, 채워진 p 하위 쉘보다 가장 바깥쪽 s 전자에 훨씬 약한 차폐 효과를 제공하므로, 코인지 금속은 해당 알칼리 금속보다 훨씬 더 높은 1차 이온화 에너지와 더 작은 이온화 방사선을 갖는다.[10]: 1177 게다가, 그들은 더 높은 용해점, 경도, 밀도를 가지고 있고, 액체 암모니아에서 반응도와 용해도가 낮으며, 화합물에서 더 많은 공동의 특성을 가지고 있다.[10]: 1177 마지막으로 알칼리 금속은 전기화학 계열의 맨 위에 있는 반면, 동전 금속은 거의 맨 아래에 있다.[10]: 1177 코인지 금속의 채운 d 쉘은 알칼리 금속의 채운 p 쉘보다 훨씬 쉽게 교란되기 때문에 2차 및 3차 이온화 에너지가 더 낮아 +1보다 높은 산화 상태와 풍부한 조정 화학 작용을 가능하게 하여 그룹 11개의 금속이 명확한 전환 금속 특성을 갖게 된다.[10]: 1177 특히 주목할 만한 것은 루비듐과 세슘을 가진 금성형 이온 화합물로서 액체 암모니아 용액에서 용해된 형태로도 발생하는 오라이드 이온(Au−)을 형성하는 것이다: 여기 금은 5d6s의101 구성이 수은의 준 폐쇄형 쉘 5d6s102 구성보다 1개의 전자를 적게 가지고 있기 때문에 유사 할로겐으로 작용한다.[10]: 1177
생산 및 격리
순수 알칼리 금속의 생산은 물과 같이 흔히 사용되는 물질과의 반응성이 극심하기 때문에 다소 복잡하다.[30][66]규산염 광석에서 모든 안정적인 알칼리 금속을 얻을 수 있다: 황산은 우선 원하는 알칼리 금속 이온과 알루미늄(III) 이온을 광석(누출)에서 용해하는데 사용되며, 이때 기본 강우량이 알루미늄 이온을 수산화물로 침전시켜 혼합물에서 제거한다.남은 불용성 알칼리 금속 탄산염은 선택적으로 침전된다. 그리고 염산은 염산에 용해되어 염화물을 생산한다.그리고 나서 그 결과는 증발하기 위해 남겨지고 알칼리 금속은 분리될 수 있다.[66]리튬과 나트륨은 일반적으로 액체 염소화물과 전기분해를 통해 격리되며, 염화칼슘은 혼합물의 용해점을 낮추기 위해 첨가된다.그러나 무거운 알칼리 금속은 일반적으로 다른 방식으로 더 격리되는데, 여기서 환원제(일반적으로 칼륨과 마그네슘의 경우 나트륨 또는 가장 무거운 알칼리 금속의 경우 칼슘)를 사용하여 염화알칼리 금속을 감소시킨다.액체 또는 기체 제품(알칼리 금속)은 정화를 위해 부분 증류를 거친다.[66]순수 알칼리 금속으로 가는 대부분의 경로는 높은 반응성으로 인해 전기분해를 필요로 하는데, 이는 나트륨, 칼륨, 루비듐, 세슘과 리튬의 질화물을 산출하는 해당 알칼리 금속 아지드의 열분해 중 하나이며, 리튬의 질화물은 그렇지 않다.[123]: 77
리튬염은 약수터, 소금 웅덩이, 소금 퇴적물에서 추출해야 한다.그 금속은 염화 리튬과 염화칼륨의 융합으로 전해질 수 있다.[183]
나트륨은 주로 바닷물과 건조 해저에서 발생하지만,[30] 현재는 다운스 셀(Downs cell)을 이용해 물질의 용해점을 700 °C 이하로 낮춰 염화나트륨의 전기분해를 통해 생산된다.[184][185]아지드화나트륨의 열분해를 통해 극히 순수한 나트륨이 생성될 수 있다.[186]칼륨은 실바이트(염화칼륨)와 같은 많은 미네랄에서 발생한다.[30]이전에 칼륨은 일반적으로 염화칼륨이나 수산화칼륨의 전기분해로부터 만들어졌으며,[187] 캐나다, 러시아, 벨라루스, 독일, 이스라엘, 미국, 요르단과 같은 곳에서 1800년대 말과 1900년대 초에 나트륨이 생산되는 방법과 유사한 방법으로 광범위하게 발견되었다.[188]그것은 또한 바닷물로부터도 생산될 수 있다.[30]그러나 이러한 방법은 칼륨 금속이 용해된 염화칼륨에서 용해되고 작동 온도에서 현저하게 기화하여 잠재적으로 폭발성 과산화수소를 형성하기 때문에 문제가 있다.그 결과 현재 순수한 칼륨 금속은 850 °C에서 나트륨 금속으로 녹은 염화칼륨을 감소시켜 생산되고 있다.[10]: 74
- Na (g) + KCl (l) ⇌ NaCl (l) + K (g)
나트륨은 칼륨보다 반응성이 떨어지지만, 이런 고온에서는 칼륨이 나트륨보다 휘발성이 높고 쉽게 증류할 수 있기 때문에 평형이 오른쪽으로 이동하여 칼륨 가스를 더 많이 생산하고 거의 완성될 때까지 진행되기 때문에 이 과정이 효과가 있다.[10]: 74
나트륨과 같은 금속은 녹은 염을 전기분해하여 얻는다.Rb & Cs는 주로 Li 가공 제품에서 얻었다.순수 세슘을 만들기 위해 세슘 광석과 루비듐 광석을 으깨어 나트륨 금속으로 650 °C까지 가열하여 분절증류 기법을 통해 분리할 수 있는 합금을 생성한다.금속 세슘은 너무 반응적이어서 취급할 수 없기 때문에 보통 세슘 아지드(CsN3)로 제공된다.세슘 수산화물은 세슘이 물과 얼음(CsOH)과 공격적으로 상호작용할 때 형성된다.[189]
루비듐은 지구 표면에서 16번째로 널리 퍼져있는 원소지만, 그것은 매우 드물다.북아메리카, 남아프리카, 러시아, 캐나다에서 발견된 몇몇 광물들은 루비듐을 함유하고 있다.일부 칼륨 미네랄(레피돌라이트, 바이오타이트, 장골, 카르날라이트)은 세슘과 함께 그것을 함유하고 있다.폴루카이트, 카르날라이트, 류카이트, 레피돌라이트는 모두 루비듐을 함유한 미네랄이다.리튬 추출의 부산물로서 레피돌라이트로부터 상업적으로 획득하고 있다.루비듐은 상업적 공급원인 칼륨 바위와 브라인에서도 발견된다.대부분의 루비듐은 현재 리튬을 정제하는 부산물로 얻어진다.루비듐은 진공관에 게터(getter)로 사용되는데, 진공관에 있는 미량 가스와 결합해 제거하는 물질이다.[190][191]
1950년대와 1960년대에 몇 년 동안 알카르브라는 칼륨 생산의 부산물이 루비듐의 주요 공급원이었다.알카르브는 루비듐이 21% 함유된 반면 나머지는 칼륨과 세슘이 소량 함유된 것이다.[192]오늘날 가장 큰 세슘 생산국들, 예를 들어 캐나다 매니토바에 있는 탄코 광산은 폴루카이트로부터 부산물로 루비듐을 생산한다.[193]오늘날, 칼륨과 세슘에서 루비듐을 분리하는 일반적인 방법은 루비듐과 세슘알룸(Cs, Rb)Al(SO4)/212HO의2 분수 결정법으로서, 약 30회 재분할 후 순수 루비듐알룸을 산출한다.[193][194]루비듐이 풍부한 광물의 부족과 제한적인 용도는 루비듐 화합물의 생산을 연간 2~4톤으로 제한한다.[193]그러나 세슘은 위의 반응에서 생성되지 않는다.대신, 폴루카이트 광석의 채굴은 산소화, 알칼리성 분해, 직접감소 등 3가지 방법으로 광석에서 추출한 순수 세슘을 얻는 주요 방법이다.[193][195]두 금속 모두 리튬 생산의 부산물로 생산되는데, 1958년 이후 리튬의 열핵 성질에 대한 관심이 급격히 증가하면서 그에 상응하는 루비듐과 세슘 생산도 증가했다.[10]: 71 순수 루비듐과 세슘 금속은 750 °C와 저압에서 칼슘 금속으로 염화물을 줄임으로써 생산된다.[10]: 74
자연에서 극도의 희소성으로 인해 대부분의 프랑슘은 핵반응 Au + O → Fr + 5n에 합성되어 프랑슘-209, 프랑슘-210, 프랑슘-211을 산출한다.[63][196]지금까지 조립된 프랑슘의 최대량은 약 30만 개의 중성 원자로,[197] 위에서 주어진 핵반응을 이용해 합성되었다.[197]유일한 천연 동위원소 프랑슘-223이 구체적으로 요구될 때, 천연 우라늄-238의 딸 중 하나인 천연 라듐-226의 중성자 조사로부터 합성적으로 생성된 액티늄-227의 알파 딸로 생산된다.[198]
적용들
리튬, 나트륨, 칼륨은 응용이 많은 반면 루비듐과 세슘은 학문적 맥락에서 매우 유용하지만 아직 응용이 많지 않다.[10]: 68 리튬은 리튬이온 배터리에 많이 쓰이고, 산화리튬은 실리카 처리를 도울 수 있다.리튬 스타아레이트(Stearate)는 두껍고 윤활유를 만드는 데 사용될 수 있다. 수산화리튬에서 생산되는데, 이 리튬은 우주 캡슐과 잠수함에서 이산화탄소를 흡수하는 데도 사용된다.[10]: 70 염화 리튬은 알루미늄 부품의 브레이징 합금으로 사용된다.[199]금속 리튬은 마그네슘과 알루미늄이 첨가된 합금에 사용되어 매우 견고하고 가벼운 합금을 준다.[10]: 70
나트륨 화합물은 많은 용도를 가지고 있는데, 가장 잘 알려진 것은 식탁용 소금으로서 염화나트륨이다.지방산의 나트륨 염은 비누로 사용된다.[200]순수 나트륨 금속은 나트륨-바푸어 램프에 사용하는 등 응용 분야도 많아 다른 종류의 조명에 비해 매우 효율적인 빛을 내고 [201][202]다른 금속의 표면을 매끄럽게 하는 데 도움을 줄 수 있다.[203][204]강력한 환원제로서, 그것은 종종 티타늄과 지르코늄과 같은 많은 다른 금속들의 염화물을 감소시키는데 사용된다.더욱이 중성자 흡수를 향한 용융점과 점성, 단면도가 낮아 고속증식 원자로에서 열교환액으로 매우 유용하다.[10]: 74
칼륨은 식물 영양의 중요한 요소이기 때문에 칼륨 화합물은 종종 수정제로[10]: 73 [205] 사용된다.수산화칼륨은 매우 강한 염기로, 다양한 물질의 pH를 조절하는데 사용된다.[206][207]질산칼륨과 과망간산칼륨은 강력한 산화제로 자주 사용된다.[10]: 73 과산화칼륨은 이산화탄소와 반응해 탄산칼륨과 산소 가스를 공급하기 때문에 호흡마스크에 사용된다.순수 칼륨 금속은 자주 사용되지 않지만, 나트륨이 함유된 합금은 고속 증식 원자로에서 순수 나트륨을 대체할 수 있다.[10]: 74
루비듐과 세슘은 원자 시계에서 자주 사용된다.[208]세슘 원자시계는 매우 정확하다;[57] 만약 공룡 시대에 시계를 만들었다면, 그것은 4초도 안 걸릴 것이다(8,000만년 후).그러한 이유로 세슘 원자는 두 번째 원자의 정의로 사용된다.[209]루비듐 이온은 자주색 불꽃놀이에 자주 사용되며,[210] 세슘은 석유 산업에서 유체 시추에 자주 사용된다.[57][211]
프랑슘은 상업적 용도가 없지만,[61][62][212] 프랑슘의 비교적 단순한 원자 구조 때문에 무엇보다도 분광학 실험에 사용되어 에너지 수준과 아원자 입자 사이의 결합 상수에 관한 더 많은 정보를 얻게 되었다.[213]레이저로 포장된 프랑슘-210 이온에서 방출되는 빛에 관한 연구는 양자 이론에 의해 예측된 것과 유사한 원자 에너지 수준 사이의 전환에 대한 정확한 데이터를 제공했다.[214]
생물학적 역할 및 주의사항
금속
순수 알칼리 금속은 공기와 물과 함께 위험하게 반응하며 열, 화재, 산화제, 산, 대부분의 유기 화합물, 할로겐화탄소, 플라스틱 및 수분으로부터 멀리 떨어져 있어야 한다.또한 이산화탄소와 사염화탄소와 반응하여 알칼리 금속 화재에 사용될 때 정상적인 소화기가 역효과를 내도록 한다.[215]금속화재를 위해 고안된 일부 D등급 건식분말소화기가 효과적이어서 산소를 빼내고 알칼리 금속을 식힌다.[216]
실험은 보통 흄 후드 안에서 몇 그램의 소량만을 사용하여 행해진다.소량의 리튬은 냉수와의 반응에 의해 폐기될 수 있지만, 더 무거운 알칼리 금속은 덜 반응하는 이소프로판올에 용해되어야 한다.[215][217]알칼리 금속은 광유나 불활성 대기 아래에 보관해야 한다.사용되는 불활성 대기는 질소와 반응하는 리튬을 제외하고 아르곤 또는 질소 가스일 수 있다.[215]루비듐과 세슘은 기름 아래에서도 공기와 멀리 떨어져 있어야 한다. 왜냐하면 기름으로 확산되는 소량의 공기라도 위험하게 폭발하는 과산화수소의 형성을 유발할 수 있기 때문이다. 같은 이유로 칼륨은 6개월 이상 산소가 함유된 대기에서 기름 밑에 보관해서는 안 된다.[218][219]
이온스
알칼리 금속 이온의 생체유기화학은 광범위하게 검토되었다.[220]고체 상태의 결정 구조는 작은 펩타이드, 핵산 성분, 탄수화물, 이오노포레 복합체에서 알칼리 금속 이온의 많은 복합체에 대해 결정되었다.[221]
리튬은 자연적으로 생물학적 계통에서 흔적으로만 발생하며 알려진 생물학적 역할은 없지만 섭취했을 때 신체에 영향을 미친다.[222]탄산리튬은 부작용은 있지만 하루 약 0.5~2g의 양으로 조울증(매닉우울증)을 치료하기 위해 정신의학에서 기분안정제로 쓰인다.[222]리튬을 과다 섭취하면 다른 증상 중에서도 졸음, 졸음, 구토, 중추신경계 독성이 발생하는데,[222][222] 이는 양극성 질환 치료에 필요한 리튬의 복용량이 독성 용량보다 약간 적기 때문에 위험하다.[222][223]생화학, 인체에 의해 처리되는 방식, 그리고 쥐와 염소를 이용한 연구를 통해 인간의 리튬의 자연 생물학적 기능은 아직 규명되지 않았지만 필수적인 미량 원소임을 알 수 있다.[224][225]
나트륨과 칼륨은 알려진 모든 생물학적 시스템에서 발생하며, 일반적으로 세포 내부와 외부의 전해질로 기능한다.[226][227]나트륨은 혈량, 혈압, 삼투성 평형, pH를 조절하는 필수 영양소로서 나트륨에 대한 최소 생리학적 요건은 하루에 500mg이다.[228]염화나트륨(일반 소금이라고도 함)은 식단에서 나트륨의 주요 공급원이며, 절임이나 육포와 같은 양념과 방부제로 사용된다. 대부분은 가공식품에서 나온다.[229]나트륨에 대한 식이요법 기준 섭취량은 하루 1.5g이지만 [230]미국의 대부분의 사람들은 고혈압을 촉진하는 최소 양인 [231]2.3g 이상을 섭취하고 있다.[232] 이는 전세계적으로 760만 명의 조기 사망자를 발생시킨다.[233]
칼륨은 동물세포 내부의 주요 양이온([226]양성이온)인 반면 나트륨은 동물세포 외부의 주요 양이온이다.[226][227]이러한 충전된 입자의 농도 차이는 세포의 내부와 외부 사이에 전위 차이를 유발하며, 막 전위로 알려져 있다.칼륨과 나트륨의 균형은 세포막의 이온전달 단백질에 의해 유지된다.[234]칼륨과 나트륨 이온에 의해 생성되는 세포막 전위는 세포가 작용 전위 즉, 전기 방전의 "스파이크"를 발생시킬 수 있게 한다.신경전달, 근육수축, 심장기능과 같은 신체기능에 있어 세포의 배출능력은 매우 중요하다.[234]따라서 이러한 균형의 붕괴는 치명적일 수 있다. 예를 들어, 대량의 칼륨 화합물을 섭취하면 고칼륨혈증이 심혈관계 시스템에 강하게 영향을 미칠 수 있다.[235][236]미국에서 염화칼륨은 치사주사 처형을 위해 사용된다.[235]

그들의 유사한 원자 반지름 때문에, 루비듐과 체내의 세슘은 칼륨을 모방하고 유사하게 흡수된다.루비듐은 알려진 생물학적 역할은 없지만 신진대사를 촉진하는 데 도움이 될 수 있으며,[237][238][239] 세슘과 마찬가지로 체내 칼륨을 대체하여 칼륨 결핍을 일으킨다.[237][240][237][239]부분 치환술은 꽤 가능하고 다소 독성이 없다: 70kg의 사람이 평균 0.36g의 루비듐을 함유하고 있으며, 이 값이 50~100배 증가된 것은 시험 대상자에게 부정적인 영향을 주지 않았다.[241]쥐는 루비듐에 의한 칼륨의 최대 50% 치환까지 생존할 수 있다.[239][242]루비듐(그리고 훨씬 더 낮은 범위까지)은 저포칼륨혈증에 대한 일시적인 치료제로 기능할 수 있다. 루비듐은 일부 시스템에서는 생리학적으로 칼륨을 적절하게 대체할 수 있지만, 세슘은 결코 그렇게 할 수 없다.[238]루비듐이 염소에 필수적이라는 결핍증상의 형태에 있어서 극히 제한적인 증거가 있을 뿐이다; 이것이 사실이라고 해도, 일반적으로 음식에 존재하는 미량의 양은 충분하다.[243][244]
세슘 화합물은 대부분의 사람들이 거의 마주치지 않지만, 대부분의 세슘 화합물은 약한 독성을 가지고 있다.루비듐과 마찬가지로 세슘은 체내에서 칼륨을 대체하는 경향이 있지만, 훨씬 더 크고 따라서 더 가난한 대체물이다.[240]과도한 세슘은 저칼륨혈증, 적혈증, 급성 심장마비로 이어질 수 있지만,[245] 그러한 양은 보통 자연 발생원에서 발생하는 것은 아니다.[246]이와 같이 세슘은 주요한 화학적 환경 오염물질이 아니다.[246]생쥐의 염화 세슘에 대한 치사량(LD50) 중위값은 kg당 2.3g으로 염화칼륨과 염화나트륨의 LD50 값과 맞먹는다.[247]염화 세슘은 대체 암 치료법으로 홍보되어 왔지만,[248] 과학적으로 검증되지 않은 암 치료의 일부로 사용된 50명 이상의 환자의 죽음과 연관되어 있다.[249]
세슘의 방사성 동위원소는 특별한 예방 조치를 필요로 한다: 세슘-137 감마선 선원의 부적절한 취급은 이 방사성 동위원소의 방출과 방사선 상해를 초래할 수 있다.아마도 가장 잘 알려진 사례는 1987년 고이아니아 시의 버려진 병원에서 방사선 치료 시스템이 부적절하게 폐기된 고이아니아 사고일 것이다. 그리고 그 빛나는 세슘 소금은 호기심 많고 교육을 받지 못한 구매자들에게 팔렸다.이로 인해 방사선 피폭으로 4명이 사망하고 중상을 입었다.세슘-134, 요오드-131, 스트론튬-90과 함께 세슘-137은 체르노빌 재난에 의해 분배된 동위원소들 중 하나로 건강에 가장 큰 위험을 끼친다.[98]프랑슘의 방사성 동위원소 역시 높은 붕괴 에너지와 짧은 반감기 때문에 위험할 것으로 추정되지만, 심각한 위험을 초래할 만큼 대량으로 생산된 것은 없다.[198]
메모들
- ^ 나트륨과 칼륨에 대한 Na와 K 기호는 라틴어 이름, 나트리움, 칼륨에서 유래되었다; 이것들은 독일어와 러시아어와 같은 몇몇 언어에서 원소들의 이름들의 기원이기도 하다.
- ^ 세슘은 국제 순수 및 응용 화학 연합(IUPAC)에서 추천한 철자법이다.[1]미국화학협회(ACS)는 웹스터의 제3차 신국제사전에 [2][3]이어 1921년부터 세슘 철자를 사용해 왔다.
- ^ 구 IUPAC와 그룹 번호 매기기용 CAS 시스템 모두에서, 이 그룹은 그룹 IA("그룹 1"로 발음되며, "I"는 로마 숫자로 알려져 있다.[4]
- ^ 수소도 이러한 전자적 구성을 가지고 있지만, 1주기 원소에 발란스 p-오르비탈이 없어 거동이 매우 다르기 때문에 알칼리 금속으로 간주되지 않는다.
- ^ 1869년판 멘델레예프의 주기율표에서는 구리와 은을 수소와 수은에 맞추어 그들 자신의 그룹에 놓았고, 금은 우라늄과 붕소 그룹의 미발견 에카알루미늄 아래에 잠정적으로 놓였다.
- ^ 별표는 흥분된 상태를 나타낸다.
- ^ 괄호 안에 주어진 숫자는 측정 불확도를 가리킨다.이 불확실성은 괄호화 값 이전의 숫자의 가장 작은 수치(즉, 가장 오른쪽에서 왼쪽으로 계산)에 적용된다.예를 들어 1.00794(7)는 1.00794±0.00007을, 1.00794(72)는 1.00794±0.00072를 나타낸다.[67]
- ^ 열거된 값은 무역과 상업에 적합한 재래식 값이다. 실제 값은 표본의 동위원소 구성에 따라 6.938에서 6.997까지 다양할 수 있다.[59]
- ^ 원소에는 안정된 핵종이 없으며, 괄호 안의 값은 원소의 최장수 동위원소의 질량수를 나타낸다.[58][59]
- ^ 리누스 폴링은 프랑슘의 전기성을 세슘과 같은 폴링 척도로 0.7로 추정했다.[69] 비록 프랑슘 값의 미세화를 허용하는 실험 데이터는 없지만, 세슘의 값은 이후 0.79로 정제되었다.[70]프랑슘은 세슘보다 약간 높은 이온화 에너지를 가지며,[68] 상대론적 효과에서 예상한 375.7041(2) kJ/mol과는 반대로 392.811(4) kJ/mol을 가지며, 이는 세슘이 두 가지 중 덜 전기적이라는 것을 의미한다.
참조
- ^ 국제 순수 및 응용 화학 연합(2005년).무기 화학 명명법 (IUPAC 권고 2005).케임브리지 (영국): RSC-IUPAC. ISBN0-85404-438-8. 페이지 248–49.전자 버전..
- ^ Coghill, Anne M.; Garson, Lorrin R., eds. (2006). The ACS Style Guide: Effective Communication of Scientific Information (3rd ed.). Washington, D.C.: American Chemical Society. p. 127. ISBN 978-0-8412-3999-9.
- ^ Coplen, T. B.; Peiser, H. S. (1998). "History of the recommended atomic-weight values from 1882 to 1997: a comparison of differences from current values to the estimated uncertainties of earlier values" (PDF). Pure Appl. Chem. 70 (1): 237–257. doi:10.1351/pac199870010237. S2CID 96729044.
- ^ a b Fluck, E. (1988). "New Notations in the Periodic Table" (PDF). Pure Appl. Chem. IUPAC. 60 (3): 431–436. doi:10.1351/pac198860030431. S2CID 96704008. Retrieved 24 March 2012.
- ^ Harper, Douglas. "salary". Online Etymology Dictionary.
- ^ Marggraf, Andreas Siegmund (1761). Chymische Schriften (in German). p. 167.
- ^ du Monceau, H. L. D. "Sur la Base de Sel Marine". Mémoires de l'Académie Royale des Sciences (in French): 65–68.
- ^ a b Weeks, Mary Elvira (1932). "The discovery of the elements. IX. Three alkali metals: Potassium, sodium, and lithium". Journal of Chemical Education. 9 (6): 1035. Bibcode:1932JChEd...9.1035W. doi:10.1021/ed009p1035.
- ^ a b Siegfried, R. (1963). "The Discovery of Potassium and Sodium, and the Problem of the Chemical Elements". Isis. 54 (2): 247–258. doi:10.1086/349704. JSTOR 228541. PMID 14147904. S2CID 38152048.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al am an ao ap aq ar as at au av aw ax ay az ba bb bc bd be bf bg bh bi bj bk bl bm bn bo bp bq br bs bt bu bv bw bx by bz ca cb cc cd ce cf cg ch ci cj Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Enghag, P. (2004). "11. Sodium and Potassium". Encyclopedia of the elements. Wiley-VCH Weinheim. ISBN 978-3-527-30666-4.
- ^ Davy, Humphry (1808). "On some new phenomena of chemical changes produced by electricity, in particular the decomposition of the fixed alkalies, and the exhibition of the new substances that constitute their bases; and on the general nature of alkaline bodies". Philosophical Transactions of the Royal Society of London. 98: 1–44. doi:10.1098/rstl.1808.0001.
- ^ Shaposhnik, V. A. (2007). "History of the discovery of potassium and sodium (on the 200th anniversary of the discovery of potassium and sodium)". Journal of Analytical Chemistry. 62 (11): 1100–1102. doi:10.1134/S1061934807110160. S2CID 96141217.
- ^ Ralph, Jolyon; Chau, Ida (24 August 2011). "Petalite: Petalite mineral information and data". Retrieved 27 November 2011.
- ^ a b Winter, Mark. "WebElements Periodic Table of the Elements Lithium historical information". Retrieved 27 November 2011.
- ^ Weeks, Mary (2003). Discovery of the Elements. Whitefish, Montana, United States: Kessinger Publishing. p. 124. ISBN 978-0-7661-3872-8. Retrieved 10 August 2009.
- ^ "Johan Arfwedson". Archived from the original on 5 June 2008. Retrieved 10 August 2009.
- ^ a b van der Krogt, Peter. "Lithium". Elementymology & Elements Multidict. Retrieved 5 October 2010.
- ^ Clark, Jim (2005). "Compounds of the Group 1 Elements". chemguide. Retrieved 10 August 2009.
- ^ a b Krebs, Robert E. (2006). The History and Use of Our Earth's Chemical Elements: A Reference Guide. Westport, Conn.: Greenwood Press. ISBN 978-0-313-33438-2.
- ^ a b c d Leach, Mark R. (1999–2012). "The Internet Database of Periodic Tables". meta-synthesis.com. Retrieved 6 April 2012.
- ^ a b Kaner, Richard (2003). "C&EN: It's Elemental: The Periodic Table – Cesium". American Chemical Society. Retrieved 25 February 2010.
- ^ Kirchhoff, G.; Bunsen, R. (1861). "Chemische Analyse durch Spectralbeobachtungen" (PDF). Annalen der Physik und Chemie. 189 (7): 337–381. Bibcode:1861AnP...189..337K. doi:10.1002/andp.18611890702.
- ^ Weeks, Mary Elvira (1932). "The discovery of the elements. XIII. Some spectroscopic discoveries". Journal of Chemical Education. 9 (8): 1413–1434. Bibcode:1932JChEd...9.1413W. doi:10.1021/ed009p1413.
- ^ "caesium". Oxford English Dictionary (2nd ed.). Oxford University Press. (가입 또는 참여기관 회원가입 필요)
- ^ Newlands, John A. R. (20 August 1864). "On Relations Among the Equivalents". Chemical News. 10: 94–95. Archived from the original on 1 January 2011. Retrieved 25 November 2013.
- ^ Newlands, John A. R. (18 August 1865). "On the Law of Octaves". Chemical News. 12: 83. Archived from the original on 1 January 2011. Retrieved 25 November 2013.
- ^ Mendelejew, Dimitri (1869). "Über die Beziehungen der Eigenschaften zu den Atomgewichten der Elemente". Zeitschrift für Chemie (in German): 405–406.
- ^ a b c d e Jensen, William B. (2003). "The Place of Zinc, Cadmium, and Mercury in the Periodic Table" (PDF). Journal of Chemical Education. American Chemical Society. 80 (8): 952–961. Bibcode:2003JChEd..80..952J. doi:10.1021/ed080p952. Archived from the original (PDF) on 11 June 2010. Retrieved 6 May 2012.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag Royal Society of Chemistry. "Visual Elements: Group 1 – The Alkali Metals". Visual Elements. Royal Society of Chemistry. Archived from the original on 5 August 2012. Retrieved 13 January 2012.
{{cite web}}: CS1 maint : bot : 원본 URL 상태 미상(링크) - ^ a b Fontani, Marco (10 September 2005). "The Twilight of the Naturally-Occurring Elements: Moldavium (Ml), Sequanium (Sq) and Dor (Do)". International Conference on the History of Chemistry. Lisbon. pp. 1–8. Archived from the original on 24 February 2006. Retrieved 8 April 2007.
- ^ a b Van der Krogt, Peter (10 January 2006). "Francium". Elementymology & Elements Multidict. Retrieved 8 April 2007.
- ^ "Education: Alabamine & Virginium". TIME. 15 February 1932. Archived from the original on 30 September 2007. Retrieved 1 April 2007.
- ^ MacPherson, H. G. (1934). "An Investigation of the Magneto-Optic Method of Chemical Analysis". Physical Review. American Physical Society. 47 (4): 310–315. Bibcode:1935PhRv...47..310M. doi:10.1103/PhysRev.47.310.
- ^ Adloff, Jean-Pierre; Kaufman, George B. (2005년 9월 25일)프랑슘(Atomic Number 87), 웨이백 머신에 2013년 6월 4일 보관된 마지막 자연 원소.화학 교육자 10(5)2007년 3월 26일 검색됨
- ^ "Francium". McGraw-Hill Encyclopedia of Science & Technology. Vol. 7. McGraw-Hill Professional. 2002. pp. 493–494. ISBN 978-0-07-913665-7.
- ^ a b c d e f g h i j k l m n o p q r s t u Hoffman, Darleane C.; Lee, Diana M.; Pershina, Valeria (2006). "Transactinides and the future elements". In Morss; Edelstein, Norman M.; Fuger, Jean (eds.). The Chemistry of the Actinide and Transactinide Elements (3rd ed.). Dordrecht, The Netherlands: Springer. ISBN 978-1-4020-3555-5.
- ^ a b Lougheed, R. W.; Landrum, J. H.; Hulet, E. K.; Wild, J. F.; Dougan, R. J.; Dougan, A. D.; Gäggeler, H.; Schädel, M.; Moody, K. J.; Gregorich, K. E.; Seaborg, G. (1985). "Search for superheavy elements using 48Ca + 254Esg reaction". Physical Review C. 32 (5): 1760–1763. Bibcode:1985PhRvC..32.1760L. doi:10.1103/PhysRevC.32.1760. PMID 9953034.
- ^ van der Krogt, Peter. "Ununennium". Elementymology & Elements Multidict. Retrieved 14 February 2011.
- ^ Schadel, M.; Brüchle, W.; Brügger, M.; Gäggeler, H.; Moody, K.; Schardt, D.; Sümmerer, K.; Hulet, E.; Dougan, A.; et al. (1986). "Heavy isotope production by multinucleon transfer reactions with 254Es". Journal of the Less Common Metals. 122: 411–417. doi:10.1016/0022-5088(86)90435-2.
- ^ "Hunt for element 119 set to begin". Chemistry World. 12 September 2017. Retrieved 9 January 2018.
- ^ a b c Seaborg, G. T. (c. 2006). "transuranium element (chemical element)". Encyclopædia Britannica. Retrieved 16 March 2010.
- ^ Emsley, John (2011). Nature's Building Blocks: An A-Z Guide to the Elements (New ed.). New York, NY: Oxford University Press. p. 593. ISBN 978-0-19-960563-7.
- ^ a b Lodders, Katharina (2003). "Solar System Abundances and Condensation Temperatures of the Elements". The Astrophysical Journal. 591 (2): 1220–1247. Bibcode:2003ApJ...591.1220L. doi:10.1086/375492.
- ^ Oddo, Giuseppe (1914). "Die Molekularstruktur der radioaktiven Atome". Zeitschrift für Anorganische Chemie. 87: 253–268. doi:10.1002/zaac.19140870118.
- ^ Harkins, William D. (1917). "The Evolution of the Elements and the Stability of Complex Atoms. I. A New Periodic System Which Shows a Relation Between the Abundance of the Elements and the Structure of the Nuclei of Atoms". Journal of the American Chemical Society. 39 (5): 856–879. doi:10.1021/ja02250a002.
- ^ North, John (2008). Cosmos an illustrated history of astronomy and cosmology (Rev. and updated ed.). Univ. of Chicago Press. p. 602. ISBN 978-0-226-59441-5.
- ^ Morgan, J. W.; Anders, E. (1980). "Chemical composition of Earth, Venus, and Mercury". Proceedings of the National Academy of Sciences. 77 (12): 6973–6977. Bibcode:1980PNAS...77.6973M. doi:10.1073/pnas.77.12.6973. PMC 350422. PMID 16592930.
- ^ Albarède, Francis (2003). Geochemistry: an introduction. Cambridge University Press. ISBN 978-0-521-89148-6.
- ^ "Abundance in Earth's Crust". WebElements.com. Retrieved 14 April 2007.
- ^ "List of Periodic Table Elements Sorted by Abundance in Earth's crust". Israel Science and Technology Directory.
- ^ a b c Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ "Lithium Occurrence". Institute of Ocean Energy, Saga University, Japan. Archived from the original on 2 May 2009. Retrieved 13 March 2009.
- ^ "Some Facts about Lithium". ENC Labs. Retrieved 15 October 2010.
- ^ Schwochau, Klaus (1984). "Extraction of metals from sea water". Inorganic Chemistry. Topics in Current Chemistry. Vol. 124/1984. pp. 91–133. doi:10.1007/3-540-13534-0_3. ISBN 978-3-540-13534-0.
- ^ Wise, M. A. (1995). "Trace element chemistry of lithium-rich micas from rare-element granitic pegmatites". Mineralogy and Petrology. 55 (13): 203–215. Bibcode:1995MinPe..55..203W. doi:10.1007/BF01162588. S2CID 140585007.
- ^ a b c d e Butterman, William C.; Brooks, William E.; Reese, Jr., Robert G. (2004). "Mineral Commodity Profile: Cesium" (PDF). United States Geological Survey. Archived from the original (PDF) on 22 November 2009. Retrieved 27 December 2009.
- ^ a b c Wieser, Michael E.; Berglund, Michael (2009). "Atomic weights of the elements 2007 (IUPAC Technical Report)" (PDF). Pure Appl. Chem. IUPAC. 81 (11): 2131–2156. doi:10.1351/PAC-REP-09-08-03. S2CID 98084907. Retrieved 7 February 2012.
- ^ a b c d Wieser, Michael E.; Coplen, Tyler B. (2011). "Atomic weights of the elements 2009 (IUPAC Technical Report)" (PDF). Pure Appl. Chem. IUPAC. 83 (2): 359–396. doi:10.1351/PAC-REP-10-09-14. S2CID 95898322. Retrieved 11 February 2012.
- ^ CRC Handbook of Chemistry and Physics. Vol. 4. CRC. 2006. p. 12. ISBN 978-0-8493-0474-3.
- ^ a b c Emsley, John (2001). Nature's Building Blocks. Oxford: Oxford University Press. pp. 151–153. ISBN 978-0-19-850341-5.
- ^ a b Gagnon, Steve. "Francium". Jefferson Science Associates, LLC. Archived from the original on 31 March 2007. Retrieved 1 April 2007.
- ^ a b Winter, Mark. "Geological information". Francium. The University of Sheffield. Retrieved 26 March 2007.
- ^ "It's Elemental — The Periodic Table of Elements". Jefferson Lab. Archived from the original on 29 April 2007. Retrieved 14 April 2007.
- ^ a b c Lide, D. R., ed. (2003). CRC Handbook of Chemistry and Physics (84th ed.). Boca Raton, FL: CRC Press.
- ^ a b c d e f g h i j k l m n o p q Averill, Bruce A.; Eldredge, Patricia (2007). "21.3: The Alkali Metals". Chemistry: Principles, Patterns, and Applications with Student Access Kit for Mastering General Chemistry (1st ed.). Prentice Hall. ISBN 978-0-8053-3799-0. Retrieved 24 June 2013.
- ^ "Standard Uncertainty and Relative Standard Uncertainty". CODATA reference. National Institute of Standards and Technology. Retrieved 26 September 2011.
- ^ a b c Andreev, S.V.; Letokhov, V.S.; Mishin, V.I. (1987). "Laser resonance photoionization spectroscopy of Rydberg levels in Fr". Phys. Rev. Lett. 59 (12): 1274–76. Bibcode:1987PhRvL..59.1274A. doi:10.1103/PhysRevLett.59.1274. PMID 10035190.
- ^ Pauling, Linus (1960). The Nature of the Chemical Bond (Third ed.). Cornell University Press. p. 93. ISBN 978-0-8014-0333-0.
- ^ Allred, A. L. (1961). "Electronegativity values from thermochemical data". J. Inorg. Nucl. Chem. 17 (3–4): 215–221. doi:10.1016/0022-1902(61)80142-5.
- ^ 바누섹, 페트르(2011년).화학 및 물리학 핸드북의 "전기화학 시리즈: 제92판 2017년 7월 24일 웨이백 기계(화학 고무 회사)에 보관"
- ^ a b c d e f g h i j k l m n o p q r s Clark, Jim (2005). "Atomic and Physical Properties of the Group 1 Elements". chemguide. Retrieved 30 January 2012.
- ^ Gray, Theodore. "Facts, pictures, stories about the element Cesium in the Periodic Table". The Wooden Periodic Table Table. Retrieved 13 January 2012.
- ^ The OpenLearn team (2012). "Alkali metals". OpenLearn. The Open University. Retrieved 9 July 2012.
- ^ a b Gray, Theodore. "Alkali Metal Bangs". Theodore Gray. Retrieved 13 May 2012.
- ^ Dye, James L.; Ceraso, Joseph M.; Lok, Mei; Barnett, B. L.; Tehan, Frederick J. (1974). "Crystalline salt of the sodium anion (Na−)". J. Am. Chem. Soc. 96 (2): 608–609. doi:10.1021/ja00809a060.
- ^ Tehan, Frederick J.; Barnett, B. L.; Dye, James L. (1974). "Alkali anions. Preparation and crystal structure of a compound which contains the cryptated sodium cation and the sodium anion". J. Am. Chem. Soc. 96 (23): 7203–7208. doi:10.1021/ja00830a005.
- ^ Dye, J. L. (1979). "Compounds of Alkali Metal Anions". Angew. Chem. Int. Ed. Engl. 18 (8): 587–598. doi:10.1002/anie.197905871.
- ^ Redko, M. Y.; Huang, R. H.; Jackson, J. E.; Harrison, J. F.; Dye, J. L. (2003). "Barium azacryptand sodide, the first alkalide with an alkaline Earth cation, also contains a novel dimer, (Na2)2−". J. Am. Chem. Soc. 125 (8): 2259–2263. doi:10.1021/ja027241m. PMID 12590555.
- ^ a b c Redko, M. Y.; Vlassa, M.; Jackson, J. E.; Misiolek, A. W.; Huang, R. H.; Dye, J. L. (2002). ""Inverse sodium hydride": a crystalline salt that contains H+ and Na−". J. Am. Chem. Soc. 124 (21): 5928–5929. doi:10.1021/ja025655+. PMID 12022811.
- ^ a b Sawicka, A.; Skurski, P.; Simons, J. (2003). "Inverse Sodium Hydride: A Theoretical Study" (PDF). J. Am. Chem. Soc. 125 (13): 3954–3958. doi:10.1021/ja021136v. PMID 12656631.
- ^ Burgess, John (1978). Metal Ions in Solution. Chichester: Ellis Horwood. p. 20. ISBN 978-0-85312-027-8.
- ^ a b Richens, David. T. (1997). The Chemistry of Aqua Ions. Wiley. ISBN 978-0-471-97058-3.
- ^ Persson, Ingmar (2010). "Hydrated metal ions in aqueous solution: How regular are their structures?" (PDF). Pure Appl. Chem. 82 (10): 1901–1917. doi:10.1351/PAC-CON-09-10-22. S2CID 98411500. Retrieved 23 August 2014.
- ^ a b c d e Clark, Jim (2005). "Reaction of the Group 1 Elements with Oxygen and Chlorine". chemguide. Retrieved 27 June 2012.
- ^ Shriver, Duward; Atkins, Peter (2006). Inorganic Chemistry. W. H. Freeman. p. 259. ISBN 978-0-7167-4878-6. Retrieved 10 November 2012.
- ^ a b c d e Thayer, John S. (2010). "Relativistic Effects and the Chemistry of the Heavier Main Group Elements". Relativistic Methods for Chemists. Challenges and Advances in Computational Chemistry and Physics. 10: 81, 84. doi:10.1007/978-1-4020-9975-5_2. ISBN 978-1-4020-9974-8.
- ^ Landau, A.; Eliav, E.; Ishikawa, Y.; Kaldor, U. (2001). "Benchmark calculations of electron affinities of the alkali atoms sodium to eka-francium (element 119)". J. Chem. Phys. 115 (6): 2389. Bibcode:2001JChPh.115.2389L. doi:10.1063/1.1386413.
- ^ Jones, Cameron; Mountford, Philip; Stasch, Andreas; Blake, Matthew P. (22 June 2015). "s-block Metal-Metal Bonds". In Liddle, Stephen T. (ed.). Molecular Metal-Metal Bonds: Compounds, Synthesis, Properties. John Wiley and Sons. pp. 23–24. ISBN 978-3-527-33541-1.
- ^ a b Lide, David R., ed. (2002). Handbook of Chemistry & Physics (88th ed.). CRC. ISBN 978-0-8493-0486-6. OCLC 179976746. Archived from the original on 24 July 2017. Retrieved 23 May 2008.
- ^ "Universal Nuclide Chart". Nucleonica. Institute for Transuranium Elements. 2007–2012. Retrieved 17 April 2011.
- ^ a b c Sonzogni, Alejandro. "Interactive Chart of Nuclides". National Nuclear Data Center: Brookhaven National Laboratory. Archived from the original on 22 August 2011. Retrieved 4 October 2012.
- ^ Patton, I. Jocelyn; Waldbauer, L. J. (1926). "The Radioactivity of the Alkali Metals". Chemical Reviews. 3: 81–93. doi:10.1021/cr60009a003.
- ^ McLennan, J. C.; Kennedy, W. T. (1908). "On the radioactivity of potassium and other alkali metals". Philosophical Magazine. 6. 16 (93): 377–395. doi:10.1080/14786440908636519.
- ^ "Potassium-40" (PDF). Human Health Fact Sheet. Argonne National Laboratory, Environmental Science Division. August 2005. Retrieved 7 February 2012.
- ^ National Institute of Standards and Technology (6 September 2009). "Radionuclide Half-Life Measurements". Archived from the original on 12 August 2016. Retrieved 7 November 2011.
- ^ 방사성 동위원소 개요: 세슘-137(Cs-137)미국 국립환경보건센터
- ^ a b The Radiological Accident in Goiânia. IAEA. 1988.
- ^ Delacroix, D.; Guerre, J. P.; Leblanc, P.; Hickman, C. (2002). Radionuclide and Radiation Protection Data Handbook 2002 (2nd ed.). Nuclear Technology Publishing. ISBN 978-1-870965-87-3.
- ^ L. Brown, Theodore; LeMay, Jr., H. Eugene; Bursten, Bruce E.; Burdge, Julia R. (2003). Chemistry: The Central Science (8th ed.). US: Pearson Education. ISBN 978-0-13-061142-0.
- ^ a b Clark, Jim (2005). "Reaction of the Group 1 Elements with Water". chemguide. Retrieved 18 June 2012.
- ^ IUPAC, 화학용어 종합편찬, 제2편.("금책")(1997년).온라인 수정 버전: (2006–) "전극성". doi:10.1351/골드북.E01990
- ^ Goldberg, David E. (1988). 3,000 Solved Problems in Chemistry (1st ed.). McGraw-Hill. ISBN 978-0-07-023684-4. 제17.43조 321쪽
- ^ Theodore, Louis; Dupont, R. Ryan; Ganesan, Kumar, eds. (1999). Pollution Prevention: The Waste Management Approach to the 21st Century. CRC Press. p. 15 Section 27. ISBN 978-1-56670-495-3.
- ^ a b Clark, Jim (2000). "Metallic Bonding". chemguide. Retrieved 23 March 2012.
- ^ a b Mason, Philip E. (26 January 2015). "Coulomb explosion during the early stages of the reaction of alkali metals with water". Nature Chemistry. 7 (3): 250–254. Bibcode:2015NatCh...7..250M. doi:10.1038/nchem.2161. PMID 25698335.
- ^ Buszek, Keith R. (2001) Wiley, 유기합성을 위한 시약 백과사전의 "소듐 아말감". doi:10.1002/047084289X.rs040
- ^ "Sodium-Potassium Alloy (NaK)" (PDF). BASF. December 2004. Archived from the original (PDF) on 27 September 2007.
- ^ 세보프, SC "진틀 페이즈", 113–132페이지의 금속간 화합물, 원리 및 실천: 진행, 제3권.웨스트브룩, J.H.;프리셔, R.L.: 에드;존 와일리 & 선스Ltd, Chichesterder, England doi:10.1002/0470845856 ISBN 978-0-470-84585-1
- ^ a b S.M. Kauzlarich, 무기화학 백과사전, 1994, John Wiley & Sons, ISBN 0-471-93620-0
- ^ Hagen, A. P. (17 September 2009). Inorganic Reactions and Methods, The Formation of Bonds to Group-I, -II, and -IIIB Elements. John Wiley & Sons. pp. 204–5. ISBN 978-0-470-14549-4.
- ^ Matkovich, V. I. (6 December 2012). Boron and Refractory Borides. Springer. pp. 262–92. ISBN 978-3-642-66620-9.
- ^ Hermann, Andreas; McSorley, Alexandra; N. W., Ashcroft; Hoffmann, Roald (2012). "From Wade–Mingos to Zintl–Klemm at 100 GPa: Binary Compounds of Boron and Lithium" (PDF). Journal of the American Chemical Society. 2012 (134): 18606–18. doi:10.1021/ja308492g. PMID 23066852. Archived from the original (PDF) on 27 September 2020. Retrieved 21 August 2016.
- ^ Housecroft, Catherine E.; Sharpe, Alan G. (2008). "Chapter 14: The group 14 elements". Inorganic Chemistry, 3rd Edition. Pearson. p. 386. ISBN 978-0-13-175553-6.
- ^ NIST 이온화 방사선 부문 2001 – 기술 하이라이트.physics.nist.gov
- ^ Emery, N.; et al. (2008). "Review: Synthesis and superconducting properties of CaC6". Sci. Technol. Adv. Mater. 9 (4): 044102. Bibcode:2008STAdM...9d4102E. doi:10.1088/1468-6996/9/4/044102. PMC 5099629. PMID 27878015.
- ^ Hoch, Constantin; Wendorff, Marco; Röhr, Caroline (2002). "Tetrapotassium nonastannide, K4Sn9". Acta Crystallographica Section C. 58 (4): I45–I46. doi:10.1107/S0108270102002032. PMID 11932511.
- ^ Gregory, Duncan H.; O'Meara, Paul M.; Gordon, Alexandra G.; Hodges, Jason P.; Short, Simine; Jorgensen, James D. (2002). "Structure of Lithium Nitride and Transition-Metal-Doped Derivatives, Li3−x−yMxN (M= Ni, Cu): A Powder Neutron Diffraction Study". Chem. Mater. 14 (5): 2063–2070. doi:10.1021/cm010718t.
- ^ Fischer, D.; Jansen, M. (2002). "Synthesis and structure of Na3N". Angew Chem. 41 (10): 1755–1756. doi:10.1002/1521-3773(20020517)41:10<1755::AID-ANIE1755>3.0.CO;2-C.
- ^ Fischer, D.; Cancarevic, Z.; Schön, J. C.; Jansen, M. Z. (2004). "Synthesis and structure of K3N". Z. Anorg. Allg. Chem. 630 (1): 156–160. doi:10.1002/zaac.200300280.. '유해성 이항 화합물 준비' 화학·엔지니어링 뉴스 80호(2002년 5월 20호
- ^ H.G. Von Schinging, W. Hönle Phosphides – 무기화학 Ed의 고체 화학 백과사전.R. 브루스 킹 (1994) 존 와일리 & 선즈 ISBN 0-471-93620-0
- ^ Kahlenberg, Louis (2008). Outlines of Chemistry – A Textbook for College Students. READ BOOKS. pp. 324–325. ISBN 978-1-4097-6995-8.
- ^ a b c d e f g h i j k l m n King, R. Bruce (1995). Inorganic Chemistry of Main Group Elements. Wiley-VCH. ISBN 978-0-471-18602-1.
- ^ "Welcome to Arthur Mar's Research Group". University of Alberta. University of Alberta. 1999–2013. Retrieved 24 June 2013.
- ^ Lindsay, D. M.; Garland, D. A. (1987). "ESR spectra of matrix-isolated lithium superoxide". The Journal of Physical Chemistry. 91 (24): 6158–61. doi:10.1021/j100308a020.
- ^ Vol'nov, I. I.; Matveev, V. V. (1963). "Synthesis of cesium ozonide through cesium superoxide". Bulletin of the Academy of Sciences, USSR Division of Chemical Science. 12 (6): 1040–1043. doi:10.1007/BF00845494.
- ^ Tokareva, S. A. (1971). "Alkali and Alkaline Earth Metal Ozonides". Russian Chemical Reviews. 40 (2): 165–174. Bibcode:1971RuCRv..40..165T. doi:10.1070/RC1971v040n02ABEH001903.
- ^ Simon, A. (1997). "Group 1 and 2 Suboxides and Subnitrides – Metals with Atomic Size Holes and Tunnels". Coordination Chemistry Reviews. 163: 253–270. doi:10.1016/S0010-8545(97)00013-1.
- ^ Tsai, Khi-Ruey; Harris, P. M.; Lassettre, E. N. (1956). "The Crystal Structure of Tricesium Monoxide". Journal of Physical Chemistry. 60 (3): 345–347. doi:10.1021/j150537a023.
- ^ Okamoto, H. (2009). "Cs-O (Cesium-Oxygen)". Journal of Phase Equilibria and Diffusion. 31: 86–87. doi:10.1007/s11669-009-9636-5. S2CID 96084147.
- ^ Band, A.; Albu-Yaron, A.; Livneh, T.; Cohen, H.; Feldman, Y.; Shimon, L.; Popovitz-Biro, R.; Lyahovitskaya, V.; Tenne, R. (2004). "Characterization of Oxides of Cesium". The Journal of Physical Chemistry B. 108 (33): 12360–12367. doi:10.1021/jp036432o.
- ^ Brauer, G. (1947). "Untersuchungen über das System Cäsium-Sauerstoff". Zeitschrift für Anorganische Chemie. 255 (1–3): 101–124. doi:10.1002/zaac.19472550110.
- ^ House, James E. (2008). Inorganic chemistry. Academic Press. p. 524. ISBN 978-0-12-356786-4.
- ^ Moyer, Harvey V. (1956). "Chemical Properties of Polonium". In Moyer, Harvey V. (ed.). Polonium. Oak Ridge, Tenn.: United States Atomic Energy Commission. pp. 33–96. doi:10.2172/4367751. TID-5221.
- ^ Bagnall, K. W. (1962). "The Chemistry of Polonium". Adv. Inorg. Chem. Radiochem. Advances in Inorganic Chemistry and Radiochemistry. 4: 197–229. doi:10.1016/S0065-2792(08)60268-X. ISBN 978-0-12-023604-6.
- ^ Alberto, R.; Ortner, K.; Wheatley, N.; Schibli, R.; Schubiger, A. P. (2001). "Synthesis and properties of boranocarbonate: a convenient in situ CO source for the aqueous preparation of [99mTc(OH2)3(CO)3]+". J. Am. Chem. Soc. 121 (13): 3135–3136. doi:10.1021/ja003932b. PMID 11457025.
- ^ Cotton, F. A.; Wilkinson, G. (1972). Advanced Inorganic Chemistry. John Wiley and Sons Inc. ISBN 978-0-471-17560-5.
- ^ T. Kottke, D. Stalke (September 1993). "Structures of Classical Reagents in Chemical Synthesis: (nBuLi)6, (tBuLi)4, and the Metastable (tBuLi · Et2O)2". Angew. Chem. Int. Ed. Engl. 32 (4): 580–582. doi:10.1002/anie.199305801.
- ^ 엘센브로이치, C. "Oganometalics" (2006) Wiley-VCH: Weinheim.ISBN 3-527-29390-6.
- ^ Dinnebier, R. E.; Behrens, U.; Olbrich, F. (1998). "Lewis Base-Free Phenyllithium: Determination of the Solid-State Structure by Synchrotron Powder Diffraction". Journal of the American Chemical Society. 120 (7): 1430–1433. doi:10.1021/ja972816e.
- ^ Brown, T. L.; Rogers, M. T. (1957). "The Preparation and Properties of Crystalline Lithium Alkyls". Journal of the American Chemical Society. 79 (8): 1859–1861. doi:10.1021/ja01565a024.
- ^ Schlosser, Manfred (1988). "Superbases for organic synthesis" (PDF). Pure Appl. Chem. 60 (11): 1627–1634. doi:10.1351/pac198860111627. S2CID 39746336.
- ^ Clegg, William; Conway, Ben; Kennedy, Alan R.; Klett, Jan; Mulvey, Robert E.; Russo, Luca (2011). "Synthesis and Structures of \(Trimethylsilyl)methyl]sodium and -potassium with Bi- and Tridentate N-Donor Ligands". European Journal of Inorganic Chemistry. 2011 (5): 721–726. doi:10.1002/ejic.201000983.
- ^ a b c d Gary L의 "In 유기 화학"미슬러와 도널드 A.타르, 6판 피어슨
- ^ 쿠마르 데 아닐(2007)무기 화학 교과서.뉴에이지 인터내셔널 247. ISBN 978-8122413847.
- ^ 그린우드와 어니쇼의 "원소들의 화학" 제2판 엘스비에
- ^ 코튼과 윌킨슨의 '유기화학'
- ^ a b c d e Pyykkö, Pekka (2011). "A suggested periodic table up to Z ≤ 172, based on Dirac–Fock calculations on atoms and ions". Physical Chemistry Chemical Physics. 13 (1): 161–8. Bibcode:2011PCCP...13..161P. doi:10.1039/c0cp01575j. PMID 20967377.
- ^ Gäggeler, Heinz W. (5–7 November 2007). "Gas Phase Chemistry of Superheavy Elements" (PDF). Lecture Course Texas A&M. Archived from the original (PDF) on 20 February 2012. Retrieved 26 February 2012.
- ^ Fricke, Burkhard (1975). "Superheavy elements: a prediction of their chemical and physical properties". Recent Impact of Physics on Inorganic Chemistry. Structure and Bonding. 21: 89–144. doi:10.1007/BFb0116498. ISBN 978-3-540-07109-9. Retrieved 4 October 2013.
- ^ Fricke, Burkhard (1977). "Dirac-Fock-Slater calculations for the elements Z = 100, fermium, to Z = 173" (PDF). Recent Impact of Physics on Inorganic Chemistry. 19: 83–192. Bibcode:1977ADNDT..19...83F. doi:10.1016/0092-640X(77)90010-9. Archived from the original (PDF) on 22 March 2016. Retrieved 25 February 2016.
- ^ Kul'sha, A. V. "Есть ли граница у таблицы Менделеева?" [Is there a boundary to the Mendeleev table?] (PDF). www.primefan.ru (in Russian). Retrieved 8 September 2018.
- ^ Kratz, J. V. (5 September 2011). The Impact of Superheavy Elements on the Chemical and Physical Sciences (PDF). 4th International Conference on the Chemistry and Physics of the Transactinide Elements. Retrieved 27 August 2013.
- ^ 핵 과학자들은 미래의 두 번째 '안정의 섬'에 착륙하는 것을 주시한다.유레크알러트! (2008-04-06)2016-11-25일에 검색됨.
- ^ Grumann, Jens; Mosel, Ulrich; Fink, Bernd; Greiner, Walter (1969). "Investigation of the stability of superheavy nuclei around Z=114 and Z=164". Zeitschrift für Physik. 228 (5): 371–386. Bibcode:1969ZPhy..228..371G. doi:10.1007/BF01406719. S2CID 120251297.
- ^ a b c Dietzel, P. D.; Kremer, R. K.; Jansen, M. (8 January 2007). "Superoxide compounds of the large pseudo-alkali-metal ions tetramethylammonium, -phosphonium, and -arsonium". Chemistry: An Asian Journal. 2 (1): 66–75. doi:10.1002/asia.200600306. PMID 17441140.
- ^ a b "International Union of Pure and Applied Chemistry > Periodic Table of the Elements". IUPAC. Retrieved 1 May 2011.
- ^ Folden, Cody (31 January 2009). "The Heaviest Elements in the Universe" (PDF). Saturday Morning Physics at Texas A&M. Archived from the original (PDF) on 10 August 2014. Retrieved 9 March 2012.
- ^ Emsley, J. (1989). The Elements. Oxford: Clarendon Press. pp. 22–23.
- ^ 윈터, 마크 J. (1994) 화학 본딩, 옥스퍼드 대학 출판부, ISBN 0-19-855694-2
- ^ a b c d e Cronyn, Marshall W. (August 2003). "The Proper Place for Hydrogen in the Periodic Table" (PDF). Journal of Chemical Education. 80 (8): 947–951. Bibcode:2003JChEd..80..947C. doi:10.1021/ed080p947.
- ^ Huhey, J.E.; Keiter, E.A.와 Keiter, R.L. (1993) 무기화학: 구조와 반응성의 원리, 제4판, 미국 뉴욕 하퍼콜린스.
- ^ 제임스, 오전과 주, M.P. (1992) 영국 런던 맥밀런의 화학 및 물리적 데이터.
- ^ Wigner, E.; Huntington, H. B. (1935). "On the possibility of a metallic modification of hydrogen". Journal of Chemical Physics. 3 (12): 764. Bibcode:1935JChPh...3..764W. doi:10.1063/1.1749590.
- ^ Nellis, W. J.; Weir, S. T.; Mitchell, A. C. (1999). "Metallization of fluid hydrogen at 140 GPa (1.4 Mbar) by shock compression". Shock Waves. 9 (5): 301–305. Bibcode:1999ShWav...9..301N. doi:10.1007/s001930050189. S2CID 97261131.
- ^ Cousins, David M.; Davidson, Matthew G.; García-Vivó, Daniel (2013). "Unprecedented participation of a four-coordinate hydrogen atom in the cubane core of lithium and sodium phenolates". Chem. Commun. 49 (100): 11809–11811. doi:10.1039/c3cc47393g. PMID 24217230. Retrieved 7 August 2014.
- ^ Leach, Mark R. "2002 Inorganic Chemist's Periodic Table". Retrieved 16 October 2012.
- ^ Holleman, Arnold Frederik; Wiberg, Egon (2001), Wiberg, Nils (ed.), Inorganic Chemistry, translated by Eagleson, Mary; Brewer, William, San Diego/Berlin: Academic Press/De Gruyter, ISBN 0-12-352651-5
- ^ a b c Stevenson, D. J. (20 November 1975). "Does metallic ammonium exist?". Nature. Nature Publishing Group. 258 (5532): 222–223. Bibcode:1975Natur.258..222S. doi:10.1038/258222a0. S2CID 4199721.
- ^ a b Bernal, M. J. M.; Massey, H. S. W. (3 February 1954). "Metallic Ammonium". Monthly Notices of the Royal Astronomical Society. Wiley-Blackwell for the Royal Astronomical Society. 114 (2): 172–179. Bibcode:1954MNRAS.114..172B. doi:10.1093/mnras/114.2.172.
- ^ "Solubility Rules!". chem.sc.edu.
- ^ Reedy, J. H. (1 October 1929). "Lecture demonstration of ammonium amalgam". Journal of Chemical Education. 6 (10): 1767. Bibcode:1929JChEd...6.1767R. doi:10.1021/ed006p1767.
- ^ Connelly, Neil G.; Geiger, William E. (1996). "Chemical Redox Agents for Organometallic Chemistry". Chemical Reviews. 96 (2): 877–910. doi:10.1021/cr940053x. PMID 11848774.
- ^ El Murr, N.; Sheats, J. E.; Geiger, W. E.; Holloway, J. D. L. (1979). "Electrochemical Reduction Pathways of the Rhodocenium Ion. Dimerization and Reduction of Rhodocene". Inorg. Chem. 18 (6): 1443–1446. doi:10.1021/ic50196a007.
- ^ Keller, H. J.; Wawersik, H. (1967). "Spektroskopische Untersuchungen an Komplexverbindungen. VI. EPR-spektren von (C5H5)2Rh und (C5H5)2Ir". J. Organomet. Chem. (in German). 8 (1): 185–188. doi:10.1016/S0022-328X(00)84718-X.
- ^ Shannon, R. D. (1976). "Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides" (PDF). Acta Crystallogr A. 32 (5): 751–767. Bibcode:1976AcCrA..32..751S. doi:10.1107/S0567739476001551.
- ^ a b Crookes, William (1864). "On Thallium". Journal of the Chemical Society. Harrison & Sons. 17: 112–152. doi:10.1039/js8641700112.
- ^ 국제 순수 및 응용 화학 연합(2005년).무기 화학 명명법 (IUPAC 권고 2005).케임브리지 (영국): RSC-IUPAC.ISBN 0-85404-438-8. 페이지 51.전자 버전..
- ^ Mudring, Anja-Verena (2007). "Thallium Halides – New Aspects of the Stereochemical Activity of Electron Lone Pairs of Heavier Main-Group Elements". European Journal of Inorganic Chemistry. 2007 (6): 882–890. doi:10.1002/ejic.200600975.
- ^ Russell AM & Lee KL (2005) 비철금속에서의 구조-재산 관계.뉴욕 주, 와일리-인터사이언스 302페이지ISBN 0-471-64952-X
- ^ Deming HG (1940) 기초 화학, John Wiley & Sons, New York, 페이지 705–7
- ^ Bayar, J. C. (1973) 포괄적인 무기 화학, vol. 3, 페이지 16.ISBN 1-57215-291-5
- ^ Ober, Joyce A. "Lithium" (PDF). United States Geological Survey. pp. 77–78. Archived (PDF) from the original on 11 July 2007. Retrieved 19 August 2007.
- ^ Pauling, Linus. General Chemistry (1970 ed.). Dover Publications.
- ^ "Los Alamos National Laboratory – Sodium". Retrieved 8 June 2007.
- ^ 머크 지수, 9부, 모노그래프 8325
- ^ Winter, Mark. "WebElements Periodic Table of the Elements Potassium Essential information". Webelements. Retrieved 27 November 2011.
- ^ Lemke, Charles H.; Markant, Vernon H. (2001). "Sodium and Sodium Alloys". Kirk-Othmer Encyclopedia of Chemical Technology. doi:10.1002/0471238961.1915040912051311.a01.pub2. ISBN 978-0-471-23896-6.
- ^ "Cesium Cs (Element) - PubChem". pubchem.ncbi.nlm.nih.gov. Retrieved 18 December 2021.
- ^ "WebElements Periodic Table » Rubidium » geological information". www.webelements.com. Retrieved 18 December 2021.
- ^ 류, 진리안 & 인, 주란 & 리, 신해 & 후, 제양 & 류, 위. (2019년)레피돌라이트로부터 귀중한 금속을 선별적으로 침전시키는 새로운 과정.광물 공학. 135. 29-36. 10.1016/j.mineng.2018.11.046.
- ^ "Cesium and Rubidium Hit Market". Chemical & Engineering News. 37 (22): 50–56. 1959. doi:10.1021/cen-v037n022.p050.
- ^ a b c d Butterman, William C.; Brooks, William E.; Reese, Jr., Robert G. (2003). "Mineral Commodity Profile: Rubidium" (PDF). United States Geological Survey. Retrieved 4 December 2010.
- ^ bulletin 585. United States. Bureau of Mines. 1995.
- ^ Burt, R. O. (1993). "Caesium and cesium compounds". Kirk-Othmer encyclopedia of chemical technology. Vol. 5 (4th ed.). New York: John Wiley & Sons, Inc. pp. 749–764. ISBN 978-0-471-48494-3.
- ^ Stancari, G.; Veronesi, S.; Corradi, L.; Atutov, S. N.; Calabrese, R.; Dainelli, A.; Mariotti, E.; Moi, L.; Sanguinetti, S.; Tomassetti, L. (2006). "Production of Radioactive Beams of Francium". Nuclear Instruments and Methods in Physics Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 557 (2): 390–396. Bibcode:2006NIMPA.557..390S. doi:10.1016/j.nima.2005.11.193.
- ^ a b Orozco, Luis A. (2003). "Francium". Chemical and Engineering News. 81 (36): 159. doi:10.1021/cen-v081n036.p159.
- ^ a b Price, Andy (20 December 2004). "Francium". Retrieved 19 February 2012.
- ^ USGS (2011). "Lithium" (PDF). Retrieved 4 December 2011.
- ^ "Soaps & Detergents: Chemistry". Retrieved 20 July 2015.
- ^ Lindsey, Jack L (1997). Applied illumination engineering. p. 112. ISBN 978-0-88173-212-2.
- ^ Kane, Raymond; Sell, Heinz (2001). Revolution in lamps: A chronicle of 50 years of progress. p. 241. ISBN 978-0-88173-351-8.
- ^ Stampers, National Association of Drop Forgers and (1957). Metal treatment and drop forging.
- ^ Harris, Jay C (1949). Metal cleaning bibliographical abstracts. p. 76.
- ^ Cordel, Oskar (1868). Die Stassfurter Kalisalze in der Landwirthschalt: Eine Besprechung ... (in German). L. Schnock.
- ^ Toedt, John; Koza, Darrell; Cleef-Toedt, Kathleen Van (2005). "Personal Cleansing Products: Bar Soap". Chemical composition of everyday products. Greenwood Publishing Group. ISBN 978-0-313-32579-3.
- ^ Schultz, H.; et al. (2006). "Potassium compounds". Ullmann's Encyclopedia of Industrial Chemistry. Vol. A22. p. 95. doi:10.1002/14356007.a22_031.pub2. ISBN 978-3-527-30673-2.
- ^ "Cesium Atoms at Work". Time Service Department—U.S. Naval Observatory—Department of the Navy. Archived from the original on 23 February 2015. Retrieved 20 December 2009.
- ^ "The NIST reference on Constants, Units, and Uncertainty". National Institute of Standards and Technology.
- ^ Koch, E.-C. (2002). "Special Materials in Pyrotechnics, Part II: Application of Caesium and Rubidium Compounds in Pyrotechnics". Journal Pyrotechnics. 15: 9–24. Archived from the original on 13 July 2011. Retrieved 3 November 2011.
- ^ Heiserman, David L. (1992). Exploring Chemical Elements and their Compounds. McGraw-Hill. pp. 201–203. ISBN 978-0-8306-3015-8.
- ^ Winter, Mark. "Uses". Francium. The University of Sheffield. Archived from the original on 31 March 2007. Retrieved 25 March 2007.
- ^ Gomez, E.; Orozco, L. A.; Sprouse, G. D. (7 November 2005). "Spectroscopy with trapped francium: advances and perspectives for weak interaction studies". Rep. Prog. Phys. 69 (1): 79–118. Bibcode:2006RPPh...69...79G. doi:10.1088/0034-4885/69/1/R02.
- ^ Peterson, I. (11 May 1996). "Creating, cooling, trapping francium atoms" (PDF). Science News. 149 (19): 294. doi:10.2307/3979560. JSTOR 3979560. Retrieved 11 September 2009.
- ^ a b c Lerner, Michael M. (2013). "Standard Operating Procedure: Storage and Handling of Alkali Metals". Oregon State University. Retrieved 26 August 2016.
- ^ Solomon, Robert E. (2002). Fire and Life Safety Inspection Manual. Jones & Bartlett Learning. p. 459. ISBN 978-0-87765-472-8.
- ^ Angelici, R. J. (1999). Synthesis and Technique in Inorganic Chemistry. Mill Valley, CA: University Science Books. ISBN 978-0-935702-48-4.
- ^ Martel, Bernard; Cassidy, Keith (1 July 2004). "Rubidium". Chemical risk analysis: a practical handbook. p. 215. ISBN 978-1-903996-65-2.
- ^ Wray, Thomas K. "Danger: peroxidazable chemicals" (PDF). Environmental Health & Public Safety (North Carolina State University). Archived from the original (PDF) on 8 June 2011.
- ^ Astrid, Sigel; Helmut, Sigel; Roland K.O., Sigel, eds. (2016). The Alkali Metal Ions: Their Role in Life. Metal Ions in Life Sciences. Vol. 16. Springer. doi:10.1007/978-3-319-21756-7. ISBN 978-3-319-21755-0. S2CID 5983458.
- ^ Katsuyuki, Aoki; Kazutaka, Murayama; Hu, Ning-Hai (2016). "Chapter 3. Solid State Structures of Alkali Metal Ion Complexes Formed by Low-Molecular-Weight Ligands of Biological Relevance". In Astrid, Sigel; Helmut, Sigel; Roland K.O., Sigel (eds.). The Alkali Metal Ions: Their Role in Life. Metal Ions in Life Sciences. Vol. 16. Springer. pp. 27–101. doi:10.1007/978-3-319-21756-7_3. ISBN 978-3-319-21755-0. PMID 26860299.
- ^ a b c d e Winter, Mark. "WebElements Periodic Table of the Elements Lithium biological information". Webelements. Retrieved 15 February 2011.
- ^ Gray, Theodore. "Facts, pictures, stories about the element Lithium in the Periodic Table". theodoregray.com. Retrieved 9 January 2012.
- ^ Howland, Robert H. (September 2007). "Lithium: Underappreciated and Underused?". Psychiatric Annals. 37 (9): 13–17. doi:10.3928/00485713-20070901-06. PMID 17848039.
- ^ Zarse, Kim; Terao, Takeshi; Tian, Jing; Iwata, Noboru; Ishii, Nobuyoshi; Ristow, Michael (August 2011). "Low-dose lithium uptake promotes longevity in humans and metazoans". European Journal of Nutrition. 50 (5): 387–9. doi:10.1007/s00394-011-0171-x. PMC 3151375. PMID 21301855.
- ^ a b c Winter, Mark. "WebElements Periodic Table of the Elements Potassium biological information". WebElements. Retrieved 13 January 2012.
- ^ a b Winter, Mark. "WebElements Periodic Table of the Elements Sodium biological information". WebElements. Retrieved 13 January 2012.
- ^ "Sodium" (PDF). Northwestern University. Archived from the original (PDF) on 23 August 2011. Retrieved 21 November 2011.
- ^ "Sodium and Potassium Quick Health Facts". Retrieved 7 November 2011.
- ^ "Dietary Reference Intakes: Water, Potassium, Sodium, Chloride, and Sulfate". Food and Nutrition Board, Institute of Medicine, United States National Academies. 11 February 2004. Archived from the original on 6 October 2011. Retrieved 23 November 2011.
- ^ U.S. Department of Agriculture; U.S. Department of Health and Human Services (December 2010). Dietary Guidelines for Americans, 2010 (PDF) (7th ed.). p. 22. ISBN 978-0-16-087941-8. OCLC 738512922. Archived from the original (PDF) on 27 October 2011. Retrieved 23 November 2011.
- ^ Geleijnse, J. M.; Kok, F. J.; Grobbee, D. E. (2004). "Impact of dietary and lifestyle factors on the prevalence of hypertension in Western populations". European Journal of Public Health. 14 (3): 235–239. doi:10.1093/eurpub/14.3.235. PMID 15369026. Archived from the original on 1 August 2018. Retrieved 30 August 2017.
- ^ Lawes, C. M.; Vander Hoorn, S.; Rodgers, A.; International Society of Hypertension (2008). "Global burden of blood-pressure-related disease, 2001" (PDF). Lancet. 371 (9623): 1513–1518. doi:10.1016/S0140-6736(08)60655-8. PMID 18456100. S2CID 19315480. Archived from the original (PDF) on 28 January 2012.
- ^ a b Hellgren, Mikko; Sandberg, Lars; Edholm, Olle (2006). "A comparison between two prokaryotic potassium channels (KirBac1.1 and KcsA) in a molecular dynamics (MD) simulation study". Biophys. Chem. 120 (1): 1–9. doi:10.1016/j.bpc.2005.10.002. PMID 16253415.
- ^ a b Schonwald, Seth (2004). "Potassium Chloride and Potassium Permanganate". Medical toxicology. Lippincott Williams & Wilkins. pp. 903–5. ISBN 978-0-7817-2845-4.
- ^ Markovchick, Vincent J. & Pons, Peter T. (2003). Emergency medicine secrets. Elsevier Health Sciences. p. 223. ISBN 978-1-56053-503-4.
- ^ a b c Winter, Mark. "WebElements Periodic Table of the Elements Rubidium biological information". Webelements. Retrieved 15 February 2011.
- ^ a b Relman, A. S. (1956). "The Physiological Behavior of Rubidium and Cesium in Relation to That of Potassium". The Yale Journal of Biology and Medicine. 29 (3): 248–62. PMC 2603856. PMID 13409924.
- ^ a b c Meltzer, H. L. (1991). "A pharmacokinetic analysis of long-term administration of rubidium chloride". Journal of Clinical Pharmacology. 31 (2): 179–84. doi:10.1002/j.1552-4604.1991.tb03704.x. PMID 2010564. S2CID 2574742. Archived from the original on 9 July 2012.
- ^ a b Winter, Mark. "WebElements Periodic Table of the Elements Caesium biological information". WebElements. Retrieved 13 January 2012.
- ^ Fieve, Ronald R.; Meltzer, Herbert L.; Taylor, Reginald M. (1971). "Rubidium chloride ingestion by volunteer subjects: Initial experience". Psychopharmacologia. 20 (4): 307–14. doi:10.1007/BF00403562. PMID 5561654. S2CID 33738527.
- ^ Follis, Richard H., Jr. (1943). "Histological Effects in rats resulting from adding Rubidium or Cesium to a diet deficient in potassium". American Journal of Physiology. Legacy Content. 138 (2): 246. doi:10.1152/ajplegacy.1943.138.2.246.
- ^ Gottschlich, Michele M. (2001). The Science and Practice of Nutrition Support: A Case-based Core Curriculum. Kendall Hunt. p. 98. ISBN 978-0-7872-7680-5.
- ^ Insel, Paul M.; Turner, R. Elaine; Ross, Don (2004). Nutrition. Jones & Bartlett Learning. p. 499. ISBN 978-0-7637-0765-1.
- ^ Melnikov, P.; Zanoni, L. Z. (June 2010). "Clinical effects of cesium intake". Biological Trace Element Research. 135 (1–3): 1–9. doi:10.1007/s12011-009-8486-7. PMID 19655100. S2CID 19186683.
- ^ a b Pinsky, Carl; Bose, Ranjan; Taylor, J. R.; McKee, Jasper; Lapointe, Claude; Birchall, James (1981). "Cesium in mammals: Acute toxicity, organ changes and tissue accumulation". Journal of Environmental Science and Health, Part A. 16 (5): 549–567. doi:10.1080/10934528109375003.
- ^ Johnson, Garland T.; Lewis, Trent R.; Wagner, D. Wagner (1975). "Acute toxicity of cesium and rubidium compounds". Toxicology and Applied Pharmacology. 32 (2): 239–245. doi:10.1016/0041-008X(75)90216-1. PMID 1154391.
- ^ Sartori, H. E. (1984). "Cesium therapy in cancer patients". Pharmacol Biochem Behav. 21 (Suppl 1): 11–13. doi:10.1016/0091-3057(84)90154-0. PMID 6522427. S2CID 11947121.
- ^ 우드, 레오니."'Cured' cancer patients died, court told". The Sydney Morning Herald. 20 November 2010.