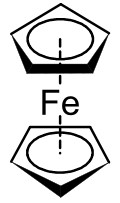
금속세
Metallocene메탈로센은 산화상태 II에서 금속중심(M)에 결합된 2개의 사이클로펜타디에닐 음이온(CH
5−
5, 약칭 Cp)으로 이루어진 화합물로, 일반식(CH55)2M이다.메탈로센과 밀접하게 관련된 것은 메탈로센 유도체, 예를 들어 티타노세 이염화물, 바나도세 이염화물이다.특정 메탈로센과 그 유도체는 촉매 특성을 나타내지만, 메탈로센은 산업적으로 거의 사용되지 않는다.[CpZr2]와 관련된 양이온성 제4족 메탈로센 유도체CH3]+ 올레핀 중합을 촉매한다.
일부 메탈로센은 금속과 2개의 시클로옥타테트라에니드 음이온(CH
82−
8, 약칭2− cot), 즉 란타노센과 악티노센(우라노세 및 기타)으로 구성됩니다.
메탈로센은 샌드위치 [1]화합물이라고 불리는 광범위한 화합물의 하위 집합이다.오른쪽 구조에서 2개의 펜타곤은 내부에 방향족 안정화를 나타내는 원이 있는 사이클로펜타디에닐 음이온이다.여기에 그것들이 엇갈린 형태로 표시되어 있습니다.
역사
최초로 분류된 금속세는 페로센으로 1951년 킬리와 파우슨,[2] 밀러 [3]등에 의해 동시에 발견되었다.Kealy와 Pauson은 시클로펜타디에닐 소금의 무수 FeCl3 산화를 통해 풀발렌을 합성하려고 시도했지만 대신 CHFe1010[2] 물질을 얻었다. 동시에, Miller 등은 시클로펜타디엔과 철의 반응에서 알루미늄, 칼륨 또는 몰리브덴 [3]산화물의 존재를 보고하였다."CHFe"의1010 구조는 Geoffrey Wilkinson [1]등 및 Ernst Otto Fischer [4]등에 의해 결정되었다.이 둘은 1973년 페로센의 [1]구조적 결정을 포함한 샌드위치 화합물에 대한 연구로 노벨 화학상을 수상했다.그들은 사이클로펜타디에닐(Cp) 리간드의 탄소 원자가 결합에 동등하게 기여하고 Cp 리간드의 p-orbitals에 있는 금속 d-orbitals와 γ-전자 때문에 결합이 발생했다고 결정했다.이 복합체는 현재 페로센으로 알려져 있으며 전이 금속 디시클로펜타디에닐 화합물군은 메탈로센으로 알려져 있다.금속의 일반식은 [(δ-CH555)2M]이다.Fischer 등은 Co와 Ni를 포함한 페로센 유도체를 최초로 준비했다. 종종 시클로펜타디에니드의 치환 유도체로부터 파생된 많은 원소의 메탈로센이 [5]준비되었다.
가장 초기의 메탈로센의 상업적인 제조자 중 하나는 콜로라도 볼더에[6] 있는 아라파호 화학이었다.
정의.
일반명은 페로센(CH55)2Fe 또는2 CpFe에서 유래한 것으로 계통명은 bis(γ-cyclopentadienyl5) 철(II)이다.국제순수응용화학연합(International Union of Pure and Applied Chemistry)의 정의에 따르면 메탈로센은 전이금속과 샌드위치 구조에서 배위된 2개의 사이클로펜타디에닐 리간드를 포함한다.즉, 2개의 사이클로펜타디에닐 음이온은 동일한 결합 길이와 강도를 가진 평행 평면상에 있다.합티시티(hapticity)라는 명명법을 사용하여 사이클로펜타디에닐 고리의 탄소 원자 5개 모두의 등가 결합은 δ로5 표시되며, 이는 펜타합토(pentahapto)로 발음된다.우라늄 원자를 사이에 두고 있는 두 개의 사이클로옥타테트라엔 고리를 가진 우라노세 같은 예외는 있다.
금속세 이름에서 -ocene의 끝 앞의 접두사는 Cp 그룹 사이에 어떤 금속 원소가 있는지를 나타냅니다.예를 들어 페로센, 철(II), 철이 존재한다.
더 엄밀한 정의 국제 순수 및 응용 화학,d-block 금속과 샌드위치 구조, 용어 메탈 외연 -ocene을 요구한다에서 제안된 이와 대조적으로 화학 문헌에서barocene(Cp2Ba) 같은non-transition 금속 화합물,, 또는 aromati 구조 또한에 적용된다.c고리는 망가노세 또는 티타노세 중염화물(CpTiCl22)에서 발견되는 것과 같이 평행하지 않다.
악티니드의 일부 메탈로센 복합체는 단일 금속 복합체에 대해 3개의 사이클로펜타디에닐 배위자가 있으며, 이들 3개는 모두 [7]δ5 결합되어 있는 것으로 보고되었다.
분류
많은 (δ-CH555)-금속 착화체가 있으며 다음과 같은 [8]공식으로 분류할 수 있습니다.
| 공식 | 묘사 |
|---|---|
| [(--CH555)2M] | 대칭적이고 클래식한 '샌드위치' 구조 |
| [(--CH555)2MLx] | 리간드가 추가된 구부러지거나 기울어진 Cp 링(L) |
| [(--CH555)MLx] | 리간드가 추가된 유일한 Cp 리간드 L('피아노-스툴' 구조) |
금속세 복합체는 [8]유형별로 분류할 수도 있다.
- 병렬
- 멀티데커
- 하프샌드위치 화합물
- 금속세가 구부러지거나 기울어짐
- 3개 이상의 Cp 리간드
합성
이러한 유형의 [8]화합물 형성에 일반적으로 세 가지 주요 경로가 사용됩니다.
금속염 및 시클로펜타디에닐 시약 사용
시클로펜타디에니드나트륨(NaCp)은 이러한 유형의 반응에 적합한 시약입니다.녹은 나트륨과 디시클로펜타디엔의 [9]반응에 의해 가장 쉽게 얻을 수 있다.전통적으로 시작점은 사이클로펜타디엔의 이합체인 디시클로펜타디엔의 균열이다.시클로펜타디엔은 강한 염기나 알칼리 금속에 의해 탈양성된다.
- MCl2 + 2 NaCH55 → (CH55)2M + 2 NaCl (M = V, Cr, Mn, Fe, Co, 용매 = THF, DME, NH3)
- CrCl3 + 3 NaCH55 → [(CH55)2Cr] +1⁄2 "C10H10" + 3 NaCl
NaCp는 이 반응에서 환원제 및 배위자로 작용한다.
금속 및 사이클로펜타디엔 사용
이 기술은 고체 금속이 아닌 기체 상태의 금속 원자를 사용합니다.고반응성 원자 또는 분자는 진공 상태에서 고온에서 생성되며 차가운 표면에서 선택된 반응 물질과 함께 결합됩니다.
- M + CH56 → MCH55 + 1⁄22 H (M = Li, Na, K)
- M + 2 CH56 → [(CH55)2M] + H2 (M = Mg, Fe)
시클로펜타디에닐 시약 사용
Cp를 금속에 전달하는 다양한 시약이 개발되었습니다.한때 인기 있었던 것은 탈륨 시클로펜타디에니드였다.금속 할로겐화물과 반응하여 용해성이 낮은 염화 탈륨과 시클로펜타디에닐 복합체를 생성한다.Cp의− 트리알킬틴 유도체도 사용되었다.
다른 많은 방법들이 개발되어 왔다.크로모센은 디에틸아민이 존재하는 상태에서 시클로펜타디엔과 직접 반응하여 크롬 헥사카르보닐로부터 제조할 수 있다.이 경우 시클로펜타디엔의 정식 탈양성자가 수소 가스로 환원되어 금속 중심부의 [10]산화를 촉진한다.
- Cr(CO)6 + 2 CH56 → Cr(CH55)2 + 6 CO + H2
메탈로센은 일반적으로 열 안정성이 높습니다.페로센은 100°C 이상의 공기에서 분해 없이 승화할 수 있다. 금속은 일반적으로 진공 승화에 의해 실험실에서 정제된다.산업적으로는 승화가 실용적이지 않기 때문에 결정화에 의해 금속이 분리되거나 탄화수소 용액의 일부로 생성된다.그룹 IV 메탈로센의 경우, 에테르 또는 THF와 같은 공여 용제는 폴리올레핀 촉매 작용에 명백히 바람직하지 않다.전하중립성 메탈로센은 일반적인 유기용매에 용해됩니다.금속세에서의 알킬 치환은 탄화수소 용제의 용해성을 증가시킨다.
구조.
직렬2 MCP의 구조적 경향은 M-C 결합의 변동을 포함하며, M-C 결합은 원자가 전자수가 [11]18에서 벗어날 때 길어진다.
| M(C5H5)2 | rM–C (오후) | 원자가 전자수 |
|---|---|---|
| Fe | 203.3 | 18 |
| 회사 | 209.6 | 19 |
| Cr | 215.1 | 16 |
| 니 | 218.5 | 20 |
| V | 226 | 15 |
(CR55)2M형 메탈로센에서는 사이클로펜타디에닐 고리가 매우 낮은 장벽으로 회전한다.단결정 X선 회절 연구는 일식 로타머 또는 시차 로타머를 모두 밝혀졌습니다.비치환 메탈로센의 경우, 엇갈린 형태와 일식 형태 사이의 에너지 차이는 몇 kJ/mol에 불과하다.페로센과 오스모세의 결정은 저온에서 일식 형태를 보이는 반면, 관련된 비스(펜타메틸시클로펜타디에닐) 복합체에서는 고리가 보통 메틸기 사이의 입체적 장애를 최소화하기 위해 엇갈린 형태로 결정화된다.
분광 특성[8]
메탈로센의 진동(적외선 및 라만) 분광법
적외선 및 라만 분광법은 순환 폴리에닐 금속 샌드위치 종 분석에 중요한 것으로 입증되었으며, 특히 공유가 또는 이온성 M-고리 결합을 설명하고 중심 고리와 배위 고리를 구별하는 데 사용된다.철기 메탈로센의 전형적인 스펙트럼 대역과 배치는 다음 [8]표에 제시되어 있다.
| 페로센(cm−1) | 루테노세(cm−1) | 오스모세(cm−1) | |
|---|---|---|---|
| C-H 스트레치 | 3085 | 3100 | 3095 |
| C~C 스트레치 | 1411 | 1413 | 1405 |
| 링 변형 | 1108 | 1103 | 1096 |
| C-H 변형 | 1002 | 1002 | 995 |
| C-H 평면 외 벤딩 | 811 | 806 | 819 |
| 링 틸트 | 492 | 528 | 428 |
| M-링 스트레치 | 478 | 446 | 353 |
| M-링 굽힘 | 170 | 185 | – |
메탈로센의 NMR(1H 및 C) 분광법
핵자기공명(NMR)은 금속 샌드위치 화합물 및 유기금속 종 연구에 가장 많이 사용되는 도구로서 액체, 기체 및 고체 상태의 핵 구조에 대한 정보를 제공한다.1상사성 유기 전이 금속 화합물에 대한 H NMR 화학적 변화는 보통 25 - 40ppm 사이에서 관찰되지만, 반자성 금속세 복합체에 대해서는 이 범위가 훨씬 좁으며, 화학적 변화는 보통 3 -[8] 7ppm 사이에서 관찰된다.
금속의 질량 분석
금속세 복합체의 질량 분석법은 매우 잘 연구되어 왔으며, 유기 부분 조각에 대한 금속의 영향은 상당한 관심을 받았으며, 금속을 포함한 조각의 식별은 종종 금속의 동위원소 분포에 의해 촉진된다.질량분석에서 관찰되는 세 가지 주요 단편은 분자 이온 피크인1010 [CHM]+과 단편 이온인55 [CHM]+과+ M이다.
파생상품
페로센의 발견 이후, 메탈로센과 다른 샌드위치 화합물의 합성 및 특성화가 연구자들의 관심을 끌었다.
메탈로세노파네스
메탈로세노페인은 하나 이상의 헤테로환형 브릿지의 도입에 의해 사이클로펜타디에닐 또는 폴리아레닐 고리의 연결을 특징으로 한다.이러한 화합물 중 일부는 고분자 골격에서 전이 금속과 함께 용해성 고분자량 중합체를 제공하기 위해 열 고리 개방 중합 과정을 거칩니다.안사-메탈로센은 두 사이클로펜타디에닐 고리 사이에 분자 내 브릿지를 가진 메탈로센의 유도체이다.
다핵금속 및 헤테로금속금속
- 페로센 유도체: 비페로세노페인은 혼합 원자가 특성에 대해 연구되어 왔다.두 개 이상의 동등한 페로센 부분을 가진 화합물의 1전자 산화 시, 전자 공극은 하나의 페로센 단위로 국부화되거나 완전히 국부화되지 않을 수 있다.
- 루테노세 유도체: 고체상태에서 비루테노세는 무질서하며 분자간 상호작용에 따라 Cp고리의 상호배향에 따른 트랜스오이드 형태를 채택한다.
- 바나도세 및 로도세 유도체: 바나도세 복합체는 헤테로 금속 복합체 합성의 시작 물질로 사용되어 왔다.18가 전자이온 [CpRh2]+은 상온에서 즉시 이량화되는 중성단량체2 CpRh와 달리 매우 안정적이며 매트릭스 절연으로 관찰되었다.
다층 샌드위치 화합물
3층 복합체는 3개의 Cp 음이온과 2개의 금속 양이온으로 번갈아 구성되어 있다.최초의 3층 샌드위치 단지,1972년에23 [12]보고되었습니다.+많은 예들이 그 이후에 보고되었으며, 종종 붕소가 함유된 [13]고리를 가지고 있다.
금속 세늄 양이온
가장 유명한 예는 주황색 철(II) 페로센의 산화로 파생된 청색 철(III) 복합체인 페로세늄 [Fe55(2+CH)]입니다(메탈로센 음이온은 거의 알려져 있지 않습니다).
적용들
초기 금속 금속 금속의 많은 유도체는 올레핀 중합에 대한 활성 촉매이다.전통적인 여전히 지배적인 이기종인 지글러-나타 촉매와는 달리, 메탈로센 촉매는 [8]균질하다.초기 메탈로센 유도체(예:Tebbe의 시약, Petasis 시약, Schwartz의 시약은 특수 유기 합성 작업에 유용합니다.
잠재적인 응용 프로그램
페로센/페로세늄 바이오센서는 일련의 연결된 산화환원 [8]사이클을 통해 샘플의 포도당 수준을 전기화학적으로 결정하기 위해 논의되었습니다.
금속세 디할라이드[CpMx](22M=Ti, Mo, Nb)는 임상시험에서 [14]멀리 진행된 것은 없지만 항산화 특성을 보인다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b c Wilkinson, G.; Rosenblum, M.; Whiting, M. C.; Woodward, R. B. (1952). "The Structure of Iron Bis-Cyclopentadienyl". J. Am. Chem. Soc. 74 (8): 2125–2126. doi:10.1021/ja01128a527.
- ^ a b Kealy, T. J.; Pauson, P. L. (1951). "A New Type of Organo-Iron Compound". Nature. 168 (4285): 1039. Bibcode:1951Natur.168.1039K. doi:10.1038/1681039b0. S2CID 4181383.
- ^ a b Miller, S. A.; Tebboth, J. A.; Tremaine, J. F. (1952). "114. Dicyclopentadienyliron". J. Chem. Soc. 1952: 632–635. doi:10.1039/JR9520000632.
- ^ Fischer, E. O.; Pfab, W. (1952). "Zur Kristallstruktur der Di-Cyclopentadienyl-Verbindungen des zweiwertigen Eisens, Kobalts und Nickels" [On the crystal structure of the di-cyclopentadienyl compounds of divalent iron, cobalt and nickel]. Z. Naturforsch. B. 7 (7): 377–379. doi:10.1515/znb-1952-0701.
- ^ Chirik, Paul J. (2010). "Group 4 Transition Metal Sandwich Complexes: Still Fresh after Almost 60 Years". Organometallics. 29 (7): 1500–1517. doi:10.1021/om100016p.
- ^ 를 클릭합니다.ARAPAHOE CHEMICALS, INC (1962-11-01). "Arapahoe Chemicals, Inc". Analytical Chemistry. 34 (12): 122A. doi:10.1021/ac60192a828. ISSN 0003-2700.
- ^ Brennan, J. G.; Andersen, R. A.; Zalkin, A. (1986). "Chemistry of trivalent uranium metallocenes: Electron-transfer reactions. Synthesis and characterization of [(MeC5H4)3U]2E (E= S, Se, Te) and the crystal structures of hexakis(methylcyclopentadienyl)sulfidodiuranium and tris(methylcyclopentadienyl)(triphenylphosphine oxide)uranium". Inorg. Chem. 25 (11): 1761–1765. doi:10.1021/ic00231a008.
- ^ a b c d e f g h Long, N. J. (1998). Metallocenes: Introduction to Sandwich Complexes. London: Wiley-Blackwell. ISBN 978-0632041626.
- ^ Panda, T. K.; Gamer, M. T.; Roesky, P. W. (2003). "An Improved Synthesis of Sodium and Potassium Cyclopentadienide". Organometallics. 22 (4): 877. doi:10.1021/om0207865.
- ^ Fischer, E. O.; Hafner, W. (1955). "Cyclopentadienyl-Chrom-Tricarbonyl-Wasserstoff" [Cyclopentadienylchromium tricarbonyl hydride]. Z. Naturforsch. B (in German). 10 (3): 140–143. doi:10.1515/znb-1955-0303. S2CID 209650632.
- ^ Flower, K. R.; Hitchcock, P. B. (1996). "Crystal and molecular structure of chromocene (η5-C5H5)2Cr". J. Organomet. Chem. 507 (1–2): 275–277. doi:10.1016/0022-328X(95)05747-D. 당시 사용 가능한 모든 금속세 구조에 대해 설명합니다.
- ^ Werner, Helmut; Salzer, Albrecht (1972-01-01). "Die Synthese Eines Ersten Doppel-Sandwich-Komplexes: Das Dinickeltricyclopentadienyl-Kation". Synthesis and Reactivity in Inorganic and Metal-Organic Chemistry. 2 (3): 239–248. doi:10.1080/00945717208069606. ISSN 0094-5714.
- ^ Grimes, R. N. (2004). "Boron clusters come of age". J. Chem. Educ. 81 (5): 657–672. Bibcode:2004JChEd..81..657G. doi:10.1021/ed081p657.
- ^ Kuo, L. Y.; Kanatzidis, M. G.; Sabat, M.; Marks, T. J.; Marks, Tobin J. (1991). "Metallocene antitumor agents. Solution and solid-state molybdenocene coordination chemistry of DNA constituents". J. Am. Chem. Soc. 113 (24): 9027–9045. doi:10.1021/ja00024a002.
기타 참고 자료
- Salzer, A. (1999). "Nomenclature of Organometallic Compounds of the Transition Elements". Pure Appl. Chem. 71 (8): 1557–1585. doi:10.1351/pac199971081557. S2CID 14367196. Archived from the original on 2007-07-16.
- Crabtree, Robert H. (2005). The Organometallic Chemistry of the Transition Metals (4th ed.). Wiley-Interscience.ISBN 0470257628
- Miessler, Gary L.; Tarr, Donald A. (2004). Inorganic Chemistry. Upper Saddle River, NJ: Pearson Education. ISBN 978-0-13-035471-6.
- Cotton, F. A.; Wilkinson, G. (1988). Inorganic Chemistry (5th ed.). Wiley. pp. 626–7.[ISBN 실종]
- Togni, A.; Halterman, R. L. (1998). Metallocenes. Wiley-VCH.[ISBN 실종]