페닐리튬
Phenyllithium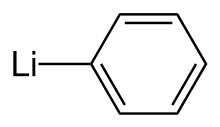 | |
| 이름 | |
|---|---|
| 시스템 IUPAC 이름 페닐리튬[1] | |
| 기타 이름 리티오벤젠[citation needed] | |
| 식별자 | |
3D 모델(JSmol) | |
| 약어 | LiPh, PhLi |
| 506502 | |
| 체비 | |
| 켐스파이더 | |
| ECHA 정보 카드 | 100.008.838 |
| EC 번호 |
|
| 2849 | |
| 메쉬 | 페닐리튬 |
PubChem CID | |
CompTox 대시보드 (EPA ) | |
| |
| |
| 특성. | |
| LiC 6H 5 | |
| 몰 질량 | 84.045 g mol−1 |
| 외모 | 무색 결정 |
| 밀도 | 828 mg cm−3 |
| 비등점 | 140~143°C(284~289°F, 413~416K) |
| 반응 | |
| 열화학 | |
표준 엔탈피/ 형성 (δHf⦵298) | 48.3~52.5kJ몰−1 |
| 위험 요소 | |
| GHS 라벨링: | |
   | |
| 위험. | |
| H226, , , , , , , | |
| P210, , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , | |
| 안전 데이터 시트(SDS) | 외부 MSDS |
| 관련 화합물 | |
관련 화합물 | 페닐구리, 페닐소듐, 페닐코발트 |
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |
페닐리튬 또는 리토벤젠은 경험식65 CHLi의 유기금속제이다.유기합성에서는 금속화제로, 유기합성에서는 [2]페닐기를 도입하기 위한 그리냐드 시약 대체제로 가장 일반적으로 사용된다.결정성 페닐리튬은 무색이지만 페닐리튬의 용액은 사용하는 용매와 [3]용질 중의 불순물에 따라 갈색 또는 빨간색의 여러 가지 색조이다.
준비
페닐리튬은 리튬 금속과 디페닐 [4]수은의 반응에 의해 처음 생성되었습니다.
- (CΩ65)2 δg + 2Li → 2C65 δLi + δg
할로겐화 페닐과 리튬 금속의 반응으로 페닐리튬이 생성됩니다.
- X-Ph + 2Li → Ph-Li + LiX
페닐리튬은 금속-할로겐 교환 반응으로 합성될 수도 있습니다.
- n-BuLi + X-Ph → n-BuX + Ph-Li
오늘날 페닐리튬을 생산하는 주요 방법은 후자의 두 가지 합성이다.
반응
PhLi의 주요 용도는 친핵성 첨가 및 치환 반응에 의한 탄소-탄소 결합 형성을 촉진하는 것이다.
- PhLi + RC2=O → PhRCOLi2
2-페닐피리딘은 페닐리튬과 피리딘의 반응에 의해 제조되며, 이는 첨가-제거 [5]경로를 수반한다.
- CHLi65 + CHN55 → CH-CHN6554 + LiH
구조 및 속성
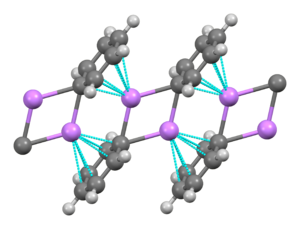
페닐리튬은 단사정계 결정을 형성하는 유기석 화합물이다.고체 페닐리튬은 이합체 LiPh22 서브유닛으로 이루어진 것으로 설명할 수 있다.페닐 고리의 Li 원자와 Ipso 탄소는 평면 4원환을 형성합니다.페닐기의 평면은 이 LiC22 고리의 평면과 수직입니다.이들 페닐리튬 이합체와 인접한 이합체 내 페닐기의 γ전자 사이에 추가적인 강한 분자간 결합이 발생하여 무한 고분자 사다리 [6]구조를 형성한다.
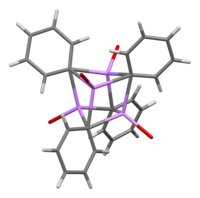
용액에서는 유기용매에 의존하는 다양한 구조를 필요로 한다.테트라히드로프랑에서는 단량체와 이합체 상태 사이에서 평형을 이룬다.에테르에는 일반적으로 판매되는 페닐리튬이 4량체로서 존재한다.4개의 Li 원자와 4개의 ipso 탄소 중심은 뒤틀린 입방체의 정점을 번갈아 차지한다.Ph
C-Li 결합 길이는 평균 2.33Ω이다. 에테르 분자는 산소 원자를 통해 각 Li 부위에 결합한다.리튬과 할로겐화 페닐을 직접 반응시키는 부산물인 LiBr이 존재할 경우 [(PhLi•EtO2)]4 복합체는 [(PhLi•EtO2)]3가 됩니다.•LiBr) LiBr의 Li 원자는 큐반형 클러스터 내의 리튬 사이트 중 하나를 차지하고 Br 원자는 인접한 탄소 [7]사이트에 위치한다.
레퍼런스
- ^ "phenyllithium (CHEBI:51470)". Chemical Entities of Biological Interest (ChEBI). Cambridge, UK: European Bioinformatics Institute. 2009-01-22. Main. Retrieved 2013-06-01.
- ^ Wietelmann, U.; Bauer, R. J. "Lithium and Lithium Compounds". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a15_393.
- ^ Gilman, H.; Zoellner, E. A.; Selby, W. M. (1932). "An Improved Procedure for the Preparation of Organolithium Compounds". Journal of the American Chemical Society. 54 (5): 1957–1962. doi:10.1021/ja01344a033.
- ^ Green, D. P.; Zuev, D. (2008). "Phenyllithium". Encyclopedia of Reagents for Organic Synthesis. Wiley and Sons. doi:10.1002/047084289X.rp076.pub2. ISBN 978-0471936237.
- ^ 에반스, J. C. W.; 앨런, C. F. H. "2-페닐피리딘" 유기합성물(1938), vol. 18, 페이지 70 doi:10.15227/orgsyn.018.0070
- ^ Dinnebier, R. E.; Behrens, U.; Olbrich, F. (1998). "Lewis Base-Free Phenyllithium: Determination of the Solid-State Structure by Synchrotron Powder Diffraction". Journal of the American Chemical Society. 120 (7): 1430–1433. doi:10.1021/ja972816e.
- ^ Hope, H.; Power, P. P. (1983). "Isolation and Crystal Structures of the Halide-Free and Halide-Rich Phenyllithium Etherate Complexes [(PhLi•Et2O)4] and [(PhLi•Et2O)3•LiBr]". Journal of the American Chemical Society. 105 (16): 5320–5324. doi:10.1021/ja00354a022.