수용액중 금속이온
Metal ions in aqueous solution수용액 또는 아쿠아 이온의 금속 이온은 물에 용해된 화학식2 [M(HO)]의 양이온입니다.nz+다양한 실험 방법에 의해 결정된 용해 수 n은 주기율표의 기간 3과 4에서 Li와+ Be에2+ 대해 4이고 대부분의 원소에 대해 6입니다.란타넘족과 악티니드족 아쿠아이온은 더 높은 용해도(종종 8~9개)를 가지고 있으며, 가장 높은 것은3+ Ac의 경우 11개로 알려져 있습니다.1차 용해 쉘에서 금속 이온과 물 분자 사이의 결합의 강도는 금속 이온의 전하인 z에 따라 증가하고 이온 반경인 r이 증가함에 따라 감소합니다.아쿠아 이온은 가수분해가 가능합니다.첫 번째 가수분해 상수의 로그는 대부분의 아쿠아이온에 대해 z2/r에 비례합니다.
아쿠아 이온은 2차 용해 껍질에서 다른 물 분자와 수소 결합을 통해 연관됩니다.첫 번째 수화 쉘의 물 분자는 두 번째 용해 쉘의 분자 및 벌크 액체의 분자와 교환됩니다.첫 번째 껍질에 있는 분자의 체류 시간은 화학 원소들 사이에서 약 100 피코초에서 200년 이상까지 다양합니다.아쿠아 이온은 전기화학에서 두드러집니다.
금속 아쿠아이온 소개
아쿠아 양이온을 형성하는 요소 H 그 리 있다 B C N O F 네 나 Mg 알 시 P S 클 아르 K 카 Sc 티 V 씨알 음 Fe 코 니 CU Zn 가 Ge* ~하듯이 세 Br Kr Rb Sr Y Zr Nb 모 Tc 루 Rh 피디 아그 씨디 인 Sn Sb* 테 I 쎄 Cs 바 라 쎄 Pr Nd pm 스엠 에우 Gd Tb 다이 호 음.정말 Tm Yb 루 Hf 타 W 리 오스 Ir Pt 아우 Hg Tl Pb 바이 포* 앳* Rn Fr* 라* 아크 Th 파 U Np 푸 암 cm Bk Cf 에스* Fm* Md* 아니오* Lr* Rf Db Sg Bh 허스 Mt 디에스 Rg Cn Nh Fl 맥씨 Lv Ts 오그
- * 아쿠아이온 구조에 대한 실험 정보 없음
대부분의 화학 원소들은 금속성입니다.금속 원소의 화합물은 일반적으로 낮은 산화 상태에서 [M(HO2)]nz+ 화학식을 갖는 단순한 아쿠아 이온을 형성합니다.산화 상태가 높아지면 단순한 아쿠아 이온이 수소 이온을 잃어버리는 것을 해리하여 물 분자와 수산화물 또는 바나듐과 같은 산화물 이온을 모두 포함하는 복합체를 생성합니다.IV) 종 [VO(HO2)].52+산화가 가장 높은 상태에서는 과망간산(VII) 이온인 MnO와−
4 같은 옥시아니온만 알려져 있습니다.니오븀 및 탄탈륨과 같이 높은 산화 상태에서만 흔히 발견되는 몇 가지 금속 원소는 아쿠아 양이온을 형성하는 것으로 알려져 있지 않으며, 금속-비금속 경계 근처에서는 비소 및 텔루륨이 가수 분해된 종으로만 알려져 있습니다.주석과 안티몬과 같은 일부 원소들은 분명히 금속이지만, 가장 높은 산화 상태에서 공유 화합물만을 형성합니다: 그들의 아쿠아시스는 낮은 산화 상태로 제한됩니다.[1]게르마늄은 금속이 아닌 반도체이지만 아쿠아티온을 형성하는 것으로 보이며, 수소는 기체임에도 불구하고 금속과 같은 아쿠아티온을 형성합니다.실험 데이터의 부족으로 인해 트락시니드가 회색으로 변했습니다. 비슷한 문제가 양이온을 형성하는 스타틴에 영향을 미치지만 그것이 아쿠아티온인지는 알 수 없습니다.일부 고방사능 원소의 경우 실험 화학이 수행되었으며, 주기성은 아쿠아 이온이 형성되었음을 시사하지만, 그러한 추정 아쿠아 이온의 구조에 대한 실험 정보는 없습니다.


수용액에서 금속 이온에 직접적으로 붙어 있는 물 분자는 첫 번째 또는 1차 용해 껍질로도 알려진 첫 번째 배위구에 속한다고 합니다.물 분자와 금속 이온 사이의 결합은 산소 원자가 두 전자를 결합에 기부하는 datative 공유 결합입니다.각각의 조정된 물 분자는 다른 물 분자에 수소 결합에 의해 부착될 수 있습니다.후자는 두 번째 조정 영역에 존재한다고 합니다.두 번째 배위구는 전하가 1 또는 2인 이온에 대해 잘 정의된 개체가 아닙니다.묽은 용액에서 그것은 물 분자 사이에 불규칙한 수소 결합 네트워크가 있는 물 구조로 합쳐집니다.[2]양이온에 대한 높은 전하는 첫 번째 용해 껍질에 있는 물 분자를 양극화시켜서 두 번째 껍질에 있는 분자와 충분히 강한 수소 결합을 형성하여 더 안정한 실체를 형성합니다.[3]
금속-산소 결합의 강도는 다양한 방법으로 추정할 수 있습니다.수화 엔탈피는 비록 간접적으로 실험적인 측정에 기반을 두고 있지만, 가장 신뢰할 수 있는 측정입니다.값의 척도는 임의로 선택한 0에 기초하지만, 두 금속의 값 간의 차이에는 영향을 미치지 않습니다.다른 측정에는 M-O 진동 주파수와 M-O 결합 길이가 포함됩니다.M-O 결합의 강도는 전하에 따라 증가하는 경향이 있고 금속 이온의 크기가 증가함에 따라 감소하는 경향이 있습니다.사실 수화 엔탈피와 이온 반지름에 대한 전하 제곱의 비율 z2/r 사이에는 매우 좋은 선형 상관관계가 있습니다.[4]용액 내 이온의 경우 섀넌의 "유효 이온 반경"이 가장 많이 사용되는 척도입니다.[5]
첫 번째와 두 번째 용해 껍질에 있는 물 분자는 서로 교환할 수 있습니다.교환 속도는 금속과 산화 상태에 따라 매우 다양합니다.금속 아쿠아 이온은 항상 용해된 음이온에 의해 용액에 동반되지만 양이온 용해에 대해 알려진 것보다 음이온 용해에 대해 알려진 것이 훨씬 적습니다.[6]
아쿠아 이온의 특성에 대한 이해는 액체 암모니아, 메탄올, 디메틸 포름아미드 및 디메틸 설폭사이드와 같은 혼합 용매[7] 및 비수 용매에 용해된 양이온의 특성에 대한 정보를 가짐으로써 도움이 됩니다.[8]
자연발생
대부분의 자연수역에는 아쿠아이온이 존재합니다.[9]Na+, K+, Mg2+, Ca는2+ 바닷물의 주요 성분입니다.
많은 다른 아쿠아 이온들은 ppm부터 ppt까지의 농도로 바닷물에 존재합니다.[9]혈중 나트륨, 칼륨, 마그네슘, 칼슘의 농도는 바닷물의 농도와 비슷합니다.혈액은 또한 철과 아연과 같은 필수 요소의 농도가 낮습니다.스포츠 음료는 등방성으로 설계되었으며 땀으로 손실되는 미네랄도 포함되어 있습니다.
마그네슘과 칼슘 이온은 가정용 물의 일반적인 구성 성분으로 각각 영구적인 경도와 일시적인 경도를 담당합니다.그것들은 종종 미네랄 워터에서 발견됩니다.
실험방법
용액 내 이온의 특성에 대한 정보는 사용되는 실험 방법의 특성에 따라 다릅니다.어떤 방법들은 양이온의 특성을 직접적으로 드러내기도 하고, 다른 방법들은 양이온과 음이온 모두에 의존하는 특성을 드러내기도 합니다.어떤 방법들은 정적인 성질의 정보를 제공하고, 평균적인 성질의 스냅샷의 일종이며, 다른 방법들은 해결책의 역학에 대한 정보를 제공합니다.
핵자기공명(NMR)
NMR 시간 척도에서 물 교환 속도가 느린 이온은 첫 번째 용해 껍질에 있는 분자와 다른 물 분자에 대해 별도의 피크를 제공합니다.용해 수는 피크 면적의 비율로 구합니다.여기서 이것은 첫 번째 용해 껍질에 있는 물 분자의 수를 가리킵니다.두 번째 용해 껍질의 분자는 용매 분자와 빠르게 교환하여 물 자체의 화학적 이동 값에서 작은 변화를 일으킵니다.이 방법의 주된 단점은 음이온과 이온쌍 형성의 위험과 함께 상당히 농축된 용액을 필요로 한다는 것입니다.
| 이온 | 베2+ | Mg2+ | 알3+ | 가3+ | 인3+ | Fe2+ | 코2+ | 니2+ | Zn2+ | Th4+ |
|---|---|---|---|---|---|---|---|---|---|---|
| 번호 | 4 | 6 | 6 | 6 | 6 | 6 | 6 | 6 | 6 | 9 |
| 핵 | 1HO | 1ㅇ | 1ㅇ | 1HO | 1ㅇ | 17오 | 1ㅇ | 1HO | 1ㅇ | 1ㅇ |
X선 회절(XRD)
아쿠아 이온을 포함하는 용액은 같은 이온을 포함하는 결정에 존재할 수 있는 장거리 순서를 갖지 않지만, 단거리 순서가 존재합니다.용액에 대한 X선 회절은 금속 이온 및 금속-산소 거리의 배위 번호를 유도할 수 있는 방사형 분포 함수를 생성합니다.높은 전하를 가진 이온을 사용하면 두 번째 용해 껍질에 대한 정보를 얻을 수 있습니다.[11][12]
이 기술은 상대적으로 집중화된 솔루션을 사용해야 합니다.X선은 전자에 의해 산란되므로 산란력은 원자 번호에 따라 증가합니다.이것은 수소 원자를 X선 산란에 거의 보이지 않게 만듭니다.
큰3+ 각도의 X-선 산란은 Cr 및 Rh와3+ 같은 3가 이온으로 두 번째 용해 쉘을 특성화하기 위해 사용되었습니다.Cr의3+ 두 번째 수화 쉘은 평균 402±20 pm 거리에서 13±1 분자를 가지는 것으로 확인되었습니다.이것은 첫 번째 수화 껍질의 모든 분자가 두 번째 껍질의 두 분자에 수소 결합되어 있다는 것을 의미합니다.[13]
중성자 회절
중성자에 의한 회절은 또한 방사형 분포 함수를 제공합니다.X선 회절과는 달리 중성자는 원자핵에 의해 산란되고 원자 번호와는 관계가 없습니다.[14]실제로, 같은 원소의 서로 다른 동위 원소가 광범위하게 다른 산란력을 가질 수 있다는 사실을 이용할 수 있습니다.고전적인 실험에서는 Ni, Ni, Cl 및 Cl 동위원소의 조합을 사용하여 4개의 염화니켈 용액에 대한 측정을 수행하여 양이온 및 음이온 용해에 대한 매우 상세한 그림을 산출했습니다.[15]여러 금속 염에 대한 데이터는 염 농도에 약간의 의존성이 있음을 보여줍니다.
| 소금. | LiCl | CaCl2 | NiCl2 | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 염의 몰농도 | 27.77 | 9.95 | 3.57 | 4.49 | 2.80 | 1.0 | 3.05 | 0.85 | 0.46 | 0.086 |
| 양이온수화번호† | 2.3 (2) | 3.0 (5) | 5.5 (3) | 6.4 (3) | 7.2 (2) | 10.0 (6) | 5.8 (2) | 6.6 (5) | 6.8 (8) | 6.8 (8) |
| θ / | 75 (5) | 52 (5) | 40 (5) | 34 (9) | 34 (9) | 38 (9) | 42 (8) | 27 (10) | 17 (10) | 0 (20) |
| 소금. | Ni(ClO4)2 | Cu(ClO4)2 | Fe(NO3)3 | NdCl3 | DyCl3 |
|---|---|---|---|---|---|
| 염의 몰농도 | 3.80 | 2.00 | 2.0 | 2.85 | 2.38 |
| 양이온수화번호† | 5.8 (2) | 4.9 (3) | 5.0 (2) | 8.5 (2) | 7.4 (5) |
| θ / | 42 (8) | 38 (6) | 22 (4) | 24 (4) | 17 (3) |
- 괄호 안의 †그림은 M-OH2 결합과 물 분자의 평면 사이의 값의 마지막 유의한 각도에 대한 표준 편차입니다.‡
이들 데이터의 대부분은 양이온 또는 음이온의 1차 수화 구에 없는 물 분자가 매우 적은 농축 용액을 의미하며, 이는 접촉 이온 쌍이 없더라도 농도에 따른 용해 수의 변화의 일부를 설명할 수 있습니다.각도 θ은 물 분자가 아쿠아 이온의 평면에 대해 기울어진 각도를 제공합니다.이 각도는 1차 용해 쉘과 2차 용해 쉘에서 물 분자 사이에 형성되는 수소 결합에 영향을 받습니다.
측정된 해 수치는 전체 해에 대한 시간 평균값입니다.측정된 1차 용해 수가 분수일 때, 서로 평형 상태에 있는 적분 용해 수를 가진 두 개 이상의 종이 존재합니다.이것은 실험 오차 내에 있는 정수인 해의 수에도 적용됩니다.예를 들어, 염화 리튬 용액의 용해 수 5.5는 농도가 동일한 두 개의 서로 다른 아쿠아 이온이 존재하기 때문으로 해석될 수 있습니다.
- [Li(H2O)6]+ ⇌ [Li(H2O)5]+ + H2O
다른 가능성은 용해된 양이온과 음이온 사이에 상호작용이 있어서 이온쌍을 형성하는 것입니다.이는 농축된 염 용액을 측정할 때 특히 적절합니다.예를 들어, 염화 리튬 용액에 대한 용해 수 3은 평형에 의한 것으로 해석될 수 있습니다.
- [Li(H2O)4]+ + Cl− ⇌ [Li(H2O)3Cl] + H2O
이온쌍을 전적으로 지지하는 것입니다.
진동 스펙트럼
적외선 스펙트럼과 라만 스펙트럼은 금속 아쿠아 이온에서 M-O 스트레칭 빈도를 측정하는데 사용될 수 있습니다.라만 분광법은 물의 라만 스펙트럼이 약한 반면 물의 적외선 스펙트럼은 강하기 때문에 특히 유용합니다.진동 주파수의 해석은 팔면체 및 사면체 이온에서 라만 스펙트럼에서 측정된 대칭적인 진동과 적외선 스펙트럼에서 측정된 대칭적인 진동의 두 가지 진동의 존재로 인해 다소 복잡합니다.
| 금속 이온 | 베2+ | Mg2+ | 음2+ | Fe2+ | 니2+ | CU2+ | Zn2+ | Hg2+ | 알3+ | 가3+ | 인3+ |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 파수/cm−1 | 530-543 | 360-365 | 395 | 389 | 405 | 440 | 385-400 | 380 | 520-526 | 475 | 400 |
진동주파수와 힘 상수의 관계는 간단하지 않지만, 이들 데이터에서 얻을 수 있는 일반적인 결론은 M-O 결합의 강도는 이온 전하가 증가하고 이온 크기가 감소함에 따라 증가한다는 것입니다.용액 내 아쿠아 이온의 M-O 스트레칭 빈도는 공지된 구조의 결정에서 그의 상대물과 비교될 수 있습니다.진동수가 매우 비슷하다면 금속 이온의 배위수는 고체 상태의 화합물에 있는 것과 용액에서 같다고 결론지을 수 있습니다.
동적 방법
전도도, 전기이동도, 확산도와 같은 데이터는 용액을 통한 이온의 이동과 관련이 있습니다.이온이 용액을 통과할 때 첫 번째와 두 번째 용해 껍질을 모두 가지고 가는 경향이 있습니다.따라서 동적 특성에서 측정된 해 수치는 정적 특성에서 얻은 해 수치보다 훨씬 높은 경향이 있습니다.
동역학적 방법으로[19] 측정한 수화수
리+ 나+ Cs+ Mg2+ 카2+ 바2+ Zn2+ 씨알3+ 알3+ 이온수송번호 13-22 7-13 4 12-14 8-12 3-5 10-13 이온 이동도 3-21 2-10 10-13 7-11 5-9 10-13 확산 5 3 1 9 9 8 11 17 13
용해도 수 및 구조
수소

수소는 금속이 아니지만, 그들과 마찬가지로 화학 반응에서 원자가 전자를 잃어 양이온+ H를 형성하는 경향이 있습니다.수용액에서, 이것은 물 분자에 즉시 붙어서 일반적으로 HO로3+ 상징되는 종(때로는 느슨하게 H로+ 표기되기도 함)을 형성합니다.[20]이러한 수화는 본질적으로 [H(OH2)]n+[21]로 간주될 수 있는 양이온을 형성합니다.
물에서의 H의+ 용해는 완전히 특성화되지 않았으며 많은 다양한 구조가 제안되었습니다.잘 알려진 두 가지 구조는 준델 양이온과 아이겐 양이온입니다.아이겐 용해 구조는 수소 이온을 중심에 두고 있습니다.하이드로늄이 세 개의 이웃한 물 분자에 강하게 수소 결합된9 HO+4 복합체.준델 HO5+2 복합체에서 양성자는 대칭적인 수소 결합에서 두 물 분자에 의해 동등하게 공유됩니다.[22][23][24][25][26]
알칼리금속
물 속의 수화된 리튬 양이온은 아마도 4면체이고 4배위일 것입니다.[27]팔면체 나트륨 이온의 1차 용해 구에는 아마도 6개의 물 분자가 있을 것입니다.[27][28]칼륨은 7좌표이고 루비듐과 세슘은 아마도 8좌표의 정사각형 반원형일 것입니다.[27]프랑슘에 대한 자료가 없습니다.
알칼리 토금속
| [Be(H2O)4]2+ | [Mg(H2O)6]2+ | Ca2+(aq) | Sr2+(aq) | Ba2+(aq) | |
|---|---|---|---|---|---|
| M-O 거리(pm) | 167 | 209 | 242§ | 263§ | 281§ |
| {\ \ H}} 용액(kJ mol) | 2494 | 1921 | 1577 | 1443 | 1305 |
- § 고체 결정 구조에 대한 데이터에서 추론한 값
베릴륨 양이온 [Be(HO2)]42+은 사면체 BeO4 코어를 갖는 매우 잘 정의된 1차 용해 쉘을 가지고 있습니다.[29]마그네슘의 경우, [Mg(HO2)]62+ 또한 팔면체 MgO6 코어를 가진 잘 특징지어지는 종입니다.[29]칼슘의 상황은 더 복잡합니다.중성자 회절 데이터는 농도에 크게 의존하는 염화칼슘, CaCl에2 대한 용해 수치를 제공했습니다: 1 mol·dm에서−3 10.0±0.6, 2.8 mol·dm에서−3 6.4±0.3으로 감소했습니다.용해 엔탈피는 이온 반경이 증가함에 따라 감소합니다.다양한 고체 수화물은 정방형 반프리즘과 십이면체 기하학에서 8배율로 알려져 있습니다.[30]물에서 칼슘과 스트론튬은 아마도 8좌표 사각형 반프리즘일 것입니다 (칼슘에 대한 7좌표는 현재 배제할 수 없지만).바륨은 잘 연구되어 있지 않습니다: 8이나 9의 배위수를 가지고 있는 것 같습니다.라듐의 이론적 시뮬레이션은 라듐의 수분이 10좌표임을 암시합니다.[27]
3족 금속, 란탄 및 악티니드
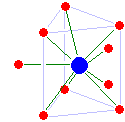
스칸듐(III)과 이트륨(III)은 모두 8좌표이지만 서로 다른 구조를 가지고 있습니다. 스칸듐은 특이한 장애를 가진 삼각기둥 구조를 가지고 있고(한 개의 캡 위치가 비어 있음), 이트륨은 정사각형의 반원기둥입니다.루테튬()III)는 삼각형의 삼각형이지만 심각한 물 부족을 가지고 있습니다. 캡핑 물 분자 중 하나는 나머지 분자보다 루테튬에 상당히 가깝고 평균 배위수는 9가 아닌 8.2에 불과합니다.이온반경에 기초하여, 로렌슘(III)는 아마도 물 부족이 없는 9좌표 장애 삼각형 기둥일 것입니다.[27]
3가 란탄 이온은 란탄으로부터 루테튬까지 크기가 꾸준히 감소하며,[31] 이를 란탄 수축이라고 합니다.란탄에서 디스프로슘에 이르기까지 협응 수는 삼각형 각형 구조로 9로 유지되지만, 사마륨에서 시작하여 캡핑 물 분자는 더 이상 동일하게 강하게 경계되지 않습니다.홀뮴의 경우 루테튬을 통해 수분 부족이 나타나고 루테튬(III)에서 평균 배위수가 8.2로 떨어집니다.양이온의 작은 크기와 물 부족에도 불구하고 구성이 유지되는데, 아마도 강한 수소 결합 때문일 것입니다.[32]유로피움()II)는 7좌표이며, 세륨(IV)는 산소가 결합된 이량체 [(HO2)7Ce-O-Ce(OH2)]76+[27]에 가수분해됩니다.
액티늄(III)은 수용액에서 11좌표입니다.토륨()IV)는 9좌표 삼변삼각기둥이며, 다른 악티니드()에 대해서도 마찬가지라고 가정합니다.IV) 수용액 중의 양이온(고체 구성이기도 함).현재까지 악티니드(III)에 대한 배위수 및/또는 구조에 대한 연구는 캘리포니아에만 적용됩니다.[32][33]하지만 로렌시움 이래로III)는 디스프로슘(dysprosium)과 유사한 이온 반경을 갖습니다.III), 우라늄(III)에서 로렌슘(III)는 모두 9개의 좌표 장애 삼각형 각형이며 캡핑 위치가 완전히 차지합니다.[32]페르미움()에 대한 데이터가 없습니다.II), mendelevium(II), 또는 노벨륨()II).
4-12족금속

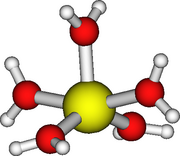
+2 및 +3 산화 상태에 있는 이들 금속의 이온은 6의 용해 수를 갖습니다.크롬()의 아쿠아이온을 제외하고는 모두 정팔면체 구조를 갖습니다.II) 및 구리(II) Jahn-Teller 왜곡의 대상이 되는 것들.구리의 경우, 두 축 Cu-O 거리는 238 pm인 반면, 네 적도 Cu-O 거리는 고체 상태에서 195 pm입니다.[35]그러나, Cu의2+ 수용액에 대한 용해수가 5 또는 6인지는 명확하지 않으며, 서로 상반된 실험 보고가 있습니다.[32]수용액 중 코발트(III)의 구조는 확인되지 않았습니다.[27]구리(I)는 4좌표 사면체로 추정됩니다.[27]
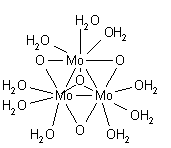
아연(II)과 카드뮴()에 대해서는 정팔면체 구조를 갖는 6의 해가 잘 설정되어 있습니다.II) 묽은 용액에서.농축 용액에서 Zn2+ 이온은 4좌표, 사면체 구조를 채택할 수 있지만, 이온 쌍체 및/또는 가수분해의 가능성 때문에 증거는 확실하지 않습니다.[36]수은의 용해수()II)는 6일 가능성이 가장 높습니다.[37] 아연(II)은 6좌표 팔면체이지만 카드뮴(II)는 6-좌표와 7-좌표 사이에서 균형을 이룰 수 있습니다.수성()II)는 의사-얀-텔러-왜곡 팔면체입니다.[27]고체 화합물에서 발견되는 수은(I) 이온의 비스쿠아 구조인 [(HO2)-Hg-Hg-(OH2)]+[38]는 각각의 수은에 배위된 3개의 물 분자가 왜곡된 사면체 배열을 완성하는 용액에서 발견되는 것과 같지 않습니다.[27]금속과 금속 결합이 있는 또 다른 아쿠아종은 몰리브덴입니다.II) [(HO)Mo ≣Mo(HO)]로 공식화된 종.각 몰리브덴은 클로로 복합체 [MoCl28]의 알려진 구조와 유사한 구조로 사각 평면 배열로 4개의 물 분자로 둘러싸여 있습니다.4−[40]
두 번째와 세 번째 전이계열에는 전이금속의 2가 이온과 3가 이온이 몇 개 존재합니다: 루테늄(II) 및 (III), 로듐(III), 이리듐(III)은 모두 팔면체이며, (루테늄과 이리듐의 구조는 고체 상태에서만 조사되었으나, 수용액 상에서는 동일한 것으로 추정됨).[27]몰리브덴(III)은 의심스러우며(수용액에서 강하게 가수분해될 수 있음), 몰리브덴(II) 각 몰리브덴이 4개의 물 분자에 결합하면서 이량체가 생깁니다.[27][32]팔라듐()II) 및 백금(II) 아쿠아 이온은 원래 정방형 평면이라고 생각되었지만 실제로는 강하게 정방형으로 길쭉한 정방형의 정방형 피라미드 또는 팔면체이며 추가로 1개 또는 2개의 물 분자가 극도로 느슨하게 결합되어 있습니다.[27]은(I)의 구조는 논쟁의 여지가 있습니다: 그것은 2개의 좌표일 수도 있고, 두 개의 매우 느슨하게 묶인 물 분자와 4개의 좌표일 수도 있습니다.[27]금(III)은 고체 상태에서 4좌표 정사각형 평면이며, 수용액에서도 동일한 구조를 갖는 것으로 가정됩니다.[27]2차 얀-텔러 효과로 인해 공유 경향이 강한 저좌표 금속의 경우 왜곡이 발생합니다.그러나 산화 상태가 4인 경우 가수분해되지 않은 유일한 종은 정사각형의 반원형 지르코늄(IV), [Zr(HO2)]84+ 및 하프늄(IV), [Hf(HO2)]84+뿐이며, 심지어는 가수분해가 일어나기 쉽습니다.[32] 이러한 지르코늄 양이온은 강산의 Zr의 희석IV 용액에서만 형성됩니다.실제로 지르코늄과 하프늄에서 만나는 양이온 종은 다핵종입니다.[41]
13-17족금속
알루미늄(III) 아쿠아이온인 [Al(HO2)]63+은 용액과 고체 상태에서 매우 잘 특징지어집니다.AlO6 코어는 팔면체 대칭, 점군 Oh.갈륨(III), 인듐(III), 탈륨(III)의 아쿠아 이온 또한 6좌표 팔면체입니다.[27]탈륨(I)의 배위기하학은 실험적으로 알려져 있지 않지만 배위구에 큰 틈이 있는 반방향일 가능성이 높습니다.[27]
주석(II)은 주석(II)의 배위구에 매우 큰 갭을 가진 3좌표 반방향입니다[42][43].[27]납의 수화수()II)는 잘 확립되어 있지 않으며 5시에서 7시 사이에 있을 수 있습니다.[27]실제로 이 양이온들은 다핵인 경향이 있습니다.[44]비스무트(III)는 수용액에서 8좌표 사각형 반원기둥이지만 고체 상태에서는 9좌표 삼각기둥입니다.[27]
금속-비금속 경계선 근처에 있는 원소들의 아쿠아 이온은 매우 쉽게 가수분해되며 실험으로 쉽게 연구될 수 없습니다.게르마늄에 대한 증거가 있습니다.II) 과염소산 매개체에서 아쿠아 이온이 형성될 수 있습니다.[45]그러나 이는 게르마늄(IV)으로 쉽게 산화됩니다.[44]안티몬(III) 아쿠아 이온은 또한 농축 산에 있는 안티몬(III)의 희석 용액에도 존재할 수 있지만, 이에 대한 직접적인 증거는 없습니다.[46]양자역학적 계산은 게르마늄(II) 및 안티몬(III) 아쿠아 이온이 존재해야 하며 높은 전하 밀도와 입체화학적으로 활성인 단독 쌍으로 인해 첫 번째 배위구의 극심한 왜곡을 보일 것입니다.게르마늄()의 경우II), 첫 번째 껍질은 보통 6의 용해 수를 갖는 것으로 계산되지만, 숫자 4-7도 가능하고 껍질은 중심 Ge와2+ 다른 거리를 가지고 두 개로 쪼개집니다.[47]안티몬(III)에 대한 유사한 조사 결과, 첫 번째 배위구가 각각 4개의 물 분자로 두 개의 수화 반구로 분할되면서 용해 수가 8로 나타났습니다.[48]폴로늄()에 대한 계산IV) 8~9 사이의 용해 수치를 나타냄.[49]
비소(III)는 가수분해된 종만을 형성하도록 계산됩니다.[50]물속의 안정한 양이온 비소(III)종은 [As(OH)]2+[51]로 계산됩니다.산화 상태 +4에서는 게르마늄(IV), 주석(IV), 납(IV)에 대해서만 가수분해가 예상됩니다.[50]양이온 텔루륨()IV)는 [Te(OH)]3+[52]로 나타납니다.
양이온성 아스타틴(I) 종은 산성 용액의 미량 규모 실험에서 추론되며, 때로는+ At를 상징하기도 하지만, 그 구조는 밝혀지지 않았습니다.[53]
비록 탈륨(I), 게르마늄(II), 주석(II), 납(II), 안티몬(III)은 단쌍의 영향을 받지만 비스무트(III)의 경우에는 그렇지 않습니다.[32]
옥소아쿠아 양이온
3보다 높은 산화 상태의 일부 원소들은 안정적이고 물이 들어있는 옥소 이온을 형성합니다.잘 알려진 예로는 바나딜()이 있습니다.IV) 및 우라닐(VI) 이온.이들은 다음과 같은 가상 반응에서 특히 안정적인 가수분해 생성물로 간주될 수 있습니다.
- [V(HO)] → [VO(HO)] + 2H
바나듐은 1개의 산화이온과 5개의 물 분자로 이루어진 왜곡된 팔면체 환경(점군 C4v)을 가지고 있습니다.[54]타이타닐, TiO는2+ 유사한 구조를 가지고 있습니다.[32]바나듐(V)은 pH 2 미만에서 다이옥소 이온 [VO2(HO2)]4+으로 존재하는 것으로 여겨지지만, 이 이온에 대한 증거는 고체 상태에서 VO+
2 단위를 갖는 것으로 나타난 옥살레이트 복합체와 같은 복합체의 형성에 달려 있습니다.[55]크롬()IV) 바나듐 이온과 유사한 이온 [CrO(HO2)]52+이 간접적인 증거에 근거하여 제안되었습니다.[56]
우라닐 이온인 UO는2+
2 트랜스 구조를 가지고 있습니다.아쿠아이온 UO2+
2(aq)는 오각형 쌍곡선 구조인 점군 D에서5h O-U-O 축에 수직인 평면에 5개의 물 분자를 가지고 있습니다.넵투닐과 플루토닐은 같은 구조를 가지고 있습니다.악티니드(V) 구조에 대해서는 알려진 바가 없습니다.[27]
열역학
이러한 맥락에서 열역학의 주요 목표는 수화 엔탈피 및 수화 엔트로피와 같은 단일 이온 열역학 양의 추정치를 도출하는 것입니다.이 양들은 반응과 관련이 있습니다.
- M (가스) + 용매 → M (용액중)
모든 측정에서 양이온과 음이온을 모두 포함하는 염 용액을 사용하기 때문에 이 반응에 대한 엔탈피는 직접 측정할 수 없습니다.대부분의 실험적 측정은 양이온과 음이온 용해 엔탈피의 합을 제공하는 물에 소금이 용해될 때 진화하는 열과 관련이 있습니다.그런 다음, 같은 양이온을 갖는 서로 다른 음이온과 같은 음이온을 갖는 서로 다른 양이온에 대한 데이터를 고려함으로써 임의의 0에 대한 단일 이온 값을 유도합니다.
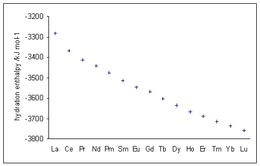
단일이온표준수화엔탈피/kJ몰−1[57]
리+
-514.6베2+
-2487.0나+
-404.6Mg2+
-1922.1알3+
-4659.7K+
-320.9카2+
-1592.4Sc3+
-3960.2... 가3+
-4684.8Rb+
-296.2Sr2+
-1444.7Y3+
-3620.0... 인3+
-4108.7Sn2+
-1554.4Cs+
-263.2바2+
-1303.7라3+
-3282.8... Tl3+
-4184.0Pb2+
-1479.9
다른 값으로는 Zn2+ -2044.3, Cd2+ -1805.8 및 Ag+ -475.3 kJ mol이−1 있습니다.
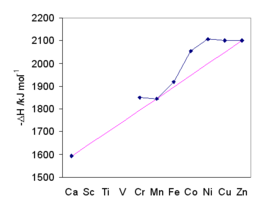
수화 엔탈피와 전하 제곱의 비율 z 대 M-O 거리 r 사이에는2eff 우수한 선형 상관관계가 있습니다.[58]
전이 금속의 값은 결정장 안정화에 영향을 받습니다.일반적인 경향은 Ca2+, Mn2+ 및 Zn을2+ 통과하는 마젠타 라인에 의해 나타나는데, 이는 팔면체 결정장에서 안정화가 이루어지지 않습니다.수화 에너지는 크기가 줄어들면 증가합니다.수정장 쪼개기는 아쿠아이온의 안정성을 더욱 높여줍니다.Ni에서2+ 최대 결정장 안정화 에너지가 발생합니다.예측과 수화 엔탈피의 일치는 결정장 이론의 일반적인 수용에 대한 하나의 근거를 제공했습니다.[59]
3가 란타넘족 이온의 수화 엔탈피는 란타넘족 수축으로 알려진 이온 반지름의 감소와 함께 원자 번호 증가에서 점점 더 음의 값을 보여줍니다.
단일 이온 수화 엔트로피가 유도될 수 있습니다.값은 다음 표에 나와 있습니다.값이 음수가 될수록 아쿠아이온을 형성하는데 있어 순서가 더 많아집니다.무거운 알칼리 금속이 다소 작은 엔트로피 값을 가지고 있다는 것은 첫 번째와 두 번째 용해 껍질 모두 다소 분명하지 않다는 것을 암시합니다.
25 °C/J degmol에서−1−1[60] 단일 이온 표준 수화 엔트로피
리+
-118.8나+
-87.4Mg2+
-267.8알3+
-464.4K+
-51.9카2+
-209.2... 가3+
-510.4Rb+
-40.2Sr2+
-205.0... 인3+
-426.8Cs+
-36.8바2+
-159.0라3+
-368.2...
아쿠아이온의 가수분해
아쿠아이온의 가수분해와 관련된 평형을 보는 두 가지 방법이 있습니다.해리 평형을 고려할 때
- [M(HO)] - H ⇌ [M(HO)(OH)]
물 분자를 제외한 가수분해 생성물의 활성은 다음과 같이 주어집니다.
대안은 평형을 착화 또는 치환 반응으로 쓰는 것입니다.
- [M(HO)] +OH ⇌ :[M(HO)(OH)] +HO
어떤 경우에
수소와 수산화 이온의 농도는 물의 자가 이온화와 관련이 있으며, K = {H} {OH}이므로 두 평형 상수는 다음과 같이 관계가 있습니다.
실제로 첫 번째 정의는 평형 상수가 수소 이온 농도 측정치로부터 결정되기 때문에 더 유용합니다.일반적으로.
일반성을 위해 요금은 생략되고 활동은 농도로 대체되었습니다.beta *}은는) 누적 가수분해 상수입니다.
용액에서 일어나는 가수분해 반응의 모델링은 대개 전위차(pH) 적정 데이터에서 평형 상수를 결정하는 것을 기반으로 합니다.이 과정은 여러 가지 이유로 인해 단순한 것과는 거리가 멀었습니다.[61]때로는 용액 속의 종들이 X선 결정학에 의해 확인된 염과 그 구조로서 침전될 수 있습니다.다른 경우, 침전된 염은 용액에 있는 것으로 가정된 것과 관련이 없습니다. 특정 결정성 물질이 용액에 낮은 용해도와 매우 낮은 농도를 모두 가질 수 있기 때문입니다.
1차 가수분해 상수
아쿠아이온에서 양성자 1개를 제거하기 위한 가수분해 상수 K의1,-1 로그
- [M(H2O)n]z+ - H+ ⇌ [M(H2O)n-1(OH)](z-1)+
- [[M(OH)]] = K [M] [H]
는 M-O 거리에 대한 전하 비율 z/d와 선형 관계를 보여줍니다.이온은 네 그룹으로 나뉩니다.직선의 기울기는 모든 그룹에서 동일하지만 절편 A는 다릅니다.[62]
log K = A + 11.0 z/d
양이온 A Mg2+, Ca2+, Sr2+, Ba2+
Al3+, Y3+, La3+−22.0±0.5 리+,나+,케이+
Be2+, Mn2+, Fe2+, Co2+, Ni2+, Cu2+, Zn2+, Cd2+
Sc3+, Ti3+, V3+, Cr3+, Fe3+, Rh3+, Ga3+, In3+
Ce4+, Th4+, Pa4+, U4+, Np4+, Pu4+,−19.8±1 Ag+, Tl+
Pb2+
Ti3+, Bi3+,−15.9±1 Sn2+, Hg2+, Sn2+, Pd2+ ca. 12
크기와 전하에서 가수분해에 가장 강한 양이온은 단단한 전이 전 금속 이온 또는 란탄 이온입니다.약간 내성이 적은 그룹은 전이 금속 이온을 포함합니다.세 번째 그룹은 대부분 전이 후 금속의 소프트 이온을 포함합니다.전하와 크기에 대해 가수분해되는 경향이 가장 강한 이온은2+ Pd, Sn2+ 및 Hg입니다2+.[62]
첫 번째 가수분해 단계의 표준 엔탈피 변화는 일반적으로 순수한 물의 해리 변화와 크게 다르지 않습니다.결과적으로 치환 반응에 대한 표준 엔탈피 변화
- [M(HO)] +OH ⇌ :[M(HO)(OH)] +HO
0에 가깝습니다.이것은 일반적으로 수산화 이온과 같은 단단한 양이온과 단단한 음이온 사이의 반응입니다.[63]이것은 표준 엔트로피 전하가 표준 자유 에너지 변화와 그에 따른 평형 상수에 주요한 기여를 한다는 것을 의미합니다.
이온 전하의 변화는 아쿠아 이온이 덜 고전하된 수산화물 복합체보다 용액에 더 큰 순서 효과를 가지기 때문에 그 효과에 책임이 있습니다.
다중 가수분해 반응


베릴륨의 가수분해는 다중 가수분해 반응의 전형적인 많은 특징들을 보여줍니다.가교 수산화물 이온을 갖는 다핵종을 포함한 다양한 종의 농도는 불용성 수산화물의 침전까지 pH의 함수로 변화합니다.베릴륨 가수분해는 [Be(HO2)(3OH)]+의 농도가 너무 낮아 측정할 수 없다는 점에서 특이합니다.대신 고체 염에서 구조가 확인된 삼량체([Be3(HO2)(6OH3))3+가 형성됩니다.다핵종의 형성은 분자 내 전하 밀도의 감소에 의해 전체적으로 구동됩니다.베릴륨 이온의 국소 환경은 [Be(HO2)(2OH)]2+에 가깝습니다.유효 전하의 감소는 전하 센터에서 순서의 엔트로피가 감소하는 형태로 자유 에너지를 방출합니다.[64]
일부 다핵 가수분해 생성물[65]
종식 양이온 구조. M2(OH)+ Be2+, Mn2+, Co2+, Ni2+
Zn2+, Cd2+, Hg2+, Pb2+두 양이온 사이의 단일 수산화물 다리 M2(OH)(2z-2)+
2Cu2+, Sn2+
Al3+, Sc3+, Ln3+, Ti3+, Cr3+
Th4+
VO2+, UO2+
2, NpO2+
2, PuO2+
2두 양이온 사이의 이중 수산화교 M
3(OH)3+
3베2+, 흐그2+ M과n+ OH− 그룹이 교대로 있는 6원 고리 M
3(OH)(3z-4)+
4Sn2+, Pb2+
Al3+, Cr3+, Fe3+, In3+M 및n+ OH− 그룹의 교대 정점이 있는 입방체, 하나의 정점이 누락됨 M
4(OH)4+
4Mg2+, Co2+, Ni2+, Cd2+, Pb2+ Mn+ 그룹과 OH− 그룹의 정점이 교대로 있는 입방체 M
4(OH)8+
8Zr4+, Th4+ 각 면에 이중 수산화교량을 배치한 M이온의n+ 정방형
[AlO134(OH)(24HO2)]127+로 공식화된 알루미늄의 가수분해 생성물은 매우 잘 특징지어지며 pH 5.4의 물 속에서 자연에 존재할 수 있습니다.[66]
아쿠아이온으로부터 두 양성자의 손실에 대한 전체적인 반응은 다음과 같이 쓸 수 있습니다.
- [M(HO)] - 2H ⇌ [M(HO)(OH)]
그러나 두 양성자의 손실에 대한 평형 상수는 평형에 동일하게 잘 적용됩니다.
- [M(HO)] - 2H⇌ [MO(HO)] + HO
물의 농도가 일정하다고 가정하기 때문입니다.이것은 일반적으로 적용됩니다. 어떤 평형 상수도 두 개의 하이드록실 이온이 있는 제품과 마찬가지로 산화물 이온이 있는 제품에서는 동일하게 유효합니다.두 가지 가능성은 고체 상태의 소금의 구조를 결정해야 구별할 수 있습니다.옥소 브리지는 금속 산화 상태가 높을 때 발생하는 경향이 있습니다.[67]예는 몰리브덴()에 의해 제공됩니다.IV) 착체 [MoO(HO)]는 삼각형의 각 가장자리에 산화물 브릿지와 세 개의 Mo 원자 모두에 브릿지를 주는 제4 산화물로 σ 결합에 의해 결합된 몰리브덴 원자의 삼각형이 있는 복합체 [MoO(HO)].
옥사니온
산화 상태 +5 이상에서는 금속의 옥소 아쿠아 이온이 매우 적습니다.오히려 수용액에서 발견되는 종은 단량체와 고분자 옥시아니온입니다.옥시아니온은 금속에 물 분자가 붙어 있지 않고 산화물 이온만 있는 가수분해의 최종 산물로 볼 수 있습니다.
교환동역학
아쿠아 이온의 제1 용해 쉘 내의 물 분자는 벌크 용매 내의 물 분자와 위치를 교환할 수 있습니다.일반적으로 속도 결정 단계는 해리 반응이라고 가정합니다.
- [M(HO)] → [M(HO)]* + HO
* 기호는 이것이 화학 반응에서의 전이 상태임을 나타냅니다.이 반응 속도는 아쿠아이온의 농도 [A]에 비례합니다.
비례 상수인 k를 온도 T에서 1차 속도 상수라고 합니다.물 교환 반응 속도의 단위는 보통 몰디엠으로 계산됩니다−3−1.
이 반응의 반감기는 log2e / k와 같습니다.시간의 차원이 있는 이 수량은 농도와 무관하기 때문에 유용합니다.1/k의 양은 또한 시간 차원과 함께 반감기를 0.6932로 나눈 것과 같으며 거주 시간 또는 시간 상수로 알려져 있습니다.[69]
물 교환을 위한 거주 시간은 C의+ 경우 약 10초에서−10 Ir의3+ 경우 약 10초+10(200년 이상)까지 다양합니다.이온의 크기와 전하, 전이금속 이온의 경우 결정장 효과 등의 요인에 따라 달라집니다.매우 빠르고 매우 느린 반응은 연구하기 어렵습니다.물 교환에 관한 가장 많은 정보는 거주 시간이 약 1μs에서 1초 사이인 시스템에서 얻어집니다.활성화, δH 및 δS의 엔탈피 및 엔트로피는 온도에 따른 속도 상수의 변화를 관찰함으로써 얻을 수 있습니다.
물 교환을 위한 운동 매개변수(25°C에서): 2가 이온, M2+(aq)
있다 Mg V 씨알 음 Fe 코 니 CU Zn UO2 거주시간(μs) 0.001 2 0.00013 0.0032 0.0316 0.32 0.79 40 0.0005 0.032 1.3 δH(kJ몰) 43 69 13 34 32 33 43 23 δ(J degmol) 8 21 -13 12 -13 -17 -22 25
바나듐에서 니켈로의 체류시간의 일반적인 증가는 원자 번호의 증가에 따른 이온 크기의 감소를 반영하는 것이며, 이는 주기율표의 일반적인 추세이지만 란탄화물 수축의 경우에만 특정한 이름이 부여되었습니다.결정장 안정화 에너지의 영향은 주기적 경향에 중첩됩니다.
물 교환에 대한 운동 매개변수(25°C에서) - 3가 이온, M3+(aq)[70]
알 티 씨알 Fe 가 Rh 인 라 거주시간(μs) 6.3x106 16 2.0x1012 316 501 3.2x1013 50 0.050 δH(kJ몰) 11 26 109 37 26 134 17 δ(J degmol) 117 -63 0 -54 -92 59
용매 교환은 일반적으로 2가 이온보다 3가 이온에 대해 느립니다. 양이온 상의 전하가 높을수록 M-OH 결합이 강해지고, 결과적으로 해리 반응 단계인 [M(HO)] → [M(HO)] + HO에 대한 활성화 에너지가 높아지기 때문입니다.표의 값은 활성화 엔탈피와 엔트로피 요인 모두에 기인한다는 것을 보여줍니다.[71]
이온 [Al(HO2)]63+은 전자가 닫힌 쉘 전자 구성인 [Ne]3s3p에26 효과적으로 있기 때문에 치환 반응에 상대적으로 비활성이며 해리를 에너지-비용 반응으로 만듭니다.팔면체 구조를 가지는3+ Cr과3 전자적 구성도 상대적으로 비활성이며, 스핀이6 낮은 Rh와3+ Ir도3+ 마찬가지입니다.
복합체형성
금속 아쿠아 이온은 종종 복합체 형성에 관여합니다.반응은 다음과 같이 적을 수 있습니다.
- pM(aq) + qL → [ML]
실제로 이것은 금속 이온의 첫 번째 수화 껍질로부터 하나 이상의 물 분자가 리간드인 L로 대체되는 치환 반응입니다.이 복합체는 내부-구 복합체(inner-sphere complex)로 설명됩니다.[ML](p-q)+과 같은 복합체는 접촉 쌍(contaction pair)으로 설명될 수 있습니다.
두 번째 수화 쉘의 물 분자(들)가 리간드로 대체될 때, 복합체는 외부-구 복합체, 또는 용매-공유 이온 쌍이라고 합니다.용매-공유 또는 접촉 쌍의 형성은 이온 페어링이 농도 의존적이기 때문에, 염의 농축된 용액의 사용을 필요로 하는 방법에 의한 아쿠아 이온의 용해 수의 결정과 특히 관련이 있습니다.예를 들어, MgCl의2 용액에서 복합체 [MgCl]+의 형성을 생각해 보십시오.복합체의 형성 상수 K는 약 1이지만 이온 강도에 따라 달라집니다.[72]다소 약한 복합체의 농도는 10mM 용액의 경우 약 0.1%에서 1M 용액(1M = 1moldm)의 경우 약 70%로 증가합니다.
전기화학
반전지 평형 M + ze ⇌ M(s)의 표준 전극 전위는 가장 무거운 초우라늄 원소를 제외한 모든 금속에 대해 측정되었습니다.
커플 Mz+/[73][74][75][76][77]M에 대한 표준 전극 전위/V
H+
0리+
−3.040있다2+
−1.85나+
−2.71Mg2+
−2.372알3+
−1.66K+
−2.931카2+
−2.868Sc3+
−2.90... Zn2+
−0.751가3+
−0.53게2+
+0.1Rb+
−2.98Sr2+
−2.899Y3+
−2.37... 씨디2+
−0.403인3+
−0.342Sn2+
−0.136누군가3+
+0.15Cs+
−3.026바2+
−2.912루3+
−2.25... Hg2+
−0.854Tl3+
+0.73Pb2+
−0.126바이3+
+0.16포4+
+0.76Fr+
−2.9라2+
−2.8Lr3+
−1.96라3+
−2.52쎄3+
−2.32Pr3+
−2.34Nd3+
−2.32pm3+
−2.30스엠3+
−2.28에우3+
−1.98Gd3+
−2.27Tb3+
−2.27다이3+
−2.32호3+
−2.37어3+
−2.33Tm3+
−2.30Yb3+
−2.23아크3+
−2.18Th4+
−1.83파4+
−1.46U4+
−1.51Np4+
−1.33푸4+
−1.80암3+
−2.06cm3+
−2.07Bk3+
−2.03Cf3+
−2.01에스3+
−1.99Fm3+
−1.97Md3+
−1.65아니요3+
−1.20
1열 전이금속 이온에[73] 대한 표준 전극 전위/V
커플 티 V 씨알 음 Fe 코 니 CU M2+ / M −1.63 −1.18 −0.91 −1.18 −0.473 −0.28 −0.228 +0.345 M3+ / M −1.37 −0.87 −0.74 −0.28 −0.06 +0.41
기타 표준 전극 전위/V[73]
Ag+ / Ag 피디2+ / 피디 Pt2+ / Pt Zr4+/Zr Hf4+ / Hf Au3+ / Au Ce4+ / Ce +0.799 +0.915 +1.18 −1.53 −1.70 +1.50 −1.32
표준 전극 전위가 음일수록 아쿠아 이온을 줄이기가 더 어렵습니다.예를 들어 아연(-0.75V)의 전위를 철(Fe(II) -0.47V, Fe(III) -0.06V)의 전위와 비교하면 철 이온이 아연 이온보다 더 쉽게 감소함을 알 수 있습니다.이것은 아연을 사용하여 철로 만들어진 큰 구조물에 양극 보호를 제공하거나 아연도금으로 작은 구조물을 보호하는 데 기초가 됩니다.
참고문헌
- ^ 버지스, 섹션 1.2
- ^ 버지스, 20쪽.
- ^ 리헨스, 25쪽.
- ^ 버지스, 181쪽.
- ^ Shannon, R.D. (1976). "Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides". Acta Crystallogr. A. 32 (5): 751–767. Bibcode:1976AcCrA..32..751S. doi:10.1107/S0567739476001551.Shannon, R.D. (1976). "Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides". Acta Crystallogr. A. 32 (5): 751–767. Bibcode:1976AcCrA..32..751S. doi:10.1107/S0567739476001551.리헨스, 부록 2.
- ^ 버지스, 11장.
- ^ 버지스, 6장.
- ^ Chipperfield, John (1999). Non-Aqueous Solvents. Oxford: OUP. ISBN 978-0-19-850259-3.
- ^ a b 스텀앤모건
- ^ 버지스, 53쪽.
- ^ Johansson, Georg (1992). Sykes, A.G. (ed.). Structures of Compexes in Solution Derived from X-ray Diffraction Measurements. Advances in Inorganic Chemistry. Vol. 39. San Diego: Academic Press. pp. 161–232. ISBN 978-0-12-023639-8.
- ^ Ohtaki, H.; Radnai, T. (1993). "Structure and dynamics of hydrated ions". Chem. Rev. 93 (3): 1157–1204. doi:10.1021/cr00019a014.
- ^ Magini, M.; Licheri, G.; Paschina, G.; Piccaluga,G.; Pinna, G. (1988). X-ray diffraction of ions in aqueous solutions : hydration and complex formation. Boca Raton, Fla: CRC Press. ISBN 978-0-8493-6945-2.
- ^ Enderby, J.E.; Nielson, G.W. (1989). Sykes, A.G. (ed.). The Coordination of Metal Aquaions. Advances in Inorganic Chemistry. Vol. 34. San Diego: Academic Press. pp. 195–218. doi:10.1016/S0898-8838(08)60017-3. ISBN 978-0-12-023634-3.
- ^ Neilson, G.W.; Enderby, J.E. (1983). "The Structure of an Aqueous Solution of Nickel Chloride". Proceedings of the Royal Society A. 390 (1799): 353–371. Bibcode:1983RSPSA.390..353N. doi:10.1098/rspa.1983.0136. S2CID 95824687.
- ^ p. Enderby, J.E. (1987). "Diffraction Studies of Aqueous Ionic Solutions". In Bellisent-Funel, M-C.; Neilson, G.W. (eds.). The Physics and Chemistry of Aqueous Solutions. NATO ASI Series. Reidel. pp. 129–145. ISBN 978-90-277-2534-9. 138.
- ^ Adams, D.M. (1967). Metal-Ligand and Related Vibrations. London: Edward Arnold. 254쪽
- ^ 버지스, 85쪽.
- ^ 리헨스, 40쪽.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. pp. 36–37. ISBN 978-0-08-037941-8.
- ^ 리헨스, 123쪽
- ^ Zavitsas, A. A. (2001). "Properties of water solutions of electrolytes and nonelectrolytes". The Journal of Physical Chemistry B. 105 (32): 7805–7815. doi:10.1021/jp011053l.
- ^ Hulthe, G.; Stenhagen, G.; Wennerström, O.; Ottosson, C-H. (1997). "Water cluster studied by electrospray mass spectrometry". Journal of Chromatography A. 512: 155–165. doi:10.1016/S0021-9673(97)00486-X.
- ^ Zundel, G.; Metzger, H. (1968). "Energiebänder der tunnelnden Überschuß-Protonen in flüssigen Säuren. Eine IR-spektroskopische Untersuchung der Natur der Gruppierungen H5O2+". Zeitschrift für Physikalische Chemie. 58 (5_6): 225–245. doi:10.1524/zpch.1968.58.5_6.225. S2CID 101048854.
- ^ Wicke, E.; Eigen, M.; Ackermann, Th (1954). "Über den Zustand des Protons (Hydroniumions) in wäßriger Lösung". Zeitschrift für Physikalische Chemie. 1 (5_6): 340–364. doi:10.1524/zpch.1954.1.5_6.340.
- ^ Stoyanov, Evgenii S.; Stoyanova, Irina V.; Reed, Christopher A. (January 15, 2010). "The Structure of the Hydrogen Ion (H+
aq) in Water". Journal of the American Chemical Society. 132 (5): 1484–1485. doi:10.1021/ja9101826. PMC 2946644. PMID 20078058. - ^ a b c d e f g h i j k l m n o p q r s t u Persson, Ingmar (2022). "Structures of Hydrated Metal Ions in Solid State and Aqueous Solution". Liquids. 2 (3): 210–242. doi:10.3390/liquids2030014.
- ^ 리헨스, 127쪽
- ^ a b 리헨스, 129쪽.
- ^ 리치언즈, 섹션 2.3
- ^ 리헨스, 185쪽.
- ^ a b c d e f g h i Persson, Ingmar (2010). "Hydrated metal ions in aqueous solution: How regular are their structures?". Pure and Applied Chemistry. 82 (10): 1901–1917. doi:10.1351/PAC-CON-09-10-22.
- ^ Thierer, Laura M.; Tomson, Neil C. (2017). "The Actinium Aqua Ion: A Century in the Making". ACS Cent. Sci. 3 (3): 153–155. doi:10.1021/acscentsci.7b00074. PMC 5364445. PMID 28386590.
- ^ Frank, Patrick; Benfatto, Maurizio; Szilagyi, Robert K.; D'Angelo, Paola; Della Longa, Stefano; Hodgson, Keith O. (2005). "The Solution Structure of [Cu(aq)]2+ and Its Implications for Rack-Induced Bonding in Blue Copper Protein Active Sites". Inorganic Chemistry. 44 (6): 1922–1933. doi:10.1021/ic0400639. PMID 15762718.
- ^ 리헨스, 제4장-제12장
- ^ 리헨스, 페이지 544.
- ^ 리헨스, 555쪽.
- ^ 리헨스, 페이지 551
- ^ Finholt, James E.; Leupin, Peter; Sykes, A. Geoffrey (1983). "Kinetics and mechanism of substitution of the quadruply bonded molybdenum(II) aqua dimer with thiocyanate and oxalate". Inorganic Chemistry. 22 (22): 3315–3333. doi:10.1021/ic00164a027.
- ^ 리헨스, 282쪽.
- ^ Richens, 페이지 215-220
- ^ Persson, Ingmar; d'Angelo, Paola; Lundberg, Daniel (2016). "Hydrated and Solvated Tin(II) Ions in Solution and the Solid State, and a Coordination Chemistry Overview of the d10s2Metal Ions" (PDF). Chemistry - A European Journal. 22 (51): 18583–18592. doi:10.1002/chem.201603904. PMID 27862415.
- ^ Persson, Ingmar; Lyczko, Krzysztof; Lundberg, Daniel; Eriksson, Lars; Płaczek, Anna (2011). "Coordination Chemistry Study of Hydrated and Solvated Lead(II) Ions in Solution and Solid State". Inorganic Chemistry. 50 (3): 1058–1072. doi:10.1021/ic1017714. PMID 21226482.
- ^ a b 리헨스, 페이지 152–4
- ^ Pan, Kuan; Fu, Yi-Chang; Huang, Teh-Shoon (December 1964). "Polarographic Behavior of Germanium(II)‐Perchlorate in Perchloric Acid Solutions". Journal of the Chinese Chemical Society. 11 (4): 176–184. doi:10.1002/jccs.196400020.
- ^ 리첸스, 페이지 155
- ^ Azam, S. S.; Lim, L.; Hofer, T. S.; Randolf, B. R.; Rode, B. M. (2009). "Hydrated Germanium (II): Irregular Structural and Dynamical Properties Revealed by a Quantum Mechanical Charge Field Molecular Dynamics Study". Journal of Computational Chemistry. 31 (2): 278–285. doi:10.1002/jcc.21315. PMID 19479764. S2CID 22766649.
- ^ Lim, Len Herald V.; Bhattacharjee, Anirban; Asam, S. Sikander; Hofer, Thomas S.; Randolf, Bernhard R.; Rode, Bernd M. (2010). "Structural and Dynamical Aspects of the Unsymmetric Hydration of Sb(III): An ab initio Quantum Mechanical Charge Field Molecular Dynamics Simulation". Inorganic Chemistry. 49 (5): 2132–2140. doi:10.1021/ic901737y. PMID 20121188.
- ^ Ayala, Regla; Martinez, Jose Manuel; Pappalardo, Rafael R.; Muñoz-Paez, A; Marcos, Enrique Sanchez (2007). "Po(IV) Hydration: A Quantum Chemical Study". J. Phys. Chem. B. 2008 (112): 5416–5422. doi:10.1021/jp076032r. PMID 18396916.
- ^ a b Hofer, Thomas S.; Weiss, Alexander K.H.; Randolf, Bernhard R.; Rode, Bernd M. (2011). "Hydration of highly charged ions" (PDF). Chemical Physics Letters. 512 (4–6): 139–145. Bibcode:2011CPL...512..139H. doi:10.1016/j.cplett.2011.05.060. PMC 3268562. PMID 22298911.
- ^ Bhattacharjee, Anirban; Hofer, Thomas S.; Pribil, Andreas B.; Randolf, Bernhard R.; Rode, Bernd M. (2009). "Hydrolysis of As(III): A femtosecond process". Chemical Physics Letters. 473 (1–3): 176–178. Bibcode:2009CPL...473..176B. doi:10.1016/j.cplett.2009.03.011.
- ^ 리헨스, 페이지 160
- ^ Kugler, H. K.; Keller, C. (1985). 'At, Astatine', System No. 8a. Gmelin Handbook of Inorganic and Organometallic Chemistry. Vol. 8 (8th ed.). Springer-Verlag. pp. 220–221. ISBN 978-3-540-93516-2.
- ^ 리헨스, 페이지 236
- ^ 리헨스, 페이지 240
- ^ 리헨스, 278쪽.
- ^ a b c 버지스의 자료, 페이지 182.
- ^ 리헨스, 그림 1.2.
- ^ Orgel, Lesie E. (1966). An introduction to transition-metal chemistry. Ligand field theory (2nd. ed.). London: Methuen. p. 76.
- ^ 버지스, 187쪽.
- ^ Baes & Mesmer, 3장.
- ^ a b Baes&Mesmer, p407
- ^ Baes&Mesmer, 409쪽.
- ^ Baes & Mesmer, 섹션 18.2.
- ^ Baes & Mesmer, 표 18.3
- ^ Richens, 145쪽.
- ^ Baes&Mesmer, 420쪽.
- ^ Richens, 그림 6.26, 페이지 295
- ^ *22장Atkins, P.W.; de Paula, J. (2006). Physical Chemistry (8th. ed.). Oxford University Press. ISBN 978-0-19-870072-2..
- ^ a b Burgess에서 각색, 표 11.4 및 11.5
- ^ 버지스, 페이지 326.
- ^ IUPAC SC-Database 금속 착물 및 리간드의 평형 상수에 대한 발표된 데이터의 종합 데이터베이스
- ^ a b c 버지스, 표 8.1
- ^ Lide, David R., ed. (2006). CRC Handbook of Chemistry and Physics (87th ed.). Boca Raton, FL: CRC Press. ISBN 0-8493-0487-3.
- ^ Vanýsek, Petr (2011). "Electrochemical Series". In Haynes, William M. (ed.). CRC Handbook of Chemistry and Physics (92nd ed.). CRC Press. pp. 5–80–9. ISBN 978-1-4398-5512-6.
- ^ 물속 298.15 K, Steven G. Bratsch(NIST)의 표준전극전위 및 온도계수
- ^ 안티몬 - 물리화학적 특성 - DACTARI
서지학
- Baes, C.F.; Mesmer, R.E. (1986) [1976]. The Hydrolysis of Cations. Malabar, FL: Robert E. Krieger. ISBN 978-0-89874-892-5.
- Burgess, John (1978). Metal Ions in Solution. Chichester: Ellis Horwood. ISBN 978-0-85312-027-8.
- Richens, David. T. (1997). The Chemistry of Aqua Ions. Wiley. ISBN 978-0-471-97058-3.
- Stumm, Werner; Morgan, James J. (1995). Aquatic Chemistry - Chemical Equilibria and Rates in Natural Waters (3rd. ed.). Wiley-Blackwell. ISBN 978-0-471-51185-4.
- Schweitzer, George K.; Pesterfield, Lester L. (2010). The Aqueous Chemistry of the Elements. Oxford: OUP. ISBN 978-0-19-539335-4.
추가열람
- H.L. 프리드먼, F.Franks, 간단한 전해질의 수용액, Springer; 1973년 판의 재인쇄, 2012 ISBN 1468429574

![{\displaystyle \{[{\ce {M(OH)}}]^{(z-1)+}\}=K_{1,-1}\{{\ce {M}}^{z+}\}\{{\ce {H}}^{+}\}^{-1}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e176d25b98e44f238e312388c7778c2dd0da6fa5)
![{\displaystyle \{[{\ce {M(OH)}}]^{(z-1)+}\}=K_{1,1}\{{\ce {M}}^{z+}\}\{{\ce {OH}}^{-}\}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fd140779b1efcea8279dd45e357bccbb9703423e)

![{\displaystyle [{\ce {M}}_{x}({\ce {OH}})_{y}]=\beta _{x,-y}*[{\ce {M}}]^{x}[{\ce {H}}]^{-y}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a0f51eff3529039469fab7a042189cb722207509)