이온 트랜스포터
Ion transporter생물학에서, 트랜스포터는 세포 통신, 항상성 유지, 에너지 생산 [1]등을 포함한 많은 다른 생물학적 기능을 수행하기 위해 생체막을 가로질러 이온(또는 다른 작은 분자)을 이동하는 막 통과 단백질이다.펌프, 유니포터, 안티포터, 심포터 등 다양한 타입의 트랜스포터가 있습니다.활성 트랜스포터 또는 이온 펌프는 이온을 농도 [2]구배까지 끌어올려 아데노신 삼인산(ATP), 햇빛 및 기타 산화환원 반응을 포함한 다양한 소스의 에너지를 잠재적 에너지로 변환하는 트랜스포터입니다.이 잠재적 에너지는 이온 운반체와 이온 채널을 포함한 2차 전달체에 의해 ATP [3]합성과 같은 중요한 세포 과정을 촉진하기 위해 사용될 수 있다.
이 페이지는 주로 펌프 역할을 하는 이온 운반체에 초점을 맞추고 있지만, 운반체는 또한 촉진된 확산을 통해 분자를 이동시키는 기능도 할 수 있다.촉진 확산은 ATP를 필요로 하지 않으며 막을 가로질러 빠르게 확산할 수 없는 분자가 이러한 단백질 전달체를 [4]통해 농도 구배를 확산시킵니다.
이온 전달체는 적절한 세포 기능을 위해 필수적이며, 따라서 그들은 세포에 의해 고도로 조절되고 다양한 방법을 사용하여 연구자들에 의해 연구된다.세포 규제의 몇 가지 예와 연구 방법이 제시될 것이다.
분류 및 명확화
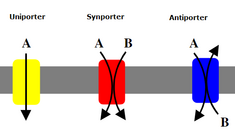
이온 트랜스포터는 12개의 트랜스포터 [5]패밀리를 포함하는 슈퍼 트랜스포터 패밀리로 분류됩니다.이들 과는 국제생화학분자생물학연합(IUBMB)에 의해 사용되는 수송분류(TC) 시스템의 일부이며 수송되는 기질, 수송 메커니즘, 사용된 에너지원, 그리고 각 원생물을 구성하는 DNA 염기서열을 비교함으로써 분류된다.ein. 가장 중요한 통합 인자는 중성종이 [5]아닌 이온의 수송을 나타내는 기질의 하전 특성이다.이온 트랜스포터는 이온 채널과 크게 다릅니다.채널은 막을 통과하는 기공인 반면, 수송체는 막의 어느 쪽에 열려 있는지 전환하기 위해 모양을 바꿔야 하는 단백질이다. 왜냐하면 이 전달체는 채널보다 분자를 움직이는 속도가 훨씬 느리기 때문이다.
전기화학적 구배 또는 농도 구배는 두 개의 분리된 [6]영역에서 화학 분자 또는 이온의 농도 차이입니다.평형 상태에서 두 영역의 이온 농도는 동일하므로 농도 차이가 있을 경우 이온은 농도 구배를 "하향"하거나 고농도에서 저농도로 흐르게 됩니다.이온 채널은 채널에 맞는 특정 이온을 농도 구배 아래로 흐르게 하여 세포막의 양쪽에 있는 농도를 균일하게 합니다.이온 채널과 이온 트랜스포터는 수동 수송의 일종인 촉진 확산을 통해 이를 달성합니다.그러나 이온수송체만이 활성수송을 할 수 있으며, 활성수송은 이온의 농도구배에 [7]반하여 이온을 이동시킨다.ATP와 같은 에너지원을 사용하여 이온수송체는 2차수송체 또는 다른 단백질에 [6]의해 에너지원으로 사용될 수 있는 농도 구배에서 이온을 이동할 수 있다.
에너지원
프라이머리 트랜스포터
1차 수송체는 에너지를 사용하여 세포막을 가로질러 Na2+, K+, Ca와 같은 이온을 운반하고 농도 [6]구배를 만들 수 있습니다.이 수송은 에너지원으로 ATP를 사용하거나 식물의 전자 [7][6]전달 사슬과 같은 방법을 통해 ATP를 생성하는데 사용될 수 있습니다.
액티브 트랜스포터
ATP를 사용하는 운반체는 ATP의 에너지를 농도 구배의 형태로 위치 에너지로 변환합니다.그들은 낮은 농도에서 높은 농도로 이온을 운반하기 위해 ATP를 사용합니다.ATP를 사용하는 단백질의 예로는 인산화에 의해 Na, K+, Ca2+ 이온을 전달하는 P형 ATPase, 음이온을 전달하는 A형 ATPase, 그리고 광범위한 분자 집합을 [6]운반하는 ABC 트랜스포터(ATP 결합 카세트 트랜스포터)가 있다.P형 ATP화효소의 예로는+ 야누스인산화효소-2에[10] 의해2+ 조절되는 Na/K-ATPase와 ADP에[3] 대한 감수성을 보이는 Ca ATP화효소, P-글리코프로틴은 인체 내 ABC수송결합단백질의 예이다.
ATP생산수송체
ATP 생산 트랜스포터는 ATP와 반대 방향으로 운행하며 트랜스포터를 이용한다.이 단백질들은 고농도에서 저농도로 이온을 운반하지만 그 과정에서 ATP가 형성된다.농도 구배 형태의 위치 에너지는 [6]ATP를 생성하기 위해 사용됩니다.동물에서, 이러한 ATP 합성은 ATP 합성 효소로 알려진 F형 ATP 효소를 사용하여 미토콘드리아에서 일어난다.이 과정은 산화적 [11][2]인산화라고 불리는 과정에서 전자전달계를 이용한다.V형 ATP 효소는 F형 ATP 효소와 반대되는 기능을 하며, 식물에서 ATP를 가수 분해하여 양성자 구배를 만드는 데 사용됩니다.엽록체의 [7]광합성 과정에서 V형 ATP화효소 소포나 식물성 액포를 사용하는 리소좀이 그 예이다.이 과정은 [12]pH와 같은 다양한 방법으로 조절할 수 있습니다.
세컨더리 트랜스포터
2차 운반체는 또한 저농도에서 고농도로 농도 구배에 대해 이온(또는 작은 분자)을 운반하지만, 1차 운반체와 달리, 2차 운반체는 1차 운반체에 의해 생성된 농도 구배에서 t까지 위치 에너지를 사용한다.랜스포트 [6]이온예를 들어 소장과 신장에서 발견되는 나트륨 의존성 포도당 운반체는 나트륨 칼륨 펌프에 의해 세포에서 생성된 나트륨 구배를 사용하여 포도당을 [13]세포로 운반하는 것을 돕는다.이것은 나트륨이 포도당을 다시 세포로 밀어 올리기에 충분한 에너지를 제공하는 농도 구배를 따라 흐를 때 발생합니다.이것은 소장과 신장에서 포도당이 손실되는 것을 막기 위해 중요하다.나트륨-글루코스 심포터와 같은 심포터는 농도 구배와 함께 이온을 운반하고, 같은 방향으로 제2분자의 수송을 결합한다.반대편 지지자는 또한 한 분자의 농도 구배를 이용하여 다른 분자를 농도 구배 위로 이동시키지만 결합된 분자는 반대 방향으로 [6]운반된다.
규정
이온 전달체는 인산화, 알로스테릭 억제 또는 활성화, 이온 농도에 대한 민감도 등 다양한 방법으로 조절될 수 있다.단백질 키나아제를 사용하여 인산기를 추가하거나 포스파타아제를 사용하여 단백질을 탈인산화하는 것은 운반체의 [14]활성을 변화시킬 수 있다.단백질이 인산기를 첨가하여 활성화되는지 또는 억제되는지 여부는 특정 단백질에 따라 달라집니다.알로스테릭 저해를 통해 조절 배위자는 조절 부위에 결합하고 전달체를 억제하거나 활성화할 수 있습니다.이온 트랜스포터는 용액 중 이온 농도(반송되는 이온은 아님)에 의해 조절될 수도 있습니다.예를 들어 전자전달계는 [6]용액 중 H이온(pH)의+ 존재에 의해 조절된다.
이온수송기 연구기술
패치 클램프
패치 클램프는 셀의 채널과 트랜스포터를 통과하는 전류를 추적하여 이를 연구하는 데 사용되는 전기생리학 기술입니다.이 기술은 채널과 트랜스포터의 [11][15]존재가 알려지기 전에 Hodgkin과 Huxley에 의해 완성되었습니다.패치 클램핑에 대한 초기 획기적인 연구 외에도, 여전히 이온 트랜스포터와 환경과 리간드가 [1][16]트랜스포터의 기능에 어떤 영향을 미치는지 연구하기 위해 연구자들에 의해 일반적으로 사용되고 있습니다.
X선 결정학
X선 결정학은 단백질의 구조를 시각화할 수 있게 해주는 놀라운 도구이지만, 그것은 단지 하나의 단백질 구조의 스냅샷일 뿐이다.운반 단백질의 구조는 연구자들이 [17][18]세포막을 가로질러 분자를 이동시키기 위해 운반체가 어떻게 그리고 무엇을 하는지 더 이해할 수 있게 해준다.
프랩
광표백 후 형광(FRAP)은 막에서 지질이나 단백질의 확산을 추적하는 데 사용되는 기술이다.이 기술은 세포 내 전달체 이동성과 세포막 내 지질 도메인 및 지질 뗏목과의 상호작용을 더 잘 이해하기 위해 사용된다.
프렛
쾨르스터 공명 에너지 전달(FRET)은 두 단백질이 서로 얼마나 가까운지를 추적하기 위해 형광을 사용하는 기술이다.이것은 트랜스포터가 다른 [1]세포 단백질과 어떻게 상호작용하는지를 연구하는데 사용되어 왔다.
이온수송체 표
| 이온 트랜스포터 |
|---|
| 신경전달물질수송체 |
| 글루탐산수송체 |
| 모노아민 트랜스포터 |
| GABA 트랜스포터 |
| 글리신 트랜스포터 |
| 아데노신 운반체 |
| 혈장막2+ Ca ATP분해효소 |
| 나트륨-칼슘 교환기 |
| 염산나트륨 심포터 |
「 」를 참조해 주세요.
레퍼런스
- ^ a b c Maffeo C, Bhattacharya S, Yoo J, Wells D, Aksimentiev A (December 2012). "Modeling and simulation of ion channels". Chemical Reviews. 112 (12): 6250–84. doi:10.1021/cr3002609. PMC 3633640. PMID 23035940.
- ^ a b Purves D, Augustine GJ, Fitzpatrick D, Katz LC, LaMantia AS, McNamara JO, Williams SM, eds. (2001). "Channels and Transporters". Neuroscience (2nd ed.). Sunderland, Mass.: Sinauer Associates. ISBN 0-87893-742-0.
- ^ a b Haumann J, Dash RK, Stowe DF, Boelens AD, Beard DA, Camara AK (August 2010). "Mitochondrial free [Ca2+] increases during ATP/ADP antiport and ADP phosphorylation: exploration of mechanisms". Biophysical Journal. 99 (4): 997–1006. Bibcode:2010BpJ....99..997H. doi:10.1016/j.bpj.2010.04.069. PMC 2920628. PMID 20712982.
- ^ Gadsby DC (May 2009). "Ion channels versus ion pumps: the principal difference, in principle". Nature Reviews. Molecular Cell Biology. 10 (5): 344–52. doi:10.1038/nrm2668. PMC 2742554. PMID 19339978.
- ^ a b Prakash S, Cooper G, Singhi S, Saier MH (December 2003). "The ion transporter superfamily". Biochimica et Biophysica Acta (BBA) - Biomembranes. 1618 (1): 79–92. doi:10.1016/j.bbamem.2003.10.010. PMID 14643936.
- ^ a b c d e f g h i Voet D, Voet VG, Pratt CW (2016-02-29). Fundamentals of biochemistry : life at the molecular level. ISBN 9781118918401. OCLC 910538334.
- ^ a b c d Scheer BT (2014-01-01). "Ion transport". AccessScience. doi:10.1036/1097-8542.352000.
- ^ Morth JP, Pedersen BP, Buch-Pedersen MJ, Andersen JP, Vilsen B, Palmgren MG, Nissen P (January 2011). "A structural overview of the plasma membrane Na+,K+-ATPase and H+-ATPase ion pumps". Nature Reviews. Molecular Cell Biology. 12 (1): 60–70. doi:10.1038/nrm3031. PMID 21179061. S2CID 9734181.
- ^ Takeuchi A, Reyes N, Artigas P, Gadsby DC (November 2009). "Visualizing the mapped ion pathway through the Na,K-ATPase pump". Channels. 3 (6): 383–6. doi:10.4161/chan.3.6.9775. PMC 2889157. PMID 19806033.
- ^ Hosseinzadeh Z, Luo D, Sopjani M, Bhavsar SK, Lang F (April 2014). "Down-regulation of the epithelial Na⁺ channel ENaC by Janus kinase 2". The Journal of Membrane Biology. 247 (4): 331–8. doi:10.1007/s00232-014-9636-1. PMID 24562791. S2CID 16015149.
- ^ a b Prebble JN (September 2010). "The discovery of oxidative phosphorylation: a conceptual off-shoot from the study of glycolysis". Studies in History and Philosophy of Biological and Biomedical Sciences. 41 (3): 253–62. doi:10.1016/j.shpsc.2010.07.014. PMID 20934646.
- ^ Tikhonov AN (October 2013). "pH-dependent regulation of electron transport and ATP synthesis in chloroplasts". Photosynthesis Research. 116 (2–3): 511–34. doi:10.1007/s11120-013-9845-y. PMID 23695653. S2CID 12903551.
- ^ Crane RK, Forstner G, Eichholz A (November 1965). "Studies on the mechanism of the intestinal absorption of sugars. X. An effect of Na+ concentration on the apparent Michaelis constants for intestinal sugar transport, in vitro". Biochimica et Biophysica Acta. 109 (2): 467–77. doi:10.1016/0926-6585(65)90172-x. PMID 5867548.
- ^ Marshall WS, Watters KD, Hovdestad LR, Cozzi RR, Katoh F (August 2009). "CFTR Cl- channel functional regulation by phosphorylation of focal adhesion kinase at tyrosine 407 in osmosensitive ion transporting mitochondria rich cells of euryhaline killifish". The Journal of Experimental Biology. 212 (Pt 15): 2365–77. doi:10.1242/jeb.030015. PMC 2712415. PMID 19617429.
- ^ Vandenberg JI, Waxman SG (June 2012). "Hodgkin and Huxley and the basis for electrical signalling: a remarkable legacy still going strong". The Journal of Physiology. 590 (11): 2569–70. doi:10.1113/jphysiol.2012.233411. PMC 3424715. PMID 22787169.
- ^ Swant J, Goodwin JS, North A, Ali AA, Gamble-George J, Chirwa S, Khoshbouei H (December 2011). "α-Synuclein stimulates a dopamine transporter-dependent chloride current and modulates the activity of the transporter". The Journal of Biological Chemistry. 286 (51): 43933–43. doi:10.1074/jbc.M111.241232. PMC 3243541. PMID 21990355.
- ^ Morth JP, Pedersen BP, Toustrup-Jensen MS, Sørensen TL, Petersen J, Andersen JP, et al. (December 2007). "Crystal structure of the sodium-potassium pump". Nature. 450 (7172): 1043–9. Bibcode:2007Natur.450.1043M. doi:10.1038/nature06419. PMID 18075585. S2CID 4344526.
- ^ Shinoda T, Ogawa H, Cornelius F, Toyoshima C (May 2009). "Crystal structure of the sodium-potassium pump at 2.4 A resolution". Nature. 459 (7245): 446–50. Bibcode:2009Natur.459..446S. doi:10.1038/nature07939. PMID 19458722. S2CID 205216514.
외부 링크
- 미국 국립 의학 도서관 의학 주제 표목의(MeSH)D12.776.157.530.450, D12.776.543.585.450에 Ion+pumps.
- 그 트랜스포터 기질 데이터베이스(TSdb).