인플루엔자 백신
Influenza vaccine | |
| 백신 설명 | |
|---|---|
| 대상 | 인플루엔자바이러스 |
| 백신 종류 | 불활성화, 감쇠, 재조합 |
| 임상 데이터 | |
| 상호 | 아프루리아, 플루아릭스, 플루존 등 |
| AHFS/Drugs.com | 비활성화:모노그래프 인트라나살:모노그래프 재조합:모노그래프 |
| 임신 카테고리 | |
| 루트 행정부. | 근육내, 비강내, 피내 |
| ATC 코드 | |
| 법적 상태 | |
| 법적 상태 | |
| 식별자 | |
| CAS 번호 | |
| 켐스파이더 |
|
| 케그 | |
독감 예방접종 또는 독감 예방주사로도 알려진 인플루엔자 백신은 인플루엔자 [7]바이러스에 의한 감염으로부터 보호하는 백신이다.새로운 버전의 백신은 인플루엔자 바이러스가 빠르게 [7]변화함에 따라 1년에 두 번 개발된다.그 효과는 해마다 다르지만,[7][8] 대부분은 보통에서 높은 수준의 독감 예방을 제공한다.미국 질병통제예방센터(CDC)는 독감 예방접종이 질병, 병원 방문, 입원 및 [9][10]사망을 감소시킨다고 추정한다.독감에 걸린 면역 근로자들은 평균적으로 [11]반나절 일찍 업무에 복귀한다.65세 이상 고령자의 백신 효과는 수준 높은 연구가 [12][13]부족하기 때문에 여전히 불확실하다.예방접종은 아이들을 보호할 수 있다.[7]
인플루엔자 예방접종은 1930년대에 시작되었고,[14][15] 미국에서는 1945년부터 대규모 접종이 가능해졌다.그것은 세계보건기구의 필수 [16]의약품 목록에 있다.
세계보건기구(WHO)와 미국 질병통제예방센터(CDC)는 6개월 이상의 거의 모든 사람들, 특히 [7][17][18][19]고위험군에 대해 매년 예방접종을 권고하고 있다.유럽질병예방통제센터(ECDC)는 또한 고위험군에 [20]대한 연간 예방접종을 권고한다.이러한 그룹에는 임산부, 노인, 6개월에서 5세 사이의 어린이, 그리고 특정 건강상의 [7][19]문제가 있는 사람들이 포함된다.
백신은 일반적으로 [21]안전하다; 백신을 접종한 어린이의 5-10%에서 열이 발생하며 일시적인 근육통이나 피로감이 발생할 수 있다.특정 해에 백신은 100만 [7]도스당 약 1건의 비율로 노년층에서 길랭-바레 증후군의 증가와 관련이 있었다.비록 대부분의 인플루엔자 백신이 계란 단백질을 사용하여 생산되지만, 계란 [23]알레르기가 있는 사람들에게 알러지 반응의 위험이 증가하지 않았기 때문에 여전히 계란 [22]알레르기가 있는 사람들에게 안전하다고 권고된다.다른 기술, 특히 재조합 백신과 난자 단백질이 아닌 세포 배양에 기초한 백신을 사용하여 생산된 백신은 2012년부터 미국에서,[24] 이후 유럽과 호주에서[25] [23]출시되기 시작했다.인플루엔자 백신은 이전 [7][22]버전의 백신 자체에 심각한 알레르기가 있었던 사람들에게는 권장되지 않는다.백신은 비활동적이고 약화된 바이러스 형태로 나온다.살아있는 약화된 백신은 일반적으로 임산부, 2세 미만의 어린이, 50세 이상의 성인,[7] 또는 면역력이 약한 사람들에게는 권장되지 않는다.종류에 따라 근육에 주입하거나 코에 분사하거나 피부 중간층(피부 [7]내)에 주입할 수 있습니다.2018-2019년과 2019-2020년 인플루엔자 [26][27][28]시즌에는 피내 백신을 사용할 수 없었다.
역사
백신은 인간과 비인간 모두에게 사용된다.인간 백신은 동물, 가금류 또는 가축 백신으로 구체적으로 식별되지 않는 한 의미합니다.
기원과 개발
1918년 전 세계적인 스페인 독감 대유행에서, "약국학자들은 그들이 알고 있는 모든 것을 시도했습니다. 출혈 환자, 산소 투여, 새로운 백신과 혈청 개발까지. (현재 우리가 Hemophilus influence라고 부르는 것은 원래 그것이 고려되었다는 사실에서 유래한 이름)여러 종류의 폐렴구균)과 병인 작용제.회복된 환자의 혈액을 새로운 피해자에게 수혈하는 한 가지 치료법만이 [29]성공의 징후를 보였습니다."
1931년, 어니스트 윌리엄 구드파스티어와 밴더빌트 대학의 동료들에 의해 배아 암탉의 알에서 바이러스 성장이 보고되었습니다.이 연구는 토마스 프란시스, 조나스 솔크, 윌슨 스미스, 맥팔레인 버넷을 포함한 몇몇 근로자들에 의해 인플루엔자 바이러스의 성장으로 확대되어 최초의 실험적인 인플루엔자 [30]백신이 탄생했다.1940년대 미군은 제2차 [31]세계대전에 사용된 인플루엔자 백신을 최초로 개발했다.닭의 난자는 인플루엔자 백신에 사용되는 바이러스를 생산하기 위해 계속 사용되었지만, 제조사들은 계란 단백질을 제거하고 [32]백신의 전신 반응성을 감소시키는 개선된 공정을 개발함으로써 바이러스의 순도를 향상시켰다.2012년 미국 식품의약국(FDA)은 세포배양에서[33][34][35] 바이러스를 성장시켜 만든 인플루엔자 백신을 승인했고, 재조합[36] 단백질로 만든 인플루엔자 백신은 임상시험에서 식물성 인플루엔자 백신을 [37]시험했다[when?].
수락
인플루엔자 백신을 만들기 위한 계란 기반 기술은 1950년대에 [38]만들어졌다.1976년 미국의 신종플루 공포에서 제럴드 포드 대통령은 잠재적인 신종플루 대유행에 직면했다.백신 접종은 서두르지만 지연과 홍보 문제로 골머리를 앓고 있다.한편, 최대 군사 봉쇄 노력은 예기치 않게 새로운 변종을 발생했던 단일 육군 기지에 국한시키는 데 성공했다.그 기지에서 많은 병사들이 중병에 걸렸지만, 오직 한 명만이 죽었다.이 프로그램은 인구의 약 24%가 예방접종을 받은 후 취소되었다.길랭-바레 증후군에 의한 정상 연간 사망률보다 25명의 초과 입원과 400명의 초과 입원 모두 백신 프로그램 자체에서 발생한 것으로 추정되어 백신 자체가 위험에서 자유롭지 않음을 보여주었다.이 결과는 백신 접종에 대한 지속적인 의구심을 뒷받침할 뿐만 아니라 백신 [39]접종의 안전성에 대한 근거 없는 주장에 대항하기 위해 인용될 수 있다.그러나 결국 1976년에 악명이 높았던 백신조차도 생명을 구할 수 있었을지도 모른다.2010년 연구는 1976년 [40]신종플루 예방접종을 받은 연구 참가자들에게서 2009년 대유행 H1N1에 대한 면역반응이 상당히 향상된 것을 발견했다.
계절독감에 대한 4대 백신
2012년 [41][42]3월 FDA에 의해 코 미스트에 의해 투여된 4중 독감 백신이 승인되었다.Fluarix Quadrivalent는 2012년 [43]12월에 FDA의 승인을 받았습니다.
2014년 캐나다 국립면역자문위원회(NACI)는 4대 인플루엔자 [44]백신에 대한 리뷰를 발표했다.
2018-2019년 인플루엔자 시즌을 시작으로 대부분의 일반 용량 계란 기반 독감 예방 접종과 미국의 모든 재조합 및 세포 성장 독감 백신은 4중 [45]접종이다.2019-2020년 인플루엔자 시즌에는 미국의 모든 일반 용량 독감 예방 접종과 모든 재조합 인플루엔자 백신은 4차 [46]접종이다.
2019년 11월 FDA는 2020-2021년 인플루엔자 [47][48]시즌부터 미국에서 Fluzone High-Dose Quadivalent 사용을 승인했다.
2020년 2월 FDA는 Fluad Quadivalent의 [49][50]미국 사용을 승인했다.2020년 7월 FDA는 Fluad와 Fluad Quadivalent를 모두 2020-2021년 인플루엔자 [49][51]시즌에 미국에서 사용하도록 승인했다.
의료 용도
미국 질병통제예방센터(CDC)는 독감 백신을 독감으로부터 보호하고 확산을 [52]막기 위한 최선의 방법으로 추천하고 있다.독감 백신은 또한 백신에 [52]들어있지 않은 변종에 걸리면 독감의 심각성을 낮출 수 있다.예방 접종 후 보호 항체가 [52][53]형성되기까지 약 2주 정도 걸립니다.
2012년 메타 분석에서 독감 예방접종이 67%의 유효성이 있는 것으로 나타났다; 가장 많은 혜택을 받은 인구는 18세에서 55세 사이의 HIV 양성 성인, 18세에서 46세 사이의 건강한 성인, 그리고 6개월에서 24개월 사이의 건강한 아이들이다.[54]인플루엔자 백신은 또한 심근경색에 대해 15-45%[55]의 혜택을 주는 것으로 보인다.
효과
백신은 그 효능, 즉 통제된 조건에서 질병의 위험을 줄이는 정도와 백신 사용 [62]후 관찰된 위험 감소 효과에 의해 평가된다.인플루엔자의 경우 반드시 [11]인플루엔자에 의한 것은 아닌 인플루엔자 유사 질환의 비율을 사용하여 측정하기 때문에 효능보다 효과가 낮을 것으로 예상된다.실제 세계에서 독감 백신의 효과에 대한 연구는 어렵다; 백신은 불완전하게 일치할 수 있고, 바이러스 확산률은 년마다 매우 다양하며, 인플루엔자는 종종 다른 인플루엔자 유사 [63]질병과 혼동된다.그러나, 대부분의 해(2007년 전 19년 중 16년) 동안 독감 백신 변종은 순환하는 [64]변종과 잘 맞아떨어져 왔고, 심지어 일치하지 않는 백신도 종종 교차 [52]보호를 제공할 수 있다.바이러스는 새로운 변종을 일으키는 [65]바이러스의 작은 돌연변이인 항원 표류에 의해 빠르게 변화한다.
계절 독감 백신의 효과는 백신 변종, 나이, 사전 면역 및 면역 기능에 따라 증상 [66]질환에 대한 평균 효능이 50-60%로 매우 다양하며, 따라서 백신 접종을 받은 사람들은 여전히 [67]인플루엔자에 걸릴 수 있다.독감 백신의 효과는 특히 [68]노인들 사이에서 차선책으로 여겨지지만,[67][69] 백신 접종은 여전히 인플루엔자에 의한 사망률과 입원 기간을 줄이는데 도움이 된다.취학 연령 아동의 예방 접종은 다른 연령층에 간접적인 보호를 제공하는 것으로 나타났다.LAIV는 특히 6세 미만의 어린이에게 탁월한 효능과 불활성화 [70][71]백신에 비해 비백신 변종에 대한 면역력을 바탕으로 권장된다.
뉴질랜드에서는 2012년부터 2015년까지 중환자실 입원 대비 백신 효과가 82%[72]였다.2019-2020년 미국 독감 시즌의 입원 인플루엔자 질환에 대한 효과는 전체적으로 41%였고 65세 [73]이상 인구에서 54%였다.한 리뷰는 [74][75]성인들 사이에서 31%의 사망 대비 효과가 있는 것으로 나타났다.
매년 반복되는 인플루엔자 예방접종은 일반적으로 [75]전년대비 일관된 독감 예방접종을 제공한다.그러나 반복 접종이 특정 인플루엔자 하위 유형에 대한 백신 효과의 감소를 야기할 수 있다는 암시적인 증거가 있다. 이는 연간 예방접종에 대한 현재 권고사항과는 관련이 없지만 향후 예방접종 정책에 [76][77]영향을 미칠 수 있다.CDC는 대부분의 연구에서 연간 인플루엔자 [75]예방접종의 전반적인 효과가 입증되었기 때문에 2019년 현재[update] 연간 백신을 권장하고 있다.
다양한 [78]인플루엔자 백신 종류들의 효과에서 유의미한 차이를 입증할 충분한 증거는 없지만,[79] 노인들에게 더 강한 면역 반응을 유도하는 고용량 또는 보조제 제품들이 있다.
COVID-19
인플루엔자 예방접종은 COVID-19를 예방하지는 않지만, 인플루엔자와 COVID-19에 동시에 감염되는 것을 방지하며, 이는 심각한 질병의 위험을 크게 증가시킨다.연구는 두 바이러스에 감염된 환자가 COVID-19만 있는 환자보다 사망할 확률이 두 배 이상 높다는 것을 보여준다.COVID-19에서 회복된 환자는 인플루엔자 백신을 안전하게 맞을 수 있다.인플루엔자 백신과 COVID-19 백신을 [53][80]동시에 안전하게 투여할 수 있다.
비판
Cochrane Collaboration의 독감 백신 검토를 이끈 톰 제퍼슨은 독감 백신에 대한 임상 증거를 "터무니없다"고 말했고, 따라서 독감 백신들은 효과가 없다고 선언했다. 그는 위약으로 통제된 무작위 임상 실험을 요구했는데, 이 임상 실험은 이 분야 대부분의 사람들이 비윤리적이라고 생각한다.독감 백신의 효능에 대한 그의 견해는 CDC와 국립보건원을 포함한 의료 기관과 앤서니 파우치 [81]같은 이 분야의 주요 인사들에 의해 거부당했다.
2012년 독감백신센터(Center for Infectious Disease Research and Policy 2012)의 리뷰를 이끈 마이클 오스터홀름 씨는 백신을 도입할 것을 권고했지만 "우리는 이 백신을 과도하게 홍보하고 남용했다.승격된 것처럼 보호되지 않습니다.모두 영업직이고 [82]홍보직입니다."
아이들.
2002년 4월, ACIP(면역실천자문위원회)는 생후 6개월에서 23개월 된 아이들에게 매년 [83]인플루엔자 예방백신을 접종할 것을 권장했다.2010년 ACIP는 6개월 [83]이상에 대해 연간 독감 예방접종을 권고했다.현재 CDC는 생후 6개월 미만의 유아를 제외한 모든 유아가 계절성 인플루엔자 [17]백신을 접종해야 한다고 권고하고 있다.예방접종 캠페인은 보통 임신부, 59개월 미만의 어린이, 노인, 만성질환이나 면역력 약화와 같이 독감에 걸릴 경우 심각한 합병증에 걸릴 위험이 높은 사람뿐만 아니라 의료 [17][84]종사자와 같은 사람들에게도 특별한 주의를 기울인다.
CDC와 WHO는 영유아 사망률도 높기 때문에 [84][85]영유아에게 인플루엔자 감염 위험을 줄이기 위해 가족 접촉자와 보호자에게 예방접종을 권고하고 있다.
아이들에게 백신은 인플루엔자 및 인플루엔자 유사 질병의 위험을 [86]줄여주는 것으로 보인다.2세 미만의 아동은 데이터가 제한됩니다.[86]2017-18년 독감 시즌 동안 CDC 책임자는 사망한 어린이의 85%가 "백신을 [87]접종받지 않았을 것 같다"고 밝혔다.
미국에서 CDC는 2019년[update] 1월 기준으로 6개월에서 35개월 사이의 아동에게 Fluzone Quadrivalent [46][88]1회 용량당 0.25밀리리터 또는 0.5밀리리터 중 하나를 투여할 것을 권고하고 있다.해당 연령 [46]그룹에 대한 Fluzone Quadivalent 용량 중 하나 또는 다른 용량에 대한 선호는 없습니다.36개월 이상의 모든 사람은 Fluzone [46]Quadivalent를 용량당 0.5밀리리터씩 받아야 합니다.2018년 10월[update] 현재,[46][89] Afluria Quadrivalent는 미국에서 6개월 이상의 어린이를 대상으로 라이센스를 취득하고 있습니다.6개월에서 35개월 사이의 어린이는 아프루리아 쿼드라이벌런트를 [46]1회 복용할 때마다 0.25밀리리터를 받아야 한다.36개월 이상의 모든 사람은 Afluria [46]Quadivalent를 용량당 0.5밀리리터씩 받아야 합니다.2018년 2월[update] 현재,[90] Afluria Tetra는 캐나다에서 5세 이상의 성인 및 어린이를 대상으로 라이센스가 부여되어 있습니다.
2014년 캐나다 국립면역자문위원회(NACI)는 건강한 5-18세 [91]아동의 인플루엔자 예방접종 리뷰를 발표했으며, 2015년에는 6-72개월 [92]아동의 소아 플루드 사용에 대한 리뷰를 발표했다.제3차 소개 센터에서 실시된 한 연구에서는 어린이 인플루엔자 백신 접종률이 31%에 불과했다.면역 억제 소아 환자(46%)와 염증성 대장 질환 환자(50%)[93]에서 높은 비율이 발견되었다.
어른들
예방접종을 받지 않은 성인의 경우, 16%가 독감과 비슷한 증상을 보이는 반면, 예방접종을 받은 성인의 약 10%는 [11]독감과 비슷한 증상을 보입니다.백신 접종은 인플루엔자 확진 환자를 약 2.4%에서 1.1%[11]로 감소시켰다.입원에 [11]대한 영향은 발견되지 않았다.
직장 성인의 경우, 코크란 공동작업의 리뷰에 따르면, 백신 접종은 전염이나 인플루엔자 [11]관련 합병증에 영향을 주지 않고 인플루엔자 증상과 근무일수 감소 모두를 약간 감소시켰다.건강한 직장 성인의 경우, 독감 백신은 바이러스학적으로 확인된 인플루엔자에 대한 적절한 보호를 제공할 수 있지만,[12] 그러한 보호는 계절에 따라 크게 감소하거나 결여된다.
의료 종사자의 경우 2006년 리뷰에서 순 [94]편익이 발견되었습니다.이 검토의 18개 연구 중 단 2개만이 직원 인플루엔자 백신 섭취에 대한 환자 사망률의 상관관계를 평가했다. 두 연구 모두 의료 [94]종사자 예방접종 비율이 환자 사망률 감소와 관련이 있는 것으로 나타났다.2014년 검토 결과, 의료 종사자가 [96]예방접종을 받지 않은 비교 환자 대비 예방접종을 받은 환자의 모든 원인 사망률이 감소했다는 중간 증거에[95] 따라 의료 종사자가 예방접종을 받았을 때 환자에게 유익성이 확인되었다.
고령자
65세 이상 성인의 효과에 대한 증거는 [97]명확하지 않다.무작위 대조군과 사례-대조군 연구를 모두 검사한 체계적 검토 결과 고품질 [12][13]증거가 부족했다.환자-대조군 연구의 검토 결과, 지역사회 거주 [98][99]노인의 실험실 확인 인플루엔자, 폐렴 및 사망에 대한 효과가 확인되었다.
비빈혈성 독감에 가장 취약한 그룹인 노인들은 백신으로부터 가장 적은 혜택을 받는다.백신 효능의 급격한 감소에는 여러 가지 이유가 있는데, 그 중 가장 흔한 것은 [100]노령화와 관련된 면역 기능의 저하와 허약함이다.빈혈이 아닌 해에, 50-64세의 미국인은 젊은 사람보다 인플루엔자 관련 사망률이 거의 10배 높으며, 65세 이상의 사람은 50-64세 [101]그룹보다 인플루엔자 관련 사망률이 10배 이상 높다.
보다 강력한 면역 [102]반응을 제공하기 위해 특별히 제조된 고용량 독감 백신이 있다.이용 가능한 증거는 노인들에게 고용량 백신을 접종하면 일반 용량 [103][104][105]백신보다 독감에 대한 면역 반응이 더 강해진다는 것을 보여준다.
보조제를 함유한 독감 백신은 미국 식품의약국(FDA)에 의해 65세 이상 성인의 사용을 위해 2015년 11월 승인되었다.이 백신은 미국에서 Fluad로 판매되며 2016-2017년 독감 시즌에 처음 판매되었다.이 백신은 스쿠알렌 오일의 수중유제인 MF59C.1 보조제를[106] 함유하고 있다.그것은 [107][108][109]미국에서 시판되는 최초의 보조 계절 독감 백신이다.MF59C.1 보조제를 [110][111][112]함유한 독감 백신을 사용하는 것이 노인들에게 중요한 이점이 있는지는 명확하지 않다.면역실무자문위원회의 지침에 따르면, 플루드는 65세 [108]이상 노인들에게 승인된 다른 인플루엔자 백신의 대안으로 사용될 수 있다.
노인과 함께 일하는 의료 종사자들에게 예방접종을 하는 것이 많은 나라에서 권장되고 있으며, 이 취약한 인구에서 [113][114][115]인플루엔자 발생을 줄이는 것을 목표로 하고 있다.의료 종사자를 예방접종하는 것이 노인을 인플루엔자로부터 보호하는 데 도움이 된다는 무작위 임상시험의 결정적인 증거는 없지만,[116] 일시적인 유익성의 증거는 있다.
Fluad Quad는 2019년 [117]9월에 호주에서, Fluad Quadivalent는 2020년 [49]2월에 미국에서, Fluad Tetra는 2020년 [118]5월에 유럽연합에서 사용이 승인되었습니다.
임신
산모와 아이를 독감 감염으로부터 보호할 뿐만 아니라, 임신부의 예방접종은 성공적인 [119]완전임신을 경험할 수 있는 가능성을 높이는 경향이 있다.
3가 불활성화 인플루엔자 백신은 [120]HIV에 감염된 임산부에게 보호 효과가 있다.
안전.
부작용
예방접종의 일반적인 부작용에는 국소 주사부위 반응과 감기 같은 증상이 포함된다.발열, 불쾌감, 그리고 근육통은 덜 흔하다.독감 백신은 독감 백신이나 백신의 어떤 성분에도 반응하여 심각한 알레르기 반응을 경험한 사람들에게는 금지된다.RAIV는 심각한 면역 결핍을 가진 어린이나 청소년이나 라이 [70]증후군 발병 위험 때문에 살리실산염 치료를 사용하는 사람들에게는 투여되지 않는다.또한 [71]2세 미만의 어린이, 임산부 및 면역 억제가 있는 성인에게는 LAIVs가 권장되지 않습니다.불활성화 독감 백신은 인플루엔자를 유발하지 않으며 [70]임신 중에는 안전하다고 간주됩니다.
독감 백신의 부작용은 발생할 수 있지만, 대개 주사 지점 주변의 통증, 홍조, 붓기, 두통, 발열, 메스꺼움 또는 피로 [121]등 경미한 것이다.비강 스프레이 백신의 부작용에는 콧물, 쌕쌕거림, 인후통, 기침, [122]구토가 포함될 수 있습니다.
몇몇 사람들에게 독감 백신은 알레르기 반응을 포함한 심각한 부작용을 일으킬 수 있지만, 이것은 드물다.게다가, 일반적인 부작용과 위험은 매년 유행하는 [52]인플루엔자의 위험과 심각한 건강상의 영향에 비해 경미하고 일시적이다.
길랭-바레 증후군
CDC는 길랭-바레 증후군이 백신 접종의 합병증으로 우려됐지만, 현대의 인플루엔자 백신에 대한 대부분의 연구는 길랭-바레와 [123][124]관련이 없다고 밝히고 있다.인플루엔자 바이러스 자체의 감염은 사망 위험(1만 명 중 1명)과 길랭-바레 증후군 발병 위험을 모두 백신 감염 의심 최고 수준(2009년 [125][126]추정치의 약 10배)보다 훨씬 높은 수준으로 증가시킨다.
비록 검토 vaccinations,[127]Guillain–Barré명의 약 1사건의 발생률 중국에 있는 대형 연구는 2009년 H1N1에 대한 백신에 가까운 100만회 분을 준다"돼지"독감 Guillain–Barré 증후군, 이집에는 몇명이(0.1억 도스)총 발생률 예방 접종을 했더라도, 실제로 낮은 등번호의 11건을 적발했다.n은중국에서의 정상 발병률, 그리고 다른 주목할 [126][128]만한 부작용은 없습니다.
계란 알레르기

비록 대부분의 인플루엔자 백신이 계란 기반 기술을 사용하여 생산되지만,[22] 그럼에도 불구하고 인플루엔자 백신은 비록 심각할지라도 계란 알레르기가 있는 사람들에게 여전히 권장된다.심각한 계란 알레르기를 가진 사람들에게서 인플루엔자 백신의 안전성을 검사하는 연구는 무지외반증이 주어진 [22]100만 도스 당 1.3 케이스에서 발생하는 매우 드문 것으로 밝혀졌습니다.
예방접종에 의한 증상의 모니터링은 증상이 [129]더 심한 사람에게 권장된다.이전의 아나필락시 반응을 보인 250명 이상을 포함한 거의 800명의 달걀 알레르기를 가진 어린이를 대상으로 한 연구는 살아있는 감쇠 독감 [130][131]백신을 투여했을 때 전신 알레르기 반응이 전혀 없었다.
다른.
여러 연구에서 대유행 H1N1 인플루엔자 ASO3 [132]보조백신 수혜자들 사이에서 기면증의 발생률이 증가했음을 확인했다. 기면증은 자가면역이며, ASO3 보조 H1N1 백신이 [133]방아쇠 역할을 하는 하이포크레틴을 모방할 수 있음을 시사한다.
미국의 성인들을 위한 일부 주사 기반 독감 백신에는 수은 기반 [134][135]방부제인 티오메살(티메로살이라고도 함)이 포함되어 있다.언론의 [136]일부 논란에도 불구하고, 세계보건기구(WHO)의 세계 백신 안전 자문 위원회는 백신에 포함된 티오메살로부터 독성의 증거가 없으며, 안전상의 이유로 더 비싼 단회 [137]투여로 바꿀 이유가 없다고 결론지었다.
종류들
독감 백신은 다음과 같이 제공됩니다.
- 바이러스의 불활성화 형태를 포함한 3가 또는 4가의 근육 주사(IIV3, IIV4, 또는 RIB4)
- 는 살고 있으나 바이러스 attenuated(약화되었다.)양식을 포함하는 약화된 인플루엔자 백신(LAIV, Q/LAIV)의 비강 스프레이.
반면cold-adapted LAIV 콧구멍의 감염을 수립하여 일한다 TIV 또는 QIV을 자아내보호 주사 후 불활화 바이러스에antigens에게 준 선물 면역 반응에 기초한( 하지만 매몰 피하 노선 또한 보호할 수 있는 일반적으로 근육)[138].[139]
추천 사항
세계 보건 기구(세계 보건 기구)을 포함한 공공 의료 기관은 연간 독감 예방 접종은 일상적으로 독감의 합병증의 위험에 있는 사람들이, 누구랑 또는 위험한 개인에 대한 관심 사는 저 사람들 특히 제공될:추천합니다.
- 노년 또는 older[19]의 50년.
- 만성 폐 질환을 가진 asthma[19]을 포함한 사람들은.
- 만성 심장 diseases[19]를 가진 사람들은.
- 만성 간 diseases[19]를 가진 사람들은.
- 만성 신장 diseases[19]를 가진 사람들은.
- 그들의 비장했던 사람들은 또는 비장 작동하지 않는다 properly[의료 표창 필요한]을 제거했다.
- 누가 immunocompromised[19]사람들
- 요양원과 다른long-term—care facilities[19]의 거주자들
- 의료 종사자들(과 환자들에게 확산을 막기 위해 멀미를 예방할)[140][141].
- 유행성 감기의 계절에 임신했거나 임신할 예정인 여성[19]
- 누가 aspirin- 또는 salicylate-containing 약물을 받는 아이들과 청소년들(18년을 통해 6개월살)과 인플루엔자 바이러스 infection[19] 후 라이 증후군을 경험하고의 위험에 있을지도 모른다.
- 아메리카 인디언/알래스카[19] 원주민
- 극도로 비만인 사람들(성인의 [19]경우 체질량지수 40파운드)
독감 백신은 생후 6개월 미만과 독감 백신 또는 [17][142][22]백신에 포함된 성분들에 대해 심각하고 생명을 위협하는 알레르기가 있는 사람들에게는 금지된다.
세계보건기구
2016년 현재[update] 세계보건기구(WHO)는 다음과 같은 경우에 계절 [143][144][145][146][147]인플루엔자 예방접종을 권고하고 있다.
우선 순위:
- 임산부
두 번째 우선순위(특정 순서 없음):
- 생후 6~59개월 아동
- 고령자
- 특정 만성 질환이 있는 개인
- 의료 종사자
캐나다
캐나다 공중보건청에 자문하는 단체인 국립면역자문위원회(NACI)는 6개월 이상의 모든 사람에게 매년 독감 예방접종을 받도록 권장하고 있으며, 6개월에서 24개월 사이의 어린이와 그들의 가정접촉은 최우선 사항으로 고려되어야 한다고 권고하고 있다.독감백신을 [148]사용하세요.특히:
- 인플루엔자 관련 합병증 또는 입원 위험이 높은 사람(병적으로 비만인 사람, 건강한 임산부, 6-59개월 아동, 노인, 원주민, 만성 건강 상태 항목별 목록 중 하나)
- 고위험군에 인플루엔자를 전염시킬 수 있는 사람(가정연락처 및 의료 종사자 포함)
- 필수 커뮤니티 서비스를 제공하는 사람
- 특정 양계업자
2019-2020년 [148]시즌에는 캐나다에서 라이브 감쇠 인플루엔자 백신(LAIV)을 사용할 수 없었다.
유럽 연합
유럽질병예방통제센터(ECDC)는 만성질환자 및 의료 종사자와 [149]함께 노인 예방백신을 우선적으로 접종할 것을 권고하고 있다.
인플루엔자 백신 접종 전략은 일반적으로 인플루엔자 순환을 제한하거나 인간 인플루엔자 질병을 없애는 것이 아니라 취약한 사람들을 보호하는 것이다.이것은 소아마비와 [150]홍역과 같은 다른 전염병에 대한 높은 집단 면역 전략과는 대조적이다.이는 또한 연간 [151]투입의 필요성과 관련된 재정 및 물류 부담의 일부에 기인한다.
미국
미국에서는 생후 6개월 [19][152]이상의 모든 사람에게 정기적인 인플루엔자 예방접종이 권장된다.예방접종 후 충분한 항체가 몸에 [152]생기기까지는 최대 2주가 소요됩니다.질병통제예방센터는 백신 접종을 10월 [19]말 이전에 할 것을 권고하고 있지만 12월이나 그 이후에 하는 것이 여전히 [19][52][152]유익하다고 생각하고 있다.
CDC에 따르면 일부 [19][153]그룹은 라이브 약독화 바이러스(LAIV4)를 피해야 한다.
1981년부터 의료 종사자에게 인플루엔자 백신을 권장하기 시작한 CDC는 미국의 일반 예방접종에 대한 포괄적인 권고안에서 특정 취약계층 구성원과 그 간병인에 대한 예방접종의 특별한 긴급성을 임상의에게 강조하고 있다.
- 예방접종은 심각한 인플루엔자 합병증의 위험이 높은 사람이나 심각한 [154]합병증에 걸릴 위험이 높은 사람과 함께 살거나 돌보는 사람들에게 특히 중요하다.2009년에는 표준 인플루엔자 백신의 새로운 고용량 배합이 [155]승인되었다.Fluzone High Dose는 65세 이상 노인 전용으로, 표준 Fluzone의 [156][157][158][159]항원 선량의 4배를 가지고 있다는 점이 다릅니다.
미국 정부는 병원들이 근로자 예방접종률을 보고하도록 요구하고 있다.미국의 일부 주와 수백 개의 병원들은 독감철에 의료진들에게 예방접종을 받거나 마스크를 착용하도록 요구한다.이러한 요건은 때때로 협소한 단체협상 근거에서 노조 소송을 야기하지만, 찬성론자들은 법원이 질병 발생 [160]시 일반인에게 영향을 미치는 강제 예방접종법을 일반적으로 승인했다는 점에 주목하고 있다.
인플루엔자에 대하여 예방 주사 특히 중요한 인플루엔자에서 오는 합병증 있을 것으로 예상될 것 고위험 그룹의 회원들을 위하여로 간주된다 6개월 나이 사람, 그리고 expe의 위험에 있을지도 모르aspirin- 또는 salicylate-containing 약물은 18년의 예를 들어 임신한 women[19][161]고 어린이들과 십대들에게.riencing인플루엔자 바이러스 감염 [19]후 재예 증후군
- 만 18세로 상한 연령을 올리면서 소아과 방문과 결석으로 인한 자녀와 학부모의 손실 시간과 합병증에[162] 대한 항생제의 필요성을 줄이는 것이 목적이다.
- 어린이 예방접종에서 기대할 수 있는 추가 혜택은 부모 및 다른 가구원 사이의 인플루엔자 환자 수 감소와 [162]일반 사회로의 확산 가능성이다.
CDC는 비강 스프레이 백신이라고도 불리는 라이브 약독감 백신(LAIV)이 2016-2017년 미국 [163]독감 시즌에는 권장되지 않는다고 밝혔다.
또한 CDC는 중증 면역 결핍자를 돌보는 의료진에게 LAIV 대신 주사([164]TIV 또는 QIV)를 맞을 것을 권고한다.
★★★
Jenny Harries 박사는 2021-2022년 영국의 겨울은 독감과 COVID-19가 처음으로 함께 유통될 것이기 때문에 "불확실할 것"이라고 주장했다.그녀는 자격이 있는 사람들에게 COVID-19와 독감 백신을 접종할 것을 촉구했다.그녀는 독감 예방접종이 매년 중요하다고 주장한다.많은 사람들이 이것을 [165]모르기 때문에 사람들은 독감이 치명적일 수 있다는 것을 알아야 한다.
호주 정부는 생후 6개월 이상의 모든 사람들에게 계절 독감 예방 접종을 권고하고 있다.호주는 불활성화 [166]백신을 사용한다.2021년까지는 난자 기반 백신이 유일한 백신이었지만 2021년 3월부터는 유료화 희망자를 위한 새로운 세포 기반 백신이 출시돼 2026년에는 [23]표준이 될 것으로 예상된다.표준 독감 백신은 다음 사람에게 [167]무료입니다.
- 사이의
- 원주민과 토레스 해협 섬 주민은 생후 6개월 이상.
- 심각한 천식, 폐질환 또는 심장질환, 면역력이 낮거나 인플루엔자 합병증을 일으킬 수 있는 당뇨병과 같은 의학적 조건을 가진 생후 6개월 이상의 모든 사람.
★★★
| 나라 | 지역 | 65세 이상 고령자 비율 |
|---|---|---|
| 아시아 | 83 | |
| 오세아니아 | 75 | |
| 유럽 | 73 | |
| 아메리카 대륙 | 68 | |
| 오세아니아 | 65 | |
| 아메리카 대륙 | 65 | |
| 유럽 | 64 | |
| 아메리카 대륙 | 61 | |
| 유럽 | 61 | |
| 아시아 | 58 | |
| 유럽 | 58 | |
| 유럽 | 54 | |
| 유럽 | 53 | |
| 유럽 | 52 | |
| 아시아 | 50 | |
| 유럽 | 50 | |
| 유럽 | 49 | |
| 유럽 | 48 | |
| 유럽 | 45 | |
| 유럽 | 38 | |
| 유럽 | 35 | |
| 유럽 | 34 | |
| 유럽 | 27 | |
| 유럽 | 20 | |
| 유럽 | 13 | |
| 유럽 | 13 | |
| 유럽 | 12 | |
| 유럽 | 8 | |
| 아시아 | 7 | |
| 유럽 | 5 |
위험 그룹
계절적으로나 유행병 중에 독감 예방접종의 섭취량은 종종 [169]낮다.유행성 독감 예방접종 섭취에 대한 체계적인 검토는 성별(남성에게서 더 높은 섭취), 민족성(소수민족 출신에서 더 높은 섭취)[170][171] 및 만성질환을 포함하여 섭취에 영향을 미칠 수 있는 몇 가지 개인적 요인을 식별했다.백신의 안전성과 효과에 대한 믿음도 중요하다.[169]
60세 이상에서 예방접종 비율을 증가시키는 데 유용한 여러 척도가 발견되었다. 여기에는 전단지와 편지를 사용한 환자 주의사항, 엽서 주의사항, 고객 봉사 프로그램, 백신 자택 방문, 단체 예방접종, 무료 예방접종, 의사 유료, 의사 주의사항 및 의사 [172]경쟁 장려 등이 포함된다.
의료 종사자
최전방 의료 종사자들은 종종 계절적 예방접종과 유행성 독감 예방접종을 받는 것이 권장된다.예를 들어, 영국에서는 환자 치료에 관여하는 모든 의료 종사자가 계절 독감 백신을 맞을 것을 권고받았으며, 2009년 대유행 기간 동안 H1N1/09(나중에 A(H1N1)pdm09[note 1][173]) 돼지 독감 바이러스에 대한 백신 접종을 권고받았다.하지만, 종종 흡수율이 [141]낮습니다.2009년 대유행 기간 동안 영국,[141] 이탈리아,[174] 그리스 [175]및 [176]홍콩을 포함한 국가에서는 의료 종사자의 저흡수 현상이 나타났다.
미국 의료 종사자들을 대상으로 한 2010년 조사에서, 63.5%가 2010-11년 시즌 동안 독감 백신을 접종했다고 보고했는데, 이는 전 시즌 61.9%에서 증가한 것이다.환자와 직접 접촉하는 미국 보건 전문가들은 의사와 치과의사(84.2%)와 간호사(82.6%)[177][178][179]와 같이 예방접종 흡수율이 높았다.
의료 종사자가 예방접종을 하는 주된 이유는 직원이 환자에게 독감을 전파하는 것을 방지하고 서비스 수요가 높은 시기에 직원의 결근을 줄이기 위함이지만, 의료 종사자가 예방접종을 받아들이거나 거절하는 결정을 말하는 이유는 종종 개인의 이익 [141]인식과 관련이 있을 수 있다.
빅토리아(호주) 공립 병원에서 2005년 의료 종사자 백신 접종률은 비임상 직원의 34%에서 실험실 직원의 42%까지 다양했다.백신을 거부하는 이유 중 하나는 부작용에 대한 우려였다; 한 연구에 따르면, 한 교육 병원의 상주 의사 31%가 호주 백신이 [180]인플루엔자를 일으킬 수 있다고 잘못 믿었다.
제조업
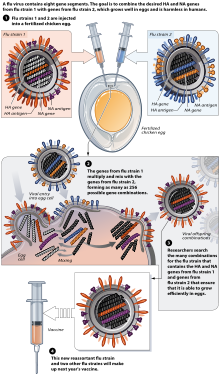
특정 변종에 맞게 조정할 필요는 없지만 광범위한 인플루엔자 [181]바이러스에 효과적일 수 있는 "범용" 인플루엔자 백신에 대한 연구는 계속되고 있다.2007년 [182]11월까지 백신 후보가 발표되지 않았지만 2021년 현재[update] 임상 전 개발 및 임상 [183][184][185][186]시험에서 여러 범용 백신 후보가 있다.
2007년 보고서에 따르면, 약 8억2600만 건의 계절 인플루엔자 백신 용량(비활성화 및 활성)의 전세계 용량은 4억1300만 건의 두 배였다.2013년까지 대유행 인플루엔자 백신을 생산하겠다는 공격적인 시나리오에서는 6개월 동안 28억 개의 과정만 생산할 수 있었다.만약 모든 고소득과 중상위 소득 국가들이 대유행으로 인해 전체 인구를 위한 백신을 찾는다면, 거의 20억 개의 과정이 필요할 것이다.만약 중국도 이 목표를 추구한다면,[187] 이 사람들에게 서비스를 제공하기 위해서는 30억 개 이상의 과정이 필요할 것이다.백신 연구 및 개발은 전 세계 [citation needed]인구가 부담할 수 있는 가격으로 훨씬 더 많은 양의 백신을 생산할 수 있는 새로운 백신 접근법을 식별하기 위해 진행 중이다.
계란 베이스
대부분의 독감 백신은 백신 제조업체에 의해 수정된 [188][182]계란으로 재배된다.북반구에서는 세계보건기구([188][189]WHO)가 겨울독감 시즌을 위해 권장하는 변종 발표(일반적으로 2월) 이후 제조공정이 시작된다.3종류의 독감(H1N1, H3N2, B종을 나타냄)을 선택하여 닭알을 따로 접종한다.이 1가의 수확물들은 3가의 [190]백신을 만들기 위해 결합된다.
2007년 11월[update] 현재 기존 주사제와 비강 스프레이 모두 계란으로 제조되고 있다.유럽연합(EU)은 노바티스가 동물 세포통을 이용해 만든 백신 옵타플루도 승인했다.이 기술은 더 확장성이 있고 알레르기 반응과 [182]닭과 같은 조류에 영향을 미치는 변종과의 호환성과 같은 계란 문제를 피할 수 있을 것으로 기대된다.
인플루엔자 백신은 [191]생후 11일 또는 12일 된 무병원균 달걀에서 생산된다.계란의 윗부분을 알코올로 닦아 소독하고, 그 후 알란토성 캐비티에서 작은 구멍이 뚫려 압력방출이 [192]되는 비농성 영역을 식별하기 위해 설탕에 절인다.두 번째 구멍을 난자 꼭대기에 뚫어 융모막을 지나 알란강 내에 인플루엔자 바이러스를 주입한다.그리고 나서 두 개의 구멍을 녹인 파라핀으로 밀봉하고 접종된 달걀을 섭씨 [191]37도에서 48시간 동안 배양한다.배양 시간 동안 바이러스가 복제되고 새로 복제된 바이러스가 알란토성[193] 액체로 방출됩니다.
48시간의 잠복기 후 달걀 윗부분을 갈라 10밀리리터의 알란토성 액체를 제거함으로써 약 15마이크로그램의 독감 백신을 얻을 수 있다.이 시점에서 바이러스는 약해지거나 죽임을 당하며 바이러스 항원은 정제되어 바이알, 주사기 또는 비강 스프레이 안에 [193]놓인다.대규모로 실시되는 이 방법은 인류를 위한 독감 백신을 생산하는 데 사용된다.
기타 제조방법
계란의 필요성을 우회하는 백신 생성 방법에는 인플루엔자 바이러스 유사 입자(VLP)의 구축이 포함된다.VLP는 바이러스와 유사하지만 바이러스 코드 요소를 포함하지 않고 단지 비리온과 유사한 방식으로 항원을 나타내기 때문에 불활성화할 필요는 없다.VLP를 생성하는 일부 방법에는 Spodoptera frugiperda Sf9 곤충 세포 배양과 식물 기반 백신 생산(예: 니코티아나 벤타미아나의 생산)이 포함된다.일부 VLP는 혈중응집억제측정(HIA)[194]에서 다른 백신에 비해 항원적으로 구별되는 바이러스 분리제의 더 넓은 패널을 인식하는 항체를 유도한다는 증거가 있다.
불활성화된 H5N1 백신을 투여해 면역체계를 활성화시키는 데 사용되는 유전자 기반 DNA [195][196][197]백신은 2011년 임상시험을 거쳤다.
2012년 11월 20일, 노바티스는 최초의 세포 배양 백신의 [24][34][198][199]FDA 승인을 받았다.2013년에는 재조합 인플루엔자 백신인 플루블록이 [36][200][201][202]미국에서 사용이 승인되었다.
2020년 9월 17일, 유럽 의약품청(EMA)의 CHMP(Medical Products Committee for Human Use)는 긍정적인 의견을 채택하여 4대 경쟁 인플루엔자 백신인 [203]수펨텍의 시판 허가를 권고하였다.이 의약품의 신청자는 사노피 [203]파스퇴르입니다.수펨텍은 2020년 11월 [25]유럽연합에서 의료 사용을 승인받았다.
호주는 개 신장의 "영원한 세포주"를 기반으로 2021년 3월 최초의 세포 기반 백신을 승인했다.그것이 생산되는 방식 때문에, 그것은 (독감 [23]변종과) 더 잘 맞는 백신을 생산한다.
비용 효율
계절 인플루엔자 백신 접종의 비용 효율은 다양한 그룹 및 다양한 [204]환경에서 광범위하게 평가되어 왔다.고령자(65세 이상)의 경우, 대부분의 발표된 연구에서 독감 예방접종과 관련된 비용 절감(예: 의료 방문 방지)이 [205]예방접종 비용을 초과하여 백신 접종이 비용 절감이라는 사실이 밝혀졌다.노년층(50-64세)에서 인플루엔자 예방접종이 비용 효율적일 가능성이 높은 것으로 발표된 여러 연구에서 밝혀졌지만, 이러한 연구 결과는 종종 경제 [206]평가에 사용된 핵심 가정에 따라 달라지는 것으로 밝혀졌다.인플루엔자 비용 효과 모델의 불확실성은 질병 [207]부담 추정과 관련된 복잡성뿐만 아니라 순환 변종과 [208][209]백신의 일치로 부분적으로 설명될 수 있다.건강한 직장 성인(18-49세)의 경우, 2012년 검토 결과, 백신 접종은 일반적으로 비용을 절감하지 못했으며, 자금 조달에 대한 적합성은 관련 건강 [210]편익을 얻기 위한 지불 의지에 따라 달라졌다.어린이에서 대부분의 연구는 인플루엔자 예방접종이 비용 효율적이라는 것을 밝혀냈다. 그러나 많은 연구는 모든 [211]환경에서 동일한 가중치를 부여하지 않을 수 있는 (간접적인) 생산성 향상을 포함했다.여러 연구는 미래의 대유행으로부터 보호하기 위해 개입의 비용 효과(예비적 예방접종 포함)를 예측하려고 시도했지만, 잠재적 미래 대유행의 심각성과 이에 [212]대한 조치의 효과에 대한 불확실성으로 인해 비용 효과 추정이 복잡해졌다.
조사.
인플루엔자 연구는 분자 바이러스학, 분자 진화, 병리 형성, 숙주 면역 반응, 유전체학, 역학 등을 포함한다.이것들은 백신, 치료법, 진단 도구와 같은 인플루엔자 대책 개발을 돕는다.개선된 인플루엔자 대책은 바이러스가 세포에 침투하고, 복제하고, 돌연변이를 일으키고, 새로운 변종으로 진화하고, 면역 반응을 유도하는 방법에 대한 기초 연구를 필요로 한다.인플루엔자 게놈 배열 분석 프로젝트는 어떤 변종이 다른 변종보다 더 치명적인지, 어떤 유전적 결정 요인이 면역원성에 가장 영향을 미치는지, 그리고 바이러스가 시간이 지남에 따라 어떻게 진화하는지에 대한 연구자들의 이해를 도울 인플루엔자[213] 배열 라이브러리를 만들고 있다.현재 백신 방법의 한계에[when?] 대한 해결책이 연구되고 있다[when?].
다른 접근법은 인터넷 콘텐츠를 사용하여 독감 예방접종 캠페인의 영향을 추정한다.구체적으로는, 연구자들은 트위터와 마이크로소프트의 빙 검색 엔진의 데이터를 사용해, 일련의 조작 후에, 이 정보를 백신 접종이 행해진 지역의 인플루엔자 유사 질병 감소율의 추정치에 매핑하는 통계 프레임워크를 제안했다.이 방법은 영국(2013/14 및 2014/15)에서 두 가지 독감 예방접종 프로그램의 영향을 정량화하기 위해 사용되었으며, 학령기 아동에게 라이브 감쇠 인플루엔자 백신(LAIV)을 투여했다.특히 영향 추정치는 전통적인 신드롬 감시 [214][215]종점에 기초한 영국 공중 보건소의 추정치에 부합했다.
유행성 독감에 대한 신속한 대응
유행성 인플루엔자 백신의 빠른 개발, 생산, 보급은 잠재적으로 유행성 인플루엔자 동안 수백만 명의 생명을 구할 수 있다.유행성 변종 식별과 백신 접종의 필요성 사이의 짧은 기간 때문에, 연구원들은 더 나은 "실시간" 접근을 제공하고 더 저렴하게 생산될 수 있는 백신 생산을 위한 새로운 기술을 찾고 있다. 따라서 인플루엔자가 유행하는 저소득 국가 및 중간소득 국가에 사는 사람들의 접근을 증가시킬 수 있다.ndemic은 라이브 감쇠(생체 기반 또는 세포 기반) 기술 및 재조합 기술(바이러스 및 바이러스 유사 입자)[216]과 같이 발생할 수 있습니다.2009년 7월[update] 현재, 70개 이상의 알려진 임상시험이 완료되었거나 대유행 인플루엔자 [217]백신에 대한 임상시험이 진행 중이다.2009년 9월 FDA는 2009년 H1N1 인플루엔자 바이러스(2009년 대유행형)에 대한 4개의 백신을 승인했으며, 최초 백신 로트는 다음 [218]달 내에 제공될 것으로 예상했다.
2020년 1월 미국 식품의약국(FDA)은 Audenz를 H5N1 독감 바이러스 [219]백신으로 승인했다.Audenz는 백신에 포함된 인플루엔자 A형 바이러스 H5N1 아형에 의한 질병 예방을 위한 능동적 예방접종을 위해 제시된 백신이다.Audenz는 [220]백신에 포함된 인플루엔자 A 바이러스 H5N1 아형에 노출될 위험이 높은 생후 6개월 이상의 사람에게 사용하도록 승인되었습니다.
범용 독감 백신
각 반구의 독감 계절마다 설계되고 만들어질 필요가 없는 "범용 백신"은 공급을 안정시키고 계절의 변이를 예측하는 오류를 방지하며 [181]돌연변이에 의한 순환 변종들의 탈출을 방지할 것이다.그러한 백신은 수십 [221]년 동안 연구 대상이 되어 왔다.
한 가지 접근법은 인체를 자극하여 면역 반응을 일으키는 21세기 최초의 수십 년 동안 사용된 계절 백신과 달리, 대신 면역 반응 자체의 구성요소를 제공하는 광범위한 중화 항체를 사용하는 것이다.최초의 중화 항체는 1993년 실험을 [222]통해 확인되었다.헤마글루티닌 단백질의 줄기에 결합된 독감 중화 항체가 발견되었다.그 단백질의 머리에 결합할 수 있는 항체가 확인되었다.고도로 보존된 M2 양성자 채널은 [221][223]항체를 광범위하게 중화하기 위한 잠재적 대상으로 제안되었다.
연구자들의 도전은 바이러스의 많은 아종을 중화시킬 수 있는 단일 항체를 식별하는 것이다. 그래서 그것들은 어떤 계절에도 유용하게 쓰일 수 있고 항원 [221]표류에 저항하는 보존된 도메인을 목표로 한다.
또 다른 접근 방식과 면역 반응을 불러일으키는 것을 이 항원을 그룹 제공하기 위해 여러분에게 도메인 이 프로젝트에서 확인되다 다른 항원과 다양한 접근법, 다른 방법(로 융합 단백질에 장착되어 있는 바이러스 유사 입자에 대한 비병원성 바이러스 DNA, 그리고 다른 사람들)을 제시하자 개발 아래에 있다.[223][224][225]
강력한 초기 T세포 반응을 가진 사람들이 인플루엔자에 감염되었을 때 그리고 T세포가 보존된 에피토프에 반응하기 때문에 더 나은 결과를 얻는다는 것을 보여주는 임상 데이터를 기반으로 T세포 반응을 특별히 활성화하는 범용 백신을 개발하기 위한 노력도 이루어졌다.개발자들의 과제는 이러한 에피토프가 경미한 면역원성만을 [223]가진 내부 단백질 도메인에 있다는 것이다.
백신 분야의 나머지 부분과 함께, 보편적 백신에 종사하는 사람들은 충분히 강력하고 지속적인 면역 반응을 [223][226]만들기 위한 백신의 능력을 향상시키기 위해 백신 보조제를 실험해 왔다.
경구 인플루엔자 백신
2019년 현재, 경구 독감 백신은 임상 [227]연구 중에 있다.경구백신 후보는 복제에 필요한 유전자를 제거하기 위해 변형된 아데노바이러스 타입 5 벡터에 기초하고 있으며, 보조제로서 작은 이중가닥 RNA 헤어핀 [228]분자를 발현하는 추가 유전자를 가지고 있다.2020년 백신 알약 형태에 대한 2단계 인체 실험은 그것이 잘 내성이 있고 허가된 주사 가능 [229]백신과 유사한 면역성을 제공한다는 것을 보여주었다.
수의학에서의 사용
수의학용 인플루엔자 예방접종은 다음의 [230]4가지 목적을 달성하는 것을 목표로 한다.
- 임상 질환으로부터의 보호
- 치명적인 바이러스에 의한 감염으로부터 보호
- 바이러스 배출로부터 보호
- 백신 접종 동물과 감염된 동물의 혈청학적 구별(이른바 DIVA 원리)
말들
말독감에 걸린 말은 열이 나고 마른 기침이 나고 콧물이 나고 며칠 동안 우울해지고 먹거나 마시기를 꺼려하지만 보통 2, 3주 안에 회복된다."예방접종 일정에는 일반적으로 3~6주 간격으로 두 가지 선량의 1차 코스가 필요하며, 그 후 6~12개월 간격으로 보조제가 필요하다.대부분의 경우 그러한 일정이 항체의 보호 수준을 유지하지 못할 수 있으며 고위험 상황에서는 [231]더 자주 투여하는 것이 좋습니다."
영국에서는 말에게 말 독감 예방접종을 하고 예방접종 카드를 제시해야 하는 것이 일반적인 요구 사항이다. 국제 승마 스포츠 연맹은 6개월마다 [232][233]예방접종을 해야 한다.
가금류
조류독감용 가금류 백신은 저렴하게 만들어져 인간 백신처럼 여과·정제되지 않아 세균이나 다른 바이러스를 제거할 수 있다.그것들은 보통 대부분의 인간 독감 백신에서처럼 헤마글루티닌뿐만 아니라 전체 바이러스를 포함하고 있다.인간과 가금류의 또 다른 차이점은 가금류 백신에 미네랄 오일을 첨가해 강한 면역 반응을 유발하지만 염증과 농양을 유발할 수 있다는 것이다.의사들은 "실수로 자신들을 찔렀던 닭 예방접종자들은 아픈 손가락이 붓거나 심지어 엄지손가락을 잃기도 했다"고 말했다.효과도 제한적일 수 있습니다.닭 백신은 종종 순환하는 독감 변종과 약간 비슷할 뿐인데, 일부는 수년 전 멕시코에서 격리된 H5N2 변종을 포함하고 있다."닭과 함께, 85%만 관련이 있는 백신을 사용한다면, 당신은 보호를 받을 것입니다,"라고 카도나 박사는 말했다.'인간의 경우 1점 돌연변이를 일으킬 수 있으며, 99.99%와 관련된 백신은 당신을 보호하지 못할 것입니다.'그리고 그것들은 (인간 백신보다) 약하다."치킨은 더 작고 6주 동안만 보호하면 됩니다. 왜냐하면 닭은 여러분이 먹기 전까지 오래 살기 때문입니다,"라고 로체스터 대학의 백신 전문가인 존 J. 트레노르 박사는 말했다.인간의 계절독감 백신에는 약 45마이크로그램의 항원이 들어 있으며 실험용 A(H5N1) 백신에는 180개의 항원이 들어 있다.닭백신은 1마이크로그램 미만일 수 있다."가금류에서 사람으로 데이터를 추정하는 데 신중해야 합니다." 데이비드 E 박사가 경고했다.농무부 남동부 가금류 연구소장인 스웨이네 씨.새는 공룡과 더 가까운 관계다.[234]
스코틀랜드 에딘버러 대학의 니콜라스 새빌이 이끄는 연구원들은 H5N1의 확산을 시뮬레이션하기 위해 수학적 모델을 사용했고 "바이러스가 소리 없이 퍼지는 것을 막기 위해서는 적어도 95%의 새들이 보호되어야 한다"고 결론지었다.실제로 90% 이상의 무리를 보호하는 것은 어렵습니다.백신을 통해 달성되는 보호 수준은 보통 [235]이보다 훨씬 낮습니다."유엔 식량농업기구는 예방접종을 [236]포함한 가금류 조류독감의 예방과 통제에 관한 권고안을 발표했다.
인간을 위한 여과되고 정제된 인플루엔자 A 백신이 개발되고[when?] 있고 많은 나라들이 비축할 것을 권고하고 있다. 그래서 조류 인플루엔자 대유행이 인간에게 퍼지기 시작하면, 사망을 피하기 위해 백신을 빠르게 투여할 수 있다.조류독감은 때때로 조류독감이라고 불리며, 보통 조류독감으로 [237]불린다.
돼지
돼지 인플루엔자 백신은 유럽과 북미에서 돼지 사육에 널리 사용되고 있다.대부분의 신종플루 백신에는 H1N1과 H3N2 변종이 포함되어 있다.
돼지 인플루엔자는 1976년 발병 이후 주요 문제로 인식되어 왔다.바이러스의 진화는 전통적인 백신에 대한 일관성 없는 반응을 초래했다.표준 시판되는 돼지 독감 백신은 바이러스 변종들이 상당한 상호 보호를 할 수 있을 만큼 충분히 일치할 때 문제를 통제하는데 효과적이다.격리된 특정 바이러스로 만들어진 맞춤형(자생) 백신이 만들어지고 [238]더 어려운 경우에 사용된다.백신 제조업체인 노바티스는 H3N2 변종(1998년 처음 확인됨)이 돼지 농가에 큰 손실을 입혔다고 주장한다.낙태 폭풍은 흔한 징후이고 암퇘지는 며칠 동안 먹는 것을 멈추고 고열이 난다.사망률은 15퍼센트까지 [239]높을 수 있다.
개들
2004년, 인플루엔자 A 바이러스의 아형 H3N8이 개 인플루엔자를 일으키는 것으로 밝혀졌다.이전에 이 바이러스에 노출되지 않았기 때문에, 개들은 이 바이러스에 대한 자연적인 면역력을 가지고 있지 않다.그러나 2004년에 [240]백신이 발견되었다.
연간 리폼
WHO의 세계 인플루엔자 감시 및 대응 [241]시스템에 의해 매년 세 개의 변종이 그 해의 독감 예방 접종에서 선택됩니다.선택된 변종들은 다음 계절에 심각한 고통을 야기할 것으로 생각되는 H1N1, H3N2, 그리고 B형 변종들이다.WHO는 2012-2013년 북반구 인플루엔자 시즌부터 (4대 인플루엔자 백신 승인과 함께) 4대 인플루엔자 백신에 사용할 두 번째 B-스트레인 사용을 권고했다.세계보건기구(WHO)는 내년에 공격할 가능성이 가장 높은 변종 바이러스를 포함시키기 위해 매년 백신 내용을 조율한다.
- "WHO 글로벌 인플루엔자 감시 네트워크는 1952년에 설립되었습니다[[242]2011년에 "글로벌 인플루엔자 감시 및 대응 시스템"으로 명칭 변경].네트워크는 WHO가 WHO 국가 인플루엔자 센터(NIC)로 인정한 83개국의 4개 WHO 협력 센터(WHO CCs)와 112개 기관으로 구성된다.이들 NIC는 자국 내에서 검체를 채취하여 1차 바이러스 분리 및 예비 항원 특성 분석을 수행합니다.그들은 높은 수준의 항원과 유전자 분석을 위해 새롭게 격리된 변종을 WHO CC에 출하하고 있으며, 그 결과 매년 [243]북반구와 남반구에 대한 인플루엔자 백신 조성에 대한 WHO 권고의 근거가 됩니다."
글로벌 인플루엔자 감시 및 대응 시스템이 백신 제조 과정을 위해 바이러스를 선택한 것은 내년에 어떤 변종이 우세할지에 대한 최선의 추정에 기초하고 있으며, 결국 정보에 정통하지만 틀릴 [244]수 있는 추측에 근거하고 있다.
WHO의 공식 권고는 1973년에 처음 발표되었습니다.1999년부터 매년 두 가지 권고가 있었습니다. 하나는 북반구이고 다른 하나는 남반구입니다.[245]
인플루엔자 백신의 역사적인 연간 재구성은 별도의 기사에 기재되어 있다.WHO의[update] 최근 계절 인플루엔자 백신 구성 권장 사항:
2020년~1965년 북반구
세계보건기구(WHO)가 2020년 2월 28일 권고하는 2020-2021년 북반구 인플루엔자 시즌에 사용하기 위한 바이러스 백신의 구성은 다음과[246] 같다.
계란 베이스의 경우:
- A/광둥-마오난/SWL1536/2019(H1N1) pdm09 유사바이러스
- A/홍콩/2671/2019(H3N2) 유사바이러스
- B/워싱턴/02/2019(B/빅토리아 계통) 유사 바이러스
- B/Puket/3073/2013(B/야마가타 계통) 유사 바이러스
세포 또는 재조합 기반의 경우:
- A/Hawaii/70/2019(H1N1) pdm09 유사바이러스
- A/홍콩/45/2019(H3N2) 유사바이러스
- B/워싱턴/02/2019(B/빅토리아 계통) 유사 바이러스
- B/Puket/3073/2013(B/야마가타 계통) 유사 바이러스
WHO는 3가 백신이 인플루엔자 B 바이러스로 B/워싱턴/02/2019([246]B/빅토리아 계통) 유사 바이러스를 사용할 것을 권고하고 있다.
- 미국
미국 식품의약국(FDA)의 백신 및 관련 생물학적 제품 자문위원회(VRBPAC)는 미국 2020-2021년 인플루엔자 시즌을 위한 계란 기반 인플루엔자 백신의 4차 배합에 [247]다음이 포함되도록 권고했다.
- A/광둥-마오난/SWL1536/2019(H1N1) pdm09 유사 바이러스
- A/HongKong/2671/2019(H3N2) 유사 바이러스
- B/Washington/02/2019 유사 바이러스(B/Victoria 계통)
- B/Puket/3073/2013 유사 바이러스(B/야마가타 계통).
위원회는 미국 2020-2021년 인플루엔자 시즌에 세포 또는 재조합 기반 인플루엔자 백신의 4대 경쟁 제품에는 [247]다음이 포함될 것을 권고했다.
- A/Hawaii/70/2019(H1N1) pdm09 유사 바이러스
- A/HongKong/45/2019(H3N2) 유사 바이러스
- B/Washington/02/2019 유사 바이러스(B/Victoria 계통)
- B/Puket/3073/2013 유사 바이러스(B/야마가타 계통)
2020-2021년 인플루엔자 시즌에 미국에서 사용되는 3가 인플루엔자 백신의 경우, 위원회는 백신 제조 방법에 따라 4가 인플루엔자 백신을 위해 위에서 권장한 A(H1N1)pdm09, A(H3N2) 및 B/Victoria 계보 바이러스를 [247]사용할 것을 권고했다.
- 유럽 연합
2020년 4월 1일 유럽 의약품청이 추천한 2020-2021년 북반구 인플루엔자 시즌에 유럽연합에서 사용하기 위한 바이러스 백신 구성은 다음과 같다.[248]
계란 기반 또는 활성 감쇠 3가 백신은 다음을 [248]포함해야 한다.
- A/광둥-마오난/SWL1536/2019(H1N1) pdm09 유사 바이러스
- A/Hong/2671/2019(H3N2) 유사 바이러스
- B/Washington/02/2019(B/Victoria 혈통) 유사 바이러스.
세포 기반 3가 백신은 다음을 [248]포함해야 한다.
- A/Hawaii/70/2019(H1N1) pdm09 유사 바이러스
- A/홍콩/45/2019(H3N2) 유사 바이러스
- B/Washington/02/2019(B/Victoria 혈통) 유사 바이러스.
4차 접종 [248]백신에는 위에 언급된 변종 외에 B/Puket/3073/2013 유사 바이러스가 권장된다.
2021년 남반구
세계보건기구(WHO)[249]가 2020년 9월 권장한 2021년 남반구 인플루엔자 시즌용 백신 구성:
계란 기반(3가):
- A/Victoria/2570/2019(H1N1) pdm09 유사 바이러스
- A/홍콩/2671/2019(H3N2) 유사 바이러스
- B/Washington/02/2019(B/Victoria 혈통) 유사 바이러스.
세포 또는 재조합 기반(3가):
- A/Wisconsin/588/2019(H1N1) pdm09 유사 바이러스
- A/홍콩/45/2019(H3N2) 유사 바이러스
- B/Washington/02/2019(B/Victoria 혈통) 유사 바이러스.
쿼드라이벌 버전에는 위의 내용과 더불어 다음과 같은 내용이 포함되어 있어야 합니다.
- B/Puket/3073/2013(B/야마가타 계통) 유사 바이러스.
호주에서 2021년 국가면역프로그램에 따른 표준 백신은 4차 백신이다.[250]
2021년~1963년 북반구
2021-2022년 북반구 인플루엔자 시즌에 사용할 바이러스 백신의 구성은 다음과 같다.
- 유럽 연합
2021년 3월 30일 유럽 의약품청이 추천한 2021-2022년 북반구 인플루엔자 시즌에 유럽연합에서 사용하기 위한 바이러스 백신 구성은 다음과 같다.[251][252]
계란 기반 또는 활성 감쇠 3가 백신은 다음을 [251]포함해야 한다.
- A/Victoria/2570/2019(H1N1) pdm09 유사 바이러스
- A/Cambodia/e0826360/2020(H3N2) 유사 바이러스
- B/Washington/02/2019(B/Victoria 혈통) 유사 바이러스.
세포 기반 3가 백신은 다음을 [251]포함해야 한다.
- A/Wisconsin/588/2019(H1N1) pdm09 유사 바이러스
- A/Cambodia/e0826360/2020(H3N2) 유사 바이러스
- B/Washington/02/2019(B/Victoria 혈통) 유사 바이러스.
4차 접종 [251]백신에는 위에 언급된 변종 외에 B/Puket/3073/2013 유사 바이러스가 권장된다.
2022년 남반구
세계보건기구(WHO)[253]가 2021년 9월 권장한 2022년 남반구 인플루엔자 시즌용 백신 구성:
계란 기반 백신:
- A/Victoria/2570/2019(H1N1) pdm09 유사 바이러스
- A/Darwin/9/2021(H3N2) 유사 바이러스
- B/오스트리아/1359417/2021(B/빅토리아 계통) 유사 바이러스 및
- B/Puket/3073/2013(B/야마가타 계통) 유사 바이러스.
세포 기반 또는 재조합 기반 백신:
- A/Wisconsin/588/2019(H1N1) pdm09 유사 바이러스
- A/Darwin/6/2021(H3N2) 유사 바이러스
- B/오스트리아/1359417/2021(B/빅토리아 계통) 유사 바이러스 및
- B/Puket/3073/2013(B/야마가타 계통) 유사 바이러스.
2022년 남반구 인플루엔자 시즌에 사용할 3가 인플루엔자 백신은 다음을 포함할 것을 권고한다.
계란 기반 백신:
- A/Victoria/2570/2019(H1N1) pdm09 유사 바이러스
- A/Darwin/9/2021(H3N2) 유사 바이러스 및
- B/오스트리아/1359417/2021(B/빅토리아 계통) 유사 바이러스.
세포 기반 또는 재조합 기반 백신:
- A/Wisconsin/588/2019(H1N1) pdm09 유사 바이러스
- A/Darwin/6/2021(H3N2) 유사 바이러스 및
- B/오스트리아/1359417/2021(B/빅토리아 계통) 유사 바이러스
2022년-195년 북반구
2022-2023년 북반구 인플루엔자 시즌에 사용할[254] 바이러스 백신의 구성은 다음과 같다.
- 유럽 연합
2022년 3월 29일 유럽 의약품청이 추천한 2022-2023년 북반구 인플루엔자 시즌에 유럽연합에서 사용하기 위한 바이러스 백신 구성은 다음과 같다.[255][256]
4대 경쟁 달걀 기반 또는 생감쇠 백신에는 [255]다음이 포함되어야 한다.
- A/Victoria/2570/2019(H1N1) pdm09 유사 바이러스
- A/Darwin/9/2021(H3N2) 유사 바이러스
- B/오스트리아/1359417/2021(B/Victoria 계통) 유사 바이러스
- B/Puket/3073/2013(B/야마가타 계통) 유사 바이러스.
4대 세포 배양 또는 재조합 기반 백신은 다음을 [255]포함해야 한다.
- A/Wisconsin/588/2019(H1N1) pdm09 유사 바이러스
- A/Darwin/6/2021(H3N2) 유사 바이러스
- B/오스트리아/1359417/2021(B/Victoria 계통) 유사 바이러스
- B/Puket/3073/2013(B/야마가타 계통) 유사 바이러스.
메모들
- ^ (H1N1) pdm09는 2009년 대유행 H1N1 바이러스의 새로운 명칭으로 다른 변종이 아닙니다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b "AusPAR: Influenza Haemagglutinin Recombinant". Therapeutic Goods Administration (TGA). August 23, 2021. Retrieved September 10, 2021.
- ^ a b "AusPAR: Inactivated quadrivalent influenza vaccine (split virion) influenza virus haemagglutinin". Therapeutic Goods Administration (TGA). December 2, 2020. Retrieved September 10, 2021.
- ^ "Summary Basis of Decision (SBD) for Supemtek". Health Canada. October 23, 2014. Retrieved May 29, 2022.
- ^ "Regulatory Decision Summary - Flucelvax Quad". Health Canada. October 23, 2014. Retrieved June 7, 2022.
- ^ "Regulatory Decision Summary - Flucelvax Quad". Health Canada. October 23, 2014. Retrieved June 7, 2022.
- ^ "Regulatory Decision Summary - Influvac Tetra". Health Canada. October 23, 2014. Retrieved June 7, 2022.
- ^ a b c d e f g h i j World Health Organization (November 2012). "Vaccines against influenza WHO position paper". Weekly Epidemiological Record. 87 (47): 461–76. hdl:10665/241993. PMID 23210147. Lay summary (PDF).
{{cite journal}}:Cite는 사용되지 않는 매개 변수를 사용합니다.lay-url=(도움말) - ^ Manzoli L, Ioannidis JP, Flacco ME, De Vito C, Villari P (July 2012). "Effectiveness and harms of seasonal and pandemic influenza vaccines in children, adults and elderly: a critical review and re-analysis of 15 meta-analyses". Human Vaccines & Immunotherapeutics. 8 (7): 851–62. doi:10.4161/hv.19917. PMC 3495721. PMID 22777099.
- ^ Rolfes MA, Foppa IM, Garg S, Flannery B, Brammer L, Singleton JA, et al. (December 9, 2016). "2015–2016 Estimated Influenza Illnesses, Medical visits, and Hospitalizations Averted by Vaccination in the United States". U.S. Centers for Disease Control and Prevention (CDC). Archived from the original on December 2, 2019. Retrieved December 24, 2017.
 이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다..
이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다.. - ^ Centers for Disease Control and Prevention (January 16, 2020). "Benefits of Flu Vaccination During 2018-2019 Flu Season". Centers for Disease Control and Prevention (CDC). Retrieved April 10, 2020.
- ^ a b c d e f Demicheli V, Jefferson T, Ferroni E, Rivetti A, Di Pietrantonj C (February 2018). "Vaccines for preventing influenza in healthy adults". Cochrane Database of Systematic Reviews. 2020 (2): CD001269. doi:10.1002/14651858.CD001269.pub6. PMC 6491184. PMID 29388196.
- ^ a b c Osterholm MT, Kelley NS, Sommer A, Belongia EA (January 2012). "Efficacy and effectiveness of influenza vaccines: a systematic review and meta-analysis". The Lancet. Infectious Diseases. 12 (1): 36–44. doi:10.1016/S1473-3099(11)70295-X. PMID 22032844.
- ^ a b Demicheli V, Jefferson T, Di Pietrantonj C, Ferroni E, Thorning S, Thomas RE, Rivetti A (February 2018). "Vaccines for preventing influenza in the elderly". Cochrane Database of Systematic Reviews. 2 (11): CD004876. doi:10.1002/14651858.CD004876.pub4. PMC 6491101. PMID 29388197.
- ^ Compans RW (2009). Vaccines for pandemic influenza. Dordrecht: Springer. p. 49. ISBN 978-3540921653.
- ^ Vaccine Analysis: Strategies, Principles, and Control. Springer. 2014. p. 61. ISBN 978-3662450246.
- ^ World Health Organization (2019). World Health Organization model list of essential medicines: 21st list 2019. Geneva: World Health Organization. hdl:10665/325771. WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ^ a b c d "Who Should and Who Should NOT get a Flu Vaccine". U.S. Centers for Disease Control and Prevention (CDC). October 11, 2019. Archived from the original on December 2, 2019. Retrieved December 2, 2019.
 이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다..
이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다.. - ^ World Health Organization (October 2017). The immunological basis for immunization series: module 23: influenza vaccines. World Health Organization (WHO). hdl:10665/259211. ISBN 978-9241513050.
- ^ a b c d e f g h i j k l m n o p q r s Grohskopf LA, Alyanak E, Ferdinands JM, Broder KR, Blanton LH, Talbot HK, et al. (August 2021). "Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices, United States, 2021-22 Influenza Season" (PDF). MMWR Recomm Rep. 70 (5): 1–28. doi:10.15585/mmwr.rr7005a1. PMC 8407757. PMID 34448800.
 이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다..
이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다.. - ^ "Implementation of the Council Recommendation on seasonal influenza vaccination (2009/1019/EU)" (PDF). European Centre for Disease Prevention and Control. January 2014. Retrieved April 10, 2020. Lay summary.
{{cite web}}:Cite는 사용되지 않는 매개 변수를 사용합니다.lay-url=(도움말) - ^ Committee to Review Adverse Effects of Vaccines; Institute of Medicine of the National Academies (2012). Stratton, Kathleen; Ford, Andrew; Rusch, Erin; Clayton, Ellen Wright (eds.). Adverse Effects of Vaccines: Evidence and Causality. National Academy of Sciences. pp. 293–419.
- ^ a b c d e "Flu Vaccine and People with Egg Allergies". U.S. Centers for Disease Control and Prevention (CDC). November 25, 2019. Archived from the original on December 2, 2019. Retrieved December 2, 2019.
 이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다..
이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다.. - ^ a b c d Roberts L (March 27, 2021). "Australia's first cell-based influenza vaccines to roll out this flu season". ABC News. Retrieved April 28, 2021.
- ^ a b "Novartis receives FDA approval for Flucelvax, the first cell-culture vaccine in US to help protect against seasonal influenza" (Press release). Novartis. November 20, 2012. Archived from the original on November 28, 2012.
- ^ a b "Supemtek EPAR". European Medicines Agency (EMA). September 15, 2020. Retrieved November 27, 2020.
- ^ "Intradermal Influenza (Flu) Vaccination". U.S. Centers for Disease Control and Prevention (CDC). October 31, 2018. Archived from the original on October 14, 2019. Retrieved October 14, 2019.
 이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다..
이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다.. - ^ "Influenza vaccines – United States, 2019–20 influenza season". U.S. Centers for Disease Control and Prevention (CDC). August 22, 2019. Archived from the original on October 14, 2019. Retrieved October 14, 2019.
 이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다..
이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다.. - ^ "Influenza Virus Vaccine Inactivated". The American Society of Health-System Pharmacists. November 19, 2018. Archived from the original on October 14, 2019. Retrieved October 13, 2019.
- ^ Institute of Medicine (2005). Knobler SL, Mack A, Mahmoud A, Lemon SM (eds.). The Threat of Pandemic Influenza: Are We Ready? Workshop Summary. The National Academies Press. p. 62. doi:10.17226/11150. ISBN 978-0-309-09504-4. PMID 20669448.
- ^ 플롯킨, S.L. 및 S.A. 플롯킨. "백신의 짧은 이력"인: 백신, 스탠리 A.플로트킨, 월터 A.오렌슈타인, 폴 A.오프잇, 에드Elsevier Health Sciences, 2008, 페이지 6-7.
- ^ A.W. "인플루엔자"의 Artainstein, A.W. 앤드류 W. 아르텐슈타인 전기, ed. 191–205.
- ^ Hampson AW (June 2008). "Vaccines for pandemic influenza. The history of our current vaccines, their limitations and the requirements to deal with a pandemic threat". Annals of the Academy of Medicine, Singapore. 37 (6): 510–17. PMID 18618064.
- ^ Milián E, Kamen AA (2015). "Current and emerging cell culture manufacturing technologies for influenza vaccines". Biomed Res Int. 2015: 504831. doi:10.1155/2015/504831. PMC 4359798. PMID 25815321.
- ^ a b "FDA approves first seasonal influenza vaccine manufactured using cell culture technology" (Press release). U.S. Food and Drug Administration (FDA). Archived from the original on January 2, 2013.
 이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다..
이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다.. - ^ "Cell-Based Flu Vaccines". U.S. Centers for Disease Control and Prevention (CDC). October 11, 2019. Archived from the original on December 2, 2019. Retrieved December 2, 2019.
 이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다..
이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다.. - ^ a b "FDA approves new seasonal influenza vaccine made using novel technology" (Press release). U.S. Food and Drug Administration (FDA). January 16, 2013. Archived from the original on May 18, 2013.
 이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다..
이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다.. - ^ Landry N, Ward BJ, Trépanier S, Montomoli E, Dargis M, Lapini G, Vézina LP (December 2010). "Preclinical and clinical development of plant-made virus-like particle vaccine against avian H5N1 influenza". PLOS ONE. 5 (12): e15559. Bibcode:2010PLoSO...515559L. doi:10.1371/journal.pone.0015559. PMC 3008737. PMID 21203523.
- ^ Osterholm MT (May 2005). "Preparing for the next pandemic". The New England Journal of Medicine. 352 (18): 1839–42. CiteSeerX 10.1.1.608.6200. doi:10.1056/NEJMp058068. PMID 15872196.
- ^ "Swine Flu Epidemics". October 9, 1999. Archived from the original on October 9, 1999.
- ^ McCullers JA, Van De Velde LA, Allison KJ, Branum KC, Webby RJ, Flynn PM (June 2010). "Recipients of vaccine against the 1976 "swine flu" have enhanced neutralization responses to the 2009 novel H1N1 influenza virus". Clinical Infectious Diseases. 50 (11): 1487–92. doi:10.1086/652441. PMC 2946351. PMID 20415539.
- ^ "First Quadrivalent Vaccine Against Seasonal Flu Wins FDA Approval". March 2, 2012. Archived from the original on March 4, 2012.
- ^ "FDA approves first quadrivalent vaccine to prevent seasonal influenza" (Press release). U.S. Food and Drug Administration (FDA). Archived from the original on December 21, 2012.
 이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다..
이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다.. - ^ "December 14, 2012 Approval Letter – Fluarix Quadrivalent". U.S. Food and Drug Administration (FDA). Archived from the original on January 2, 2013.
 이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다..
이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다.. - ^ National Advisory Committee on Immunization (NACI) (July 2014). Literature review on quadrivalent influenza vaccines (PDF). Public Health Agency of Canada. Ottawa. ISBN 978-1-100-24682-6. Cat.: HP40-117/2014E-PDF Pub.: 140118. Retrieved January 11, 2020.
- ^ "What You Should Know for the 2018-2019 Influenza Season". Centers for Disease Control and Prevention (CDC). January 10, 2019. Retrieved February 5, 2020.
 이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다..
이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다.. - ^ a b c d e f g Centers for Disease Control and Prevention (CDC), National Center for Immunization and Respiratory Diseases (NCIRD) (November 5, 2019). "Frequently Asked Influenza (Flu) Questions: 2019–2020 Season". U.S. Centers for Disease Control and Prevention (CDC). Archived from the original on December 1, 2019. Retrieved November 30, 2019.
 이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다..
이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다.. - ^ "Fluzone High-Dose Quadrivalent". U.S. Food and Drug Administration (FDA). November 4, 2019. STN: BL 103914. Retrieved February 5, 2020.
 이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다..
이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다.. - ^ "FDA approves Fluzone High-Dose Quadrivalent (Influenza Vaccine) for adults 65 years of age and older". Sanofi (Press release). November 4, 2019. Retrieved February 5, 2020.
- ^ a b c "Fluad Quadrivalent". U.S. Food and Drug Administration (FDA). July 2, 2020. STN: 125510. Retrieved August 25, 2020.
 이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다..
이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다.. - ^ "Seqirus Receives FDA Approval for Fluad Quadrivalent for Adults 65 Years and Older". Seqirus (Press release). February 24, 2020. Retrieved August 25, 2020.
- ^ "Seqirus Begins Shipping 2020/21 Influenza Vaccines to U.S. Market". Seqirus (Press release). July 30, 2020. Retrieved August 25, 2020.
- ^ a b c d e f "Key Facts About Seasonal Flu Vaccine". U.S. Centers for Disease Control and Prevention (CDC). December 2, 2019. Archived from the original on December 2, 2019. Retrieved December 2, 2019.
 이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다..
이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다.. - ^ a b 독감 백신 NHS
- ^ Osterholm MT, Kelley NS, Sommer A, Belongia EA (January 2012). "Efficacy and effectiveness of influenza vaccines: a systematic review and meta-analysis". The Lancet. Infectious Diseases. 12 (1): 36–44. doi:10.1016/s1473-3099(11)70295-x. PMID 22032844.
- ^ MacIntyre CR, Mahimbo A, Moa AM, Barnes M (December 2016). "Influenza vaccine as a coronary intervention for prevention of myocardial infarction". Heart. 102 (24): 1953–1956. doi:10.1136/heartjnl-2016-309983. PMC 5256393. PMID 27686519.
- ^ "Past Seasons Vaccine Effectiveness Estimates". U.S. Centers for Disease Control and Prevention (CDC). January 29, 2020. Archived from the original on February 12, 2020. Retrieved March 4, 2019.
 이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다..
이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다.. - ^ Centers for Disease Control Prevention (CDC) (August 13, 2004). "Assessment of the effectiveness of the 2003-04 influenza vaccine among children and adults--Colorado, 2003". MMWR. Morbidity and Mortality Weekly Report. Centers for Disease Control and Prevention. 53 (31): 707–710. ISSN 1545-861X. PMID 15306754. 식탁에서.
- ^ Centers for Disease Control Prevention (CDC) (January 16, 2004). "Preliminary assessment of the effectiveness of the 2003-04 inactivated influenza vaccine--Colorado, December 2003". MMWR. Morbidity and Mortality Weekly Report. Centers for Disease Control and Prevention. 53 (1): 8–11. ISSN 1545-861X. PMID 14724559.
- ^ "Past Weekly Surveillance Reports". Centers for Disease Control and Prevention. April 29, 2022.
- ^ Chung JR (March 11, 2022). "Interim Estimates of 2021–22 Seasonal Influenza Vaccine Effectiveness — United States, February 2022". MMWR. Morbidity and Mortality Weekly Report. 71 (10): 365–370. doi:10.15585/mmwr.mm7110a1. ISSN 0149-2195. PMC 8911998. PMID 35271561.
- ^ Eamon N. Dreisbach (June 3, 2021). "CDC unable to estimate flu vaccine effectiveness after historically mild season". Healio. Archived from the original on October 8, 2021. Retrieved April 18, 2022.
- ^ Fedson DS (1998). "Measuring protection: efficacy versus effectiveness". Developments in Biological Standardization. 95: 195–201. PMID 9855432.
- ^ Jefferson T (October 2006). "Influenza vaccination: policy versus evidence". BMJ. 333 (7574): 912–15. doi:10.1136/bmj.38995.531701.80. PMC 1626345. PMID 17068038.
- ^ "2007–2008 Influenza (Flu) Season". U.S. Centers for Disease Control and Prevention (CDC). June 26, 2008. Archived from the original on March 6, 2008.
 이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다..
이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다.. - ^ Carrat F, Flahault A (September 2007). "Influenza vaccine: the challenge of antigenic drift". Vaccine. 25 (39–40): 6852–6862. doi:10.1016/j.vaccine.2007.07.027. PMID 17719149.
- ^ Sautto GA, Kirchenbaum GA, Ross TM (January 19, 2018). "Towards a universal influenza vaccine: different approaches for one goal". Virology Journal. 15 (1): 17. doi:10.1186/s12985-017-0918-y. PMC 5785881. PMID 29370862.
- ^ a b Chow EJ, Doyle JD, Uyeki TM (June 12, 2019). "Influenza virus-related critical illness: prevention, diagnosis, treatment". Critical Care. 23 (1): 214. doi:10.1186/s13054-019-2491-9. PMC 6563376. PMID 31189475.
- ^ Krammer F, Smith GJ, Fouchier RA, Peiris M, Kedzierska K, Doherty PC, Palese P, Shaw ML, Treanor J, Webster RG, García-Sastre A (June 28, 2018). "Influenza". Nature Reviews Disease Primers. 4 (1): 3. doi:10.1038/s41572-018-0002-y. PMC 7097467. PMID 29955068.
- ^ Dabestani NM, Leidner AJ, Seiber EE, Kim H, Graitcer SB, Foppa IM, Bridges CB (September 2019). "A review of the cost-effectiveness of adult influenza vaccination and other preventive services". Preventive Medicine. 126: 105734. doi:10.1016/j.ypmed.2019.05.022. PMC 6778688. PMID 31152830.
- ^ a b c Ghebrehewet S, MacPherson P, Ho A (December 7, 2016). "Influenza". The BMJ. 355: i6258. doi:10.1136/bmj.i6258. PMC 5141587. PMID 27927672.
- ^ a b Principi N, Esposito S (March 4, 2018). "Protection of children against influenza: Emerging problems". Human Vaccines & Immunotherapeutics. 14 (3): 750–757. doi:10.1080/21645515.2017.1279772. PMC 5861800. PMID 28129049.
- ^ Thompson MG, Pierse N, Huang QS, Prasad N, Duque J, Newbern EC, et al. (September 18, 2018). "Influenza vaccine effectiveness in preventing influenza-associated intensive care admissions and attenuating severe disease among adults in New Zealand 2012–2015". Vaccine. 36 (39): 5916–5925. doi:10.1016/j.vaccine.2018.07.028. ISSN 0264-410X. PMID 30077480. S2CID 51922011.
- ^ Tenforde MW, Talbot HK, Trabue CH, Gaglani M, McNeal TS, Monto AS, et al. (December 30, 2020). "Influenza Vaccine Effectiveness Against Hospitalization in the United States, 2019–2020". The Journal of Infectious Diseases. 224 (5): 813–820. doi:10.1093/infdis/jiaa800. ISSN 0022-1899. PMC 8408767. PMID 33378531.
- ^ Ferdinands JM, Thompson MG, Blanton L, Spencer S, Grant L, Fry AM (June 23, 2021). "Does influenza vaccination attenuate the severity of breakthrough infections? A narrative review and recommendations for further research". Vaccine. 39 (28): 3678–3695. doi:10.1016/j.vaccine.2021.05.011. ISSN 0264-410X. PMID 34090700. S2CID 235361401.
- ^ a b c "Vaccine Effectiveness: How Well Do the Flu Vaccines Work?". U.S. Centers for Disease Control and Prevention (CDC). October 12, 2018. Archived from the original on October 25, 2019. Retrieved October 24, 2019.
 이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다..
이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다.. - ^ Ramsay LC, Buchan SA, Stirling RG, Cowling BJ, Feng S, Kwong JC, et al. (January 2019). "The impact of repeated vaccination on influenza vaccine effectiveness: a systematic review and meta-analysis". BMC Med. 17 (1): 9. doi:10.1186/s12916-018-1239-8. PMC 6327561. PMID 30626399.
- ^ Belongia EA, Skowronski DM, McLean HQ, Chambers C, Sundaram ME, De Serres G (July 2017). "Repeated annual influenza vaccination and vaccine effectiveness: review of evidence". Expert Rev Vaccines. 16 (7): 723–36. doi:10.1080/14760584.2017.1334554. PMID 28562111.
- ^ Gemmill I, Young K (June 7, 2018). "Summary of the NACI literature review on the comparative effectiveness of subunit and split virus inactivated influenza vaccines in older adults". Canada Communicable Disease Report. 44 (6): 129–133. doi:10.14745/ccdr.v44i06a02. ISSN 1481-8531. PMC 6449119. PMID 31015805.
- ^ "Flu & People 65 Years and Older". Centers for Disease Control and Prevention. August 26, 2021. Retrieved April 21, 2022.
- ^ Flu jab vital this winter along with Covid vaccine BBC
- ^ Brownlee S (November 1, 2009). "Does the Vaccine Matter?". The Atlantic. Archived from the original on December 9, 2014. Retrieved December 8, 2014.
- ^ Rabin RC (November 5, 2012). "Reassessing Flu Shots as the Season Draws Near". The New York Times. Archived from the original on November 10, 2016. Retrieved December 30, 2016.
'We have overpromoted and overhyped this vaccine,' said Michael T. Osterholm, director of the Center for Infectious Disease Research and Policy, as well as its Center of Excellence for Influenza Research and Surveillance. 'It does not protect as promoted. It's all a sales job: it's all public relations.'
- ^ a b "Influenza Historic Timeline Pandemic Influenza (Flu) CDC". March 11, 2020.
- ^ a b "Influenza (Seasonal)". World Health Organization (WHO). November 6, 2018. Archived from the original on October 25, 2019. Retrieved October 24, 2019.
- ^ "Study of Flu-Related Deaths in Children Shows Healthy Children at Risk". U.S. Centers for Disease Control and Prevention (CDC). February 12, 2018. Archived from the original on December 2, 2019. Retrieved December 2, 2019.
 This article incorporates text from this source, which is in the public domain.
This article incorporates text from this source, which is in the public domain. - ^ a b Jefferson T, Rivetti A, Di Pietrantonj C, Demicheli V (February 2018). "Vaccines for preventing influenza in healthy children". Cochrane Database of Systematic Reviews. 2: CD004879. doi:10.1002/14651858.CD004879.pub5. PMC 6491174. PMID 29388195.
- ^ Steenhuysen J (January 22, 2018). "U.S. CDC director urges flu vaccinations as pediatric deaths mount". Reuters. Retrieved January 26, 2018.
- ^ "Fluzone High-Dose Quadrivalent". U.S. Food and Drug Administration (FDA). November 14, 2019. Archived from the original on December 1, 2019. Retrieved November 30, 2019.
 This article incorporates text from this source, which is in the public domain.
This article incorporates text from this source, which is in the public domain. - ^ "Afluria Quadrivalent". U.S. Food and Drug Administration (FDA). November 8, 2019. Archived from the original on December 1, 2019. Retrieved November 30, 2019.
 This article incorporates text from this source, which is in the public domain.
This article incorporates text from this source, which is in the public domain. - ^ National Advisory Committee on Immunization (NACI) (November 2018). "Supplemental Statement – Afluria Tetra – An Advisory Committee Statement (ACS)". Public Health Agency of Canada. Ottawa. Cat.: HP37-25E-PDF Pub.: 180566. Retrieved January 11, 2020.
- ^ Literature review on influenza vaccination in healthy 5–18-year-olds (PDF) (Report). Ottawa: Public Health Agency of Canada. July 2014. ISBN 978-1-100-24681-9. Cat.: HP40-116/2014E-PDF Pub.: 140116.
- ^ Literature Review on Pediatric Fluad Influenza Vaccine Use in Children 6–72 Months of Age (PDF) (Report). Ottawa: Public Health Agency of Canada. 2015. Retrieved January 11, 2020.
- ^ Peleg N, Zevit N, Shamir R, Chodick G, Levy I (January 2015). "Seasonal influenza vaccination rates and reasons for non-vaccination in children with gastrointestinal disorders". Vaccine. 33 (1): 182–186. doi:10.1016/j.vaccine.2014.10.086. PMID 25444802.
- ^ a b Burls A, Jordan R, Barton P, Olowokure B, Wake B, Albon E, Hawker J (May 2006). "Vaccinating healthcare workers against influenza to protect the vulnerable – is it a good use of healthcare resources? A systematic review of the evidence and an economic evaluation". Vaccine. 24 (19): 4212–21. doi:10.1016/j.vaccine.2005.12.043. PMID 16546308.
- ^ Ahmed F, Lindley MC, Allred N, Weinbaum CM, Grohskopf L (January 2014). "Effect of influenza vaccination of healthcare personnel on morbidity and mortality among patients: systematic review and grading of evidence". Clinical Infectious Diseases. 58 (1): 50–57. doi:10.1093/cid/cit580. PMID 24046301.
- ^ Griffin MR (January 2014). "Influenza vaccination of healthcare workers: making the grade for action". Clinical Infectious Diseases. 58 (1): 58–60. doi:10.1093/cid/cit590. PMID 24046312.
- ^ Simonsen L, Viboud C, Taylor RJ, Miller MA, Jackson L (October 2009). "Influenza vaccination and mortality benefits: new insights, new opportunities". Vaccine. 27 (45): 6300–04. doi:10.1016/j.vaccine.2009.07.008. PMID 19840664.
- ^ Darvishian M, Bijlsma MJ, Hak E, van den Heuvel ER (December 2014). "Effectiveness of seasonal influenza vaccine in community-dwelling elderly people: a meta-analysis of test-negative design case-control studies". The Lancet. Infectious Diseases. 14 (12): 1228–39. doi:10.1016/S1473-3099(14)70960-0. PMID 25455990.
- ^ Nichol KL, Nordin JD, Nelson DB, Mullooly JP, Hak E (October 2007). "Effectiveness of influenza vaccine in the community-dwelling elderly". The New England Journal of Medicine. 357 (14): 1373–81. doi:10.1056/NEJMoa070844. PMID 17914038. S2CID 14850833.
- ^ Simonsen L, Taylor RJ, Viboud C, Miller MA, Jackson LA (October 2007). "Mortality benefits of influenza vaccination in elderly people: an ongoing controversy". The Lancet. Infectious Diseases. 7 (10): 658–66. doi:10.1016/S1473-3099(07)70236-0. PMID 17897608.
- ^ Thompson WW, Shay DK, Weintraub E, Brammer L, Cox N, Anderson LJ, Fukuda K (January 2003). "Mortality associated with influenza and respiratory syncytial virus in the United States". JAMA. 289 (2): 179–86. doi:10.1001/jama.289.2.179. PMID 12517228. S2CID 5018362.
- ^ "High Dose Flu Vaccine for the Elderly « Science-Based Medicine". Sciencebasedmedicine.org. October 19, 2010. Archived from the original on May 8, 2013. Retrieved October 17, 2013.
- ^ "Fluzone High-Dose Seasonal Influenza Vaccine". U.S. Centers for Disease Control and Prevention (CDC). September 6, 2019. Archived from the original on December 2, 2019. Retrieved December 2, 2019.
- ^ DiazGranados CA, Dunning AJ, Kimmel M, Kirby D, Treanor J, Collins A, et al. (August 2014). "Efficacy of high-dose versus standard-dose influenza vaccine in older adults". The New England Journal of Medicine. 371 (7): 635–45. doi:10.1056/NEJMoa1315727. PMID 25119609. S2CID 205096393.
- ^ Wells C, Grobelna A (January 8, 2019). "High Dose Influenza Vaccine for Adults: A Review of Clinical Effectiveness, Cost-Effectiveness, and Guidelines" (PDF). Rapid Response Report. Ottawa: Canadian Agency for Drugs and Technologies in Health (CADTH). ISSN 1922-8147. PMID 31141324.
- ^ Mascagni P, Vicenzi E, Kajaste-Rudnitski A, Pellicciotta G, Monti A, Cervi C, et al. (2012). "Assessment of efficacy and safety of pandemic A/H1N1/2009 influenza vaccine in a group of health care workers". La Medicina del Lavoro. 103 (3): 220–29. PMID 22838300.
- ^ "FDA approves first seasonal influenza vaccine containing an adjuvant" (Press release). U.S. Food and Drug Administration. November 24, 2015. Archived from the original on July 22, 2017. Retrieved August 20, 2017.
 This article incorporates text from this source, which is in the public domain.
This article incorporates text from this source, which is in the public domain. - ^ a b "Flu Vaccine With Adjuvant". U.S. Centers for Disease Control and Prevention (CDC). September 4, 2019. Archived from the original on December 2, 2019. Retrieved December 2, 2019.
 This article incorporates text from this source, which is in the public domain.
This article incorporates text from this source, which is in the public domain. - ^ "Fluad". U.S. Food and Drug Administration (FDA). November 8, 2019. STN 125510. Archived from the original on December 2, 2019. Retrieved December 2, 2019.
 This article incorporates text from this source, which is in the public domain.
This article incorporates text from this source, which is in the public domain. - ^ "Influenza vaccine with squalene adjuvant: new preparation. No better than available products". Prescrire International. 13 (74): 206–08. December 2004. PMID 15599987.
- ^ Camilloni B, Basileo M, Valente S, Nunzi E, Iorio AM (2015). "Immunogenicity of intramuscular MF59-adjuvanted and intradermal administered influenza enhanced vaccines in subjects aged over 60: A literature review". Human Vaccines & Immunotherapeutics. 11 (3): 553–63. doi:10.1080/21645515.2015.1011562. PMC 4514405. PMID 25714138. Lay summary.
{{cite journal}}: Cite uses deprecated parameterlay-url=(help) - ^ Van Damme P, Arnou R, Kafeja F, Fiquet A, Richard P, Thomas S, et al. (May 2010). "Evaluation of non-inferiority of intradermal versus adjuvanted seasonal influenza vaccine using two serological techniques: a randomised comparative study". BMC Infectious Diseases. 10: 134. doi:10.1186/1471-2334-10-134. PMC 2895601. PMID 20504306.
- ^ Haverkate M, D'Ancona F, Giambi C, Johansen K, Lopalco PL, Cozza V, Appelgren E, VENICE project gatekeepers contact points (May 2012). "Mandatory and recommended vaccination in the EU, Iceland and Norway: results of the VENICE 2010 survey on the ways of implementing national vaccination programmes". Euro Surveillance. 17 (22). doi:10.2807/ese.17.22.20183-en. PMID 22687916.
- ^ Field RI (November 2009). "Mandatory vaccination of health care workers: whose rights should come first?". P & T. 34 (11): 615–18. PMC 2810172. PMID 20140133.
- ^ Kassianos G (2015). "Willingness of European healthcare workers to undergo vaccination against seasonal influenza: current situation and suggestions for improvement". Drugs in Context. 4: 212268. doi:10.7573/dic.212268. PMC 4316812. PMID 25657810.
- ^ Thomas RE, Jefferson T, Lasserson TJ (June 2016). "Influenza vaccination for healthcare workers who care for people aged 60 or older living in long-term care institutions". The Cochrane Database of Systematic Reviews. 2016 (6): CD005187. doi:10.1002/14651858.CD005187.pub5. PMC 8504984. PMID 27251461.
- ^ "Fluad Quad Australian prescription medicine decision summary". Therapeutic Goods Administration (TGA). December 13, 2019. Retrieved August 24, 2020.
- ^ "Fluad Tetra EPAR". European Medicines Agency (EMA). March 24, 2020. Retrieved May 29, 2020.
- ^ Fell DB, Sprague AE, Liu N, Yasseen AS, Wen SW, Smith G, Walker MC (June 2012). "H1N1 influenza vaccination during pregnancy and fetal and neonatal outcomes". American Journal of Public Health (Submitted manuscript). 102 (6): e33–40. doi:10.2105/AJPH.2011.300606. PMC 3483960. PMID 22515877.
- ^ Madhi SA, Cutland CL, Kuwanda L, Weinberg A, Hugo A, Jones S, et al. (September 2014). "Influenza vaccination of pregnant women and protection of their infants". The New England Journal of Medicine. 371 (10): 918–31. doi:10.1056/NEJMoa1401480. hdl:2263/42412. PMID 25184864.
- ^ "Flu shot". CDC. 2020. Retrieved September 24, 2020.
- ^ "Misconceptions about flu vaccines". CDC. 2020. Retrieved September 24, 2020.
- ^ Haber P, Sejvar J, Mikaeloff Y, DeStefano F (2009). "Vaccines and Guillain-Barré syndrome". Drug Safety. 32 (4): 309–23. doi:10.2165/00002018-200932040-00005. PMID 19388722. S2CID 33670594.
- ^ "Reorganized text". JAMA Otolaryngology–Head & Neck Surgery. 141 (5): 428. May 2015. doi:10.1001/jama.248.6.698. PMID 25996397.
- ^ Stowe J, Andrews N, Wise L, Miller E (February 2009). "Investigation of the temporal association of Guillain-Barre syndrome with influenza vaccine and influenza-like illness using the United Kingdom General Practice Research Database". American Journal of Epidemiology. 169 (3): 382–88. doi:10.1093/aje/kwn310. PMID 19033158.
- ^ a b Sivadon-Tardy V, Orlikowski D, Porcher R, Sharshar T, Durand MC, Enouf V, et al. (January 2009). "Guillain-Barré syndrome and influenza virus infection". Clinical Infectious Diseases. 48 (1): 48–56. doi:10.1086/594124. PMID 19025491.
- ^ Vellozzi C, Burwen DR, Dobardzic A, Ball R, Walton K, Haber P (March 2009). "Safety of trivalent inactivated influenza vaccines in adults: background for pandemic influenza vaccine safety monitoring". Vaccine. 27 (15): 2114–20. doi:10.1016/j.vaccine.2009.01.125. PMID 19356614.
- ^ Reinberg S (February 2, 2011). "Last Year's H1N1 Flu Vaccine Was Safe, Study Finds". U.S. News & World Report. Archived from the original on April 25, 2013.
- ^ National Advisory Committee on Immunization (NACI) (August 2012). "Statement on Seasonal Influenza Vaccine for 2012–2013" (PDF). Canada Communicable Disease Report. Ottawa. 38. Archived from the original (PDF) on January 17, 2013. Retrieved July 18, 2013.
- ^ Turner PJ, Southern J, Andrews NJ, Miller E, Erlewyn-Lajeunesse M (December 2015). "Safety of live attenuated influenza vaccine in young people with egg allergy: multicentre prospective cohort study". BMJ. 351: h6291. doi:10.1136/bmj.h6291. PMC 4673102. PMID 26645895.
- ^ Greenhawt M (December 2015). "Live attenuated influenza vaccine for children with egg allergy". BMJ. 351: h6656. doi:10.1136/bmj.h6656. PMID 26657778. S2CID 37037904.
- ^ Technical Report: Narcolepsy in association with pandemic influenza vaccination (PDF). Stockholm, Sweden: European Centre for Disease Prevention and Control (ECDC). 2012. ISBN 978-92-9193-388-4. Archived from the original (PDF) on December 31, 2013. Retrieved December 30, 2013.
- ^ Yong E (2013). "Narcolepsy confirmed as autoimmune disease". Nature. doi:10.1038/nature.2013.14413. S2CID 74850662.
- ^ "Thimerosal in Flu Vaccine". U.S. Centers for Disease Control and Prevention. October 16, 2015. Archived from the original on December 2, 2019. Retrieved December 2, 2019.
 This article incorporates text from this source, which is in the public domain.
This article incorporates text from this source, which is in the public domain. - ^ "Thimerosal in Vaccines Thimerosal – Concerns – Vaccine Safety". U.S. Centers for Disease Control and Prevention. October 27, 2015. Archived from the original on November 2, 2019. Retrieved December 2, 2019.
 This article incorporates text from this source, which is in the public domain.
This article incorporates text from this source, which is in the public domain. - ^ Offit PA (September 2007). "Thimerosal and vaccines – a cautionary tale". The New England Journal of Medicine. 357 (13): 1278–79. doi:10.1056/NEJMp078187. PMID 17898096. S2CID 36318722.
- ^ Global Advisory Committee on Vaccine Safety (July 14, 2006). "Thiomersal and vaccines". World Health Organization (WHO). Archived from the original on November 6, 2009. Retrieved November 20, 2007.
- ^ Plotkin SA, Orenstein WA (1988). Vaccines. Philadelphia: W.B. Saunders Company. p. 424. ISBN 978-0-7216-1946-0. Retrieved September 7, 2020.
- ^ Product Monograph: Flumist (PDF), Astrazeneca Canada Inc., June 20, 2014, retrieved September 5, 2020
- ^ To KW, Lai A, Lee KC, Koh D, Lee SS (October 2016). "Increasing the coverage of influenza vaccination in healthcare workers: review of challenges and solutions". The Journal of Hospital Infection. 94 (2): 133–42. doi:10.1016/j.jhin.2016.07.003. PMID 27546456.
- ^ a b c d Rubin GJ, Potts HW, Michie S (March 2011). "Likely uptake of swine and seasonal flu vaccines among healthcare workers. A cross-sectional analysis of UK telephone survey data". Vaccine. 29 (13): 2421–28. doi:10.1016/j.vaccine.2011.01.035. PMID 21277402.
- ^ "Seasonal Flu Shot". U.S. Centers for Disease Control and Prevention (CDC). December 9, 2019. Retrieved January 12, 2020.
 This article incorporates text from this source, which is in the public domain.
This article incorporates text from this source, which is in the public domain. - ^ "Vaccine use". World Health Organization (WHO). Archived from the original on December 15, 2012. Retrieved January 15, 2017.
- ^ "Influenza (Seasonal) Fact sheet". World Health Organization (WHO). November 2016. Archived from the original on November 30, 2014. Retrieved January 15, 2017.
- ^ "Influenza (Seasonal)". WHO. November 6, 2018. Archived from the original on October 14, 2019. Retrieved October 14, 2019.
- ^ "Methods for assessing influenza vaccination coverage in target groups (2016)". WHO/Europe. March 19, 2018. Retrieved October 14, 2019.
- ^ "Recommendations on influenza vaccination during the 2019–2020 winter season". WHO/Europe. September 24, 2019. Retrieved October 14, 2019.
- ^ a b Canadian Immunization Guide Chapter on Influenza and Statement on Seasonal Influenza Vaccine for 2019–2020 (PDF) (Report). Public Health Agency of Canada. May 2019. Cat.: HP37-25E-PDF; Pub.: 180883.
- ^ "Risk groups for severe influenza". European Centre for Disease Prevention and Control (ECDC). Archived from the original on October 22, 2019. Retrieved October 22, 2019.
- ^ "ECDC Reviews – New WHO recommendations on seasonal influenza ..." European Centre for Disease Prevention and Control (ECDC). Archived from the original on May 10, 2017. Retrieved December 25, 2016.
- ^ "ECDC Guidance: Priority risk groups for influenza vaccination" (PDF). European Centre for Disease Prevention and Control (ECDC). pp. 7–8. Archived from the original (PDF) on December 25, 2016. Retrieved December 25, 2016.
- ^ a b c "Children & Influenza (Flu)". U.S. Centers for Disease Control and Prevention (CDC). October 23, 2019. Archived from the original on November 11, 2019.
 This article incorporates text from this source, which is in the public domain.
This article incorporates text from this source, which is in the public domain. - ^ "Live Attenuated Influenza Vaccine [LAIV] (The Nasal Spray Flu Vaccine)". U.S. Centers for Disease Control and Prevention (CDC). September 16, 2019. Archived from the original on October 14, 2019. Retrieved October 14, 2019.
 This article incorporates text from this source, which is in the public domain.
This article incorporates text from this source, which is in the public domain. - ^ "Influenza Vaccination: A Summary for Clinicians – Health Professionals – Seasonal Influenza (Flu)". U.S. Centers for Disease Control and Prevention (CDC). September 6, 2018. Archived from the original on February 24, 2008.
 This article incorporates text from this source, which is in the public domain.
This article incorporates text from this source, which is in the public domain. - ^ "Fluzone, Fluzone High-Dose and Fluzone Intradermal". U.S. Food and Drug Administration (FDA). July 11, 2017. Archived from the original on July 22, 2017. Retrieved June 1, 2020.
{{cite web}}: CS1 maint: unfit URL (link) - ^ Couch RB, Winokur P, Brady R, Belshe R, Chen WH, Cate TR, et al. (November 2007). "Safety and immunogenicity of a high dosage trivalent influenza vaccine among elderly subjects". Vaccine. 25 (44): 7656–63. doi:10.1016/j.vaccine.2007.08.042. PMC 2243220. PMID 17913310.
- ^ Lee JK, Lam GK, Shin T, Kim J, Krishnan A, Greenberg DP, et al. (May 2018). "Efficacy and effectiveness of high-dose versus standard-dose influenza vaccination for older adults: a systematic review and meta-analysis". Expert Rev Vaccines. 17 (5): 435–443. doi:10.1080/14760584.2018.1471989. PMID 29715054. S2CID 21688517.
- ^ Robertson CA, DiazGranados CA, Decker MD, Chit A, Mercer M, Greenberg DP (December 2016). "Fluzone High-Dose Influenza Vaccine". Expert Rev Vaccines. 15 (12): 1495–1505. doi:10.1080/14760584.2016.1254044. PMID 27813430.
- ^ Literature review update on the efficacy and effectiveness of high-dose (Fluzone High-Dose) and MF59-adjuvanted (Fluad) trivalent inactivated influenza vaccines in adults 65 years of age and older (PDF) (Report). Ottawa: Public Health Agency of Canada. May 2018. HP40-210/2018E-PDF. Retrieved June 1, 2020.
- ^ Tanner L (January 13, 2013). "Hospitals crack down on workers who refuse flu shots". NBC News. Archived from the original on December 3, 2013. Retrieved July 24, 2014.
- ^ Centers for Disease Control Prevention (CDC) (December 2010). "Seasonal influenza and 2009 H1N1 influenza vaccination coverage among pregnant women – 10 states, 2009–10 influenza season" (PDF). Morbidity and Mortality Weekly Report (MMWR). 59 (47): 1541–45. PMID 21124293. Archived (PDF) from the original on June 25, 2017.
 This article incorporates text from this source, which is in the public domain.
This article incorporates text from this source, which is in the public domain. - ^ a b Altman LK (February 28, 2008). "Panel Advises Flu Shots for Children Up to Age 18". The New York Times. Archived from the original on January 22, 2015.
- ^ "ACIP votes down use of LAIV for 2016–2017 flu season" (Press release). U.S. Centers for Disease Control and Prevention (CDC). June 22, 2016. Archived from the original on November 25, 2016. Retrieved November 26, 2016.
 This article incorporates text from this source, which is in the public domain.
This article incorporates text from this source, which is in the public domain. - ^ "Immunization Schedules". U.S. Centers for Disease Control and Prevention (CDC). Archived from the original on November 5, 2014. Retrieved November 4, 2014.
 This article incorporates text from this source, which is in the public domain.
This article incorporates text from this source, which is in the public domain. - ^ Getting flu with Covid makes you twice as likely to die, says UK health chief The Guardian
- ^ "Flu vaccine FAQs". Healthdirect, Department of Health, Government of Australia. April 1, 2019. Retrieved May 29, 2019.
- ^ "Influenza fact sheet". Healthdirect, Department of Health, Government of Australia. April 1, 2019. Retrieved May 29, 2019.
- ^ "Health care use – Influenza vaccination rates – OECD Data". theOECD. Retrieved April 24, 2020.
- ^ a b Han YK, Michie S, Potts HW, Rubin GJ (March 2016). "Predictors of influenza vaccine uptake during the 2009/10 influenza A H1N1v ('swine flu') pandemic: Results from five national surveys in the United Kingdom". Preventive Medicine. 84: 57–61. doi:10.1016/j.ypmed.2015.12.018. PMC 4766366. PMID 26757401.
- ^ Bish A, Yardley L, Nicoll A, Michie S (September 2011). "Factors associated with uptake of vaccination against pandemic influenza: a systematic review". Vaccine. 29 (38): 6472–84. doi:10.1016/j.vaccine.2011.06.107. PMID 21756960.
- ^ Brien S, Kwong JC, Buckeridge DL (February 2012). "The determinants of 2009 pandemic A/H1N1 influenza vaccination: a systematic review". Vaccine. 30 (7): 1255–64. doi:10.1016/j.vaccine.2011.12.089. PMID 22214889.
- ^ Thomas RE, Lorenzetti DL (May 2018). "Interventions to increase influenza vaccination rates of those 60 years and older in the community". The Cochrane Database of Systematic Reviews. 5: CD005188. doi:10.1002/14651858.CD005188.pub4. PMC 6494593. PMID 29845606.
- ^ Centers for Disease Control Prevention (CDC) (October 2009). "Update on influenza A (H1N1) 2009 monovalent vaccines" (PDF). Morbidity and Mortality Weekly Report (MMWR). 58 (39): 1100–01. PMID 19816398. Archived (PDF) from the original on June 29, 2011.
 This article incorporates text from this source, which is in the public domain.
This article incorporates text from this source, which is in the public domain. - ^ La Torre G, Di Thiene D, Cadeddu C, Ricciardi W, Boccia A (December 2009). "Behaviours regarding preventive measures against pandemic H1N1 influenza among Italian healthcare workers, October 2009". Euro Surveillance. 14 (49). PMID 20003908.
- ^ Amodio E, Anastasi G, Marsala MG, Torregrossa MV, Romano N, Firenze A (February 2011). "Vaccination against the 2009 pandemic influenza A (H1N1) among healthcare workers in the major teaching hospital of Sicily (Italy)". Vaccine. 29 (7): 1408–12. doi:10.1016/j.vaccine.2010.12.041. PMID 21199700.
- ^ Chor JS, Ngai KL, Goggins WB, Wong MC, Wong SY, Lee N, et al. (August 2009). "Willingness of Hong Kong healthcare workers to accept pre-pandemic influenza vaccination at different WHO alert levels: two questionnaire surveys". BMJ. 339: b3391. doi:10.1136/bmj.b3391. PMC 2731837. PMID 19706937.
- ^ Schnirring L (August 18, 2011). "CDC updates flu vaccination recommendations". Center for Infectious Disease Research and Policy (CIDRAP). Archived from the original on October 25, 2019. Retrieved October 24, 2019.
- ^ Centers for Disease Control Prevention (CDC) (August 2011). "Influenza vaccination coverage among health-care personnel – United States, 2010–11 influenza season" (PDF). Morbidity and Mortality Weekly Report (MMWR). 60 (32): 1073–77. PMID 21849963. Archived (PDF) from the original on May 25, 2017.
 This article incorporates text from this source, which is in the public domain.
This article incorporates text from this source, which is in the public domain. - ^ Centers for Disease Control Prevention (CDC) (September 2012). "Influenza vaccination coverage among health-care personnel: 2011–12 influenza season, United States" (PDF). Morbidity and Mortality Weekly Report (MMWR). 61: 753–57. PMID 23013720. Archived (PDF) from the original on June 24, 2017.
 This article incorporates text from this source, which is in the public domain.
This article incorporates text from this source, which is in the public domain. - ^ Bull AL, Bennett N, Pitcher HC, Russo PL, Richards MJ (February 2007). "Influenza vaccine coverage among health care workers in Victorian public hospitals". The Medical Journal of Australia. 186 (4): 185–86. doi:10.5694/j.1326-5377.2007.tb00858.x. PMID 17309419. S2CID 25091208.
- ^ a b Abbasi J (November 2019). "The Search for a Universal Flu Vaccine Heats Up". JAMA. 322 (20): 1942–1944. doi:10.1001/jama.2019.16816. PMID 31693060. S2CID 207903441.
- ^ a b c Greenfieldboyce N (November 8, 2007). New and Old Ways to Make Flu Vaccines (Radio broadcast). NPR. Archived from the original on October 24, 2019. Retrieved October 23, 2019.
- ^ Nachbagauer R, Krammer F (April 2017). "Universal influenza virus vaccines and therapeutic antibodies". Clinical Microbiology and Infection. 23 (4): 222–228. doi:10.1016/j.cmi.2017.02.009. PMC 5389886. PMID 28216325.
- ^ Balfour H (June 2, 2021). "First-in-human universal flu vaccine trial begins". European Pharmaceutical Review.
The Phase I trial (NCT04896086) will assess the safety and immunogenicity of the experimental vaccine, FluMos-v1
- ^ Bernstein DI, Guptill J, Naficy A, Nachbagauer R, Berlanda-Scorza F, Feser J, et al. (January 2020). "Immunogenicity of chimeric haemagglutinin-based, universal influenza virus vaccine candidates: interim results of a randomised, placebo-controlled, phase 1 clinical trial". The Lancet. Infectious Diseases. 20 (1): 80–91. doi:10.1016/S1473-3099(19)30393-7. PMC 6928577. PMID 31630990.
- ^ Nachbagauer R, Feser J, Naficy A, Bernstein DI, Guptill J, Walter EB, et al. (January 2021). "A chimeric hemagglutinin-based universal influenza virus vaccine approach induces broad and long-lasting immunity in a randomized, placebo-controlled phase I trial". Nature Medicine. 27 (1): 106–114. doi:10.1038/s41591-020-1118-7. PMID 33288923.
- ^ "Influenza Vaccine Strategies for Broad Global Access". Path. October 2007. Archived from the original on October 14, 2019. Retrieved September 16, 2009.
- ^ a b "how it's made" (PDF). Archived from the original (PDF) on July 5, 2010.
- ^ "Influenza vaccine viruses and reagents". World Health Organization (WHO). Archived from the original on May 27, 2013.
- ^ "Recommendations for the production and control of influenza vaccine (inactivated)" (PDF). World Health Organization (WHO). Archived (PDF) from the original on October 28, 2013. Retrieved May 27, 2013.
- ^ a b Racaniello V (December 2009). "Influenza virus growth in eggs". Virology Blog. Archived from the original on December 25, 2014.
- ^ Izzat F (April 2012). "Viral Cultivation in Chicken Embryo". Youtube. Archived from the original on May 26, 2015.
- ^ a b "How Influenza (Flu) Vaccines Are Made". U.S. Centers for Disease Control and Prevention (CDC). November 26, 2019. Archived from the original on December 2, 2019. Retrieved December 2, 2019.
 This article incorporates text from this source, which is in the public domain.
This article incorporates text from this source, which is in the public domain. - ^ Bright RA, Carter DM, Daniluk S, Toapanta FR, Ahmad A, Gavrilov V, et al. (May 2007). "Influenza virus-like particles elicit broader immune responses than whole virion inactivated influenza virus or recombinant hemagglutinin". Vaccine. 25 (19): 3871–78. doi:10.1016/j.vaccine.2007.01.106. PMID 17337102.
- ^ "Priming with DNA vaccine makes avian flu vaccine work better (NIH News)". October 3, 2011. Archived from the original on September 27, 2012.
- ^ Clinical trial number NCT00776711 for "Vaccine for Prevention of Bird Flu" at ClinicalTrials.gov
- ^ Clinical trial number NCT01086657 for "An Open-Label, Randomized Phase I Study in Healthy Adults of the Safety and Immunogenicity of Prime-Boost Intervals with Monovalent Influenza Subunit Virion (H5N1) Vaccine, A/Indonesia/05/2005 (Sanofi Pasteur, Inc), Administered Alone or Following Recombinant DNA Plasmid (H5) Vaccine, VRC-AVIDNA036-00-VP (VRC, NIAID)" at ClinicalTrials.gov
- ^ Center for Biologics Evaluation and Research. "Approved Products – November 20, 2012 Approval Letter – Flucelvax". U.S. Food and Drug Administration (FDA). Archived from the original on December 3, 2012.
 This article incorporates text from this source, which is in the public domain.
This article incorporates text from this source, which is in the public domain. - ^ "Seqirus receives FDA approval for Flucelvax Quadrivalent (Influenza Vaccine) for people four years of age and older" (Press release). Seqirus. May 23, 2016. Archived from the original on January 16, 2017. Retrieved January 15, 2017.
- ^ Roos R (October 14, 2019). "FDA approves first flu vaccine grown in insect cells". Center for Infectious Disease Research and Policy (CIDRAP). Archived from the original on October 14, 2019. Retrieved October 14, 2019.
- ^ "Flublok". U.S. Food and Drug Administration (FDA). February 26, 2018. STN 125285. Archived from the original on October 14, 2019. Retrieved October 14, 2019.
 This article incorporates text from this source, which is in the public domain.
This article incorporates text from this source, which is in the public domain. - ^ "Flublok Quadrivalent". U.S. Food and Drug Administration (FDA). August 2, 2019. STN 125285. Archived from the original on October 14, 2019. Retrieved October 14, 2019.
 This article incorporates text from this source, which is in the public domain.
This article incorporates text from this source, which is in the public domain. - ^ a b "Supemtek: Pending EC decision". European Medicines Agency (EMA). September 17, 2020. Retrieved September 21, 2020. Text was copied from this source which is © European Medicines Agency. Reproduction is authorized provided the source is acknowledged.
- ^ Jit M, Newall AT, Beutels P (April 2013). "Key issues for estimating the impact and cost-effectiveness of seasonal influenza vaccination strategies". Human Vaccines & Immunotherapeutics. 9 (4): 834–40. doi:10.4161/hv.23637. PMC 3903903. PMID 23357859.
- ^ Postma MJ, Baltussen RP, Palache AM, Wilschut JC (April 2006). "Further evidence for favorable cost-effectiveness of elderly influenza vaccination". Expert Review of Pharmacoeconomics & Outcomes Research. 6 (2): 215–27. doi:10.1586/14737167.6.2.215. PMID 20528557. S2CID 12765724.
- ^ Newall AT, Kelly H, Harsley S, Scuffham PA (2009). "Cost effectiveness of influenza vaccination in older adults: a critical review of economic evaluations for the 50- to 64-year age group". PharmacoEconomics. 27 (6): 439–50. doi:10.2165/00019053-200927060-00001. PMID 19640008. S2CID 20855671.
- ^ Newall AT, Viboud C, Wood JG (June 2010). "Influenza-attributable mortality in Australians aged more than 50 years: a comparison of different modelling approaches". Epidemiology and Infection. 138 (6): 836–42. doi:10.1017/S095026880999118X. PMID 19941685. S2CID 29939376.
- ^ Newall AT, Dehollain JP, Creighton P, Beutels P, Wood JG (August 2013). "Understanding the cost-effectiveness of influenza vaccination in children: methodological choices and seasonal variability". PharmacoEconomics. 31 (8): 693–702. doi:10.1007/s40273-013-0060-7. PMID 23645539. S2CID 8616720.
- ^ Newall AT, Scuffham PA (December 2011). "Uncertainty and variability in influenza cost-effectiveness models". Australian and New Zealand Journal of Public Health. 35 (6): 576, author reply 576–77. doi:10.1111/j.1753-6405.2011.00788.x. PMID 22151168. S2CID 22402257.
- ^ Gatwood J, Meltzer MI, Messonnier M, Ortega-Sanchez IR, Balkrishnan R, Prosser LA (January 2012). "Seasonal influenza vaccination of healthy working-age adults: a review of economic evaluations". Drugs. 72 (1): 35–48. doi:10.2165/11597310-000000000-00000. PMID 22191794. S2CID 46305863.
- ^ Newall AT, Jit M, Beutels P (August 2012). "Economic evaluations of childhood influenza vaccination: a critical review". PharmacoEconomics. 30 (8): 647–60. doi:10.2165/11599130-000000000-00000. PMID 22788257. S2CID 38289883.
- ^ Newall AT, Wood JG, Oudin N, MacIntyre CR (February 2010). "Cost-effectiveness of pharmaceutical-based pandemic influenza mitigation strategies". Emerging Infectious Diseases. 16 (2): 224–30. doi:10.3201/eid1602.090571. PMC 2957998. PMID 20113551.
- ^ "Influenza Genome Sequencing Project – Overview". National Institutes of Health – National Institute of Allergy and Infectious Diseases. Archived from the original on June 27, 2011. Retrieved May 27, 2013.
- ^ Lampos V, Yom-Tov E, Pebody R, Cox IJ (2015). "Assessing the impact of a health intervention via user-generated Internet content" (PDF). Data Mining and Knowledge Discovery. 29 (5): 1434–57. doi:10.1007/s10618-015-0427-9. S2CID 215415165.
- ^ Wagner M, Lampos V, Yom-Tov E, Pebody R, Cox IJ (December 2017). "Estimating the Population Impact of a New Pediatric Influenza Vaccination Program in England Using Social Media Content". Journal of Medical Internet Research. 19 (12): e416. doi:10.2196/jmir.8184. PMC 6257312. PMID 29269339.
- ^ "Acute Respiratory Infections (Update September 2009)". World Health Organization (WHO). September 2009. Archived from the original on September 29, 2009. Retrieved September 16, 2009.
- ^ "Tables on the Clinical trials of pandemic influenza prototype vaccines". World Health Organization (WHO). July 2009. Archived from the original on March 6, 2009. Retrieved September 21, 2009.
- ^ "FDA Approves Vaccines for 2009 H1N1 Influenza Virus" (Press release). September 15, 2009. Archived from the original on October 15, 2009. Retrieved October 15, 2009.
 This article incorporates text from this source, which is in the public domain.
This article incorporates text from this source, which is in the public domain. - ^ Keown A (February 4, 2020). "FDA Approves Seqirus' Audenz as Vaccine Against Potential Flu Pandemic". BioSpace. Retrieved February 5, 2020.
- ^ "Audenz". U.S. Food and Drug Administration (FDA). January 31, 2020. STN: 125692. Retrieved February 5, 2020.
 This article incorporates text from this source, which is in the public domain.
This article incorporates text from this source, which is in the public domain. - ^ a b c Cho A, Wrammert J (April 2016). "Implications of broadly neutralizing antibodies in the development of a universal influenza vaccine". Current Opinion in Virology. 17: 110–115. doi:10.1016/j.coviro.2016.03.002. PMC 4940123. PMID 27031684.
- ^ Okuno Y, Isegawa Y, Sasao F, Ueda S (May 1993). "A common neutralizing epitope conserved between the hemagglutinins of influenza A virus H1 and H2 strains". Journal of Virology. 67 (5): 2552–2558. doi:10.1128/JVI.67.5.2552-2558.1993. PMC 237575. PMID 7682624.
- ^ a b c d Soema PC, Kompier R, Amorij JP, Kersten GF (August 2015). "Current and next generation influenza vaccines: Formulation and production strategies". European Journal of Pharmaceutics and Biopharmaceutics. 94: 251–263. doi:10.1016/j.ejpb.2015.05.023. PMID 26047796.
- ^ Deng L, Cho KJ, Fiers W, Saelens X (February 2015). "M2e-Based Universal Influenza A Vaccines". Vaccines. 3 (1): 105–36. doi:10.3390/vaccines3010105. PMC 4494237. PMID 26344949.
- ^ Gottlieb T, Ben-Yedidia T (November 2014). "Epitope-based approaches to a universal influenza vaccine". Journal of Autoimmunity. 54: 15–20. doi:10.1016/j.jaut.2014.07.005. PMID 25172355.
- ^ Toussi DN, Massari P (April 2014). "Immune Adjuvant Effect of Molecularly-defined Toll-Like Receptor Ligands". Vaccines. 2 (2): 323–53. doi:10.3390/vaccines2020323. PMC 4494261. PMID 26344622.
- ^ Sederstrom J (July 19, 2019). "Researchers Exploring Oral Flu Vaccine and Treatment Options". Drug Topics. Retrieved January 27, 2020.
- ^ Jasty M, Bragdon CR, Schutzer S, Rubash H, Haire T, Harris WH (December 1989). "Bone ingrowth into porous coated canine total hip replacements. Quantification by backscattered scanning electron microscopy and image analysis". Scanning Microscopy. 3 (4): 1051–6, discussion 1056–57. doi:10.1016/s1473-3099(15)00252-2. PMID 2633331.
- ^ Liebowitz D, Gottlieb K, Kolhatkar NS, Garg SJ, Asher JM, Nazareno J, et al. (April 2020). "Efficacy, immunogenicity, and safety of an oral influenza vaccine: a placebo-controlled and active-controlled phase 2 human challenge study". The Lancet. Infectious Diseases. Elsevier. 20 (4): 435–444. doi:10.1016/S1473-3099(19)30584-5. PMID 31978354. S2CID 210892802.
- ^ Influenza Report (online book) Archived May 10, 2016, at the Wayback Machine chapter Avian Influenza by Timm C. Harder and Ortrud Werner
- ^ equiflunet_vaccines Archived January 10, 2006, at the Wayback Machine
- ^ "UAE Equestrian & Racing Federation". March 22, 2005. Archived from the original on March 22, 2005.
- ^ "FEI guidelines" (PDF). Archived (PDF) from the original on October 26, 2007.
- ^ McNeil Jr DG (May 2, 2006). "Turning to Chickens in Fight With Bird Flu". The New York Times. Archived from the original on November 14, 2012.
- ^ "Bird flu warning over partial protection of flocks". August 16, 2006. Archived from the original on September 26, 2007.
- ^ "FAO Recommendations on the Prevention, Control and Eradication of Highly Pathogenic Avian Influenza (HPAI) in Asia" (PDF). Archived (PDF) from the original on February 2, 2010. Retrieved September 16, 2009.
- ^ Yen HL, Peiris JS (May 2012). "Virology: bird flu in mammals". Nature. 486 (7403): 332–33. Bibcode:2012Natur.486..332Y. doi:10.1038/nature11192. PMID 22722190. S2CID 205229301.
- ^ "Swine Flu Virus Turns Endemic". September 15, 2007. Archived from the original on April 29, 2009.
- ^ "Custom Vaccines: Swine". Archived from the original on April 30, 2009.
- ^ Karaca K, Dubovi EJ, Siger L, Robles A, Audonnet JC, Jiansheng Y, et al. (February 2007). "Evaluation of the ability of canarypox-vectored equine influenza virus vaccines to induce humoral immune responses against canine influenza viruses in dogs". American Journal of Veterinary Research. 68 (2): 208–12. doi:10.2460/ajvr.68.2.208. PMID 17269888.
- ^ "Global Influenza Surveillance and Response System (GISRS)". World Health Organization. Archived from the original on October 3, 2011. Retrieved October 22, 2019.
- ^ "Spotlight: Influenza". World Health Organization. Retrieved October 22, 2019.
- ^ "Global influenza surveillance". WHO. Archived from the original on April 30, 2003.
- ^ Brown D (February 18, 2008). "Keeping ahead of flu comes down to guessing game". Knoxville News Sentinel. The Washington Post. Archived from the original on January 11, 2009. Retrieved December 22, 2015.
- ^ World Health Organization (2000). WHO Report on Global Surveillance of Epidemic-prone Infectious Diseases – Influenza. World Health Organization (WHO). hdl:10665/66485. WHO/CDS/CSR/ISR/2000/1.
- ^ a b "Recommended composition of influenza virus vaccines for use in the 2020–2021 northern hemisphere influenza season". World Health Organization (WHO). February 28, 2020. Archived from the original on March 12, 2020. Retrieved August 25, 2020.
- ^ a b c "Influenza Vaccine for the 2020-2021 Season". U.S. Food and Drug Administration (FDA). July 10, 2020. Retrieved July 12, 2020.
 This article incorporates text from this source, which is in the public domain.
This article incorporates text from this source, which is in the public domain. - ^ a b c d "EU recommendations for 2020/2021 seasonal flu vaccine composition". European Medicines Agency (EMA). April 1, 2020.
- ^ "Recommended composition of influenza virus vaccines for use in the 2021 southern hemisphere influenza season". World Health Organization. September 25, 2020. Archived from the original on October 3, 2020. Retrieved April 29, 2021.
- ^ "Flu vaccine". SA Health. Retrieved April 29, 2021.
- ^ a b c d "EU recommendations for 2021/2022 seasonal flu vaccine composition". European Medicines Agency (EMA). March 30, 2021. Text was copied from this source which is © European Medicines Agency. Reproduction is authorized provided the source is acknowledged.
- ^ https://www.ema.europa.eu/en/documents/regulatory-procedural-guideline/biologics-working-party-bwp-ad-hoc-influenza-working-group-amended-european-union-recommendations/2022_en-0.pdf[bare URL PDF]
- ^ "Recommended composition of influenza virus vaccines for use in the 2021 southern hemisphere influenza season". World Health Organization. September 24, 2021.
- ^ "Recommended composition of influenza virus vaccines for use in the 2022-2023 northern hemisphere influenza season". World Health Organization (WHO). February 25, 2022. Retrieved March 29, 2022.
- ^ a b c "EU recommendations for 2022-2023 seasonal flu vaccine composition". European Medicines Agency (EMA). March 29, 2022. Retrieved March 29, 2022. Text was copied from this source which is © European Medicines Agency. Reproduction is authorized provided the source is acknowledged.
- ^ https://www.ema.europa.eu/documents/regulatory-procedural-guideline/biologics-working-party-bwp-ad-hoc-influenza-working-group-eu-recommendations-seasonal-influenza/2023_en.pdf[bare URL PDF]
Further reading
- World Health Organization (October 2017). The immunological basis for immunization series: module 23: influenza vaccines. World Health Organization (WHO). hdl:10665/259211. ISBN 978-9241513050.
- Ramsay M (ed.). "Chapter 19: Influenza". Immunisation against infectious disease. Public Health England.
- Hamborsky J, Kroger A, Wolfe S, eds. (2015). "Chapter 12: Influenza". Epidemiology and Prevention of Vaccine-Preventable Diseases (13th ed.). Washington D.C.: U.S. Centers for Disease Control and Prevention (CDC). ISBN 978-0990449119.
- Budd A, Blanton L, Grohskopf L, Campbell A, Dugan V, Wentworth DE, et al. (March 29, 2019). "Chapter 6: Influenza". In Roush SW, Baldy LM, Hall MA (eds.). Manual for the surveillance of vaccine-preventable diseases. Atlanta GA: U.S. Centers for Disease Control and Prevention (CDC).
- National Advisory Committee on Immunization (May 2020). "Canadian Immunization Guide Chapter on Influenza and Statement on Seasonal Influenza Vaccine for 2020–2021" (PDF). Public Health Agency of Canada. Cat.: HP37-25F-PDF; Pub.: 200003. Lay summary.
{{cite web}}: Cite uses deprecated parameterlay-url=(help) - National Advisory Committee on Immunization (NACI) (May 2018). NACI literature review on the comparative effectiveness and immunogenicity of subunit and split virus inactivated influenza vaccines in adults 65 years of age and older (PDF). Government of Canada. ISBN 9780660264387. Cat.: HP40-213/2018E-PDF; Pub.: 180039. Lay summary.
{{cite book}}: Cite uses deprecated parameterlay-url=(help) - Rajaram S, Wojcik R, Moore C, Ortiz de Lejarazu R, de Lusignan S, Montomoli E, et al. (August 2020). "The impact of candidate influenza virus and egg-based manufacture on vaccine effectiveness: Literature review and expert consensus". Vaccine. 38 (38): 6047–6056. doi:10.1016/j.vaccine.2020.06.021. PMID 32600916.
External links
- Inactivated Influenza Vaccine Information Statement, US Centers for Disease Control and Prevention (CDC)
- Live, Intranasal Influenza Vaccine Information Statement, US Centers for Disease Control and Prevention (CDC)
- Seasonal Influenza (Flu) Vaccination and Preventable Disease, US Centers for Disease Control and Prevention (CDC)
- Misconceptions about Seasonal Flu and Flu Vaccines, US Centers for Disease Control and Prevention (CDC)
- "Influenza Vaccine". Drug Information Portal. U.S. National Library of Medicine.
- Influenza Vaccines at the US National Library of Medicine Medical Subject Headings (MeSH)






