독감
Influenza| 독감 | |
|---|---|
| 기타 이름 | 독감, 독감, 그리페 |
 | |
| 인플루엔자 바이러스, 약 10만배 확대 | |
| 전문 | 전염병 |
| 증상 | 발열, 콧물, 인후염, 근육통, 두통, 기침, 피로 |
| 평상시 시작 | 노출 후 1~4일 |
| 기간 | 2~8일 |
| 원인들 | 인플루엔자 바이러스 |
| 예방 | 손 씻기, 독감 백신 |
| 약물 | 오셀타미비르 같은 항바이러스제 |
| 빈도 | 연간[1][2] 300만~500만건의 중증환자 발생 |
| 죽음 | >연간[3][4] 사망 건수 20만~15만 건 |
흔히 '독감'으로 알려진 인플루엔자는 인플루엔자 바이러스에 의해 발생하는 전염병이다.증상은 가벼운 것에서부터 심한 것까지 다양하며 종종 발열, 콧물, 인후염, 근육통, 두통, 기침, 피로 등이 있다.이러한 증상은 바이러스에 노출된 후 1~4일(일반적으로 이틀)부터 시작하여 약 2~8일간 지속된다.설사와 구토는 특히 어린이들에게 발생할 수 있다.인플루엔자는 폐렴으로 진행될 수 있는데, 폐렴은 바이러스나 그에 따른 박테리아 감염에 의해 발생할 수 있다.다른 감염의 합병증으로는 급성 호흡곤란증후군, 뇌막염, 뇌염 등이 있으며 천식, 심혈관 질환 등 기존의 건강 문제가 악화되고 있다.
인플루엔자 바이러스에는 A, B, C, D라는 네 종류가 있다.수생 조류는 인플루엔자A바이러스(IAV)의 1차 발생원으로, 사람과 돼지를 포함한 다양한 포유류에도 널리 퍼져 있다.인플루엔자 B 바이러스(IBV)와 인플루엔자 C 바이러스(ICV)는 주로 사람을 감염시키고, 소와 돼지에서는 인플루엔자 D 바이러스(IDV)가 발견된다.IAV와 IBV는 인간에게 순환하며 계절성 전염병을 일으키며 ICV는 주로 어린이들에게 경미한 감염을 일으킨다.IDV는 인간을 감염시킬 수 있지만 질병을 유발하는 것으로 알려져 있지 않다.인간에게 인플루엔자 바이러스는 주로 기침과 재채기로 인해 생성된 호흡기 방울을 통해 전염된다.에어로졸과 중간 물체를 통한 전염과 바이러스에 오염된 표면도 발생한다.
기침과 재채기를 할 때 손을 자주 씻고 입과 코를 가리는 것은 전달을 감소시킨다.매년 예방접종을 하는 것이 독감 예방에 도움이 될 수 있다.독감 바이러스, 특히 IAV는 빠르게 진화하기 때문에 독감 백신은 어떤 독감 변종이 유통되고 있는지에 맞춰 정기적으로 업데이트된다.현재 사용 중인 백신은 IAV 하위 유형 H1N1 및 H3N2와 하나 또는 두 개의 IBV 하위 유형으로부터 보호를 제공한다.인플루엔자 감염은 항체나 항원 검사 등 실험실 방법과 중합효소 연쇄반응(PCR)으로 진단해 바이러스 핵산을 확인한다.이 병은 보조적인 방법으로 치료할 수 있으며 심한 경우에는 오셀타미비르 같은 항바이러스제로 치료할 수 있다.건강한 개인에게 인플루엔자는 전형적으로 자기 제한을 받고 거의 치명적이지 않지만 고위험군에서는 치명적일 수 있다.
보통 해에 인구의 5-15%가 독감에 걸린다.매년 300만~500만 명의 중증 환자가 발생하고 있으며, 세계적으로 매년 65만 명에 이르는 호흡기 관련 사망자가 발생하고 있다.사망은 어린이, 노인, 만성적인 건강 상태를 가진 사람들을 포함한 고위험군에서 가장 흔하게 발생한다.세계의 온대 지역에서는, 인플루엔자 발병 건수가 겨울 동안 절정에 달한 반면, 열대성 인플루엔자는 일년 내내 발생할 수 있다.1800년대 후반부터 유행성 전염병이라 불리는 새로운 인플루엔자 변종이 10~50년마다 대규모로 발생하였다.1900년 이후 가장 심한 독감 유행이었던 1918~1920년 스페인 독감, 1957년 아시아 독감, 1968년 홍콩 독감, 1977년 러시아 독감, 2009년 신종 플루 등 5가지 독감 유행병이 발생했다.
징후 및 증상
바이러스에 노출되는 시간과 잠복기라 불리는 증상의 발달 사이의 시간은 1~4일로, 가장 흔히 1~2일이다.그러나 많은 감염은 무증상이다.[8]증상의 발병은 갑자기 나타나며 초기 증상은 발열, 오한, 두통, 근육통 또는 통증, 불편함, 식욕 상실, 에너지/피로 부족, 혼란 등 주로 특이하지 않다.이런 증상들은 대개 마른 기침, 쓰리거나 마른 목, 쉰 목소리, 답답하거나 콧물 같은 호흡기 증상을 동반한다.기침은 가장 흔한 증상이다.[1]특히 어린이들에게서 메스꺼움, 구토, 설사,[9] 위장염 등의 위장 증상도 나타날 수 있다.[10]표준 인플루엔자 증상은 일반적으로 2-8일간 지속된다.[11]2021년의 한 연구는 인플루엔자가 긴 COVID와 유사한 방법으로 장기간의 지속적인 증상을 일으킬 수 있다는 것을 시사한다.[12]
증상성 감염은 보통 경미하고 상부 호흡기에만 국한되지만 폐렴으로의 진행은 비교적 일반적이다.폐렴은 1차 바이러스 감염이나 2차 박테리아 감염에 의해 발생할 수 있다.1차 폐렴은 발열, 기침, 노동을 거친 호흡, 파르스름한 피부를 유발하는 산소 농도가 빠른 속도로 진행되는 것이 특징이다.특히 류머티즘 심장병 등 심혈관 질환이 기저에 있는 사람들에게 흔하다.2차 폐렴은 통상 1~3주[13] 정도 증상이 호전된 뒤 재발열, 가래 생성, 폐 내 유체 증식 등이 나타나지만 인플루엔자 증상이 나타난 지 불과 며칠 지나지 않아 발생할 수도 있다.[1][13]1차 폐렴 환자의 약 3분의 1이 2차 폐렴으로 이어지며, 이는 폐렴구균과 포도상구균에 의해 가장 많이 발생한다.[8][1]
바이러스학
바이러스 종류
인플루엔자 바이러스는 네 가지 종으로 구성되어 있다.네 종은 각각 자체 속과의 유일한 구성원이며, 네 종은 Orthomyxovirae과에 속하는 일곱 종 중 네 종으로 구성되어 있다.다음 구성 요소:[1][14]
- 인플루엔자A바이러스(IAV), 알파인플루엔자바이러스속
- 인플루엔자 B바이러스(IBV), 베타인플루엔자바이러스속
- 인플루엔자 C바이러스(ICV), 속개미플루엔자바이러스
- 인플루엔자 D바이러스(IDV), 델테인플루엔자바이러스속
IAV는 계절성 전염병 및 때때로 유행성 전염병뿐만 아니라 중증의 대부분의 경우에 책임이 있다.그것은 모든 연령대의 사람들을 감염시키지만 노인들, 아주 어린 사람들, 만성적인 건강 문제를 가진 사람들에게 불균형적으로 심각한 질병을 유발하는 경향이 있다.조류는 IAV의 1차 저수지로, 특히 오리, 거위, 해안조류, 갈매기 등 수생 조류는 돼지, 말, 해양 포유류 등 포유류 사이에서도 바이러스가 순환한다.[15][16]IAV는 바이러스성 단백질인 해마글루틴(H)과 뉴라미니다아제(N)를 기반으로 한 아형으로 분류된다.[17]2019년 현재 H형 18개, N형 11개가 확인되었다.대부분의 잠재적 조합은 조류에서 보고되었지만, H17-18과 N10-11은 박쥐에서만 발견되었다.H 하위 유형 H1-3과 N 하위 유형 N1-2만이 인간에게 순환한 것으로 알려져 있으며,[17] 현재 유통되고 있는 IAV 하위 유형은 H1N1과 H3N2이다.[2]IAV는 또한 H1N1/A/duck/Alberta/35/76과 같은 자연적 숙주종, 지리적 기원, 격리 연도 및 변형률 수를 포함하도록 보다 구체적으로 분류할 수 있다.[1][9]
IBV는 주로 사람을 감염시키지만 물개, 말, 개, 돼지에서 확인되었다.[17]IBV는 IAV와 같은 하위 유형을 가지고 있지 않지만, B/Victoria/2/1987과 B/Yamagata/16/1988과 같은 두 개의 항원적으로 구별되는 라인이 있다.[1] 또는 (B/)Victoria(-like)와 (B/)Victoria(-like)와 (B/)야마가타(-)와 같다.[17][2]두 선 모두 인간에게 유통되고 있으며,[1] 어린이들에게 불균형적으로 영향을 미친다.[9]IBV는 IAV와 함께 계절적 전염병에 기여하지만, 대유행과 연관된 적은 없다.[17]
ICV는 IBV와 마찬가지로 주로 사람에게서 발견되지만 돼지, 야생견, 낙타, 소, 개에서도 발견된다.[10][17]ICV 감염은 주로 어린이들에게 영향을 미치며, 위장염이나 폐렴과 같은 더 심각한 증상이 나타날 수 있지만, 대개 증상이[1][9] 없거나 가벼운 감기 같은 증상을 보인다.[10]IAV와 IBV와는 달리 ICV는 항바이러스제, 백신, 독감에 대한 다른 조치와 관련된 연구의 주요 초점이 되지 않았다.[17]ICV는 6개의 유전적/유전적 선으로 분류된다.[10][18]
IDV는 돼지와 소로부터 격리되었고, 후자는 자연 저수지가 되었다.인간, 말, 낙타, 염소, 양과 같은 작은 반추동물에서도 감염이 관찰되었다.[17][18]IDV는 멀리 ICV와 관련이 있다.목축업자들은 이전 IDV 감염에 대해 가끔 양성 반응을 보였지만, 그것은 인간에게 질병을 유발하는 것으로 알려져 있지 않다.[1][9][10]ICV와 IDV는 IAV와 IBV보다 항원 진화 속도가 느리다.이러한 항원적 안정성 때문에 비교적 적은 수의 새로운 선들이 생겨난다.[18]
게놈과 구조
인플루엔자 바이러스는 음의 단일 가닥의 RNA 게놈을 가지고 있으며, 이는 세분화되어 있다.게놈의 부정적인 감각은 그것이 메신저 RNA(mRNA)를 합성하는 템플릿으로 사용될 수 있다는 것을 의미한다.[8]IAV와 IBV는 10개의 주요 단백질을 인코딩하는 8개의 게놈 세그먼트를 가지고 있다.ICV와 IDV는 9개의 주요 단백질을 인코딩하는 7개의 게놈 세그먼트를 가지고 있다.[10]RNA 의존 RNA 중합효소(RdRp) 복합체의 3개 서브유닛(PB1, transcriptase), 5' caps를 인식하는 PB2, 엔도누클리스인 PA(ICV와 IDV의 경우 P3)를 인코딩하는 세그먼트도 있다.[19]비구조 단백질(NS1)과 핵 수출 단백질(NEP)처럼 매트릭스 단백질(M1)과 막 단백질(M2)은 한 세그먼트를 공유한다.[1]IAV와 IBV의 경우 헤마글루틴(HA)과 뉴라미디아제(NA)가 각각 한 세그먼트에 인코딩되는 반면, ICV와 IDV는 HA와 NA의 기능을 병합한 한 세그먼트에 헤마글루틴-에스테라제 융합(HEF) 단백질을 인코딩한다.마지막 게놈 부분은 바이러스성 핵단백질(NP)을 암호화하고 있다.[19]인플루엔자 바이러스는 또한 PB1-F2와 PA-X와 같은 다양한 부속 단백질을 암호화하는데, 이는 대체적인 개방형 판독 프레임을[1][20] 통해 표현되며 숙주 방어 억제, 바이러스성, 병원성 등에 중요하다.[21]
바이러스 입자로 불리는 바이러스 입자는 플롬폴릭적이며 필라멘트, 바실리폼 또는 구형 형태에 따라 다양하다.임상적 고립은 플롬폴릭적인 경향이 있는 반면, 실험실 성장에 적응한 균주는 전형적으로 구형의 처녀성을 생성한다.필라멘트 바이온은 약 250나노미터(nm) x 80nm, 바실리폼 120–250 x 95nm, 구형 120nm 직경이다.[22]처녀막은 각 세그먼트에 대해 별도의 리보핵단백질(RNP) 콤플렉스에서 뉴클레오프로테인과 결합한 게놈의 각 세그먼트로 구성되며, 모두 바이러스성 봉투라고 불리는 지질빌라이어 막으로 둘러싸여 있다.각 RNP에 바인딩된 모든 하위 유니트의 RdRp 복사본이 있다.봉투는 RNP를 둘러싸는 내부의 매트릭스 단백질에 의해 구조적으로 강화되며,[3] 봉투의 외부 표면에서 바깥쪽으로 확장되는 HA와 NA(또는 HEF[18]) 단백질을 함유하고 있다.HA와 HEF[18] 단백질은 뚜렷한 "머리"와 "stalk" 구조를 가지고 있다.M2 단백질은 바이러스 입출구에 필요한 바이러스성 봉투를 통해 양성자 이온 채널을 형성한다.IBV에는 봉투에 정박해 있는 NB라는 표면 단백질이 들어 있지만 그 기능은 알 수 없다.[1]
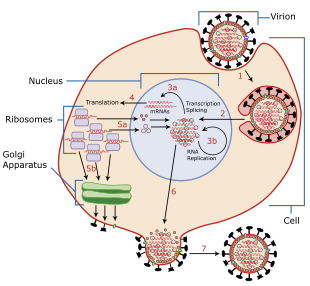
라이프 사이클
바이러스성 수명 주기는 목표 세포에 결합하는 것으로 시작된다.결합은 세포막 표면의 시알산 수용체를 포함하는 세포와 결합하는 evelope 표면의 바이러스 HA 단백질에 의해 매개된다.[1][15][3]"G147R" 돌연변이와 N2 하위 유형을 가진 N1 하위 유형의 경우, NA 단백질은 입력을 시작할 수 있다.결합에 앞서 NA 단백질은 점액을 저하시켜 표적세포에 대한 접근을 촉진시켜 표적세포에 대한 접근을 방해하는 세포외 디코이 수용체를 제거하는데 도움을 준다.[3]결합 후, 바이러스는 그 안에 있는 처녀성을 포함하는 내분자에 의해 세포 안으로 내분된다.엔도솜은 세포 vATPase에[20] 의해 산성화되어 낮은 pH를 가지며, 이는 바이러스성 외피를 내막과 융합할 수 있는 HA의 순응적 변화를 촉발한다.[21]동시에 수소 이온은 M2 이온 채널을 통해 처녀막으로 확산되어 내부 단백질-단백질 상호작용을 방해하여 RNP를 숙주세포의 세포솔로 방출한다.RNP를 둘러싼 M1 단백질 껍질이 분해되어 사이토솔의 RNP를 완전히 풀어준다.[20][3]
그런 다음 RNP는 바이러스 국산화 신호의 도움을 받아 핵으로 수입된다.그곳에서 바이러스성 RNA 중합효소는 유전체 음성-센스 스트랜드(genomic negence strand)를 템플릿으로 사용하여 mRNA를 전사한다.중합효소는 세포 RNA에서 prime mRNA 합성에 이르는 바이러스 mRNA에 대해 5' cap을 찍으며, mRNA의 3'-끝은 전사 끝에 polyadenylated된다.[19]일단 바이러스 mRNA를 전사하면 핵 밖으로 내보내고 숙주 리보솜에 의해 캡 의존적인 방식으로 번역되어 바이러스 단백질을 합성한다.[20]RdRp는 또한 보완적 RNP 복합체에서 바이러스 게놈의 보완적 양성 가닥을 합성하는데, 이 가닥은 음성감 게놈의 복제본을 합성하기 위해 바이러스 중합체에 의해 템플릿으로 사용된다.[1][3]이 과정에서 조류인플루엔자 바이러스(AIV)의 RdRps는 포유류 인플루엔자 바이러스보다 높은 온도에서 최적으로 기능한다.[11]
새로 합성된 바이러스 중합효소 서브유닛과 NP 단백질을 핵으로 수입해 바이러스 복제 속도를 더욱 높이고 RNP를 형성한다.[19]HA, NA, M2 단백질을 M1과 NEP 단백질의[21] 도움으로 골기 장치를[19] 통해 세포막으로 밀거래하여 세포막에 삽입한다.NS1, PB1-F2, PA-X를 포함한 바이러스 비구조 단백질은 항바이러스 반응을 비활성화하기 위해 호스트 세포 과정을 조절한다.[1][21][3]PB1-F2 아소는 PB1과 상호작용하여 중합체를 핵에서 더 오래 유지한다.[16]M1과 NEP 단백질은 감염의 후기 단계에서 핵에 국부화하여 바이러스성 RNP에 결합하고 세포질로의 수출을 중재하는데, 그곳에서 재생된 내포솜의 도움으로 세포막으로 이동하며 게놈의 세그먼트에 결합된다.[1][3]
유전자 바이러스는 세포막에서 싹을 틔워 세포를 떠나는데, 세포막의 세포질 쪽에 M1 단백질이 축적되면서 시작된다.바이러스 게놈은 HA, NA, M2 단백질을 가진 세포막의 일부에서 파생된 바이러스성 봉투 안에 통합된다.싹이 트는 끝에서 HA 단백질은 NA 단백질의 시알리드 효소 활성에 의해 분해될 때까지 세포 시알산에 붙어 있다.그리고 나서 그 바이러스는 세포에서 방출된다.NA의 시알리드아제 활성은 또한 바이러스 표면에서 시알산 잔류물을 제거하는데, 이것은 새로 조립된 바이러스가 세포 표면 근처에 모여 감염성이 향상되는 것을 방지하는 데 도움이 된다.[1][3]인플루엔자 복제의 다른 측면과 유사하게 최적의 NA 활동은 온도 및 pH에 의존한다.[11]궁극적으로 세포 내에 다량의 바이러스 RNA가 존재하게 되면 사멸(apoptosis) 즉, 세포 요인에 의해 시작되어 바이러스 복제를 제한하는 프로그램된 세포사멸(programed cell death)이다.[20]
항원적 표류 및 이동
인플루엔자 바이러스가 진화하는 두 가지 핵심 과정은 항원적 표류와 항원적 이동이다.항원적 표류는 인플루엔자 바이러스의 항원이 항원의 (HA 또는 NA) 유전자에 돌연변이가 점진적으로 축적되어 변화할 때를 말한다.[15]이것은 숙주 면역 반응에 의해 작용하는 진화 압력에 반응하여 발생할 수 있다.항원성 표류는 특히 HA 단백질의 경우 흔하며, 이 경우 머리 부위의 아미노산 변화가 항원 표류를 구성할 수 있다.[2][18]그 결과 기존에 존재하는 항체 매개 면역성을 회피할 수 있는 새로운 변종이 만들어진다.[1][9]항원적 표류는 모든 인플루엔자 종에서 발생하지만 A보다 B에서 더 느리고 C와 D에서 가장 느리다.[18]항원성 표류는 계절성 독감의 주요 원인이며,[23] 독감 백신을 매년 업데이트해야 한다.HA는 비활성화된 백신의 주요 성분이기 때문에, 감시는 순환하는 변종들 사이에서 이 항원의 항원적 표류를 감시한다.인간의 인플루엔자 바이러스의 항원학적 진화는 돼지나 동일인의 인플루엔자 바이러스보다 빠른 것으로 보인다.야생조류에서 하위형 항원성 변화는 제한적으로 보이지만 가금류에서 관찰된 바 있다.[1][9]
항원적 변화는 인플루엔자 바이러스의 항원, 대개 HA의 갑작스럽고 급격한 변화다.항원 이동 중에 동일한 세포를 감염시키는 항원적으로 다른 변종은 서로 게놈 분열을 재조정하여 복합적 유전체를 생성한다.모든 인플루엔자 바이러스가 게놈을 세분화했기 때문에, 모두 재분배할 수 있다.[10][18]그러나 항원적 이동은 동일한 속성의[19] 인플루엔자 바이러스 사이에서만 발생하며 IAV 사이에서 가장 흔히 발생한다.특히 재변형은 AIVs에서 매우 흔해 조류에서 다양한 인플루엔자 바이러스를 발생시키지만 인간, 등신, 개복치 라인에서는 드물다.[24]돼지, 박쥐, 메추리 등은 포유류와 조류 IAV에 모두 수용체가 있어 재배치를 위한 잠재적 '믹싱 용기'이다.[17]동물성 변종이 인간 변종과 함께 재복구한다면 인간 대 인간 전달이 가능한 새로운 변종이 등장할 수 있다.[2]이 때문에 유행병이 발생했지만 한정된 숫자에 불과해 다음이 언제 일어날지 예측하기 어렵다.[1][9]
메커니즘
전송
감염된 사람은 호흡, 말, 기침, 재채기를 통해 인플루엔자 바이러스를 전염시킬 수 있는데, 이 바이러스는 바이러스 입자가 포함된 호흡기 방울과 에어로졸을 공기 중으로 퍼트린다.감염되기 쉬운 사람은 이 입자들과 접촉함으로써 독감에 걸릴 수 있다.[13][25]호흡기 방울은 비교적 크고 2m 이하로 이동하다가 인근 표면에 떨어진다.에어로졸은 크기가 작고 공기 중에 매달려 있는 시간이 길기 때문에 정착하는 데 시간이 오래 걸리고 호흡기 물방울보다 더 멀리 이동할 수 있다.[25][4]에어로졸을 흡입하면 감염으로 이어질 [26]수 있지만 대부분의 전염은 상부 호흡기의 점막과 접촉하는 호흡기 물방울을[8] 통해 감염자 주변 약 2m 부근에 있다.[26]사람, 체액 또는 중간[8][25] 물체(포미트)와의 접촉을 통한 전염도 발생할 수 있다. 예를 들어 독감 바이러스가 비집체 표면에서 몇 시간 동안 생존할 수 있기 때문이다.[4]손이 오염되면 얼굴을 만지면 감염될 수 있다.[27]
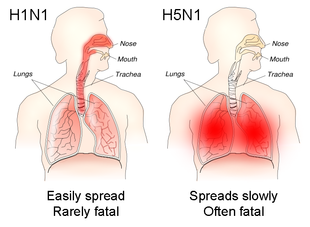
인플루엔자는 보통 증상이 시작되기 하루 전에서 5-7일 후까지 전염이 가능하다.[9]건강한 성인의 경우, 바이러스는 최대 3~5일 동안 제거된다.어린이들과 면역체계에 의해, 그 바이러스는 몇 주 동안 전염될 수 있다.[8]2-17세의 아이들은 인플루엔자의 가장 주요한 확산자로 여겨진다.[1][9]이전에 인플루엔자 바이러스에 여러 번 노출되지 않은 아이들은 다른 아이들보다 더 많은 양과 긴 기간 동안 바이러스를 배출한다.[1]인플루엔자에 노출될 위험이 있는 사람은 보건의료 종사자, 사회복지사, 독감에 취약한 사람과 함께 살거나 돌보는 사람 등이다.장기요양시설에서는 독감이 도입된 뒤 빠르게 확산될 수 있다.[9]낮은 온도, 낮은 절대 습도 및 상대 습도, 태양으로부터 오는 자외선의 감소,[26][28] 그리고 혼잡함 등 다양한 요소들이 인플루엔자 전염을 부추길 가능성이 있다.[25]H1N1과 같은 상부 호흡기를 감염시키는 인플루엔자 바이러스는 더 순하지만 더 전염성이 강한 반면, H5N1과 같은 하부 호흡기를 감염시키는 바이러스는 더 심각한 질병을 유발하는 경향이 있지만 전염성은 덜하다.[8]
병리학
인간에게 인플루엔자 바이러스는 우선 호흡기의 상피세포를 감염시켜 감염을 일으킨다.감염 중 질환은 주로 상피세포 감염과 사망에 따른 폐염과 절충에 의한 결과로서 면역체계의 감염 반응에 의한 염증과 결합한다.비흡수 장기는 관여할 수 있지만, 독감이 이러한 경우에 관여하는 메커니즘은 알려져 있지 않다.심한 호흡기 질환은 기도의 방해, 치경구조의 상실, 상피세포 감염 및 사망에 의한 폐 상피성 상실, 폐구조를 유지하는 세포외 기질의 저하 등 복수의 비독점적 메커니즘에 의해 유발될 수 있다.특히 치경세포 감염은 가스교환을 저해하고 바이러스가 내피세포를 감염시켜 다량의 친염증 시토카인을 만들어내기 때문에 심각한 증상을 유발하는 것으로 보인다.[13]
인플루엔자 바이러스에 의한 폐렴은 하부 호흡기에서 바이러스 복제가 높은데, 사이토카인 폭풍이라는 강력한 친염증 반응을 동반한다.[1]H5N1 또는 H7N9에 감염되면 특히 높은 수준의 프로염증 시토카인이 생성된다.[15]박테리아 감염의 경우, 인플루엔자 동안 대식세포의 조기 고갈은 박테리아 감염에 반응하는 데 중요하기 때문에 폐에 박테리아 성장에 유리한 환경을 조성한다.조직 수리를 장려하는 호스트 메커니즘은 부주의로 세균 감염을 허용할 수 있다.감염은 또한 조직 무결성은 보존하지만 박테리아의 성장을 증가시키기 위해 염증을 줄일 수 있는 전신 글루코코르티코이드의 생산을 유도한다.[13]
인플루엔자의 병태생리학은 수용체 인플루엔자 바이러스가 세포에 들어가는 동안 결합하는 것에 의해 크게 영향을 받는다.포유류 인플루엔자 바이러스는 호흡기 상피세포와 같은 다양한 호흡기 세포에서 가장 흔히 발견되는 α-2,6 링크에 의해 나머지 과두당과 연결된 시알산에 우선적으로 결합한다.[1][15][3][20]AIV는 α-2,3 연계가 있는 시알산을 선호하는데, 이는 위장 상피세포의[1][15][3] 조류와 하부 호흡기의 인간에게 가장 많이 나타난다.[29]또한 HA 단백질의 분리는 결합 서브 유닛인1 HA와 핵융합 서브 유닛인2 HA로 수행되며, 어떤 세포가 감염될 수 있는지에 영향을 미친다.포유류 인플루엔자 바이러스와 저병원성 AIV의 경우, 갈라지는 세포외여서 적절한 보호제가 있는 세포로 감염을 제한하는 반면, 고병원성 AIV의 경우 갈라지는 세포내 세포내 및 유비쿼터스 보호제에 의해 행해져 더욱 다양한 세포의 감염이 가능해져 더욱 심한 d에 기여한다.이서시키다[1][24][30]
면역학
세포는 바이러스성 RNA를 검출하기 위한 센서를 가지고 있으며, 이는 이후 인터페론 생성을 유도할 수 있다.인터페론은 면역세포를 감염현장으로 모집하는 항바이러스 단백질과 단백질의 발현을 중재하고, 인근 미감염 세포에도 감염 사실을 통보한다.일부 감염된 세포는 면역세포를 감염 부위에 모집하는 친염증 시토카인을 분비한다.면역세포는 감염된 세포를 죽이고 바이러스 입자와 세포사멸을 통해 바이러스 감염을 조절한다.그러나 악화되는 면역 반응은 사이토카인 폭풍을 통해 숙주 유기체에 해를 끼칠 수 있다.[1][11][20]면역반응에 대응하기 위해 인플루엔자 바이러스는 NS1, NEP, PB1-F2, PA-X 등 인터페론 생성과 숙주 유전자 발현을 억제해 숙주 면역반응을 줄이는 데 관여하는 다양한 비구조적 단백질을 암호화한다.[1][21]
백혈구의 한 종류인 B세포는 인플루엔자 항원 HA와 NA(또는 HEF[18])와 다른 단백질에 덜 결합하는 항체를 생성한다.일단 이 단백질에 묶이면 항체는 바이러스들이 세포 수용체에 결합하는 것을 차단하여 바이러스를 중화시킨다.인간의 경우 바이러스 노출 후 1주일까지 규모 있는 항체 반응이 발생한다.[31]이 항체 반응은 특히 ICV와 IDV의 경우 일반적으로 강력하고 오래 지속된다.[1][18]다시 말해, 유년기에 특정 변종에 노출된 사람들은 말년에 적당한 수준에서 여전히 그 변종에 대한 항체를 가지고 있으며, 이것은 관련 변종에 어느 정도 보호를 제공할 수 있다.[1]그러나 사람이 노출되는 첫 번째 HA 아형이 향후 감염과 백신에 대한 항체 기반 면역 반응에 영향을 미치는 '원래 항원죄'가 있다.[2]
예방
예방접종
특히 고위험군에 대해서는 매년 예방접종을 하는 것이 독감과 인플루엔자 관련 합병증을 예방하는 일차적이고 가장 효과적인 방법이다.[8][1][32]독감에 대한 백신은 3가성 또는 4가성으로, H1N1 변종, H3N2 변종, IBV 변종 2개에 해당하는 1개 또는 2개의 IBV 변종에 대한 보호를 제공한다.[8][2]두 가지 종류의 백신이 사용되고 있다: "죽였다" (즉, 비활성화된) 바이러스를 포함하는 비활성화된 백신과 약화된 바이러스를 포함하는 살아있는 감쇠 인플루엔자 백신 (LAIVs)이다.[1]불활성화 백신은 세제로 인해 바이러스가 교란되는 전체 바이러스, 분할 바이러스, 바이러스 항원 HA와 NA만 함유된 서브유닛 등 세 종류가 있다.[33]대부분의 독감 백신은 불활성화 되어 근육내 주사를 통해 투여된다.LAIV는 비강에 뿌려진다.[1]
예방접종 권고는 나라마다 다르다.다른 나라 추천 위험 그룹에서, 임산부 등과 같은 고도의 위해 제한된다 어떤 특정한 나이 위에 모든 사람들에게, 6months,[32] 같은, 어린 아이, workers,[1]노인, 만성 질병을 가진 사람들이, 의료(신생아를 제외한)예방 접종을 추천하는 위험한 사람들과 접촉한 사람. 그리고 pe바이러스를 쉽게 전염시키는 [9]사람어린 영아는 안전상의 이유로 독감 백신을 접종할 수 없지만 임신 중 산모에게 불활성 백신을 투여하면 산모로부터 소극적 면역력을 물려받을 수 있다.[34]인플루엔자 예방접종도 재조정 확률을 낮추는 데 도움이 된다.[11]
계절독감 백신의 효능은 크게 다르며, 백신 변형률, 연령, 사전 면역력, 면역 기능에 따라 평균 효능이 50~60%[2]로 추정되므로 백신 접종자는 여전히 인플루엔자에 걸릴 수 있다.[32]독감 백신의 효능은 특히 노인들 사이에서 차선책으로 여겨지지만,[1] 예방접종은 입원 기간뿐만 아니라 인플루엔자로 인한 사망률과 입원률을 줄이는 데에도 여전히 이롭다.[32][35]학령기 아동의 예방접종은 다른 연령대에 대한 간접적인 보호를 제공하는 것으로 나타났다.RAIV는 특히 6세 미만 아동에게 우수한 효능을 바탕으로 어린이에게 권장되며, 비활성화된 백신과 비교할 때 비백신 변종에 대한 면역력이 높아진다.[9][34]
예방접종의 일반적인 부작용으로는 국소주사 현장 반응과 감기 증상 등이 있다.열, 병, 근통이 덜 흔하다.독감 백신은 독감 백신이나 백신의 어떤 구성요소에 반응하여 심각한 알레르기 반응을 경험한 사람들을 위해 금지된다.LAIV는 면역결핍이 심한 아동이나 청소년이나 레이 증후군에 걸릴 위험 때문에 살리실산 치료를 받고 있는 사람들에게 주어지지 않는다.[9]또한 LAIV는 2세 미만 아동,[34] 임산부, 면역억제 성인에게 권장되지 않는다.비활성화된 독감 백신은 독감을 유발할 수 없으며 임신 중 안전한 것으로 간주된다.[9]
일반적으로 인플루엔자 백신은 백신 변종과 순환 변종 사이에 항원적 일치가 있을 때만 효과가 있다.[8][2]게다가, 상업적으로 이용 가능한 대부분의 독감 백신은 발생된 닭알에서 인플루엔자 바이러스의 전파에 의해 제조되며, 6~8개월이 걸린다.[2]독감 계절은 북반구와 남반구마다 다르기 때문에 WHO는 매년 2회, 각 반구마다 한 번씩 모임을 갖고 HA 억제 측정의 관찰을 바탕으로 독감 백신에 어떤 변종을 포함시켜야 하는지를 논의한다.[8][3]다른 제조 방법으로는 MDCK 세포 배양 기반 비활성 백신과 곤충 세포에서 바쿨로바이러스 과다 억제로 제조된 재조합형 소단위 백신 등이 있다.[2][36]
항바이러스성 항암제모프로필락스
독감은 생후 3개월 이상 된 사람이 구강으로 복용할 수 있는 항바이러스제 오셀타미비르와 7세 이상 노인도 흡입할 수 있는 자나미비르로 피폭 후 예방이나 중증도를 줄일 수 있다.케모프로필락스는 합병증 발생 위험이 높은 개인과 금기 또는 효과 부족으로 독감 백신을 접종할 수 없는 사람에게 가장 유용하다.[8]피폭 후 화학조미필락시술은 오셀타미비르를 확진 또는 의심 인플루엔자 환자와 접촉한 후 48시간 이내에 복용하고 36시간 이내에 자나마비르를 복용하는 경우에만 권장된다.[8][9]현재 독감 시즌 백신을 아직 접종하지 않은 사람, 접촉 후 2주 미만인 사람, 백신과 순환변종 사이에 현저한 불일치가 있는 경우, 예방접종 이력과 무관하게 폐쇄적인 환경에서 발생하였을 때 백신을 접종할 것을 권장한다.[9]
감염관리
독감의 확산을 줄이려면 손 위생이 중요하다.자주 비누와 물로 손 씻기, 알코올을 이용한 손 세정제 사용, 손으로 눈, 코, 입을 만지지 않는 것 등이 이에 해당한다.기침이나 재채기를 할 때 코와 입을 가리는 것은 중요하다.[37]독감 전염을 제한하는 다른 방법으로는 아플 때 집에 틀어박혀 있는 것,[1] 증상이 끝난 후 하루까지 다른 사람과 접촉을 피하는 것,[9] 문 손잡이와 같이 바이러스에 의해 오염될 가능성이 있는 표면을 소독하는 것 등이 있다.[1]미디어와 포스터를 통한 건강교육은 앞서 언급한 예절과 위생을 일깨우는 데 자주 사용된다.[8]
현재까지 연구 결과 마스크 사용과 함께 계절성 인플루엔자가 크게 감소하지 않아 마스크 사용에 대한 불확실성이 존재한다.마찬가지로, 국가 진입 지점에서의 선별의 효과성은 잘 연구되지 않는다.[37]학교 폐쇄, 격리 또는 검역을 통한 감염자 접촉 회피, 집단 집회 제한 등의 사회적 거리조치는 전염을 줄일 수 있지만,[1][37] 이런 조치는 비용이 많이 들고 인기가 없으며 실행이 어려운 경우가 많다.따라서 일반적으로 권장되는 감염관리 방법은 호흡기 예절, 손위생, 마스크 착용 등으로 저렴하고 수행이 용이하다.의약품 조치는 효과적이지만 발생 초기에는 이용할 수 없을 수 있다.[38]
건강관리 환경에서 감염된 개인은 개별 방으로 유인하거나 배정될 수 있다.감염된 체액에 노출될 위험이 있는 경우 감염된 개인과 접촉할 때 마스크, 장갑, 가운과 같은 보호복을 착용하는 것이 좋다.환자를 음압실에 머물게 하고 에어로졸 생성 활동을 피하는 것이 도움이 될 수 있지만,[8] 공기 중에 인플루엔자가 퍼지는 것을 막기 위해 특별한 공기 조절과 환기 시스템이 필요하지 않다고 여겨진다.[4]주택가에서는 독감 확산이 통제될 때까지 신규 입학을 마감해야 할 수도 있다.환자를 돌봄 가정에 퇴원시킬 때, 알려진 독감 발생이 있다면 주의하는 것이 중요하다.[9]
조류나 돼지 같은 동물에는 인플루엔자 바이러스가 유통되기 때문에 이들 동물로부터 전염되는 예방이 중요하다.수처리, 동물 실내 사육, 병든 동물 격리, 예방접종, 그리고 생물학적 치료가 주로 사용된다.고밀도 농장, 뒷마당 농장, 살아있는 가금류 시장, 그리고 물 주체가 있는 곳에서 떨어진 높은 지대에 가금류와 위작품을 배치하는 것은 야생 조류와의 접촉을 최소화하는 데 도움이 된다.[1]살아있는 가금류 시장의 폐쇄가 가장 효과적인 조치로[15] 보이며 H5N1, H7N9, H9N2의 확산을 억제하는 데 효과가 있는 것으로 나타났다.[16]다른 생물학적 대책으로는 청소·소독 시설 및 차량 소독, 가금농장 방문 금지, 도축 목적의 새를 농장으로 데려오지 않는 것,[39] 옷 갈아입는 것, 족욕장 소독, 음식과 물 처리 등이 있다.[1]
살아있는 가금류 시장이 문을 닫지 않으면 미분양 가금류를 제거하고 시설을 소독하는 '청정한 날'과 새 가금류가 도착하기 전에 감염물질을 제거하는 '이월 금지' 정책을 통해 인플루엔자 바이러스의 확산을 줄일 수 있다.만약 새로운 인플루엔자 바이러스가 앞서 언급한 생물학적 치료법을 위반했다면, 바이러스가 토착화되는 것을 막기 위해 격리, 제독, 도살 등을 통해 이를 근절하기 위한 신속한 탐지가 필요할 수 있다.[1]일부 국가에서 사용되는 조류 H5, H7, H9 아형에 대해 백신이 존재한다.[15]예를 들어 중국에서는 H7N9에 대한 국내산 조류 예방접종이 확산을 성공적으로 제한해, 다른 전염 제한 조치와 함께 백신 접종을 사용할 경우 효과적인 전략이[24] 될 수 있음을 보여준다.[1]돼지와 말의 경우, 인플루엔자 관리는 생물학적 과민성 예방접종에 의존한다.[1]
진단
증상에 근거한 진단은 계절성 전염병 중 건강한 사람에게 상당히 정확하며 폐렴, 급성호흡곤란증후군(ARDS), 패혈증, 또는 뇌염, 심근염, 근육조직의 파열 등이 발생할 경우 의심해야 한다.[13]인플루엔자는 다른 바이러스성 호흡기 질환과 유사하기 때문에 확인을 위해 실험실 진단이 필요하다.테스트를 위해 샘플을 채취하는 일반적인 방법에는 코와 목 면봉이 있다.[1]감염으로 인해 상부 호흡기가 제거되었지만 하부 호흡기가 제거되지 않은 경우 하부 호흡기에서 샘플을 채취할 수 있다.인플루엔자 검사는 독감철에 독감과 비슷한 증상을 보이거나 독감 환자와 관련이 있는 병원에 입원한 사람에게 권장된다.심각한 경우 조기 진단은 환자의 결과를 개선한다.[32]독감을 식별할 수 있는 진단 방법으로는 바이러스 배양, 항체 및 항원 검출 검사, 핵산 기반 검사 등이 있다.[40]
바이러스는 세포질 효과를 관찰하기 위해 포유류 세포나 발생 난자의 배양에서 3-10일 동안 배양될 수 있다.그런 다음 항체 얼룩, 적혈구를 이용한 혈액흡수 또는 면역항체 현미경 검사를 통해 최종 확인을 할 수 있다.세포질 효과가 나타나기 전에 면역력을 통해 감염을 확인할 수 있는 쉘 바이알 문화는 기존 문화보다 민감해 1~3일 뒤 결과가 나온다.[1][32][40]문화는 새로운 바이러스의 특성화, 항바이러스 약물에 대한 민감성 관찰, 항원 표류 감시 등에 활용될 수 있지만 상대적으로 속도가 느리고 전문 기술과 장비가 필요하다.[1]
독감에 대한 항체반응은 자연감염이나 예방접종 후 발견하는 데 사용될 수 있다.공통 혈청검사로는 HA 특이 항체를 검출하는 혈청정화 억제검사, 항체가 바이러스를 중화시켰는지 여부를 확인하는 바이러스 중화검사, 효소연계 면역흡수제 검사 등이 있다.이러한 방법은 상대적으로 저렴하고 빠른 경향이 있지만 핵산소 기반 시험보다 신뢰성이 떨어진다.[1][40]
직접 형광 또는 면역 형광 항체(DFA/IFA) 검사는 형광 라벨이 붙은 독감 특이 항체를 가진 검체에서 호흡기 상피세포를 점착시킨 뒤 형광현미경으로 검사하는 것이다.IAV와 IBV를 구별할 수 있지만 IAV를 하위 유형으로 구분할 수는 없다.[40]급속인플루엔자 진단시험(RIDT)은 검사 결과를 얻기 위한 간단한 방법이며, 비용이 저렴하며, 30분도 안 되는 시간에 신속하게 결과를 산출하기 때문에 흔히 사용되지만 IAV와 IBV 또는 IAV 하위 유형을 구별할 수 없고 핵산성 기반 시험만큼 민감하지 않다.[1][40]
핵산 기반 테스트(NATs)는 바이러스성 핵산을 증폭 및 검출한다.대부분의 이러한 테스트는 몇 시간이 걸리지만 빠른 분자 측정은 RIDT만큼 빠르다.[40][32]NAT 중에서는 역전사 중합효소 연쇄반응(RT-PCR)이 가장 전통적이며 IAV형 아형이 가능하기 때문에 인플루엔자[40] 진단에 있어 금본위제라고 여겨지지만 상대적으로 비용이 많이 들고 문화보다 거짓 양성반응이 일어나기 쉽다.[1]기타 NAT은 루프 매개 등온 증폭 기반 측정, 단순 증폭 기반 측정 및 핵산 시퀀스 기반 증폭을 사용해 왔다.핵산 염기서열 분석법은 바이러스 검체의 핵산 염기서열을 입수해 바이러스와 항바이러스 약물에 대한 내성을 파악할 수 있다.전통적인 방법은 상어 시퀀싱이지만, 시퀀싱 속도와 처리량이 뛰어난 차세대 방식으로 대체된 경우가 많다.[40]
치료
경증이나 온건한 질병의 경우 독감 치료가 뒷받침되며 아세트아미노펜, 이부프로펜 등 항균제,[41] 탈수증을 피하기 위한 적절한 수분 섭취, 집에서 쉬는 휴식 등이 있다.[9]기침약과 목 스프레이는 인후염에 도움이 될 수 있다.독감으로 아픈 동안에는 술과 담배 사용을 피하는 것이 좋다.[41]아스피린은 레이 증후군에 걸릴 위험이 높아져 어린이들에게 독감을 치료하지 않는 것이 좋다.[42]코르티코스테로이드 역시 사망률 증가와 관련이 있기 때문에 만성 폐쇄성 폐질환이나 천식 악화 등 패혈성 쇼크나 기저 질환을 치료할 때를 제외하고는 권장하지 않는다.[32]2차 세균감염이 발생하면 항생제를 이용한 치료가 필요할 수 있다.[9]
항바이러스제
| 마약 | 행정경로 | 승인된 사용 연령 |
|---|---|---|
| 오셀타미비르 | 구강 | 생후 최소 2주 이상 |
| 자나미비르 | 흡입 | 최소 5살 이상 |
| 페라미비르 | 정맥주사 | 최소 18세 |
| 라니나미비르 | 흡입[1] | 최소 10세 이상에게는 40 밀리그램(mg)의 복용량, 10세[43] 미만인 경우 20mg |
| 발록사비르 마르복실 | 구강[4] | 최소 12살[32] |
항바이러스제는 특히 면역체계가 손상된 중증 환자들을 치료하는 데 주로 사용된다.항바이러스제는 증상이 나타난 후 처음 48시간 이내에 시작할 때 가장 효과적이다.후기 행정은 면역결함의 기저에 있는 사람들, 더 심각한 증상을 가진 사람들, 혹은 만약 이 개인들이 여전히 바이러스를 흘리고 있다면 합병증이 생길 위험이 더 높은 사람들에게 여전히 유익할 것이다.검사 결과가 돌아오기를 기다리는 대신 인플루엔자가 의심돼 병원에 입원해 증상이 악화되는 경우에도 항바이러스 치료를 권고한다.[1][32]독감에 대한 대부분의 항바이러스제는 뉴라미디아제(NA) 억제제와 M2 억제제의 두 가지 범주로 나뉜다.[11]발록사비르 마르복실은 바이러스성 RNA 중합효소의 내분비 활성을 대상으로 하는 주목할 만한 예외로 IAV와 IBV에 대한 NA와 M2 억제제의 대안으로 사용될 수 있다.[8][15][4]
NA 억제제는 감염된 세포로부터의 바이러스 방출과 바이러스 복제 속도가 손상되도록 IAV 및 IBV 바이러스[1] 바이러스의 활성 부위에서 시알산의 결합을 모방하여 NA 수용체의 효소 활성을 목표로 한다.[9]NA 억제제로는 프로드마약 형태로 경구적으로 소비되어 간에서 활성 형태로 전환되는 오셀타미비르와 불침투로 흡입되는 분말인 자나미비르가 있다.오셀타미비르와 자나미비르는 예방과 노출 후 예방에 효과적이며, 전반적인 연구에 따르면 NA 억제제가 합병증, 입원, 사망률[1] 및 질병 기간을 줄이는 데 효과적이다.[11][32][4]또한, 비록 후기 행정은 심각한 경우 여전히 유익할 수 있지만,[4] 초기 NA 억제제가 제공될수록 더 좋은 결과를 얻을 수 있다.[1][32]다른 NA 억제제로는 라니냐미비르와[1] 페라미비르 등이 있는데, 그 중 후자는 이를 용인하거나 흡수할 수 없는 사람들을 위해 오셀타미비르의 대안으로 사용할 수 있다.[32]
아만타딘과 리만타딘은 인플루엔자 바이러스의 M2 이온 채널을 차단하는 경구 투여 약물로 바이러스 유출을 방지한다.[1][4]이 약들은 IAV에[32] 대항하여 기능할 뿐이지만 IAV들 사이에 광범위한 저항 때문에 더 이상 사용을 권장하지 않는다.[4]2003년 H3N2에서 처음으로 저항력이 나타났으며 2008년에는 전세계로 확산되었다.오셀타미비르 저항은 더 이상 널리 퍼지지 않는데, 이는 요충지에 내성이 있는 2009년 유행병 H1N1 변종(H1N1 pdm09)이 순환 중에 내성 변종을 대체한 것으로 보이기 때문이다.2009년 대유행 이후, 오셀타미비르 내성은 주로 치료를 받고 있는 환자들,[1] 특히 면역억제제와 어린 아이들에게서 관찰되었다.[4]오셀타미비르 저항은 보통 H1N1에서 보고되지만 H3N2와 IBV에서는 덜 일반적으로 보고되었다.[1]이 때문에 면역항암제 1차 선택약으로 오셀타미비르가 권장되는 반면 면역항암제의 경우 H3N2와 IBV, Zamanivir가 H1N1 pdm09에 대해 오셀타미비르가 권장된다.자나미비르 저항은 덜 자주 관찰되며, 과라미비르와 발록사비르 마복실에 대한 저항도 가능하다.[4]
예후
건강한 개인에게 인플루엔자 감염은 대개 자가 제한적이며 거의 치명적이지 않다.[8][9]증상은 보통 2~8일간 지속된다.[11]독감은 사람들이 직장이나 학교를 결석하게 할 수 있고, 그것은 직업 성취도 감소와, 나이든 어른들의 독립성 감소와 관련이 있다.피로와 우울증은 회복 후 몇 주 동안 지속될 수 있으며 건강한 성인들은 해결하는데 몇 주가 걸릴 수 있는 폐 이상을 경험할 수 있다.합병증과 사망률은 주로 고위험군 및 병원에 입원한 사람들에게 발생한다.심각한 질병과 사망률은 보통 1차 바이러스 감염에 의한 폐렴이나 2차 세균 감염에 의한 것으로 [1][9]ARDS로 진행될 수 있다.[11]
그 밖에 발생할 수 있는 호흡기 합병증으로는 축농증, 기관지염, 기관지염, 기관지염, 기관지염, 폐에 과다한 유체 증식, 만성 기관지염, 천식 등이 있다.중이염과 크롭은 어린이들에게 가장 흔하게 발생할 수 있다.[8][1]2차 S. aureus 감염은 주로 어린이들에게서 저혈압, 발열, 피부가 붉어지고 벗겨지면서 독성 쇼크 증후군을 일으키는 것으로 관찰되었다.[1]심혈관계에 영향을 미치는 합병증은 드물며 심막염, 심장박동이 빠르고 느리거나 불규칙한 완전심근염, 기존 심혈관질환의 악화 등이 있다.[8][9]근육조직의 붕괴를 동반한 근육의 염증이나 부기는 드물게 발생하는데, 주로 어린이들에게서 다리의 극심한 부드러움과 근육통으로 나타나며 2~3일 정도 걷기를 꺼린다.[1][9][13]
인플루엔자는 임신에 영향을 줄 수 있는데, 여기에는 작은 신생아 크기, 조산 위험 증가, 출생 직전 또는 출생 직후의 아동 사망 위험 증가 등이 포함된다.[9]신경학적 합병증은 무균성 뇌수막염, 뇌염, 확산성 뇌염, 횡격근염, 기예인-바레 증후군 등 드물게 인플루엔자와 연관돼 왔다.[13]게다가, 열 발작과 Reye 증후군은 가장 흔하게 어린이들에게 발생할 수 있다.[1][9]인플루엔자 관련 뇌병증은 혈중 바이러스가 있는 상태에서 중추신경계 감염으로 직접 발생할 수 있으며, 경련과 함께 발열, 혼수상태로 빠르게 진행됨으로 나타난다.[8]두통, 졸음, 혼수상태로 특징지어지는 뇌염 무기력증이라는 비정형적인 형태의 뇌염은 감염 후 어느 시점에는 거의 발생하지 않을 수 있다.[1]인플루엔자 관련 뇌병증 생존자의 경우 신경학적 결함이 발생할 수 있다.[8]주로 어린이의 경우, 심한 경우 면역체계가 사이토카인을 분비하는 백혈구를 극적으로 과잉 생산해 심한 염증을 유발하는 경우가 드물다.[8]
노화에 따른 면역력 약화나 만성질환으로 [9]65세 이상 고령자는 1세 미만 아동, 이전에 인플루엔자 바이러스에 여러 차례 노출되지 않은 아동처럼 합병증 발달을 위한 고위험군이다.임산부는 3배[1] 증가하며 출산 후 2주까지 지속되는 높은 위험성을 가지고 있다.[9][32]특히 35–40보다 큰 체질량 지수를 가진 비만은 더 많은 양의 바이러스 복제, 2차 세균 감염의 심각성 증가, 그리고 예방접종 효과 감소와 관련이 있다.건강 조건 내부 사람들은 또한 위험 이상으로욘 사람은 선천성 또는 만성 심장 질환이나 폐(예를 들어 천식), 신장, 간, 혈액, 신경, 또는 대사(예를 들어 당뇨병)disorders,[8][1][9]것을 화학 요법, asplenia 오랜 시간 스테로이드 치료, 비장에서 면역력이 약화된 사람들은 포함하여 고려되고 있다. dysfunct이온, 또는 HIV 감염.[9]현재의 담배 사용이나 과거의 담배 사용도 사람을 위험에 빠뜨린다.[32]인플루엔자에서 유전자의 역할은 잘 연구되지 않지만,[1] 인플루엔자 사망률의 요인이 될 수도 있다.[11]
역학

인플루엔자는 일반적으로 계절성 전염병과 산발적인 유행병으로 특징지어진다.인플루엔자의 부담은 대부분 IAV와 IBV에 의한 독감 시즌의 결과물이다.IAV 아형 중 H1N1과 H3N2는 현재 인간에게 순환하며 계절성 독감의 원인이 되고 있다.어린이들에게 불균형적으로 발생하지만, 가장 심각한 원인은 노인들, 아주 어린 사람들,[1] 그리고 면역체계가 보장된 사람들이다.[4]통상적으로 인플루엔자 바이러스는 전 세계 인구의 5~15%를 감염시켜 [3][40]연간[1][2] 300만~500만 건의 중증질환을 유발하고, 호흡기 질환으로 인한 사망자는 연간 29만~65만 명에 이른다.[3][4][45]매년 성인의 5~10%, 어린이의 20~30%가 독감에 걸린다.[17]신고된 인플루엔자 환자 수는 대개 실제 환자 수보다 훨씬 적다.[1][34]
계절성 전염병 동안, 그렇지 않으면 기침이 나거나 목이 아픈 건강한 사람들의 약 80%가 독감에 걸린다고 추정된다.[1]인플루엔자로 입원한 사람의 약 30~40%가 폐렴에 걸리고, 병원 전체 중증 폐렴 환자의 약 5%가 인플루엔자에 기인한 것으로 성인에서도 ARDS의 가장 흔한 원인이 되고 있다.어린이들에게, 인플루엔자는 ARDS의 가장 흔한 두 가지 원인 중 하나이고, 다른 하나는 호흡기 세포융합 바이러스다.[13]매년 약 3~5%의 어린이들이 인플루엔자로 인해 이염 매개체가 발생한다.[8]독감으로 인해 장기 부전이 발생하는 성인과 PIM 점수와 급성 신부전증이 있는 아동은 사망률이 더 높다.[13]계절성 인플루엔자 때는 사망률이 매우 젊은 층과 노인층에 집중되는 반면, 독감 유행 때는 젊은 층이 높은 비율로 영향을 받는 경우가 많다.[11]
온대지방에서는 계절에 따라 독감 발생 건수가 다르다.아마도 적은 햇빛, [28]낮은 습도, 낮은 온도, 항원 표류로 인한 바이러스 단백질의 사소한 변화로 인해 비타민 D 수치가 낮아지는 것은 겨울철에 절정에 이르는 연간 전염병의 원인이 된다.북반구에서는 10월에서 5월(더 좁게 12월에서 4월[11]), 남반구에서는 5월에서 10월(더 좁게 6월에서 9월[11])이다.따라서 온대 지방에는 매년 두 번의 뚜렷한 인플루엔자 시즌이 있는데, 하나는 북반구에, 하나는 남반구에 있다.[1][9][2]열대지방과 아열대지방은 계절성이 더 복잡하고, 최저기온, 일조시간, 최대강우, 높은 습도 등 다양한 기후요인의 영향을 받는 것으로 보인다.[1][46]따라서 독감은 이 지역에서 일년 내내 발생할 수 있다.[11]현대에 유행하는 인플루엔자 유행병은 아시아가 인플루엔자 바이러스의 핵심 보루인 가운데,[46] 동반구나 남반구에서 시작되는 경향이 있다.[11]
IAV와 IBV가 함께 순환하기 때문에 두 개의 전송 패턴은 동일하다.[1]그러나 ICV의 계절성은 잘 이해되지 않는다.ICV 감염은 2세 미만의 어린이들에게 가장 흔하며, 성인기까지 대부분의 사람들이 이 감염에 노출되었다.ICV 관련 입원은 3세 미만 아동에게 가장 흔하게 발생하며 다른 바이러스나 세균과의 공동 감염이 자주 동반되어 질병의 심각성을 높일 수 있다.어린이들 사이에서 호흡기 질환에 대한 모든 입원을 고려할 때, ICV는 그러한 경우 중 극히 일부에 불과한 것으로 보인다.ICV 감염의 대규모 발생이 발생할 수 있기 때문에 발병률이 상당히 다양하다.[10]
신종 인플루엔자 바이러스에 의한 인플루엔자 발생이 일반적이다.[19]인구의 사전 면역 수준에 따라 신종 인플루엔자 바이러스는 빠르게 확산돼 수백만 명의 사망자와 함께 유행병을 일으킬 수 있다.이러한 유행병은 계절성 독감과 대조적으로 동물성 독감 바이러스와 관련된 항원적 변화로 인해 발생한다.현재까지 알려진 독감 유행병은 모두 IAV에 의해 발생했으며, 이들은 1년 동안 여러 차례의 파도가 치는 과정에서 기원에서 다른 세계로 확산되는 동일한 패턴을 따르고 있다.[1][9][32]대유행성 변종은 다른 건강한 사람들의 높은 폐렴 비율과 관련이 있는 경향이 있다.[13]일반적으로 각 인플루엔자가 유행한 후에는 유행성 변종이 계절성 인플루엔자의 원인으로 계속 유통되어 이전의 변종을 대체한다.[1]1700년부터 1889년까지, 인플루엔자 유행병은 약 50-60년에 한 번 발생했다.이후 10~50년에 한 번꼴로 유행병이 발생했기 때문에 시간이 지날수록 유행병이 잦아지고 있는지도 모른다.[46]
역사
인플루엔자 바이러스가 언제 처음으로 인간을 감염시켰는지, 언제 최초의 인플루엔자 대유행이 발생했는지 알 수 없다.[48]아마도 중국에서 최초의 인플루엔자 유행은 기원전 6,000년경에 일어났을 것이고,[49] 인플루엔자에 대한 가능한 설명은 기원전 5세기 그리스 저술에 존재한다.[46][50]AD 1173–1174년과 AD 1387년에 전염병은 "인플루엔자"로 명명된 유럽 전역에서 발생했다.이러한 전염병 등이 인플루엔자에 의한 것인지는 당시 유행성 호흡기 질환에 대한 일관된 명명 패턴이 없었으며, '인플루엔자'가 수세기가 지나도록 호흡기 질환에 완전히 붙지 않았기 때문에 불분명하다.[51]인플루엔자는 1493년에 아메리카 대륙으로 옮겨졌을지도 모른다. 그 때 인플루엔자와 비슷한 전염병이 안틸레스 인구의 대부분을 죽였다.[52][53]
인플루엔자 대유행의 첫 번째 설득력 있는 기록은 1510년에 기록되었다; 그것은 북아프리카와 유럽으로 퍼지기 전에 동아시아에서 시작되었다.[48]대유행 이후 1557년과 1580년에는 계절성 인플루엔자가 발생하였고, 이후 유행성 전염병이 발생하였다.[51]1557년 독감 대유행은 잠재적으로 처음으로 독감이 임신부의 유산과 사망과 관련이 있었다.[54]1580년 독감 대유행은 여름 동안 아시아에서 시작되었고, 아프리카, 그 다음 유럽, 그리고 마침내 미국으로 퍼졌다.[46]16세기 말에 이르러 인플루엔자는 전염병과 풍토병 형태를 지닌 특정하고 인식 가능한 질병으로 이해되기 시작하고 있었다.[51]1648년, 말들도 독감을 겪는다는 것이 발견되었다.[48]
1700년 이후의 독감 데이터는 더 많은 정보를 제공하므로 이 시점 이후 독감 유행병을 식별하는 것이 더 쉬우며, 각각 독감에 대한 이해도가 점차적으로 높아진다.[55]18세기 최초의 독감 유행은 1729년 봄에 러시아에서 시작되었고, 3년 동안 뚜렷한 파도와 함께 전 세계로 퍼졌으며, 후기에는 더 치명적이다.18세기의 두 번째 유행성 독감은 1781-1782년에 중국에서 가을에 시작되었다.[46]이 대유행으로 인플루엔자는 갑자기 온열질환이 발병하게 되었다.[55]다음 유행성 독감은 1830년부터 1833년까지, 겨울에 중국에서 시작되었다.이 대유행병은 발병률이 높았지만 사망률은 낮았다.[23][46]
경미한 인플루엔자 유행병은 1847년부터 1851년까지 제3차 콜레라 유행과 동시에 발생했으며, 중요한 통계가 기록되는 최초의 인플루엔자 대유행이었기 때문에 인플루엔자 사망률이 처음으로 명확하게 기록되었다.[55]고병원성 조류인플루엔자는 1878년에[55] 인지되었고 곧 인간으로의 전염과 연결되었다.[48]1889년 H2N2 변종에서 비롯되었을지도 모르는 대유행병이 유행할 무렵,[56] 독감은 쉽게 알아볼 수 있는 질병이 되어 있었다.[48]
당초 인플루엔자를 담당하는 미생물제제는 1892년 R. F. J. 파이퍼에 의해 그 이름에 '인플루엔자'를 간직하고 있는 해모필루스 인플루언제 박테리아 종으로 청렴결백했다.[48][55]이듬해 바이러스가 많은 질병의 원인으로 확인되면서 바이러스학 분야가 형성되기 시작했다.1901년부터 1903년까지 이탈리아와 오스트리아의 연구원들은 당시 "조류 전염병"[24]이라고 불리던 조류 인플루엔자가 박테리아가 통과하기에 너무 작은 모공을 가진 필터를 사용함으로써 박테리아보다 작은 미세한 물질에 의해 발생한다는 것을 보여줄 수 있었다.그러나 바이러스와 박테리아의 근본적인 차이점은 아직 완전히 이해되지 않았다.[55]
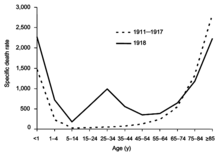
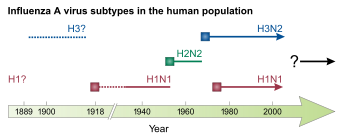
1918년부터 1920년까지 스페인 독감 대유행은 역사상 가장 파괴적인 인플루엔자 대유행이자 가장 치명적인 유행병 중 하나가 되었다.아마도 H1N1에 의해 야기된 유행병은 1차 세계대전 중과 그 후에 전세계에 퍼지기 전에 미국에서 시작되었을 것이다.1918년 상반기의 초기 파동은 비교적 경미했고 과거 독감 유행병과도 닮았지만,[46] 그해 말 2차 파동은 사망률이 훨씬 높아 대부분의 사망자를 차지했다.사망률이 낮은 제3의 물결은 제2의 물결 이후 몇 달 만에 많은 곳에서 일어났다.[23]1920년 말까지 전세계 인구의 약 3분의[11] 1에서 절반 정도가 감염되었고, 수천만 명의 사망자가 불균형하게 젊은 성인들이 감염된 것으로 추정된다.[46]1918년 대유행 때는 전염의 호흡 경로가 명확하게 확인되었고[23] 인플루엔자는 세균이 아닌 '필터 패서'에 의한 것으로 나타났으나, 인플루엔자 원인에 대한 합의가 10년 더 부족했고 인플루엔자에 대한 연구는 감소했다.[55]전염병 이후, H1N1은 다음 번 유행병이 될 때까지 계절적인 형태로[1] 인간에게 유통되었다.[55]
1931년 리처드 쇼프는 돼지 인플루엔자의 원인으로 바이러스를 식별하는 3개의 논문을 발표했는데, 이 질병은 1918년 2차 대유행 때 처음 특징지어졌던 돼지들 사이에서 당시 새롭게 인정받은 질병이었다.[54][55]쇼페의 연구는 인간 인플루엔자에 대한 연구에 활력을 불어넣었고, 그 이후 독감 연구로부터 바이러스학, 세리학, 면역학, 실험 동물 모델, 백신학, 면역 치료의 많은 발전이 일어났다.[55]인플루엔자 바이러스가 발견된 지 불과 2년 후인 1933년 IAV가 인간 인플루엔자의 주범으로 확인되었다.[54][58]IAV의 아형은 1930년대에 걸쳐 발견되었고 [55]IBV는 1940년에 발견되었다.[17]
제2차 세계 대전 동안 미국 정부는 인플루엔자에 대한 불활성화 백신 개발에 힘썼고, 그 결과 1945년 미국에서 처음으로 인플루엔자 백신이 허가되었다.[1]ICV는 2년 후인 1947년에 발견되었다.[17]1955년 조류독감은 IAV에 의한 것으로 확인되었다.[24]제2차 세계대전 이후 4건의 인플루엔자 유행병이 발생했는데, 각각 1918년의 유행병보다 덜 심각하다.그 중 첫 번째는 1957년부터 1958년까지 H2N2 변종에[1][38] 의해 발생하여 중국 윈난성에서 시작된 아시아 독감이었다.사망자의 수는 아마도 100만 명을 넘어섰을 것이며, 대부분은 아주 젊고 나이든 사람들이다.[46]특히 1957년 대유행은 세계적인 감시 시스템과 새로운 인플루엔자 바이러스를 연구할 수 있는 실험실이 있는 곳에서 발생한 최초의 독감 유행병이었다.[23]유행병 이후, H2N2는 계절성 독감의 원인이 되는 IAV 하위 유형이었다.[1]인플루엔자에 대한 최초의 항바이러스제인 아만타딘은 1966년 사용 승인을 받았으며, 1990년대 이후 추가 항바이러스제가 사용되고 있다.[4]
1968년에, H3N2는 인간에게 돌고 있던 조류 H3N2 변종과 H2N2 변종 사이의 재분배 결과 인간에 도입되었다.소설 H3N2 변종은 홍콩에서 처음 등장하여 전 세계로 확산되어 홍콩 독감의 대유행으로 50만~200만 명이 사망하였다.이것은 항공 여행에 의해 크게 확산된 최초의 전염병이었다.[3][23]H2N2와 H3N2는 전염성이 약해진 1971년까지 전염병 후 H2N2가 공동 순환되어 H3N2로 완전히 대체되었다.[3]1977년 인체에서 H1N1이 다시 등장했는데, 아마도 실험실 사고로 냉동고에서 방출된 후 사이비판증을 유발했을 것이다.[23][55]1977년 '독감 유행병'이 자연사에 포함되어야 하는지는 논란의 여지가 있다.[46]이 H1N1 변종은 1957년 이전에 순환한 H1N1 변종과 항원적으로 유사했다.1977년 이후, H1N1과 H3N2 모두 계절성 인플루엔자의 일부로 인간에게 순환되어 왔다.[1]1980년에는 인플루엔자 바이러스를 하위형으로 분류하는 현행 분류체계가 도입되었다.[59]

어느 순간 IBV는 두 개의 선으로 갈라져 B/빅토리아와 B/야마가타 같은 선으로 이름이 붙었는데, 둘 다 1983년부터 인간에게 순환되어 왔다.[17]1996년 중국[24] 광둥성에서 HPAI H5N1이 검출되었고 1년 후 홍콩의 가금류에서 출현하여 점차 세계적으로 확산되었다.당시 홍콩에서 인체에서 H5N1이 소규모로 발생했으며,[30] 1997년부터는 산발적인 인간사례가 발생하여 높은 사망률을 보이고 있다.[15][40]가장 최근의 유행성 독감은 2009년 돼지독감 유행병으로 멕시코에서 발생하여 수십만 명의 사망자를 낳았다.[23]그것은 인간, 돼지, 조류 인플루엔자 바이러스를 재조정한 새로운 H1N1 변종에서 비롯되었다.[16][4]2009년 유행병은 이전의 H1N1 변종을 새로운 변종과 교체하는 효과가 있었지만 다른 인플루엔자 바이러스는 없었다.결과적으로, H1N1, H3N2 및 두 IBV 라인은 2009년 대유행 이후 계절적 형태로 유통되고 있다.[1][23][24]
2011년 미국 오클라호마의 돼지에게서 IDV가 발견되었고, 이후 소가 IDV의 1차 저수지로 확인되었다.[10][17]같은 해 중국에서 조류 H7N9이 검출돼 2013년부터 인체 감염을 일으키기 시작해 상하이와 안휘를 시작으로 중국에 주로 남아 있다.[40]HPAI H7N9는 2016년경에 등장했고 때때로 우발적으로 인간을 감염시켰다.Other AIVs have less commonly infected humans since the 1990s, including H5N6, H6N1, H7N2-4, H7N7, and H10N7-8,[15] and HPAI H subtypes such as H5N1-3, H5N5-6, and H5N8 have begun to spread throughout much of the world since the 2010s.조류독감 바이러스로 인해 발생할 수 있는 미래 독감 유행은 [24]거의 피할 수 없는 것으로 간주되고 있으며, 세계화의 증가로 인해 새로운 바이러스가 확산되기 쉬워졌기 [23]때문에 향후 유행에[54] 대비하고 인플루엔자의 예방과 치료를 개선하기 위한 노력이 계속되고 있다.[1]
어원
인플루엔자라는 단어는 이탈리아어 인플루엔자, 중세 라틴어 인플루언서에서 유래했는데, 원래 "방문" 또는 "인플루엔자"를 의미한다.'추위의 팽창'을 뜻하는 인플루엔자 디 프레도, '별의 팽창'을 뜻하는 인플루엔자 디 스텔 같은 용어가 14세기부터 증명되고 있다.후자는 그 질병의 원인을 언급했는데, 그 당시 몇몇 사람들은 그것을 좋지 않은 점성술적 조건 탓으로 돌렸다.1504년 초기에, 인플루엔자는 한 번에 많은 사람들에게 영향을 미치는 질병에 대한 "방문" 또는 "발병"을 의미하기 시작했다.1743년 이탈리아에서 시작되어 유럽 전역에 퍼진 독감이 발발하는 동안, 이 단어는 영어에 도달했고 발음으로 영어화되었다.1800년대 중반부터 독감은 심한 감기를 가리키는 데에도 쓰이고 있다.[60][61][62]단축된 형태인 (독감)은 1839년에 철자독감에 의한 플루(flue)가 1893년에 처음 증명되었기 때문에 처음으로 증명되었다.[63]독감에 사용된 다른 이름으로는 전염병인 카타르, 프랑스어인 라그페, 땀 흘리는 병, 특히 1918년 유행병인 스페인 열병이 있다.[64]
리서치
인플루엔자 연구는 광범위하며, 인플루엔자 바이러스가 어떻게 숙주에 침투하는지, 인플루엔자 바이러스와 박테리아의 관계, 인플루엔자 증상이 어떻게 진행되는지, 그리고 어떤 인플루엔자 바이러스를 다른 것보다 더 위험하게 만드는 것을 이해하기 위한 노력을 포함한다.[65]인플루엔자 바이러스에 의해 암호화된 비구조적 단백질은 주기적으로 발견되고 그 기능은 지속적으로 연구되고 있다.[21]과거 유행병, 특히 1918년 유행병은 독감 유행병을 이해하기 위한 많은 연구의 대상이다.[46]전 세계 인플루엔자 감시 및 대응 시스템은 전 세계 인플루엔자 감염과 역학을 감시하는 연구소의 네트워크다.[66]추가적인 연구 분야로는 인플루엔자의 진단, 치료, 예방 등을 개선할 수 있는 방법이 있다.
기존 진단방법은 장점과 함께 다양한 한계가 있다.예를 들어, NAT은 민감도와 특수성이 높지만 높은 비용, 복잡성, 유지보수 및 필요한 교육으로 인해 리소스가 부족한 지역에서는 실용적이지 못하다.저렴한 휴대용 RIDT는 인플루엔자를 빠르게 진단할 수 있지만 민감도가 가변적이며 IAV를 서브타입할 수 없다.이러한 한계 등의 결과, 새로운 진단방법에 대한 연구는 독감종과 IAV 하위유형을 구별할 수 있는 동시에 기존 방법보다 비용 효율적이고 노동집약적이며 덜 복잡하고 덜 복잡한 새로운 방법을 생산하는 것에 초점을 맞추고 있다.개발 중인 한 가지 접근방식은 RT-PCR, 세롤로지 분석과 같은 다양한 진단 테스트를 마이크로칩 형태로 사용하는 진단 장치인 랩온어칩이다.이 칩들은 높은 반응 효율, 낮은 에너지 소비, 낮은 폐기물 발생 등 많은 잠재적 이점을 가지고 있다.[40]
새로운 항바이러스제 역시 생동감 있는 약물로 완강한 항바이러스제가 제거되고 오셀타미비르 내성이 우려돼 개발 중이다.여기에는 Zamanivir의 정맥 형성 등 정맥주입이 가능한 NA 억제제, 여러 RNA 바이러스에 사용되는 중합효소 억제제인 favipirarvir, 바이러스 전사 시 필요한 캡 바인딩을 방지하는 pimodivir, HA 성숙을 억제하는 nitazoxanide 등이 포함된다.[1][11]호흡기의 과도한 염증을 줄이는 것도 인플루엔자 병리학의 주요 메커니즘 중 하나이기 때문에 많은 연구를 거쳐야 한다.[11][13]개발 중인 다른 치료법으로는 바이러스성 단백질을 대상으로 하는 단핵항체와 다핵항체, 회복기 혈장, 숙주 항바이러스 반응을 수정하기 위한 다른 접근법,[32][67] 폐 손상을 복구하기 위한 줄기세포 기반 치료법 등이 있다.[11]
LAIVs에 대한 많은 연구는 여전히 면역성을 부여하는 백신에서 무해한 인플루엔자 바이러스를 만들기 위해 삭제할 수 있는 게놈 서열을 식별하는 데 초점을 맞추고 있다.[21]그러나 인플루엔자 바이러스 항원의 높은 변동성과 빠른 진화는 효과적인 백신 개발에 큰 장애물이다.게다가, 다음 독감 시즌에 어떤 변종이 유통될지 예측하기 어렵고, 다음 시즌에 충분한 양의 독감 백신을 제조하는 것은 어렵고,[2] LAIVs는 효능이 제한적이며, 매년 반복되는 백신 접종은 잠재적으로 효능이 떨어졌다.[1]이러한 이유로, 많은 또는 모든 인플루엔자 바이러스에 대한 보호를 제공할 수 있는 "광범위한" 또는 "범용" 독감 백신이 연구되고 있다.접근 방식 이러한 백신 개발을 위해 동일한 줄기다 chimeras지만 다른 CEO와 같은 HAstalk-based 방법 computationally 최적화된 넓게 인플루엔자를 중화시키는 항원, 항유전자형 항체 백신 매우적으로 바이러스성 단백질과 면역 반응을 이끌어 내는 등 HAhead-based 메서드를 포함합니다.[2][67]mRNA백신 프로를 제공한다.독감에 대한 치료 또한 연구중이다.[68]
동물에서
새들
오리, 거위, 해안조류, 갈매기 같은 수생 조류는 IAV의 주요 저수지다.[15][16]조류에서 AIV는 증상이 거의 발생하지 않는 저병원성 조류인플루엔자(LPAI) 바이러스나 중증질환을 유발하는 고병원성 조류인플루엔자(HPAI) 바이러스일 수 있다.HPAI 감염의 증상은 에너지와 식욕부진, 계란 생산량 감소, 연약 또는 탈모 알, 머리, 빗, 와트, 후크 등의 붓기, 와트, 빗, 다리의 보라색 변색, 콧물 배출, 기침, 재채기, 발작, 설사를 포함한다.HPAI 바이러스에 감염된 새들도 감염 징후 없이 갑자기 죽을 수 있다.[39]
LPAI와 HPAI의 구분은 일반적으로 AIV가 닭에게 얼마나 치명적인지를 기준으로 할 수 있다.유전자 수준에서 AIV는 일반적으로 HA 유전자에 추가 잔류물을 포함하고 있는 HA 단백질에 다변성 분열 부위가 있는 경우 HPAI 바이러스로 식별될 수 있다.[16][24]대부분의 AIV는 LPAI이다.주목할 만한 HPAI 바이러스는 HPAI H5N1과 HPAI H7N9이다.HPAI 바이러스는 21세기에 주요한 질병 부담으로 작용하여 많은 수의 새들이 죽었다.H7N9의 경우 일부 순환 균주가 원래 LPAI였으나 HA 다변량 분할 부지를 인수하여 HPAI가 되었다.조류 H9N2 역시 LPAI이지만 재분배 과정에서 H5N1과 H7N9에 유전자를 공통적으로 기증하는 형태여서 우려된다.[1]
철새들은 멀리 떨어진 곳에 독감을 퍼뜨릴 수 있다.그 예로 2005년 H5N1형 변종이 많은 철새들의 기항지이자 번식지인 중국 칭하이호에서 조류에 감염돼 아시아, 유럽, 중동 등 20여 개국에 바이러스를 전파한 사례가 있다.[15][24]AIV는 야생 조류에서 국내산 자유거리 오리로, 오염된 물, 에어로졸, 조미료를 통해 가금류로 전염될 수 있다.[1]그러므로 오리는 야생 조류와 국내 조류 사이의 중요한 매개체 역할을 한다.[24]가금류로의 전염은 전형적으로 뒷마당 농장과 여러 종이 서로 교류하는 살아있는 동물 시장에서 일어난다.거기서부터 AIV는 적절한 생물학적 과실이 없는 상태에서 양계 농장으로 확산될 수 있다.가금류 중에서는 에어로졸과 오염된 배설물,[1] 우리, 사료, 죽은 동물을 통해 HPAI 전염이 일어난다.[15]가금류에서 야생 조류로 HPAI 바이러스의 역전이 발생했으며 대량 살처분과 대륙 간 확산에 관여하고 있다.[16]
AIV는 때때로 에어로졸, 찜질, 오염된 물을 통해 인간을 감염시켰다.[1]야생 조류로부터의 방향 전달은 드물다.[24]대신, 대부분의 전염은 주로 닭, 오리, 거위뿐만 아니라 기니새, 꿩, 메추라기 같은 다양한 새들을 포함한다.[16]AIV 감염의 주요 위험 요인은 농장이나 살아있는 가금류 시장에서 조류에 노출되는 것이다.[15]일반적으로 AIV 감염은 잠복기가 3~5일이지만 최대 9일이 될 수 있다.H5N1과 H7N9는 심각한 하부 호흡기 질환을 유발하는 반면, H9N2와 같은 다른 AIV는 일반적으로 결막염과 함께 보다 가벼운 상부 호흡기 질환을 유발한다.[1]조류 H2, H5-7, H9, H10 아형의 호흡기 방울, 에어로졸, 찜질을 통해 한 사람에서 다른 사람으로 제한된 전송이 발생했지만 AIV의 지속적인 인간 대 인간 전송은 일어나지 않았다.[1][2]2013년 이전에는 H5N1이 인간을 감염시키는 가장 흔한 AIV였다.그 이후로 H7N9는 대부분의 인간사례를 담당하게 되었다.[15]
돼지들
돼지 독감은 사람의 독감과 비슷한 호흡기 질환으로 전 세계적으로 발견된다.증상이 없는 감염은 흔하다.증상은 일반적으로 감염 후 1-3일 후에 나타나며 발열, 무기력, 거식증, 체중 감소, 호흡곤란, 기침, 재채기, 코막힘 등이 있다.sows에서는 임신이 중단될 수도 있다.합병증은 2차 감염과 잠재적으로 치명적인 기관지폐쇄증이다.돼지는 감염 후 하루 안에 전염이 되고 보통 7~10일 동안 바이러스를 전파하는데, 이는 무리 내에서 빠르게 확산될 수 있다.돼지는 보통 증상이 나타난 뒤 3~7일 이내에 감염을 회복한다.예방 및 통제 조치에는 비활성화된 백신과 감염된 가축을 도살하는 것이 포함된다.신종플루의 원인이 되는 인플루엔자 바이러스는 IAV 아형 H1N1, H1N2, H3N2이다.[69]
일부 IAV는 에어로졸을 통해 돼지에서 인간으로 전달될 수 있고 그 반대의 경우도 있다.[1]더욱이 돼지는 박쥐, 메추리 등과 함께 호흡기에 α-2,3 수용체와 α-2,6 시알산 수용체를 모두 가지고 있기 때문에 인플루엔자 바이러스의 혼합 용기로 인정받고 있다.[17]그 때문에 조류독감과 포유류 인플루엔자 바이러스 모두 돼지를 감염시킬 수 있다.만약 공동감염이 발생한다면, 재감염이 가능하다.[16]이것의 주목할 만한 예는 2009년에 돼지, 조류, 인간 인플루엔자 바이러스를 재조정하여 2009년 독감 대유행을 일으킨 새로운 H1N1 변종을 낳았다.[16][4]그러나 인간에서 돼지로의 유출 사건은 돼지에서 인간으로 가는 사건보다 더 흔한 것으로 보인다.[16]
다른동물
인플루엔자 바이러스는 소, 말, 개, 고양이, 해양 포유류를 포함한 많은 다른 동물에서 발견되었다.거의 모든 IAV는 명백히 새의 조상 바이러스의 후손이다.예외는 배트인플루엔자(bat influense)와 같은 바이러스인데, 이 바이러스는 출처가 확실치하다.이러한 박쥐 바이러스는 HA와 NA 하위 유형 H17, H18, N10, N11을 가지고 있다.H17N10과 H18N11은 다른 IAV와 재복제할 수 없지만 여전히 다른 포유류에서 복제할 수 있다.[1]AIV는 때때로 포유동물과 교차한다.예를 들어 2016년 말~2017년 초 뉴욕에서 조류 H7N2 변종이 고양이를 감염시키고 있는 것으로 나타났다.[1]
Equine IAV에는 H7N7과 H3N8의 2개[1] 라인이 포함된다.그러나 H7N7은 1970년대 후반 이후 말에서 검출되지 않아 말에서 멸종했을 가능성이 있다.[19][16]H3N8은 에어로졸을 통해 퍼지며 호흡기 질환을 일으킨다.[1]Equine H3N8은 α-2,3 sialic acid에 주적으로 결합되기 때문에, 말은 보통 데드엔드 숙주로 여겨지지만, 개와 낙타로의 전염이 발생하여 말들이 재변경을 위해 그릇을 섞는 것이 아니냐는 우려가 나오고 있다.캐닌에서 유통되고 있는 IAV는 동일 유도 H3N8과 조류 유도 H3N2뿐이다.Canine H3N8은 다른 하위 유형과 재조정하는 것이 관찰되지 않았다.H3N2는 훨씬 넓은 호스트 범위를 가지며 H1N1과 H5N1로 재할당할 수 있다.닭에서 H6N1이 나온 것으로 보이는 격리된 케이스가 개를 감염시킨 것으로 밝혀져 다른 AIV가 개에서 나올 수도 있다.[16]
IAV에 감염되는 다른 포유류로는 물개에는 H7N7과 H4N5, 고래에는 H1N3, 밍크에는 H10N4와 H3N2가 있다.[19]포유류에 적응하는 AIV와 관련된 다양한 돌연변이가 확인되었다.HA 단백질은 시알산이 결합하는 형태로 다양하기 때문에 HA 수용체 결합 부위의 돌연변이는 AIV가 포유류를 감염시킬 수 있다.다른 돌연변이로는 어떤 시알산 NA 단백질이 갈라지는가에 영향을 미치는 돌연변이와 포유류 호흡기의 낮은 온도에 대한 내성을 개선하고 NP와 PB2 결합을 안정화하여 RNP 어셈블리를 향상시키는 PB2 중합효소 소단위 돌연변이가 있다.[16]
IBV는 주로 사람에게서 발견되지만 돼지, 개, 말, 물개에서도 검출되었다.[17]마찬가지로, ICV는 주로 인간을 감염시키지만 돼지, 개, 소, 낙타에서 관찰되었다.[10][17]IDV는 돼지에게 인플루엔자 같은 병을 유발하지만, 자연 저수지인 소에 미치는 영향은 비교적 알려져 있지 않다.인체 독감을 닮은 호흡기 질환을 스스로 유발하거나, 공동감염 시 다른 병원균과 함께 소 호흡기 질환(BRD) 복합체의 일부일 수 있다.BRD는 축산업계의 관심사여서 IDV가 BRD에 관여할 가능성이 있어 IDV에 대한 보호를 제공할 수 있는 소용 백신 연구로 이어졌다.[17][18]D/swine/Okahoma/1334/2011 (D/OK)과 D/boine/Okahoma/660/2013 (D/660) 두 개의 항원 라인이 유통되고 있다.[17]
참조
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al am an ao ap aq ar as at au av aw ax ay az ba bb bc bd be bf bg bh bi bj bk bl bm bn bo bp bq br bs bt bu bv bw bx by bz ca cb cc cd ce cf cg ch ci cj ck cl cm cn co cp cq cr cs Krammer F, Smith GJ, Fouchier RA, Peiris M, Kedzierska K, Doherty PC, Palese P, Shaw ML, Treanor J, Webster RG, García-Sastre A (28 June 2018). "Influenza". Nature Reviews Disease Primers. 4 (1): 3. doi:10.1038/s41572-018-0002-y. PMC 7097467. PMID 29955068.
- ^ a b c d e f g h i j k l m n o p Sautto GA, Kirchenbaum GA, Ross TM (19 January 2018). "Towards a universal influenza vaccine: different approaches for one goal". Virology Journal. 15 (1): 17. doi:10.1186/s12985-017-0918-y. PMC 5785881. PMID 29370862.
- ^ a b c d e f g h i j k l m n o p Allen JD, Ross TM (2018). "H3N2 influenza viruses in humans: Viral mechanisms, evolution, and evaluation". Human Vaccines & Immunotherapeutics. 14 (8): 1840–1847. doi:10.1080/21645515.2018.1462639. PMC 6149781. PMID 29641358.
- ^ a b c d e f g h i j k l m n o p q Lampejo T (July 2020). "Influenza and antiviral resistance: an overview". European Journal of Clinical Microbiology & Infectious Diseases. 39 (7): 1201–1208. doi:10.1007/s10096-020-03840-9. PMC 7223162. PMID 32056049.
- ^ "Flu Symptoms & Diagnosis". Centers for Disease Control and Prevention (CDC). 10 July 2019. Retrieved 24 January 2020.
- ^ "Flu Symptoms & Complications". Centers for Disease Control and Prevention (CDC). 26 February 2019. Retrieved 6 July 2019.
- ^ Call SA, Vollenweider MA, Hornung CA, Simel DL, McKinney WP (February 2005). "Does this patient have influenza?". JAMA. 293 (8): 987–97. doi:10.1001/jama.293.8.987. PMID 15728170.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x Dharmapalan D (October 2020). "Influenza". Indian Journal of Pediatrics. 87 (10): 828–832. doi:10.1007/s12098-020-03214-1. PMC 7091034. PMID 32048225.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah Ghebrehewet S, MacPherson P, Ho A (7 December 2016). "Influenza". The BMJ. 355: i6258. doi:10.1136/bmj.i6258. PMC 5141587. PMID 27927672.
- ^ a b c d e f g h i j Sederdahl BK, Williams JV (13 January 2020). "Epidemiology and Clinical Characteristics of Influenza C Virus". Viruses. 12 (1): 89. doi:10.3390/v12010089. PMC 7019359. PMID 31941041.
- ^ a b c d e f g h i j k l m n o p q r s t Peteranderl C, Herold S, Schmoldt C (August 2016). "Human Influenza Virus Infections". Seminars in Respiratory and Critical Care Medicine. 37 (4): 487–500. doi:10.1055/s-0036-1584801. PMC 7174870. PMID 27486731.
- ^ 사람들은 또한 '긴 독감'을 앓고 있다는 연구 결과가 나왔다. BBC
- ^ a b c d e f g h i j k l Kalil AC, Thomas PG (19 July 2019). "Influenza virus-related critical illness: pathophysiology and epidemiology". Critical Care. 23 (1): 258. doi:10.1186/s13054-019-2539-x. PMC 6642581. PMID 31324202.
- ^ "Virus Taxonomy: 2019 Release". International Committee on Taxonomy of Viruses. Retrieved 9 March 2021.
- ^ a b c d e f g h i j k l m n o p Li YT, Linster M, Mendenhall IH, Su YC, Smith GJ (11 December 2019). "Avian influenza viruses in humans: lessons from past outbreaks". British Medical Bulletin. 132 (1): 81–95. doi:10.1093/bmb/ldz036. PMC 6992886. PMID 31848585.
- ^ a b c d e f g h i j k l m n Joseph U, Su YC, Vijaykrishna D, Smith GJ (January 2017). "The ecology and adaptive evolution of influenza A interspecies transmission". Influenza and Other Respiratory Viruses. 11 (1): 74–84. doi:10.1111/irv.12412. PMC 5155642. PMID 27426214.
- ^ a b c d e f g h i j k l m n o p q r s Asha K, Kumar B (5 February 2019). "Emerging Influenza D Virus Threat: What We Know so Far!". Journal of Clinical Medicine. 8 (2): 192. doi:10.3390/jcm8020192. PMC 6406440. PMID 30764577.
- ^ a b c d e f g h i j k Su S, Fu X, Li G, Kerlin F, Veit M (17 November 2017). "Novel Influenza D virus: Epidemiology, pathology, evolution and biological characteristics". Virulence. 8 (8): 1580–1591. doi:10.1080/21505594.2017.1365216. PMC 5810478. PMID 28812422.
- ^ a b c d e f g h i McCauley JW, Hongo S, Kaverin NV, Kochs G, Lamb RA, Matrosovich MN, Perez DR, Palese P, Presti PM, Rimstad E, Smith GJ (2011). "Orthomyxoviridae". International Committee on Taxonomy of Viruses. Retrieved 9 March 2021.
- ^ a b c d e f g Shim JM, Kim J, Tenson T, Min J, Kainov DE (12 August 2017). "Influenza Virus Infection, Interferon Response, Viral Counter-Response, and Apoptosis". Viruses. 9 (8): 223. doi:10.3390/v9080223. PMC 5580480. PMID 28805681.
- ^ a b c d e f g Hao W, Wang L, Li S (3 October 2020). "Roles of the Non-Structural Proteins of Influenza A Virus". Pathogens. 9 (10): 812. doi:10.3390/pathogens9100812. PMC 7600879. PMID 33023047.
- ^ Dadonaite B, Vijayakrishnan S, Fodor E, Bhella D, Hutchinson EC (August 2016). "Filamentous influenza viruses". J Gen Virol. 97 (8): 1755–1764. doi:10.1099/jgv.0.000535. PMC 5935222. PMID 27365089.
- ^ a b c d e f g h i j Saunders-Hastings PR, Krewski D (6 December 2016). "Reviewing the History of Pandemic Influenza: Understanding Patterns of Emergence and Transmission". Pathogens. 5 (4): 66. doi:10.3390/pathogens5040066. PMC 5198166. PMID 27929449.
- ^ a b c d e f g h i j k l Lycett SJ, Duchatel F, Digard P (24 June 2019). "A brief history of bird flu". Philosophical Transactions of the Royal Society of London, Series B. 374 (1775): 20180257. doi:10.1098/rstb.2018.0257. PMC 6553608. PMID 31056053.
- ^ a b c d Kutter JS, Spronken MI, Fraaij PL, Fouchier RA, Herfst S (February 2018). "Transmission routes of respiratory viruses among humans". Current Opinion in Virology. 28: 142–151. doi:10.1016/j.coviro.2018.01.001. PMC 7102683. PMID 29452994.
- ^ a b c Killingley B, Nguyen-Van-Tam J (September 2013). "Routes of influenza transmission". Influenza and Other Respiratory Viruses. 7 Suppl 2 (Suppl 2): 42–51. doi:10.1111/irv.12080. PMC 5909391. PMID 24034483.
- ^ Weber TP, Stilianakis NI (November 2008). "Inactivation of influenza A viruses in the environment and modes of transmission: a critical review". J Infect. 57 (5): 361–373. doi:10.1016/j.jinf.2008.08.013. PMC 7112701. PMID 18848358.
- ^ a b Moriyama M, Hugentobler WJ, Iwasaki A (29 September 2020). "Seasonality of Respiratory Viral Infections". Annual Review of Virology. 7 (1): 83–101. doi:10.1146/annurev-virology-012420-022445. PMID 32196426.
- ^ Shao W, Li X, Goraya MU, Wang S, Chen JL (7 August 2017). "Evolution of Influenza A Virus by Mutation and Re-Assortment". International Journal of Molecular Sciences. 18 (8): 1650. doi:10.3390/ijms18081650. PMC 5578040. PMID 28783091.
- ^ a b Steinhauer DA (25 May 1999). "Role of hemagglutinin cleavage for the pathogenicity of influenza virus". Virology. 258 (1): 1–20. doi:10.1006/viro.1999.9716. PMID 10329563.
- ^ Einav T, Gentles LE, Bloom JD (23 July 2020). "SnapShot: Influenza by the Numbers" (PDF). Cell. 182 (2): 532–532.e1. doi:10.1016/j.cell.2020.05.004. PMID 32707094. S2CID 220715148.
- ^ a b c d e f g h i j k l m n o p q r Chow EJ, Doyle JD, Uyeki TM (12 June 2019). "Influenza virus-related critical illness: prevention, diagnosis, treatment". Critical Care. 23 (1): 214. doi:10.1186/s13054-019-2491-9. PMC 6563376. PMID 31189475.
- ^ Tregoning JS, Russell RF, Kinnear E (4 March 2018). "Adjuvanted influenza vaccines". Human Vaccines & Immunotherapeutics. 14 (3): 550–564. doi:10.1080/21645515.2017.1415684. PMC 5861793. PMID 29232151.
- ^ a b c d Principi N, Esposito S (4 March 2018). "Protection of children against influenza: Emerging problems". Human Vaccines & Immunotherapeutics. 14 (3): 750–757. doi:10.1080/21645515.2017.1279772. PMC 5861800. PMID 28129049.
- ^ Dabestani NM, Leidner AJ, Seiber EE, Kim H, Graitcer SB, Foppa IM, Bridges CB (September 2019). "A review of the cost-effectiveness of adult influenza vaccination and other preventive services". Preventive Medicine. 126: 105734. doi:10.1016/j.ypmed.2019.05.022. PMC 6778688. PMID 31152830.
- ^ Barr IG, Donis RO, Katz JM, McCauley JW, Odagiri T, Trusheim H, Tsai TF, Wentworth DE (9 October 2018). "Cell culture-derived influenza vaccines in the severe 2017–2018 epidemic season: a step towards improved influenza vaccine effectiveness". NPJ Vaccines. 3: 44. doi:10.1038/s41541-018-0079-z. PMC 6177469. PMID 30323955.
- ^ a b c Jefferson T, Del Mar CB, Dooley L, Ferroni E, Al-Ansary LA, Bawazeer GA, van Driel ML, Jones MA, Thorning S, Beller EM, Clark J, Hoffmann TC, Glasziou PP, Conly JM (20 November 2020). "Physical interventions to interrupt or reduce the spread of respiratory viruses". Cochrane Database of Systematic Reviews. 2020 (11): CD006207. doi:10.1002/14651858.CD006207.pub5. hdl:10072/399941. PMC 8094623. PMID 33215698.
- ^ a b Saunders-Hastings P, Crispo JA, Sikora L, Krewski D (September 2017). "Effectiveness of personal protective measures in reducing pandemic influenza transmission: A systematic review and meta-analysis". Epidemics. 20: 1–20. doi:10.1016/j.epidem.2017.04.003. PMID 28487207.
- ^ a b "Avian Influenza (AI)". U.S. Department of Agriculture, Animal and Plant Health Inspection Service. Retrieved 9 March 2021.
- ^ a b c d e f g h i j k l Vemula SV, Zhao J, Liu J, Wang X, Biswas S, Hewlett I (12 April 2016). "Current Approaches for Diagnosis of Influenza Virus Infections in Humans". Viruses. 8 (4): 96. doi:10.3390/v8040096. PMC 4848591. PMID 27077877.
- ^ a b "Flu: MedlinePlus Medical Encyclopedia". U.S. National Library of Medicine. Archived from the original on 14 February 2010. Retrieved 7 February 2010.
- ^ Banday AZ, Arul A, Vignesh P, Singh MP, Goyal K, Singh S (2 January 2021). "Kawasaki disease and influenza-new lessons from old associations". Clinical Rheumatology. 40 (7): 2991–2999. doi:10.1007/s10067-020-05534-1. PMC 7778392. PMID 33387094.
- ^ "Laninamivir". National Center for Advancing Translational Sciences. Retrieved 9 March 2021.
- ^ "Estimated Influenza Illnesses, Medical visits, Hospitalizations, and Deaths in the United States – 2018–2019 influenza season". Centers for Disease Control and Prevention (CDC). 9 January 2020. Retrieved 5 March 2020.
- ^ "Up to 650 000 people die of respiratory diseases linked to seasonal flu each year". Geneva: World Health Organization. 13 December 2017. Retrieved 16 June 2021.
- ^ a b c d e f g h i j k l Potter CW (October 2001). "A history of influenza". Journal of Applied Microbiology. 91 (4): 572–579. doi:10.1046/j.1365-2672.2001.01492.x. PMID 11576290.
- ^ Palese P (December 2004). "Influenza: old and new threats". Nature Medicine. 10 (12 Suppl): S82–87. doi:10.1038/nm1141. PMID 15577936. S2CID 1668689.
- ^ a b c d e f Morens DM, Taubenberger JK, Folkers GK, Fauci AS (15 December 2010). "Pandemic influenza's 500th anniversary". Clinical Infectious Diseases. 51 (12): 1442–1444. doi:10.1086/657429. PMC 3106245. PMID 21067353.
- ^ Mordini E, Green M, eds. (2013). Internet-Based Intelligence in Public Health Emergencies: Early Detection and Response in Disease Outbreak Crises. IOS Press. p. 67. ISBN 978-1614991755.
- ^ Martin PM, Martin-Granel E (June 2006). "2,500-year evolution of the term epidemic". Emerging Infectious Diseases. 12 (6): 976–980. doi:10.3201/eid1206.051263. PMC 3373038. PMID 16707055.
- ^ a b c Morens DM, North M, Taubenberger JK (4 December 2010). "Eyewitness accounts of the 1510 influenza pandemic in Europe". Lancet. 376 (9756): 1894–1895. doi:10.1016/S0140-6736(10)62204-0. PMC 3180818. PMID 21155080.
- ^ Guerra F (1988). "The earliest American epidemic. The influenza of 1493". Soc Sci Hist. 12 (3): 305–325. doi:10.2307/1171451. JSTOR 1171451. PMID 11618144.
- ^ Guerra F (1993). "The European-American exchange". Hist Philos Life Sci. 15 (3): 313–327. PMID 7529930.
- ^ a b c d Institute of Medicine (US) Forum on Microbial Threats (2005). "1: The Story of Influenza". In Knobler S, Mack A, Mahmoud A, Lemon S (eds.). The Threat of Pandemic Influenza: Are We Ready? Workshop Summary (2005). Washington, DC: The National Academies Press. pp. 60–61. doi:10.17226/11150. ISBN 978-0-309-09504-4. PMID 20669448.
- ^ a b c d e f g h i j k l Taubenberger JK, Hultin JV, Morens DM (2007). "Discovery and characterization of the 1918 pandemic influenza virus in historical context". Antiviral Therapy. 12 (4 Pt B): 581–591. PMC 2391305. PMID 17944266.
- ^ Vijgen L, Keyaerts E, Moës E, Thoelen I, Wollants E, Lemey P, Vandamme A, Van Ranst M (February 2005). "Complete genomic sequence of human coronavirus OC43: molecular clock analysis suggests a relatively recent zoonotic coronavirus transmission event". Journal of Virology. 79 (3): 1595–1604. doi:10.1128/JVI.79.3.1595-1604.2005. PMC 544107. PMID 15650185.
- ^ Taubenberger JK, Morens DM (January 2006). "1918 Influenza: the mother of all pandemics". Emerging Infectious Diseases. 12 (1): 15–22. doi:10.3201/eid1201.050979. PMC 3291398. PMID 16494711.
- ^ Smith W, Andrewes CH, Laidlaw PP (1933). "A virus obtained from influenza patients". Lancet. 2 (5732): 66–68. doi:10.1016/S0140-6736(00)78541-2.
- ^ Heinen PP (15 September 2003). "Swine influenza: a zoonosis". Veterinary Sciences Tomorrow. ISSN 1569-0830. Archived from the original on 11 February 2007. Retrieved 28 December 2016.
- ^ Vázquez-Espinosa E, Laganà C, Vázquez F (October 2020). "The Spanish flu and the fiction literature". Rev Esp Quimioter. 33 (5): 296–312. doi:10.37201/req/049.2020. PMC 7528412. PMID 32633114.
- ^ "influenza (n.)". Online Etymology Dictionary. Retrieved 9 March 2021.
- ^ "influenza". Oxford English Dictionary. Retrieved 9 March 2021.
- ^ "flu (n.)". Online Etymology Dictionary. Retrieved 20 July 2021.
- ^ Calisher CH (August 2009). "Swine flu". Croatian Medical Journal. 50 (4): 412–415. doi:10.3325/cmj.2009.50.412. PMC 2728380. PMID 19673043.
- ^ "Influenza Basic Research". National Institute of Allergy and Infectious Diseases. 13 March 2017. Retrieved 24 March 2021.
- ^ "Global Influenza Surveillance and Response System (GISRS)". World Health Organization. Archived from the original on 3 October 2011. Retrieved 24 March 2021.
- ^ a b Nachbagauer R, Krammer F (April 2017). "Universal influenza virus vaccines and therapeutic antibodies". Clinical Microbiology and Infection. 23 (4): 222–228. doi:10.1016/j.cmi.2017.02.009. PMC 5389886. PMID 28216325.
- ^ Rosa SS, Prazeres DM, Azevedo AM, Marques MP (15 April 2021). "mRNA vaccines manufacturing: Challenges and bottlenecks". Vaccine. 39 (16): 2190–2200. doi:10.1016/j.vaccine.2021.03.038. PMC 7987532. PMID 33771389.
- ^ "Swine influenza". World Organisation for Animal Health. Retrieved 9 March 2021.