4-메틸라미노렉스
4-Methylaminorex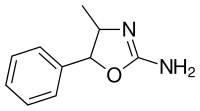 | |
 | |
| 임상자료 | |
|---|---|
| 경로: 행정 | 경구, 기화, 절연, 주입 |
| 법적현황 | |
| 법적현황 | |
| 약동학 데이터 | |
| 생체이용가능성 | 62% 구강, 79% 비, 91~93.5% 흡연, 100% IV |
| 신진대사 | 간체 |
| 제거 반감기 | 10-19시간 |
| 배설 | 레날 |
| 식별자 | |
| |
| CAS 번호 |
|
| 펍켐 CID | |
| 드러그뱅크 | |
| 켐스파이더 | |
| 유니 |
|
| 화학 및 물리적 데이터 | |
| 공식 | C10H12N2O |
| 어금질량 | 176.21 g·190−1 |
| 3D 모델(JSmol) | |
| 치랄리티 | 인종 혼합물 |
| |
| |
| | |
4-메틸라미노렉스(4-MAR, 4-MAX)는 맥닐 연구소가 1960년 처음 합성해 만든 2-아미노-5-아릴록사졸린급 흥분제다.[1] 거리 이름인 "U4Euh"("유포리아")와 "얼음"으로도 알려져 있다. 그것은 많은 나라에서 흥분제로 금지되어 있다.
4-메틸아미노렉스는 필로폰에 필로폰에 필로폰에 버금가는 효과를 내지만 지속시간이 길다.
이 약으로 동물실험을 한 결과 코카인, 암페타민과 유사한 남용부담이 있음을 알 수 있다. 한 연구에서는 "인종 시스, 인종 트랜스 및 4-메틸라미노렉스의 4개 개별 광학 이소머의 Stimulus 특성이 S(+)암페타민 황산염 1mg/kg을 식염수와 구별하도록 훈련된 쥐를 대상으로 조사되었다. S(+)암페타민 자극은 조사된 모든 요원에게 일반화되었다."[2] 쥐가 0.75mg/kg S(+-암페타민 또는 1.5mg/kg 펜플루라민)를 암페타민 자극제로 아미노렉스까지 일반화된 식염수에서 펜플루라민은 구별하도록 훈련한 두 번째 연구.[3] 랫드는 코카인 8mg/kg을 일반화된 4메틸아미노렉스에서 코카인 스티물루스까지 구별하도록 훈련받았다.[4] cis-4-methylaminorex의 강화 효과는 영장류에서 정맥주사 약물 자가 투여의 두 가지 모델에서 결정되었다. 차량 또는 4-메틸아미노렉스 복용량은 코카인을 대체했다. 4-메틸라미노렉스의 두 가지 다른 선량 중 하나는 차량 제어 수준 이상으로 자가 관리 동작을 유지했다.[5]
화학
4-Methylaminorex는 (±-cis 및 (±-trans)의 네 가지 스테레오 아오모어로 존재한다. (±-c)등분자는 오락적으로 사용되는 형태다. (±-)-이소머의 (4R,5S)-이소머와 항산화제(4S,5R)-이소머의 (1:1-혼합물) 이소머는 일반적으로 dl-페닐프로판올아민에서 합성되어 시안화나트륨을 브로민으로 반응시켜 한 번에 사이클화한다. 대체 합성 경로는 일반적으로 시안오겐 브로마이드를 나트륨이나 시안산칼륨으로 대체하여 중간을 형성한 다음 농축 염산과 반응시키는 등 더 많은 단계를 수반한다. 마이크로그램에서 보고된 방법은 dl-페닐프로판올아민 염산염부터 시작하여 염산을 별도로 첨가할 필요가 있는 것으로 대체되었지만, 곁가지 제품이 지적되고 있다. (±)-트랜스 이소머[레이스메이트 (1:1 혼합물) (4S,5S)-이소머 (4R,5R)-이소머]는 위와 같은 방식으로 합성되지만 대신 dl-노레페드린을 출발 재료로 사용한다. 시안산염 반응은 시안겐 브로마이드와 다르게 진행되며 대신 DEA 마이크로그래프에서 언급된 바와 같이 노레페드린을 트랜스4-메틸라미노렉스(trans-4-methylaminorex)로 변환한다. 이에 비해 시아노겐 브롬화물은 노레페드린을 시스 이소머로, 노르데우스페드린을 최종 생산물의 트랜스 이소머로 변형시켰다.
복용량
4-메틸아미노렉스는 훈제, 절연, 구강 복용 등이 가능하다.
식이섬유의 경우, ED50은 (±-cis isomer)의 경우 랫드에서 8.8mg/kg이다. (±)-트랜스 이소머는 7.0mg/kg에서 약간 더 강력하다. 레크리에이션 약으로서 유효 복용량은 5 ~ 25 mg이다.[6]
1970년대 McNeil Laboratories, Inc.는 공감각적(가장 흔히 천식-메디신인으로 사용되는)으로서 4-메틸라미노렉스를 의약품 시장에 도입하려고 시도하고 있었으며, 연구 명칭은 McN-822로, 인간 선량은 체중의 0.25mg/kg이 되었을 것이라고 언급하였다. 그들은 또한 생쥐의 LD50: 17mg/kg p.o도 언급한다.
4-메틸아미노렉스의 사용에 관한 특허는 "구강적으로 투여할 때 다른 디콘테스트제 및 아노레시제처럼 중추신경계 자극제 부작용을 일으키지 않는다"는 것이다. 언급된 선량은 체중의 0.25mg/kg이다.[8]
영향들
구강으로 복용할 경우 일반적으로 최대 16시간, 훈제 또는 절연 시 최대 12시간까지 지속되는 효과가 있다. 일화적으로 대량 투여가 36시간까지 지속된다고 보고되었다. 그 효과는 자연에서 자극제로, 행복감을 낳고, 주의력을 증가시키며, 인지력을 증가시킨다. 일화적으로는 누트로피컬과 비슷한 효과를 내는 것으로 보고되어 왔다. 그러나 이 점에서 다른 정신운동약과 다르거나 효과적이라는 주장을 뒷받침할 연구는 없다. 더욱이 4-메틸아미노렉스는 메틸페니데이트, 덱스트로암페타민 등 널리 사용되는 임상심리 자극제의 안전 프로파일을 가지고 있지 않다.
| 시간(h) | 소변 내 4-메틸라미노렉스 농도(µg/ml) |
|---|---|
| 0-6 | 45 |
| 6-24 | 1.0 |
| 24-36 | 0.1 |
| 36-48 | 탐지되지 않음 |
4메틸라미노렉스와 디아제팜으로 인한 사망자가 한 명 보고되었다. 4-메틸라미노렉스 농도는 혈액 21.3mg/L, 소변 12.3mg/L이었다. 혈중 디아제팜 농도는 0.8mg/L이었다.[9] 쥐에 대한 한 실험은 소변에서 4-메틸라미노렉스의 배설물을 연구했다: "트랜스4-메틸라미노렉스의 농도는 GC/MS로 정량적으로 측정했을 때 이틀 동안 각각 12시간 간격으로 4번 주입한 후 랫드 소변에서 12-메틸라미노렉스 농도"[10]
또 다른 연구는 쥐의 4-메틸라미노렉스 스테레오이머의 약동학 및 조직 분포에 초점을 맞췄다.[11]
"심폐고혈압은 식욕억제제 아미노렉스의 섭취와 관련이 있다. 폐고혈압 진단을 받은 3명의 재산에서 비슷한 화합물인 4메틸라미노렉스가 발견됐다."[12]
신경독성 연구
4-메틸아미노렉스의 가능한 신경독성을 연구하는 세 가지 연구가 있다. 첫번째 study[13]( 높은 용량이 있고 몇 마리의 쥐들 죽간대성 발작을 일으켰다)쥐에(쥐 5의 라세미 cis-4-methylaminorex의 주입, 10년, 20mg/kg 후 30분 정도까지 18h이 살해되었다)한 트립 토판 수소수 산화 효소(TPH)활동의 감소(세로토닌 신경 독성에 대하여 가능한 마커)bu을 제안했다 단기적 영향들을 공부하는 게 꽤 많은 양을 사용하여.ctIting 연구: "주사 후 30분 동안 TPH 활성도에 변화가 관찰되지 않았으며, 8시간 후에는 이 효소의 활성도가 회복되는 것으로 보였다." 그리고 "이 약제는 필로폰이나 MDMA에 비해 신경독성이 현저히 낮다."
Astudy[14]2년 뒤 처음 것보다 출판되 또한 트립 토판 수산화 효소 활동에 감축을 제안했다, 그들은 너무(cis-4-methylaminorex의 10mg/kg)과(쥐 주사 7일 후에 3h, 18h또는 사망했다)으로 장기적인 효과 연구되고, 그들은 트립 토판 수소수 산화 효소(TPH)활동의 20-40%,"recov의 감소 사실을 발견해 고 선량을 사용했다.ery 치료 후 18시간 만에 TPH 활성도가 다시 현저하게 감소하였다." 그러나 "다른 아날로그와 달리 5-HT의 선조체 수준은 여러 번의 4-메틸라미노렉스 치료 후 TPH 활성과 함께 감소하지 않은 것이 주목할 만하다."
최근 study[15](쥐를 사용하여)어떤 장기적인 효과 물질이 제안하는 것을 찾으려고 노력했고 대신 세로토닌 수준에 증가를 찾을 수 있지는 않았다고 그들은 또한"f의와 stereoisomersaminorex 억제의 효과적인 복용량보다 많이 마시면 현재 실험에 사용되는 정도 막혀번(각 이성질체의 15mg/kg) 많은 양을 사용했다ood 섭취." 하루 3회 복용량을 반복했고 마지막 투약 후 7일 만에 쥐가 죽었다. "Since a long-lasting depletion of dopamine or 5-HT appears to be a good predictor of dopamine or 5-HT neurotoxicity (Wagner et al. 1980; Ricaurte et al. 1985), the results suggest that the aminorex compounds except 4S,5S-dimethylaminorex, unlike MDMA or fenfluramine, are not toxic to either dopamine or 5-HT neurotransmitter systems in the CBA str쥐의 일종이다. 4-메틸라미노렉스 복용으로 SD 랫드에서 7일, 즉 선조체 트립토판 수산화효소 활성 감소를 장기간 유발했지만 5-HT 및 5-HIAA 수준에서는 변화가 발견되지 않은 것으로 보고되었다(Hanson et al. 1992).[12]
그 첫 번째 연구[11]는 또한 도파민 (DA) 수치의 감소(도파민 신경독성의 가능한 표시자)를 제안했지만, "그러나 약물 투여 후 8시간 동안 DA, DOPAC 또는 HVA 수치의 제어 값과 어떤 차이도 관찰되지 않았다."라는 연구를 인용했고, 그 후기 연구[12-13]는 장기적 감소를 발견하지 못했다.
참조
- ^ US 3278382, "2-amino-5-aryloxazoline 구성 및 사용 방법"
- ^ Glennon RA, Misenheimer B (March 1990). "Stimulus properties of a new designer drug: 4-methylaminorex ("U4Euh")". Pharmacology, Biochemistry, and Behavior. 35 (3): 517–21. doi:10.1016/0091-3057(90)90282-M. PMID 1971111. S2CID 10464868.
- ^ Young R (May 1992). "Aminorex produces stimulus effects similar to amphetamine and unlike those of fenfluramine". Pharmacology, Biochemistry, and Behavior. 42 (1): 175–8. doi:10.1016/0091-3057(92)90462-O. PMID 1356272. S2CID 31002190.
- ^ Young R, Glennon RA (May 1993). "Cocaine-stimulus generalization to two new designer drugs: methcathinone and 4-methylaminorex". Pharmacology, Biochemistry, and Behavior. 45 (1): 229–31. doi:10.1016/0091-3057(93)90110-F. PMID 8516363. S2CID 7648152.
- ^ Mansbach RS, Sannerud CA, Griffiths RR, Balster RL, Harris LS (October 1990). "Intravenous self-administration of 4-methylaminorex in primates". Drug and Alcohol Dependence. 26 (2): 137–44. doi:10.1016/0376-8716(90)90120-4. PMID 2242714.
- ^ "Erowid 4-methylaminorex Vault : Dosage". Archived from the original on 2007-05-26. Retrieved 2006-11-22.
- ^ "System Timed Out (Library of Congress Online Catalog)". Archived from the original on 2021-05-31. Retrieved 2007-09-02.
- ^ "Method of decongesting the nose ... - Google Patents".
- ^ Davis FT, Brewster ME (March 1988). "A fatality involving U4Euh, a cyclic derivative of phenylpropanolamine". Journal of Forensic Sciences. 33 (2): 549–53. doi:10.1520/JFS11971J. PMID 3373171.
- ^ Kankaanpää A, Meririnne E, Ellermaa S, Ariniemi K, Seppälä T (September 2001). "Detection and assay of cis- and trans-isomers of 4-methylaminorex in urine, plasma and tissue samples". Forensic Science International. 121 (1–2): 57–64. doi:10.1016/S0379-0738(01)00453-4. PMID 11516888.
- ^ Meririnne E, Ellermaa S, Kankaanpää A, Bardy A, Seppälä T (June 2004). "Pharmacokinetics and tissue distribution of the stereoisomers of 4-methylaminorex in the rat". The Journal of Pharmacology and Experimental Therapeutics. 309 (3): 1198–205. doi:10.1124/jpet.103.060053. PMID 14742748. S2CID 28124406.
- ^ a b Gaine SP, Rubin LJ, Kmetzo JJ, Palevsky HI, Traill TA (November 2000). "Recreational use of aminorex and pulmonary hypertension". Chest. 118 (5): 1496–7. doi:10.1378/chest.118.5.1496. PMID 11083709. Archived from the original on 2013-01-12.
- ^ Bunker CF, Johnson M, Gibb JW, Bush LG, Hanson GR (May 1990). "Neurochemical effects of an acute treatment with 4-methylaminorex: a new stimulant of abuse". European Journal of Pharmacology. 180 (1): 103–11. doi:10.1016/0014-2999(90)90597-Y. PMID 1973111.
- ^ Hanson GR, Bunker CF, Johnson M, Bush L, Gibb JW (August 1992). "Response of monoaminergic and neuropeptide systems to 4-methylaminorex: a new stimulant of abuse". European Journal of Pharmacology. 218 (2–3): 287–93. doi:10.1016/0014-2999(92)90181-3. PMID 1358636.
- ^ Zheng Y, Russell B, Schmierer D, Laverty R (January 1997). "The effects of aminorex and related compounds on brain monoamines and metabolites in CBA mice". The Journal of Pharmacy and Pharmacology. 49 (1): 89–96. doi:10.1111/j.2042-7158.1997.tb06758.x. PMID 9120777. S2CID 20224300.


