캘시트리올
Calcitriol | |
 | |
| 임상자료 | |
|---|---|
| 발음 | 미국: /ˌkælsɪˈtraɪl/;[1][2][3][4][5] 영국:/kælˈsɪtriɒl/ |
| 상명 | 로칼트롤, 칼치젝스, 데코스트리올 등 |
| 기타 이름 | 1,25-디하이드록시콜시페롤, 1알파, 25-디하이드록시비타민 D3, 1,25-디하이드록시비타민 D3, 1α,25-(OH)2D3, 125(OH)2D[6] |
| AHFS/Drugs.com | 모노그래프 |
| 메드라인플러스 | a682335 |
| 라이센스 데이터 | |
| 임신 범주 |
|
| 경로: 행정 | 입으로, IV[7] |
| ATC 코드 | |
| 법적현황 | |
| 법적현황 | |
| 약동학 데이터 | |
| 단백질 결합 | 99.9% |
| 신진대사 | 신장 |
| 제거 반감기 | 5~8시간(자녀), 27시간(자녀) |
| 배설 | 배변(50%), 소변(16%) |
| 식별자 | |
| |
| CAS 번호 | |
| 펍켐 CID | |
| IUPHAR/BPS | |
| 드러그뱅크 | |
| 켐스파이더 | |
| 유니 | |
| 체비 | |
| 켐벨 | |
| CompTox 대시보드 (EPA) | |
| ECHA InfoCard | 100.046.315 |
| 화학 및 물리적 데이터 | |
| 공식 | C27H44O3 |
| 어금질량 | 416.646 g·190−1 |
| 3D 모델(JSmol) | |
| |
| |
| (iii) | |
캘시트리올은 일반적으로 신장에서 만들어지는 비타민 D의 활성 형태다.[8][9]그것은 또한 1,25-디하이드록시콜레칼시페롤로도 알려져 있다.그것은 세포핵에 있는 비타민D 수용체에 결합하고 활성화시키는 호르몬으로, 이것은 많은 유전자의 발현을 증가시킨다.[10]캘시트리올은 주로 장에서 칼슘을 섭취하는 양을 늘림으로써 혈중 칼슘(Ca2+)을 증가시킨다.[7]
신장질환에 의한 저혈중 칼슘과 과파병증, 저혈중증, 골다공증, 골연화증, 가족성 저인산혈증 등의 치료약으로 투여할 수 있으며,[7][11] 입으로 복용하거나 정맥에 주사하여 복용할 수 있다.[7]과다한 양이나 섭취는 허약, 두통, 메스꺼움, 변비, 요로감염, 복통 등을 유발할 수 있다.[7][11]심각한 부작용은 고혈중 칼슘과 아나필락시스를 포함할 수 있다.[7]약물 투여 시작 후와 복용량이 변경될 때 정기적인 혈액검사를 권고한다.[11]
캘시트리올은 1971년 비타민 D의 활성 형태로 확인되었고 1978년 미국에서 의약품 사용이 승인되었다.[7]그것은 일반적인 약으로 이용할 수 있다.[11]2017년에는 미국에서 256번째로 가장 많이 처방된 약으로 100만 개 이상의 처방전이 있었다.[12][13]
그것은 세계보건기구의 필수 의약품 목록에 올라 있다.[14]
의료용
Calcitriol은 다음에 대해 규정된다.[15]
비타민D 아날로그 칼시포트리올(칼시포트리엔)이 더 많이 쓰이지만 [16]칼시트리올은 건선 치료에 연고에 사용돼 왔다.[17]칼시트리올은[18] 건선과 건선관절염 치료를 위해 입으로 투여하기도 했다.[19]캘커트리올과 기타 VDR-리간드 아날로그의 비칼리학적 작용과 가능한 치료적 응용에 대한 연구가 검토되었다.[20]
역효과
석회암 치료와 관련된 주요 부작용은 고칼륨증이다 – 초기 증상으로는 메스꺼움, 구토, 변비, 거식증, 무관심, 두통, 갈증, 명예, 땀 흘림 및/또는 다뇨증이 있다.임상 사용 시 다른 비타민 D 화합물(콜칼시페롤, 에르고칼시페롤)에 비해 캘시트리올은 고칼슘혈증을 유발할 위험이 높다.그러나 이러한 에피소드는 비교적 짧은 반감기 때문에 더 짧고 다루기 쉬울 수 있다.[15]
높은 캘시트리올 수치는 보충제가 아닌 환자의 인간 질병 상태에서도 볼 수 있다.고칼슘혈증과 높은 석회암 수치를 가진 사람에게는 보통 낮은 온전한 부갑상선 호르몬 수치가 존재한다.
석회화 수치의 상승으로 고칼륨혈증이 발생하는 주요 질환은 대식세포에서 발현되는 ectopic 25(OH)D-1-hydroxylase(CYP27B1)로 과잉생산이 발생하는 림프종, 결핵, 사코이데시스 등이다.[21]유사한 결과를 산출하는 기타 조건:
- 진균 감염: 진균 지로베치, 히스토플라즘증, coccidioidomycosis, paracoccidioidomycosis, candiasis
- 기타 과립성 질환: PR3+ 혈관염, 크론병, 급성 과립성 폐렴, 탈곡성 과립종, 실리콘 유도 과립종, BCG 관련 과립성 간염, 파라핀 관련 과립종
- 유전적 조건: 윌리엄스 증후군, 가독산염, CYP24A1 돌연변이(성인/유아), SLC34A1 돌연변이
- 기타; 마이코박테리움 아비움, 나병, 지질성 폐렴, 고양이 긁힘열, 베릴리오시스
어떤 식물들은 1,25-디하이드록시콜레칼시페롤의 글리코시드를 함유하고 있다.동물을 방목하여 이러한 글리코사이드의 섭취는 비타민 D 독성으로 이어져, 연조직에 과다한 칼슘이 축적되는 석회화 현상을 초래한다.inosis)을 초래한다.레인지랜드 식물인 세스트럼 디우르눔, 솔라눔 말라코사일론, 트리세툼 플라브스켄 등 3개 식물이 이들 글리코사이드 성분을 함유하고 있는 것으로 알려져 있다.이 중 세스트럼 디우르눔만 미국, 주로 플로리다에서 발견된다.[22]
작용기전
캘시트리올은 다음과 같이 혈중 칼슘 수치([Ca2+
])를 증가시킨다.
- 위장관으로부터 식이 칼슘의 흡수를 촉진한다.
- 칼슘의 신장관 재흡수가 증가하여 소변에서 칼슘의 손실을 감소시킨다.
- 뼈에서 칼슘의 자극적인 배출.이를 위해 골세포라고 불리는 특정 유형의 골세포에 작용하여 LANKL을 분비하게 하고, 이는 다시 골세포가 활성화된다.[23]
캘시트리올은 이 세 가지 역할 모두에서 부갑상선호르몬(PST)과 함께 작용한다.예를 들어, PTH는 골성형도 간접적으로 자극한다.그러나 PTH의 주효과는 신장이 Ca의2+
반작용인 무기인산염(Pi)을 배설하는 비율을 높이는 것이다.혈청 인산염의 감소로 인해 히드록사파타이트(3Ca5(PO4))가 발생한다.OH) 뼈에서 용해되어 혈청 칼슘을 증가시킨다.PTH는 또한 캘시트리올의 생산을 자극한다(아래 참조).[24]
캘시트리올의 많은 효과는 비타민D 수용체 또는 VDR이라고도 불리는 캘시트리올 수용체와의 상호작용에 의해 매개된다.[25]예를 들어, 장내 상피세포에 있는 캘리트리올 수용체의 무한 비활성 형태는 세포질 내에 존재한다.캘시트리올이 수용체에 결합하면 리간드-수용체 복합체가 세포핵으로 반투명되는데, 여기서 리간드-수용체는 칼슘 결합 단백질을 암호화하는 유전자의 발현을 촉진하는 전사 인자의 역할을 한다.칼슘 결합 단백질의 수치는 세포가 장에서 장 점막을 가로질러 더 많은 칼슘2+
(Ca)을 혈액으로 활발하게 운반할 수 있게 한다.[24]대체 비유전자 경로를 PDIA3 또는 VDR을 통해 매개할 수 있다.[26]
전기성을 유지하기 위해서는 장내 상피세포에 의해 촉매되는 Ca2+
이온의 수송이 주로 무기인 인산염이라는 반작용과 동반되어야 한다.따라서 캘시트리올은 인산염의 장 흡수를 자극하기도 한다.[24]
혈청 캘시트리올이 충분한 수치의 혈청 캘시트리올이 뼈에서 칼슘의 총체적 손실을 막아준다는 점에서 칼시트리올이 뼈에서 칼슘의 분출을 자극한다는 관측은 상반된 것으로 보인다.석회암 절제 장내 흡수에 따른 혈청 칼슘의 수치가 증가하면 골수체의 호르몬 자극에 의해 뼈에서 손실되는 칼슘보다 더 많은 칼슘을 섭취하게 된다고 여겨진다.[24]식이 칼슘 결핍이나 장내 운반의 결함 등 조건이 있어야 혈청 칼슘이 감소하는 결과를 초래하는 경우 뼈에서 칼슘이 전반적으로 손실되는 현상이 발생한다.
또한 캘시트리올은 뼈에서 칼슘이 방출되는 것을 억제함으로써 혈중 칼슘을 주로 감소시키는 호르몬인 캘시토닌의 분비를 억제한다.[27][24]
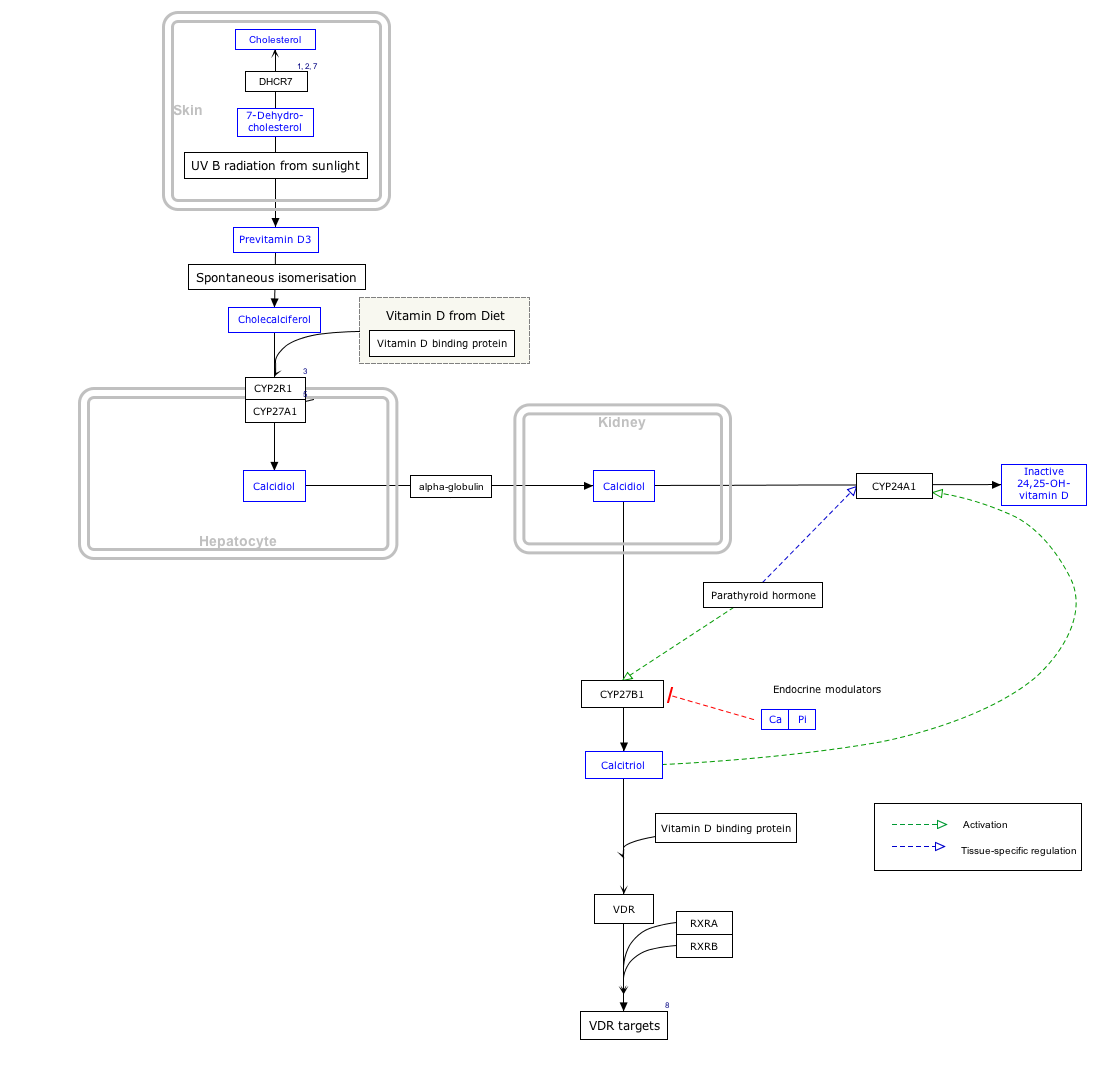
생합성 및 그 조절
캘시트리올은 신장에 있는 네프론의 근위부 관모세포에서 1알파 위치에 있는 25-히드록시비타민 D3 1-알파-히드록실라아제, 미토콘드리아 산소효소, 25-히드록시콜칼시페롤(칼시페디올)의 히드록실화를 촉진하는 효소의 작용에 의해 생성된다.
이 효소의 활성은 PTH에 의해 자극된다.이것은 Ca2+ homeostasis에서 중요한 통제 지점이다.[24]캘시트리올 생산에 미치는 추가적인 영향으로는 락토제네시스(유방샘에서 우유가 형성됨)를 자극하는 호르몬인 프로락틴이 증가해 칼슘이 많이 필요한 과정이 있다.[28]또한 혈청 인산염의 높은 수치와 뼈의 골세포에 의한 FGF23 호르몬의 생산량 증가로 활동량이 감소한다.[29]
캘시트리올은 또한 태반과 활성화된 대식세포들을 포함한 많은 다른 조직들에 의해 신장에서 소량으로 생산된다.[30]
알파칼시돌이라는 약물을 사용하면 간에서 25 히드록시돌을 활성 대사물로써 캘시트리올을 생성한다.이는 신장병 환자 중 신장 1알파-하이드록실라아제가 손실된 다른 비타민D 전구체보다 더 큰 효과를 낼 것이다.[31]
대화형 경로 지도
각 기사에 연결하려면 아래의 유전자, 단백질, 대사물을 클릭하십시오. [§ 1]
- ^ 대화형 경로 맵은 WikiPathways에서 편집할 수 있다."VitaminDSynthesis_WP1531".
신진대사
체내 캘시트리올의 반감기는 몇 주 만에 반감기를 측정하는 전구체 캘시페디올과 달리 몇 시간 단위로 측정된다.[32]캘시트리올은 1,24,25-트리히드록시비타민 D, 캘시트로산을 형성하기 위해 추가적인 히드록시화에 의해 비활성화된다.이것은 CYP24A1 24-히드록실라제의 작용을 통해 발생한다.[33]캘시트로산은 물에 더 잘 녹으며 담즙과 소변에 배설된다.
역사
1971년 마이클 F에 의해 처음 확인되었다. 홀릭은 [34][35]헥터 델루카의 실험실에서 일하고 있으며 토니 노먼과 동료들도 일하고 있다.[36]
이름
캘시트리올은 특히 1,25-디하이드록시콜레칼시페롤을 가리킨다.셸레칼시페롤은 이미 하나의 히드록실 그룹을 가지고 있기 때문에, 이 명명법에는 2개(1,25)만 더 명시되어 있지만, 실제로는 3개(1,3,25-트리올)가 있다.1-hydroxy 그룹은 알파 위치에 있으며, 이것은 약어 1α,25-(OH3)2D에서와 같이 이름에 명시될 수 있다.[6]
캘시트리올은 엄밀히 말하면 에르고칼시페롤(비타민D2)의 히드록시팔(hydroxylation)[6]의 산물이 아니라 셀레칼시페롤(vitamin D3)에서 유래한 캘시페디올(25-OH 비타민D3)의2 1-히드록시팔(hydroxylation) 제품이다.[6]그러나 1,25-디하이드록시비타민 D 또는 1,25(OH)2D라는 용어는 두 가지 유형의 활성 비타민 D를 가리키는 데 종종 사용된다.실제로 둘 다 비타민D 수용체와 결합해 생물학적 효과를 낸다.[37]임상 용도로는 차이가 크게 중요할 것 같지 않다.[31]
캘시트리올은 로칼트롤(로체), 칼시젝스(아보트), 데코스트리올(미베, 제살리스), 벡티컬(갈데르마), 롤시컬(선파마) 등 다양한 상표명으로 의료용 의약품으로 판매되고 있다.
참조
- ^ Elsevier, Dorland's Illustrated Medical Dictionary, Elsevier.
- ^ Wolters Kluwer, Stedman's Medical Dictionary, Wolters Kluwer.
- ^ Merriam-Webster, Merriam-Webster's Medical Dictionary, Merriam-Webster.
- ^ Houghton Mifflin Harcourt, The American Heritage Dictionary of the English Language, Houghton Mifflin Harcourt, archived from the original on 2015-09-25, retrieved 2015-09-25.
- ^ Merriam-Webster, Merriam-Webster's Unabridged Dictionary, Merriam-Webster, archived from the original on 2020-05-25, retrieved 2015-09-25.
- ^ a b c d "IUPAC-IUB Joint Commission on Biochemical Nomenclature (JCBN): Nomenclature of vitamin D. Recommendations 1981". European Journal of Biochemistry. 124 (2): 223–7. May 1982. doi:10.1111/j.1432-1033.1982.tb06581.x. PMID 7094913.
- ^ a b c d e f g "Calcitriol Monograph for Professionals". Drugs.com. American Society of Health-System Pharmacists. Retrieved 9 April 2019.
- ^ Encyclopedia of Endocrine Diseases. Academic Press. 2018. p. 344. ISBN 9780128122006.
- ^ "Office of Dietary Supplements - Vitamin D". ods.od.nih.gov. 9 October 2020. Retrieved 31 October 2020.
- ^ Norman AW (August 2008). "From vitamin D to hormone D: fundamentals of the vitamin D endocrine system essential for good health". The American Journal of Clinical Nutrition. 88 (2): 491S–499S. doi:10.1093/ajcn/88.2.491S. PMID 18689389.
- ^ a b c d British national formulary : BNF 76 (76 ed.). Pharmaceutical Press. 2018. pp. 1050–1051. ISBN 9780857113382.
- ^ "The Top 300 of 2020". ClinCalc. Retrieved 11 April 2020.
- ^ "Calcitriol - Drug Usage Statistics". ClinCalc. Retrieved 11 April 2020.
- ^ World Health Organization (2021). World Health Organization model list of essential medicines: 22nd list (2021). Geneva: World Health Organization. hdl:10665/345533. WHO/MHP/HPS/EML/2021.02.
- ^ a b Rossi, S, ed. (2006). Australian Medicines Handbook. Adelaide. ISBN 978-0-9757919-2-9.
- ^ Kircik L (August 2009). "Efficacy and safety of topical calcitriol 3 microg/g ointment, a new topical therapy for chronic plaque psoriasis". Journal of Drugs in Dermatology. 8 (8 Suppl): s9-16. PMID 19702031.
- ^ Kin KC, Hill D, Feldman SR (June 2016). "Calcipotriene and betamethasone dipropionate for the topical treatment of plaque psoriasis". Expert Review of Clinical Pharmacology. 9 (6): 789–97. doi:10.1080/17512433.2016.1179574. PMID 27089906. S2CID 38261070.
- ^ Smith EL, Pincus SH, Donovan L, Holick MF (September 1988). "A novel approach for the evaluation and treatment of psoriasis. Oral or topical use of 1,25-dihydroxyvitamin D3 can be a safe and effective therapy for psoriasis". Journal of the American Academy of Dermatology. 19 (3): 516–28. doi:10.1016/S0190-9622(88)70207-8. PMID 2459166.
- ^ Huckins D, Felson DT, Holick M (November 1990). "Treatment of psoriatic arthritis with oral 1,25-dihydroxyvitamin D3: a pilot study". Arthritis and Rheumatism. 33 (11): 1723–7. doi:10.1002/art.1780331117. PMID 2242069.
- ^ Nagpal S, Na S, Rathnachalam R (August 2005). "Noncalcemic actions of vitamin D receptor ligands". Endocrine Reviews. 26 (5): 662–87. doi:10.1210/er.2004-0002. PMID 15798098..
- ^ Tebben, Peter J.; Singh, Ravinder J.; Kumar, Rajiv (October 2016). "Vitamin D-Mediated Hypercalcemia: Mechanisms, Diagnosis, and Treatment". Endocrine Reviews. 37 (5): 521–547. doi:10.1210/er.2016-1070. PMC 5045493. PMID 27588937.
- ^ "Calcinogenic Glycosides". Plants Poisonous to Livestock. Cornell Department of Animal Science. Retrieved 16 June 2021.
- ^ Bringhurst F, Demay MB, Krane SM, Kronenberg HM (2008). "Bone and Mineral Metabolism in Health and Disease". In Fauci AS, Braunwald E, Kasper D, Hauser S, Longo D, Jameson J, Loscalzo J (eds.). Harrison's Principles of Internal Medicine (17th ed.). McGraw-Hill. ISBN 978-0-07-159991-7.
- ^ a b c d e f Voet D, Voet JG (2004). "Biomolecules, mechanisms of enzyme action, and metabolism". Biochemistry. Vol. 1 (3rd ed.). Wiley. pp. 663–4. ISBN 978-0-471-25090-6.
- ^ Christakos S, Dhawan P, Verstuyf A, Verlinden L, Carmeliet G (January 2016). "Vitamin D: Metabolism, Molecular Mechanism of Action, and Pleiotropic Effects". Physiological Reviews. 96 (1): 365–408. doi:10.1152/physrev.00014.2015. PMC 4839493. PMID 26681795.
- ^ Hii, CS; Ferrante, A (2 March 2016). "The Non-Genomic Actions of Vitamin D." Nutrients. 8 (3): 135. doi:10.3390/nu8030135. PMC 4808864. PMID 26950144.
- ^ Peleg S, Abruzzese RV, Cooper CW, Gagel RF (August 1993). "Down-regulation of calcitonin gene transcription by vitamin D requires two widely separated enhancer sequences". Molecular Endocrinology. 7 (8): 999–1008. doi:10.1210/mend.7.8.8232320. PMID 8232320.
- ^ Ajibade DV, Dhawan P, Fechner AJ, Meyer MB, Pike JW, Christakos S (July 2010). "Evidence for a role of prolactin in calcium homeostasis: regulation of intestinal transient receptor potential vanilloid type 6, intestinal calcium absorption, and the 25-hydroxyvitamin D(3) 1alpha hydroxylase gene by prolactin". Endocrinology. 151 (7): 2974–84. doi:10.1210/en.2010-0033. PMC 2903940. PMID 20463051.
- ^ Rodríguez-Ortiz ME, Rodríguez M (2015). "FGF23 as a calciotropic hormone". F1000Research. 4: 1472. doi:10.12688/f1000research.7189.1. PMC 4815615. PMID 27081473.
- ^ Adams JS, Hewison M (July 2012). "Extrarenal expression of the 25-hydroxyvitamin D-1-hydroxylase". Archives of Biochemistry and Biophysics. 523 (1): 95–102. doi:10.1016/j.abb.2012.02.016. PMC 3361592. PMID 22446158.
- ^ a b Mazzaferro S, Goldsmith D, Larsson TE, Massy ZA, Cozzolino M (March 2014). "Vitamin D metabolites and/or analogs: which D for which patient?". Current Vascular Pharmacology. 12 (2): 339–49. doi:10.2174/15701611113119990024. PMID 23713876.
- ^ Brandi ML (September 2010). "Indications on the use of vitamin D and vitamin D metabolites in clinical phenotypes". Clinical Cases in Mineral and Bone Metabolism. 7 (3): 243–50. PMC 3213838. PMID 22460535.
- ^ Jones G, Prosser DE, Kaufmann M (January 2014). "Cytochrome P450-mediated metabolism of vitamin D". Journal of Lipid Research. 55 (1): 13–31. doi:10.1194/jlr.R031534. PMC 3927478. PMID 23564710.
- ^ Holick MF, Schnoes HK, DeLuca HF, Suda T, Cousins RJ (July 1971). "Isolation and identification of 1,25-dihydroxycholecalciferol. A metabolite of vitamin D active in intestine". Biochemistry. 10 (14): 2799–804. doi:10.1021/bi00790a023. PMID 4326883.
- ^ Holick MF, Schnoes HK, DeLuca HF (April 1971). "Identification of 1,25-dihydroxycholecalciferol, a form of vitamin D3 metabolically active in the intestine". Proceedings of the National Academy of Sciences of the United States of America. 68 (4): 803–4. Bibcode:1971PNAS...68..803H. doi:10.1073/pnas.68.4.803. PMC 389047. PMID 4323790.
- ^ Norman AW, Myrtle JF, Midgett RJ, Nowicki HG, Williams V, Popják G (July 1971). "1,25-dihydroxycholecalciferol: identification of the proposed active form of vitamin D3 in the intestine". Science. 173 (3991): 51–4. Bibcode:1971Sci...173...51N. doi:10.1126/science.173.3991.51. PMID 4325863. S2CID 35236666.
- ^ Cantorna MT, Snyder L, Lin YD, Yang L (April 2015). "Vitamin D and 1,25(OH)2D regulation of T cells". Nutrients. 7 (4): 3011–21. doi:10.3390/nu7043011. PMC 4425186. PMID 25912039.
외부 링크
- "Calcitriol". Drug Information Portal. U.S. National Library of Medicine.