에트리트네이트
Etretinate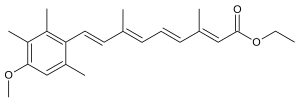 | |
 | |
| 임상자료 | |
|---|---|
| 상명 | 티가손(Tigason) |
| AHFS/Drugs.com | Drugs.com 아카이브 |
| 메드라인플러스 | a601010년 |
| 경로: 행정 | 구강 |
| ATC 코드 | |
| 법적현황 | |
| 법적현황 |
|
| 약동학 데이터 | |
| 단백질 결합 | >99% |
| 대사물 | 자유산, Z형, 체인 단축 |
| 제거 반감기 | 120일 |
| 식별자 | |
| |
| CAS 번호 | |
| 펍켐 CID | |
| IUPHAR/BPS | |
| 드러그뱅크 | |
| 켐스파이더 | |
| 유니 | |
| 케그 | |
| 체비 | |
| 켐벨 | |
| CompTox 대시보드 (EPA) | |
| ECHA InfoCard | 100.053.727 |
| 화학 및 물리적 데이터 | |
| 공식 | C23H30O3 |
| 어금질량 | 354.490 g·190−1 |
| 3D 모델(JSmol) | |
| |
| |
| | |
에트레틴(거래명 테기슨)은 호프만-라 로슈가 개발한 약으로 1986년 FDA로부터 중증 건선 치료를 승인받았다.2세대 레티노이드다.[1]이어 1996년 캐나다 시장, 1998년 미국 시장에서 출생 결함 위험이 높아 퇴출됐다.일본에서는 티가슨으로 시중에 남아 있다.
약리학
에트레틴은 지방질이 많고 방향성이 좋은 레티노이드다.지방조직에서 저장·방출되기 때문에 투약 중단 후에도 효과가 오래 지속될 수 있다.그것은 치료 후 최대 3년 동안 혈장에서 검출될 수 있다.에트레틴은 치료지수가 낮고 120일의 긴 제거 반감기1/2(t)가 있어 [1]복용이 어렵다.
에트레틴은 (에틸 에스테르 없이) 유리산인 아시트레틴으로 대체되었다.아세트레틴은 지방질이 적고 반감기가 50시간밖에 되지 않는 반면 체내에서 에트레틴으로 부분적으로 대사되어 아직 장시간 작용하는 테라토겐이며 치료 후 2년간 임신이 금지된다.[1][2]
주의사항
- 에트레티네이트는 테라토겐으로, 사용 후 오랜 시간 동안 선천적 결함을 일으킬 수 있다.따라서 산아제한은 치료 중, 그리고 치료가 중단된 후 최소 3년 동안 권고한다.[3]
- 에트레틴은 뼈 성장에 방해가 될 수 있으므로 어린이에게는 피해야 한다.[3]
- 환자가 에트리테이트를 복용한 적이 있다면 선천적 결함의 위험 때문에 미국, 영국, 퀘벡 등에서 헌혈할 자격이 없다.[4][5]일본에서는 약 사용을 중단한 후 2년 동안 헌혈을 하지 않을 수도 있다.[6]
부작용
부작용은 대표적인 과비타민증 A인데, 가장 흔히 나타난다[3].
- 뼈 또는 관절 통증, 뻣뻣함, 장기 치료 시 특발성 골격 과다증
- 근육 경련 또는 복통
- 건조하고 타는 듯한 가려운 눈꺼풀
- 특이한 타박상
역사
이 약은 1986년 FDA로부터 심한 건선을 치료하기 위해 승인되었다.이어 1996년 캐나다 시장, 1998년 미국 시장에서 출생 결함 위험이 높아 퇴출됐다.[3][7][8]
일본에서는 이 약이 시판 중인 티가슨 브랜드에 그대로 남아 있다.[6]
참고 항목
참조
- ^ a b c Mutschler E, Schäfer-Korting M (2001). Arzneimittelwirkungen (in German) (8 ed.). Stuttgart: Wissenschaftliche Verlagsgesellschaft. p. 728f. ISBN 3-8047-1763-2.
- ^ Jasek W, ed. (2007). Austria-Codex (in German) (62nd ed.). Vienna: Österreichischer Apothekerverlag. p. 5669. ISBN 978-3-85200-181-4.
- ^ a b c d Drugs.com 에트레티네이트 아카이브
- ^ "Donor Selection Guidelines: Etretinate". UK Blood Transfusion and Tissue Transplantation Services.
- ^ "Medications taken on a regular basis that exclude you from donating blood". Héma-Québec.
- ^ a b "Tigason Drug information sheet". RAD-AR Council Japan. Archived from the original on 27 January 2013.
- ^ Qureshi ZP, Seoane-Vazquez E, Rodriguez-Monguio R, Stevenson KB, Szeinbach SL (July 2011). "Market withdrawal of new molecular entities approved in the United States from 1980 to 2009". Pharmacoepidemiology and Drug Safety. 20 (7): 772–7. doi:10.1002/pds.2155. PMID 21574210.
- ^ Fung M, Thornton A, Mybeck K, Wu JH, Hornbuckle K, Muniz E (1 January 2001). "Evaluation of the Characteristics of Safety Withdrawal of Prescription Drugs from Worldwide Pharmaceutical Markets-1960 to 1999". Therapeutic Innovation & Regulatory Science. 35 (1): 293–317. doi:10.1177/009286150103500134. S2CID 73036562.


