심실하구
Subventricular zone| 심실하구 | |
|---|---|
| 식별자 | |
| NeuroEx ID | nlx_144262 |
| 신경조영술의 해부학적 용어 | |

심실하구(SVZ)는 척추동물 뇌의 각 측면 심실의 외벽에 위치한 영역이다.[2]그것은 배아 두뇌와 성인 두뇌 모두에 존재한다.배아생물에서 SVZ는 신경생성세포가 포함된 2차 증식구역을 말하며, 신경생성 과정에서 뉴런을 생성하기 위해 분열한다.[3]뇌와 척수의 1차 신경줄기세포, 즉 방사상 활엽세포라고 불리는 세포는 대신 심실존(VZ)에 상주한다(VZ가 발달하는 심실내부를 선회하기 때문에 이른바).[4]
등측 텔렌스팔론에 상주하는 발달하는 대뇌피질에서 SVZ와 VZ는 성인에게 존재하지 않는 일시적인 조직이다.[4]그러나 복측 텔렌지팔론의 SVZ는 평생 지속된다.성인 SVZ는 세포 구성뿐만 아니라 가변 두께와 세포 밀도의 네 개의 뚜렷한 층으로[5] 구성되어 있다.해마의 틀니트 회와 함께 SVZ는 성인 포유류 뇌에서 신경 유전자가 발생하는 것으로 밝혀진 두 곳 중 하나이다.[6]성체 SVZ 신경생성은 후각 전구로 이동하는 후각류의 신경블라스 전구 형태를 띠는 것이다.SVZ는 또한 뇌손상에 따른 아스트로사이테의 생성에도 관여하는 것으로 보인다.[7]
구조
1층
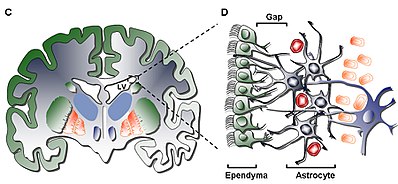
가장 안쪽 층(Layer I)은 심실 공동에 있는 단층(모노레이어)의 표피 세포를 포함하고 있다. 이러한 세포는 심실 표면에 평행하거나 수직으로 서 있을 수 있는 비피질 혈증과 몇 개의 기저 팽창을 가지고 있다.이러한 팽창은 저자극층(Layer II)과 상호 연결된 아스트로시틱 프로세스와 밀접하게 상호작용할 수 있다.[5]
레이어 II
2차층(Layer II)은 전자를 보완하는 저세포 간극을 제공하며, 접합 복합체와 연결되지만 희귀 신경소마타를 제외한 세포체가 부족한 기능상 상관관계가 있는 GFAP(Glial Fibrillary Acid Process Process, GFAP)-양성 아스트로시틱 공정의 네트워크를 포함하고 있는 것으로 나타났다.이 층의 기능은 아직 인간에게 알려져 있지 않지만, 1층과 2층의 아스트로사이틱과 경피간 상호연결은 뉴런 기능을 조절하고 대사성 동점선을 확립하며, 발달 중 뉴런 줄기세포 증식과 분화를 조절하는 작용을 할 수 있다는 가설이 제기되었다.잠재적으로, 그러한 계층의 특성은 상위 포유동물에게만 공통된 철새세포를 가지고 있는 것으로 보이는 소의 SVZ의 동질층과의 유사성을 고려할 때 초기 발달 수명이나 세포이동의 경로의 나머지 역할을 할 수 있다.[5]
레이어 3
세 번째 층(Layer III)은 체내에서 증식할 수 있는 아스트로시테스의 아군을 유지하고 체외에서 자기 재생 능력을 가진 다발성 신경성질체를 형성하는 것으로 여겨지는 아스트로시테 세포체의 리본을 형성한다.리본 안에서 일부 과두세포와 표피세포가 발견되어 알 수 없는 기능을 할 뿐만 아니라, 층에 존재하는 아스트로사이테의 모집단에 비해 드물다.레이어 III에 존재하는 아스트로시테는 전자현미경을 통해 세 개의 모집단으로 나눌 수 있는데, 아직 독특한 기능은 없지만 알아볼 수 있다; 첫 번째 유형은 레이어 II에서 주로 발견되는 길고 수평이며 접선 돌출부의 작은 아스트로시테이다; 두 번째 유형은 아스트로시테 리본, 샤락 내뿐만 아니라 레이어 III와 레이어 사이에서 발견된다.세 번째 유형은 해마 바로 위의 측면 심실에서 발견되며, 두 번째 유형과 크기는 비슷하지만 오르가넬은 거의 없다.[5]
4층
네 번째와 마지막 층(Layer IV)은 아스트로시테스의 리본이 있는 레이어 III와 뇌 실질 사이의 전이 구역 역할을 한다.그것은 그 지역에 미엘린이 많이 함유된 것으로 확인된다.[5]
세포유형
4가지 셀 유형은 SVZ에 설명되어 있다.[8]
1. Ciliated Ependymal Cells (Type E): 심실의 루멘을 향하게 하고, 뇌척수액을 순환시키는 기능을 한다.
2.증식신경블라스틱(A형): PSA-NCAM(NCAM1) Tuj1(TUBB3) Hu를 표현하고, 후각 전구로 순서대로 이동한다.
3. 저속 증식 세포(타입 B): 네스틴과 GFAP를 표현하고, A형 뉴로블라스트의[9] 이동을 억제하는 기능을 한다.
4. 능동적으로 세포 증식 또는 수송 증폭 프로제네이터(타입 C): 네스틴을 표현하고, 지역 전체에[10] 걸쳐 체인 사이에 간격을 두고 군집을 형성한다.
함수
SVZ는 성인의 뇌에 있는 신경 유전자와 자기 재생 뉴런의 알려진 장소로,[11] 세포의 증식을 촉진하는 상호 작용하는 세포 유형, 세포외 분자, 국부적인 후생 유전적 규제로 인해 그러한 역할을 한다.틀니트회(Dentate Gyrus)의 아구간 영역과 함께, 심실하구간은 성인의 신경생성 과정에서 신경줄기세포(NSC)의 원천 역할을 한다.그것은 설치류, 원숭이, 인간의 성인 뇌에 가장 많은 수의 증식 세포를 포함하고 있다.[12]2010년에는 표피 성장인자 수용체 신호 경로와 노치 신호 경로의 상호작용에 의해 신경줄기세포와 신경증생세포(NPC) 사이의 균형이 유지되는 것으로 나타났다.[13]
아직 인간의 뇌에서 심층적으로 연구된 것은 아니지만, 설치류 뇌의 SVZ 기능은 어느 정도 그 능력을 검사하고 규정해 왔다.이러한 연구를 통해, 이중기능 아스트로시테는 설치류 SVZ에서 지배적인 세포라는 것이 밝혀졌다; 이 아스트로시테는 뉴런 줄기세포뿐만 아니라 다른 세포와의 상호작용을 통해 신경생성을 촉진하는 보조 세포로도 작용한다.[8]또한 이 기능은 체외 신경생식을 촉진하기 위해 신경줄기세포와 상호작용을 하는 미세글리아와 내피세포에 의해 유도되며 테나신-C(헬프들이 상호작용을 위한 경계를 정의함)와 루이스 X(신경전구체에 대한 인자와 신호인자를 정의함)와 같은 세포외 매트릭스 성분에 의해서도 유도된다.[14]그러나 인간 SVZ는 설치류 SVZ와는 두 가지 뚜렷한 면에서 다르다; 첫 번째는 인간의 아스트로사이테가 세포체가 부족한 층에 의해 오히려 분리되고, 두 번째는 인간 SVZ가 설치류 SVZ에서 볼 수 있는 이주 신경블라스트의 사슬이 부족하여 보다 적은 N을 공급한다.설치류보다 인간의 신경 세포의 [2]움버이러한 이유로 설치류 SVZ는 SVZ와 그 구조 대 기능 관계에 관한 귀중한 정보 출처로서 증명되지만, 인간 모델은 현저하게 다른 것으로 증명될 것이다.
후생유전자 DNA변형은 신경줄기세포의 분화 과정에서 유전자 발현을 조절하는 데 중심적인 역할을 한다.DNA 메틸전달효소 DNMT3A에 의한 DNA 내 5-메틸시토신(5mC)으로의 시토신 전환은 SVZ에서 발생하는 후생유전적 수정의 중요한 유형으로 보인다.[15]
또 SVZ가 뇌종양줄기세포(BTSC)의 증식장소 역할을 할 수도 있다는 현재의 학설도 있다.[16] 뇌종양줄기세포는 신경세포의 구조나 신경세포, 아스트로시테스, 올리고덴드로시테스로 분화하는 능력과 유사하다.BTSC의 소수인구가 종양을 생성할 수 있을 뿐만 아니라 선천적인 자기갱신능력과 다기능능력을 통해 종양을 유지할 수 있다는 연구결과가 나왔다.이는 BTSC가 신경줄기세포에서 발생한다는 추론을 허용하지 않지만, 우리 자신의 세포에서 그렇게 많은 피해를 줄 수 있는 세포까지 존재하는 관계에 대해 흥미로운 의문을 제기한다.[citation needed]
현재 연구
현재 SVZ는 공공 부문과 민간 부문의 개인에 의해 연구되고 있는 많은 다른 측면들이 있다.그러한 연구 관심사는 신경 유전체에서 SVZ의 역할, 뉴런의 방향 이동에서부터 앞서 언급된 종양이네시스까지 다양하다.아래에는 주로 SVZ의 한 측면에 초점을 맞춘 세 가지 다른 실험실 그룹의 작업 요약이 있다. 여기에는 뇌 손상 후 세포 교체에서 SVZ의 역할, NSC 증식 시뮬레이션 및 다양한 종양유전암에서의 역할이 포함된다.
뇌손상 후 세포교체 역할
그들의 리뷰에서, 로만코 등은 급성 뇌 손상이 SVZ에 미치는 영향을 특징으로 삼았다.전반적으로, 저자들은 SVZ에 대한 적당한 모욕은 회복이 가능한 반면 더 심한 부상은 그 지역에 영구적인 손상을 야기한다고 판단했다.또한 SVZ 내의 신경줄기세포 집단은 이러한 부상 반응에 책임이 있을 가능성이 높다.[17]
주어진 방사선의 양 또는 선량의 인식을 위해 제공되는 SVZ에 대한 조사의 영향은 대부분 종양 근처의 정상 세포의 허용오차에 의해 결정된다.기술한 바와 같이, 방사선량과 연령의 증가로 인해 SVZ의 세 가지 세포 유형이 감소하였으나, 백질 괴사가 없음에도 불구하고 SVZ의 수리 용량은 관찰되었다. 이는 SVZ가 뇌의 신경 글리아를 점진적으로 대체할 수 있었기 때문일 것이다.화학요법도 SVZ에 대한 영향을 검사했는데, 현재 많은 질병에 사용되고 있지만 중추신경계 내의 합병증으로 이어지기 때문이다.이를 위해 MTX(Metotrexate, Metotrexate, MTX)를 단독으로 사용하였으며, 이를 위해 SVZ의 총 핵 밀도의 약 70%가 고갈되었지만, 신경블라스틱 세포(시제 세포)의 손실이 발생하였다는 사실을 밝혀냈으며, SVZ NSC가 여전히 그러한 치료를 받지 않은 피험자와 유사한 신경 가스를 생성한다는 것은 주목할 만한 사실이었다.뇌에 대한 혈액공급 중단과 관련해 뇌 저산소증/허혈증(H/I)도 선조체 및 신피질에 있는 뉴런의 50%가 파괴되는 등 SVZ의 세포수를 20% 감소시키는 것으로 조사되었으나, 사망한 SVZ의 세포형은 부위 자체와 마찬가지로 균일하지 않았다.이후 시험 결과, 각 셀의 다른 부분이 제거되었지만, 내적 SVZ 세포군은 대부분 살아 있는 것으로 나타났다.이것은 그러한 세포의 일정한 복원력을 제공할 수 있으며, 허혈에 따른 증식 인구로 작용하는 미확정 조제 세포가 작용한다.기계적 뇌손상은 설치류에서 관찰된 바와 같이 세포의 이동과 증식을 유도하기도 하며, 또한 세포 수를 증가시킬 수도 있어 이전에 보유하고 있던 새로운 신경세포가 생성될 수 없다는 관념을 부정한다.[citation needed]
결론적으로, 이 그룹은 SVZ의 세포가 어떤 해로운 영향에 민감하기 때문에 손상을 입지 않는다는 점을 감안하여 SVZ의 세포가 평생 동안 새로운 뉴런과 글리아를 생산할 수 있다는 것을 결정할 수 있었다.따라서, SVZ는 가벼운 부상 후에 스스로 회복할 수 있고 잠재적으로 뇌의 다른 영향을 받는 부위로 대체 세포 치료를 제공할 수 있다.[citation needed]
신경생성에서 신경펩타이드 Y의 역할
데크레스택 등은 심실하부 내의 신경세포 확산에 관한 메커니즘을 특성화하고 분석하기 위한 시도로, 신경펩타이드 Y(NPY) 주입을 통해 마우스 심실하부 신경전구체의 확산을 관찰했다.[18]NPY는 후각 상피와 해마에서 뉴런 세포의 증식을 자극하는 것으로 이전에 보여진 중추신경계의 공통 표현 단백질이다.펩타이드의 효과는 회전 철새천을 통해 신경블라스트가 후각 전구와 선조체로 이동하는 증거를 제공하는 BrdU 라벨링과 세포 표현법을 통해 관찰되었다.이러한 데이터는 신경생성이 그러한 펩타이드의 도입을 통해 자극될 것이라는 저자의 가설을 뒷받침한다.[citation needed]
NPY는 많은 생리적, 병리적 조건과 연관된 36개의 아미노산 펩타이드로서 발달하고 성숙한 설치류 뇌에서 광범위하게 표현되는 여러 수용체를 가지고 있다.그러나, 이 그룹에 의해 수행된 생체내 연구 결과, Y1 수용체는 심실 부위에서 표현력이 증가된 NPY의 유도를 통해 특별히 매개된 신경역류 효과를 보였다.Y1 수용체 확인은 이와 같은 유사성 사건에서 발현된 세포의 표현형이 실제로 DCX+( 선조체까지 직접 이동하는 뉴로블라스트)형인 세포라는 사실도 밝혀준다.심실하부(이전 연구)에서 신경생성을 조절하기 위한 선조체 도파민, GABA 및 글루탐산염 파라미터에 대한 NPY 주입의 영향과 함께, 이 발견은 앞서 언급한 신경전달물질의 2차 변조기일 수 있으므로 여전히 고려 중에 있다.[citation needed]
모든 연구에 필요한 것처럼, 이 그룹은 연구 결과의 적용에 대한 넓은 관점으로 실험을 수행했는데, 그들은 이것이 잠재적으로 심실하구 신경줄기세포 증식의 자극을 통해 내생적 뇌수리의 잠재적 후보자들에게 이익이 될 수 있다고 주장했다.성인 신경생물의 이러한 자연 분자 조절은 선조체 영역의 관리 가능한 형태의 신경퇴행장애를 제공하는 약리학적 파생물 외에 시험된 NPY 및 Y1 수용체와 같은 적절한 분자의 치료법과 결합될 것이다.[citation needed]
뇌종양의 잠재적인 원인으로서
키노네스-히노조사 외 연구진은 잠재적 종양에서 심실하 영역의 역할을 특성화하기 위한 시도로 뇌종양 줄기세포(BTSC)는 신경줄기세포에 사용되는 유사한 검사에 의해 뇌종양으로부터 격리될 수 있는 줄기세포라는 사실을 밝혀냈다.[5]뉴런 줄기세포의 신경세포와 유사한 부직구 형성에 있어서, 이들 BTSC는 체외에서 뉴런, 아스트로시, 올리고드로시 등으로 분화할 수 있었지만, 그보다 중요한 것은 낮은 세포 농도로 종양을 시작함으로써 자가 재생 능력을 제공할 수 있다는 점이다.따라서 이러한 자기 재생 능력을 가진 소수의 BTSC들이 백혈병,[citation needed] 유방암과 같은 질병에서 종양을 유지하고 있다는 것이 제안되었다.
몇 가지 특성화 요인은 BTSC가 여러 가지 특징을 공유하기 때문에 뉴런 줄기세포(NSC)가 그 기원이라는 제안으로 이어진다.이러한 특징은 그림에서 볼 수 있다.
이 소분류는 SVZ가 미생성 수용체 보유 및 미생성 자극에 대한 반응, 특히 표피 성장인자 수용체(EGFR)를 표현하는 C형 세포에 의해 입증된 종양성(tomorigenesis)에 있어 명백한 역할을 하는 증거를 제시하여, SVZ를 고증식과 침습성으로 만든다.또한, SVZ 내에 미세 글리아와 내피 세포가 존재하여 신경 유전자를 강화하는 것은 물론, SVZ에서 신경 블라스트의 일부 방향 이동을 제공하는 것으로 밝혀졌다.[citation needed]
최근 인간 SVZ는 뇌종양 환자에게 표현력과 유전적 수준으로 특징지어지고 있다.이러한 데이터를 통해 환자의 절반에서 SVZ는 정확한 종양부위(Terminigenesis)인 반면 나머지 환자에서는 침투된 부위를 나타낸다.[19]따라서 인간에게 해당 지역의 NSC 세대와 제거 또는 조사된 후 2차 종양에 자리를 내주는 1차 종양의 일관된 자가 재생 세포 사이에 관계가 존재할 가능성이 분명히 있다.[citation needed]
SVZ 줄기세포가 교모세포와 같은 뇌종양의 기원 세포인지는 확실히 입증되어야 하지만, 높은 수준의 교모세포가 SVZ에 침투하거나 접촉하는 환자들에게 종양의 공격성과 사망률 증가를 시사하는 강력한 증거가 있다.[20][21]
전립선암에서 종양 유도 신경생성증은 SVZ에서 신경증진세포(NPC)를 모집하는 것이 특징이다.NPC는 종양에 침투해 종양 성장을 자극하는 자율신경세포(아드레날린 신경세포 주)로 분화한다.[22]
참고 항목
참조
- ^ Popp A, Urbach A, Witte OW, Frahm C (2009). Reh TA (ed.). "Adult and Embryonic GAD Transcripts Are Spatiotemporally Regulated during Postnatal Development in the Rat Brain". PLoS ONE. 4 (2): e4371. doi:10.1371/journal.pone.0004371. PMC 2629816. PMID 19190758.
- ^ a b Quiñones-Hinojosa, A; Sanai, N; Soriano-Navarro, M; Gonzalez-Perez, O; Mirzadeh, Z; Gil-Perotin, S; Romero-Rodriguez, R; Berger, MS; Garcia-Verdugo, JM; Alvarez-Buylla, A (Jan 20, 2006). "Cellular composition and cytoarchitecture of the adult human subventricular zone: a niche of neural stem cells". The Journal of Comparative Neurology. 494 (3): 415–34. doi:10.1002/cne.20798. PMID 16320258. S2CID 11713373.
- ^ Noctor, SC; Martínez-Cerdeño, V; Ivic, L; Kriegstein, AR (February 2004). "Cortical neurons arise in symmetric and asymmetric division zones and migrate through specific phases". Nature Neuroscience. 7 (2): 136–44. doi:10.1038/nn1172. PMID 14703572. S2CID 15946842.
- ^ a b Rakic, P (October 2009). "Evolution of the neocortex: a perspective from developmental biology". Nature Reviews. Neuroscience. 10 (10): 724–35. doi:10.1038/nrn2719. PMC 2913577. PMID 19763105.
- ^ a b c d e f Quiñones-Hinojosa, A; Chaichana, K (Jun 2007). "The human subventricular zone: a source of new cells and a potential source of brain tumors". Experimental Neurology. 205 (2): 313–24. doi:10.1016/j.expneurol.2007.03.016. PMID 17459377. S2CID 20491538.
- ^ Ming, GL; Song, H (May 26, 2011). "Adult neurogenesis in the mammalian brain: significant answers and significant questions". Neuron. 70 (4): 687–702. doi:10.1016/j.neuron.2011.05.001. PMC 3106107. PMID 21609825.
- ^ Lim, Daniel A.; Alvarez-Buylla, Arturo (May 2016). "The Adult Ventricular–Subventricular Zone (V-SVZ) and Olfactory Bulb (OB) Neurogenesis". Cold Spring Harbor Perspectives in Biology. 8 (5): a018820. doi:10.1101/cshperspect.a018820. ISSN 1943-0264. PMC 4852803. PMID 27048191.
- ^ a b Doetsch, F; García-Verdugo, JM; Alvarez-Buylla, A (Jul 1, 1997). "Cellular composition and three-dimensional organization of the subventricular germinal zone in the adult mammalian brain". The Journal of Neuroscience. 17 (13): 5046–61. doi:10.1523/JNEUROSCI.17-13-05046.1997. PMC 6573289. PMID 9185542.
- ^ Luskin, MB (Jul 1993). "Restricted proliferation and migration of postnatally generated neurons derived from the forebrain subventricular zone". Neuron. 11 (1): 173–89. doi:10.1016/0896-6273(93)90281-U. PMID 8338665. S2CID 23349579.
- ^ Doetsch, F; Caillé, I; Lim, DA; García-Verdugo, JM; Alvarez-Buylla, A (Jun 11, 1999). "Subventricular zone astrocytes are neural stem cells in the adult mammalian brain". Cell. 97 (6): 703–16. doi:10.1016/S0092-8674(00)80783-7. PMID 10380923.
- ^ Lim, DA; Alvarez-Buylla, A (Jun 22, 1999). "Interaction between astrocytes and adult subventricular zone precursors stimulates neurogenesis". Proceedings of the National Academy of Sciences of the United States of America. 96 (13): 7526–31. doi:10.1073/pnas.96.13.7526. PMC 22119. PMID 10377448.
- ^ Gates, MA; Thomas, LB; Howard, EM; Laywell, ED; Sajin, B; Faissner, A; Götz, B; Silver, J; Steindler, DA (Oct 16, 1995). "Cell and molecular analysis of the developing and adult mouse subventricular zone of the cerebral hemispheres". The Journal of Comparative Neurology. 361 (2): 249–66. doi:10.1002/cne.903610205. PMID 8543661. S2CID 12720709.
- ^ Aguirre A, Rubio ME, Gallo V (September 1998). "Notch and EGFR pathway interaction regulates neural stem cell number and self-renewal". Nature. 467 (7313): 323–7. doi:10.1038/nature09347. PMC 2941915. PMID 20844536.
- ^ Bernier, PJ; Vinet, J; Cossette, M; Parent, A (May 2000). "Characterization of the subventricular zone of the adult human brain: evidence for the involvement of Bcl-2". Neuroscience Research. 37 (1): 67–78. doi:10.1016/S0168-0102(00)00102-4. PMID 10802345. S2CID 45832289.
- ^ 왕 Z, 탕 B, 헤 Y, 진 P. 신경 유전자의 DNA 메틸화 역학후생유전체학. 2016년 3월 8일:401-14. doi: 10.2217/epi.15.119.Epub 2016 3월 7일. 리뷰.PMID 26950681
- ^ Parent JM, von dem Bussche N, Lowenstein DH (2006). "Prolonged seizures recruit caudal subventricular zone glial progenitors into the injured hippocampus" (PDF). Hippocampus. 16 (3): 321–8. doi:10.1002/hipo.20166. hdl:2027.42/49285. PMID 16435310. S2CID 17643839.
- ^ Romanko, MJ; Rola, R; Fike, JR; Szele, FG; Dizon, ML; Felling, RJ; Brazel, CY; Levison, SW (Oct 2004). "Roles of the mammalian subventricular zone in cell replacement after brain injury". Progress in Neurobiology. 74 (2): 77–99. doi:10.1016/j.pneurobio.2004.07.001. PMID 15518954. S2CID 44399750.
- ^ Decressac, M; Prestoz, L; Veran, J; Cantereau, A; Jaber, M; Gaillard, A (Jun 2009). "Neuropeptide Y stimulates proliferation, migration and differentiation of neural precursors from the subventricular zone in adult mice". Neurobiology of Disease. 34 (3): 441–9. doi:10.1016/j.nbd.2009.02.017. PMID 19285132. S2CID 24661524.
- ^ Piccirillo, Sara G. M.; Spiteri, Inmaculada; Sottoriva, Andrea; Touloumis, Anestis; Ber, Suzan; Price, Stephen J.; Heywood, Richard; Francis, Nicola-Jane; Howarth, Karen D. (2015-01-01). "Contributions to Drug Resistance in Glioblastoma Derived from Malignant Cells in the Sub-Ependymal Zone". Cancer Research. 75 (1): 194–202. doi:10.1158/0008-5472.CAN-13-3131. ISSN 0008-5472. PMC 4286248. PMID 25406193.
- ^ Mistry, A.; et al. (2016). "Influence of glioblastoma contact with the lateral ventricle on survival: a meta-analysis". Journal of Neuro-Oncology. 131 (1): 125–133. doi:10.1007/s11060-016-2278-7. PMC 5262526. PMID 27644688.
- ^ Mistry, A.; et al. (2017). "Decreased survival in glioblastomas is specific to contact with the ventricular-subventricular zone, not subgranular zone or corpus callosum". Journal of Neuro-Oncology. 132 (2): 341–349. doi:10.1007/s11060-017-2374-3. PMC 5771712. PMID 28074322.
- ^ Cervantes-Villagrana RD, Albores-García D, Cervantes-Villagrana AR, García-Acevez SJ (18 June 2020). "Tumor-induced Neurogenesis and Immune Evasion as Targets of Innovative Anti-Cancer Therapies". Signal Transduct Target Ther. 5 (1): 99. doi:10.1038/s41392-020-0205-z. PMC 7303203. PMID 32555170.