키타라빈
Cytarabine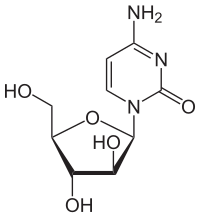 | |
 | |
| 임상자료 | |
|---|---|
| 상명 | 키토사르-U, 디포시트 등 |
| AHFS/Drugs.com | 모노그래프 |
| 메드라인플러스 | a682222 |
| 라이센스 데이터 | |
| 임신 범주 |
|
| 경로: 행정 | 주입 가능(정맥 주사 또는 주입, 경막 내 또는 피하) |
| ATC 코드 | |
| 법적현황 | |
| 법적현황 |
|
| 약동학 데이터 | |
| 생체이용가능성 | 입으로 20% |
| 단백질 결합 | 13% |
| 신진대사 | 간 |
| 제거 반감기 | biphasic: 10분, 1~3시간 |
| 배설 | 콩팥을 |
| 식별자 | |
| |
| CAS 번호 | |
| 펍켐 CID | |
| IUPHAR/BPS | |
| 드러그뱅크 | |
| 켐스파이더 | |
| 유니 | |
| 케그 | |
| 체비 | |
| 켐벨 | |
| PDB 리간드 | |
| CompTox 대시보드 (EPA) | |
| ECHA InfoCard | 100.005.188 |
| 화학 및 물리적 데이터 | |
| 공식 | C9H13N3O5 |
| 어금질량 | 243.219 g·198−1 |
| 3D 모델(JSmol) | |
| |
| |
| (iii) | |
시토신 아라비노사이드(ara-C)로도 알려진 시타라빈은 급성 골수성 백혈병(AML), 급성 림프구 백혈병(ALL), 만성 골수성 백혈병(CML), 비 호지킨 림프종을 치료하는 데 사용되는 화학요법 약물이다.[1] 그것은 정맥, 피부 밑, 또는 뇌척수액에 주사함으로써 주어진다.[1] 뇌막염과 관련된 림프종의 더 나은 결과의 잠정적인 증거가 있는 지방질 제형이 있다.[1]
흔한 부작용으로는 골수 억제, 구토, 설사, 간 질환, 발진, 구강 궤양 형성, 출혈 등이 있다.[1] 다른 심각한 부작용으로는 의식 상실, 폐질환, 알레르기 반응 등이 있다.[1] 임신 중에 사용하면 아기를 해칠 수 있다.[1] 시타라빈은 항이메타볼라이트 및 뉴클레오사이드 아날로그 약물군에 있다.[2] DNA 중합효소의 기능을 차단해 효과가 있다.[1]
시타라빈은 1960년에 특허를 받았고 1969년에 의료용으로 승인되었다.[3] 그것은 세계보건기구의 필수 의약품 목록에 올라 있다.[4]
의학적 용법
시타라빈은 주로 급성 골수성 백혈병, 급성 림프구 백혈병(ALL) 치료와 유도 화학요법의 중추인 [5]림프종 치료에 사용된다.
시타라빈도 항바이러스 활동을 하고 있으며, 일반화된 헤르페스바이러스 감염의 치료에 이용되어 왔다. 그러나, 시타라빈은 이 환경에서 그다지 선택적이지 않고 골수 억제와 다른 심각한 부작용을 일으킨다. 따라서, ara-C는 독성 프로필[6] 때문에 인간에게 유용한 항바이러스제가 아니다.
시타라빈(Cytarabine)은 또한 신경계 연구에도 이용되어 문화권에서 활엽세포의 증식을 억제하는데, 이는 뉴런에 중요한 영향을 미치는 활엽세포의 양이다.[citation needed]
부작용
시타라빈의 독특한 독성 중 하나는 높은 용량으로 주어졌을 때 소뇌 독성이며, 이것은 아탁시아로 이어질 수 있다. 시타라빈은 그라눌로시토페니아와 다른 신체 방어기능을 손상시켜 감염을 일으킬 수 있고 혈소토페니아는 출혈을 일으킬 수 있다.
독성: 췌장염, 백혈병, 혈소판감소증, 빈혈, GI 장애, 구내염, 결막염, 폐염, 발열, 피부염, 팔마 식물의 홍반감각. 골수병증은 높은 복용량이나 잦은 경막내 Ara-C 투여 후 보고된 경우가 드물다.[7]
고선량으로 지정된 프로토콜에 사용될 경우, 시타라빈은 뇌·소뇌 기능장애, 안구 독성, 폐 독성, 심한 GI 궤양, 말초신경병증(Rare)을 유발할 수 있다.
부작용을 예방하고 치료효율을 향상시키기 위해 이러한 약물의 다양한 파생상품(아미노산, 펩타이드, 지방산, 인산 등)을 평가해 왔으며, 전달 시스템도 제각각이었다.[8]
작용기전
시토신 아라비노사이드에는 시토신 베이스와 아라비노오스 설탕이 결합되어 있다. 1β-아라비노푸라노실시토신의 화학적 명칭을 가진 항모충제다. 원래 발견된 특정 해면은 아라비노사이드 당분을 사용해 다른 화합물(DNA의 일부가 아님)을 형성한다. 시토신 아라비노사이드(Cytosine arbinoside)는 인간의 디옥시토신이 인간의 DNA에 통합될 만큼 비슷하지만, 세포가 죽을 만큼 충분히 다르다. 시토신 아라비노사이드(Cytosine arabinoside)는 DNA 합성을 방해한다. 작용 방식은 세포 주기가 S상(DNA의 합성성)을 유지하면 DNA가 손상되는 시토신 아라비노사이드 3인산염으로 빠르게 전환되기 때문이다. 따라서 체세포 분열을 위해 DNA 복제가 필요한 빠르게 분열하는 세포가 가장 큰 영향을 받는다. 시토신 아라비노사이드 또한 DNA 합성에 필요한 DNA와[9] RNA 중합효소와 뉴클레오티드 환원효소 모두를 억제한다. 시타라빈(Cytarabine)은 뉴클레오시드의 당 성분을 변화시킨 일련의 암 치료제 중 첫 번째다. 다른 암 치료제들은 염기서열을 변형시킨다.[10]
시타라빈은 종종 연속 정맥주입에 의해 주어지는데, 이는 초기 빠른 간격 비율과 느린 아날로그 비율에 따른 것이다.[11] 시타라빈은 주로 hENT-1에 의해 세포로 운반된다.[12] 그리고 나서 그것은 디옥시시티딘 키나아제와 결국 시타라빈-5'-트리인산염에 의해 단인산화되는데, 이것은 DNA 합성 동안 DNA에 통합되는 활성 대사물이다.
몇 가지 저항 메커니즘이 보고되었다.[13] 시타라빈은 세럼에 있는 시티딘 디아미노효소에 의해 활동하지 않는 우라실 유도체로 빠르게 디아밍된다. 시타라빈-5"-모노인산염은 데옥시티딜산염 디아미노아제에 의해 디아밍화되며, 우리딘-5"-모노인산염 아날로그로 이어진다.[14] 시타라빈-5'-삼인산염은 SAMHD1의 기질이다.[15] 더욱이 SAMHD1은 환자에게서 시타라빈 효능의 효능을 제한하는 것으로 나타났다.[16]
항바이러스제로 사용될 때, 시타라빈-5'-삼인산염은 바이러스 DNA 합성을 억제하여 기능한다.[17] 시타라빈은 조직 배양 중에 세포 내 헤르페스 바이러스 및 백신 바이러스 복제를 억제할 수 있다. 그러나 시타라빈 치료는 머린 모델에서 헤르페스바이러스 감염에 대해서만 효과가 있었다.
역사
이러한 화합물이 DNA 합성 체인 종단기의 역할을 할 수 있다는 깨달음과 함께 카리브해 스폰지 크립토테카 암호로부터 아라비노스가 함유된 뉴클레오티드를 격리시킴으로써 잠재적인 항암 치료제로서 이러한 새로운 뉴클레오티드를 탐구하게 되었다.[18] 시타라빈은 1959년 리처드 월윅, 월든 로버츠, 찰스 덱커에 의해 버클리 캘리포니아 대학에서 처음 합성되었다.[19]
1969년 6월 미국 식품의약국(FDA)의 승인을 받았으며, 처음에는 업존에 의해 시토사르-U라는 상표명으로 미국에서 시판되었다.
이름
또한 ara-C(arabinofuranosyl cytidine)라고도 알려져 있다.[20]
- 키토사르-U
- 타라빈 PFS(Pfizer)
- 디포사이토(더 오래 지속되는 지질 제형)
- 아라크
참조
- ^ a b c d e f g "Cytarabine". The American Society of Health-System Pharmacists. Archived from the original on 11 June 2016. Retrieved 8 December 2016.
- ^ British national formulary: BNF 69 (69 ed.). British Medical Association. 2015. p. 589. ISBN 9780857111562.
- ^ Fischer, Janos; Ganellin, C. Robin (2006). Analogue-based Drug Discovery. John Wiley & Sons. p. 511. ISBN 9783527607495. Archived from the original on 2016-12-20.
- ^ World Health Organization (2019). World Health Organization model list of essential medicines: 21st list 2019. Geneva: World Health Organization. hdl:10665/325771. WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ^ Pigneux A, Perreau V, Jourdan E, et al. (October 2007). "Adding lomustine to idarubicin and cytarabine for induction chemotherapy in older patients with acute myeloid leukemia: the BGMT 95 trial results". Haematologica. 92 (10): 1327–34. doi:10.3324/haematol.11068. PMID 18024370.
- ^ Lauter, CB.; Bailey, EJ.; Lerner, AM. (Nov 1974). "Assessment of cytosine arabinoside as an antiviral agent in humans". Antimicrob Agents Chemother. 6 (5): 598–602. doi:10.1128/aac.6.5.598. PMC 444699. PMID 15825312.
- ^ Watterson J, Toogood I, Nieder M, et al. (December 1994). "Excessive spinal cord toxicity from intensive central nervous system-directed therapies". Cancer. 74 (11): 3034–41. doi:10.1002/1097-0142(19941201)74:11<3034::AID-CNCR2820741122>3.0.CO;2-O. PMID 7954266.
- ^ Chhikara BS, Parang K (2010). "Development of cytarabine prodrugs and delivery systems for leukemia treatment". Expert Opinion on Drug Delivery. 7 (12): 1399–1414. doi:10.1517/17425247.2010.527330. PMID 20964588. S2CID 2988492.
- ^ Perry, Michael J. (2008). The Chemotherapy source book. Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins. p. 80. ISBN 978-0-7817-7328-7.
- ^ Feist, Patty (April 2005). "A Tale from the Sea to Ara C". Archived from the original on 2007-03-06.
- ^ Liliemark JO, Gahrton G, Paul CY, Peterson CO (Jun 1987). "ara-C in plasma and ara-CTP in leukemic cells after subcutaneous injection and continuous intravenous infusion of ara-C in patients with acute nonlymphoblastic leukemia". Semin Oncol. 14 (2 Suppl 1): 167–71. PMID 3589691.
- ^ Clarke, Marilyn L.; MacKey, John R.; Baldwin, Stephen A.; Young, James D.; Cass, Carol E. (2002). "The Role of Membrane Transporters in Cellular Resistance to Anticancer Nucleoside Drugs". Clinically Relevant Resistance in Cancer Chemotherapy. Cancer Treatment and Research. Vol. 112. pp. 27–47. doi:10.1007/978-1-4615-1173-1_2. ISBN 978-1-4613-5428-4. PMID 12481710.
- ^ Shelton J, Lu X, Hollenbaugh JA, Cho JH, Amblard F, Schinazi RF (Dec 2016). "Metabolism, Biochemical Actions, and Chemical Synthesis of Anticancer Nucleosides, Nucleotides, and Base Analogs". Chem Rev. 116 (23): 14379–14455. doi:10.1021/acs.chemrev.6b00209. PMC 7717319. PMID 27960273.
- ^ Drake JC, Hande KR, Fuller RW, Chabner BA (Mar 1980). "Cytidine and deoxycytidylate deaminase inhibition by uridine analogs". Biochem Pharmacol. 29 (5): 807–11. doi:10.1016/0006-2952(80)90561-4. PMID 20227960.
- ^ Hollenbaugh JA, Shelton J, Tao S, Amiralaei S, Liu P, Lu X, Goetze RW, Zhou L, Nettles JH, Schinazi RF, Kim B (Jan 2017). "Substrates and Inhibitors of SAMHD1". PLOS ONE. 12 (1): e0169052. Bibcode:2017PLoSO..1269052H. doi:10.1371/journal.pone.0169052. PMC 5207538. PMID 28046007.
- ^ Schneider C, Oellerich T, Baldauf HM, Schwarz SM, Thomas D, Flick R, Bohnenberger H, Kaderali L, Stegmann L, Cremer A, Martin M, Lohmeyer J, Michaelis M, Hornung V, Schliemann C, Berdel WE, Hartmann W, Wardelmann E, Comoglio F, Hansmann ML, Yakunin AF, Geisslinger G, Ströbel P, Ferreirós N, Serve H, Keppler OT, Cinatl J Jr (Dec 2016). "SAMHD1 is a biomarker for cytarabine response and a therapeutic target in acute myeloid leukemia" (PDF). Nat Med. 23 (2): 250–255. doi:10.1038/nm.4255. PMID 27991919. S2CID 205398095.
- ^ Lemke, Thomas L.; Williams, David H.; Foye, William O. (2002). Foye's principles of medicinal chemistry. Hagerstwon, MD: Lippincott Williams & Wilkins. p. 963. ISBN 0-683-30737-1.
- ^ Schwartsmann, Gilberto; da Rocha, Adriana Brondani; Berlinck, Roberto GS; Jimeno, Jose (April 2001). "Marine organisms as a source of new anticancer agents". The Lancet Oncology. 2 (4): 221–225. doi:10.1016/s1470-2045(00)00292-8. PMID 11905767.
- ^ Sneader, Walter (2005). Drug discovery: a history. New York: Wiley. p. 258. ISBN 0-471-89979-8.
- ^ Ogbomo H, Michaelis M, Klassert D, Doerr HW, Cinatl J (December 2008). "Resistance to cytarabine induces the up-regulation of NKG2D ligands and enhances natural killer cell lysis of leukemic cells". Neoplasia. 10 (12): 1402–10. doi:10.1593/neo.08972. PMC 2586691. PMID 19048119.


