모폴리노
Morpholino모폴리노는 모폴리노 올리고머라고도 하며 인광다이아미드산 모르폴리노 올리고머(PMO)로도 알려져 있으며, 유전자 발현을 수정하기 위해 분자생물학에서 사용되는 올리고머 분자의 일종이다.그것의 분자 구조는 인광다이아미드산 그룹을 통해 연결된 메틸에네모폴린 고리의 등뼈에 부착된 DNA 염기를 포함하고 있다.모폴리노스는 리보핵산(RNA)의 염기서열 표면의 작은 부분(약 25 베이스)에 대한 다른 분자의 접근을 차단한다.모폴리노는 유전자 기능을 쓰러뜨려 역유전학의 연구 도구로 쓰인다.
이 글에서는 핵산 아날로그인 모폴리노 반시센스 과점만을 논한다.'모르폴리노'라는 단어는 6membed morpholine 링을 함유한 화학물질을 가리키며 다른 화학적 이름에서 발생할 수 있다.다른 모폴린 함유 분자와의 혼동을 피하기 위해, 올리고를 설명할 때, "몰폴리노"는 통상적인 이름으로 자본화되는 경우가 많지만, 이러한 용법은 과학 문헌 전반에 걸쳐 일관되지 않는다.모폴리노 올리고는 때때로 PMO(인포도아미다메이트 모폴리노 올리고머의 경우), 특히 의학 문헌에서 언급된다.비보-모르폴리노스와 PPMO는 세포 진입을 용이하게 하기 위해 화학군이 균일하게 부착된 모폴리노스의 변형된 형태다.
유전자 녹다운은 세포 내 특정 유전자의 발현을 줄임으로써 이루어진다.단백질 코딩 유전자의 경우, 이것은 보통 세포 내 해당 단백질의 양을 감소시키는 결과를 낳는다.유전자 발현을 쓰러뜨리는 것은 특정 단백질의 기능에 대해 배우는 방법이다; 비슷한 방식으로, 단백질이 RNA 대본 인코딩에서 특정 엑손의 분열을 유발하는 것은 엑손에 의해 인코딩된 단백질 함수의 기능을 결정하는 데 도움이 될 수도 있고 때로는 단백질 활동을 완전히 무너뜨릴 수도 있다.이 분자들은 쥐, 제브라피쉬, 개구리, 성게를 포함한 몇몇 모형 유기체의 연구에 적용되었다.[1]모폴리노스는 또한 프리 mRNA의 스플라이싱을 수정하거나 miRNA의 성숙과 활동을 억제할 수 있다.[3]모폴리노스를 RNA에 조준하고 모폴리노를 세포로 전달하는 기술은 최근 저널 기사와[4] 책 형태로 검토되고 있다.[5]
모폴리노는 박테리아나[6] 바이러스[7] 등 병원성 유기체와 유전질환을 대상으로 한 의약품 치료제로 개발 중이다.[8]새렙타테라피틱스의 모폴리노 기반 의약품 에테플리르센은 승인 과정이 논란에 휩싸였지만 2016년 9월 미국 식품의약국(FDA)으로부터 듀첸 근위축증을 유발하는 일부 돌연변이를 치료한 데 대해 가속화된 승인을 받았다.[9]다른 모르폴리노 기반 약품 골로디르센, 빌톨라르센, 캐시머센(Duchenne 근육위축증에도 해당)은 2019~2021년 FDA의 승인을 받았다.[10][11][12]
역사
모폴리노 올리고는 AntiVirals Inc.(현재의 Sarepta Therapeutics)의 서머턴(Gene Tools)에 의해 구상되었으며, 원래 웰러와 협력하여 개발되었다.[13]
구조
모폴리노는 천연 핵산 구조의 재설계의 산물인 합성 분자다.[14]보통 길이가 25개의 염기들이 표준 핵산 염기-페어링에 의해 RNA 또는 단일 가닥 DNA의 상호보완적인 염기서열에 결합된다.구조적으로 볼 때 모폴리노스와 DNA의 차이는 모폴리노스가 표준 핵산 베이스를 갖고 있는 반면, 그 베이스들은 인산염 대신 인산염 그룹을 통해 연결된 메틸에네몰폴린 링에 걸리기 마련이다.[14]그림은 RNA와 Morpholino의 다른 두 가닥의 구조를 비교한 것이다.음이온인산염을 충전되지 않은 인광다이아미드산 그룹으로 대체하면 일반적인 생리학적 pH 범위에서 이온화가 제거되므로 유기체나 세포의 모폴리노는 충전되지 않은 분자다.모폴리노의 전체 등뼈는 이러한 변형된 서브유닛으로 만들어진다.
함수
모폴리노는 많은 항산화 구조 유형(예: 인광로티오아이트, siRNA)과는 달리 표적 RNA 분자의 저하를 유발하지 않는다.대신, 모폴리노는 RNA 내의 표적 시퀀스에 결합하여 "긴장 차단"에 의해 작용하며, 그렇지 않으면 RNA와 상호작용할 수 있는 분자를 억제한다.[15] 모폴리노 올리고는 종종 배아에서 특정 mRNA 대본의 역할을 조사하는데 사용된다.발달생물학자들은 제브라피쉬의 난자나 배아에 모르폴리노 올리고,[16] 아프리카 발톱 개구리(제노푸스),[17] 성게와[18] 킬리피쉬(F. 헤테로클리토스)를 주입하거나, 이후 발달 단계에서 모르폴리노를 병아리[19] 배아로 전기화한다.적절한 세포질 전달 시스템으로 모폴리노스는 세포 배양에 효과적이다.[20][21]올리고가 분만 덴드리머와 공칭적으로 연결된 비보-모르폴리노스는 성체 동물이나 조직 배양액에서 체계적으로 투여할 때 세포에 들어간다.[22]
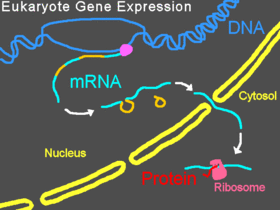
진핵생물의 정상 유전자 발현
진핵생물에서, 사전 mRNA는 핵에서 옮겨지고, 인트론은 쪼개지고, 성숙한 mRNA는 핵에서 세포질로 수출된다.리보솜의 작은 서브유닛은 보통 mRNA의 5의 끝에서 결합하여 시작하고, 다양한 다른 진핵 시작 인자에 의해 거기에 결합되어 개시 콤플렉스를 형성한다.개시 콤플렉스는 mRNA 가닥을 따라 시작 코돈에 도달할 때까지 스캔한 다음 리보솜의 큰 서브 유닛이 작은 서브 유닛에 부착되어 단백질의 번역을 시작한다.이 모든 과정을 유전자 발현이라고 한다; 그것은 DNA의 염기서열로 인코딩된 유전자의 정보가 단백질의 구조로 변환되는 과정이다.모폴리노는 모폴리노의 염기서열에 따라 스플라이싱, 변환 차단, RNA의 다른 기능 사이트 차단 등을 할 수 있다.
번역 차단
MRNA(morpholinos)는 5'번역되지 않은 메신저 RNA(mRNA) 부위로 묶여 리보솜 개시 콤플렉스의 진행을 5'캡에서 시작 코돈으로 방해할 수 있다.이를 통해 대상 대본의 부호화 영역('노킹다운' 유전자 발현)의 번역을 막을 수 있다.이것은 조사자가 특정 단백질의 기능을 알고 싶을 때 실험적으로 유용하다; 모폴리노스는 단백질의 표현을 때려눕히고 그 녹다운이 세포나 유기체를 어떻게 변화시키는지를 배우는 편리한 수단을 제공한다.어떤 모르폴리노스는 기존의 단백질이 분해된 후 대상 단백질이 Western Blotte에 의해 검출되지 않을 정도로 효과적으로 표현을 쓰러뜨린다.
2016년 합성펩타이드 콘주화 PMO(Phosphetide-confuried PMO)가 카바페넴을 파괴하기 위해 많은 약물에 내성이 있는 박테리아가 사용하는 효소인 뉴델리 메탈로-베타-락타마아제의 발현을 억제하는 것으로 밝혀졌다.[23][24]
사전 mRNA 스플라이싱 수정
모르폴리노스는 스플라이스를 유도하는 소형 핵 리보뉴클레오프로틴(snRNP) 복합체가 프리 mRNA의 한 가닥에 있는 인트론 경계에서 표적과 결합하는 것을 막거나, 핵포필릭 아데닌 기지를 차단하여 스플라이스 애로 구조를 형성하는 것을 막거나, 또는 스플라이스 레리어 구조를 형성하는 것을 방해하여 사전 mRNA 처리 단계를 방해할 수 있다.스플라이스 소음기와[25] 스플라이스 인핸서 같은 [26]스플라이스 규제 단백질의 결합으로snRNP U1 (기부 사이트에서) 또는 U2/U5 (폴리피리미딘 모이티 및 수용체 사이트에서)의 결합을 방지하면 일반적으로 성숙한 mRNA에서 exon을 제외하는 변형된 스플라이싱이 발생할 수 있다.일부 스플라이스 대상을 대상으로 하면 인트론 포함이 되는 반면, 암호 스플라이스 사이트의 활성화는 부분 포함 또는 제외로 이어질 수 있다.[27]U11/U12 snRNP의 대상도 차단할 수 있다.[28]스플라이스 수정은 역투명효소 중합효소 연쇄반응(RT-PCR)으로 편리하게 분석할 수 있으며, RT-PCR 제품의 젤 전기영양 후 밴드 시프트로 보인다.[2]
기타 응용 프로그램: 다른 mRNA 사이트 차단 및 프로브로 사용
MiRNA 활동과 성숙을 막기[29][30] 위해 모폴리노를 사용해왔다.[3]플루오르세신 특이 항체와 결합된 플루오르세신 태그 모폴리노스는 miRNA에 대한 현장 혼합을 위한 탐사로 사용할 수 있다.[31]모폴리노는 리보리움 활동을 차단할 수 있다.[32]U2 및 U12 snRNP 기능은 모폴리노스에 의해 억제되었다.[33]단백질 부호화 영역 내에서 "슬립퍼리" mRNA 시퀀스를 목표로 하는 모폴리노스는 변환 프레임 전환을 유도할 수 있다.[34]모폴리노스는 RNA 편집,[35] 폴리 A 미행[36], 번역 시퀀스를 차단할 수 있다.[37]이러한 다양한 대상에 대한 모폴리노 활동은 모폴리노스가 mRNA와 단백질이나 핵산의 상호작용을 차단하는 범용 도구로 사용될 수 있음을 시사한다.
특수성, 안정성 및 비억제 효과
모폴리노는 성체 세포보다 광범위한 유전자 발현 범위를 가지고 있고 표적 이외의 상호작용에 의해 강한 영향을 받을 수 있는 동물 배아 체계의 표준 녹다운 도구가 되었다.단세포 또는 소세포 단계에서 개구리 또는 물고기 배아에 초기 주사를 놓은 후, 모폴리노 효과는 유기생성과 분화의 대부분의 과정이 지난 후 최대 5일 후까지 측정될 수 있으며,[38] 대상-게네 녹다운과 일치하는 관찰된 표현형태를 가지고 있다.관련 없는 시퀀스를 가진 제어 올리고는 대개 배아 표현형, 모폴리노 올리고의 시퀀스 특이성, 비항체 효과의 결여에 대한 증거에 아무런 변화를 일으키지 않는다.녹다운에 필요한 선량은 동일한 mRNA를 대상으로 하는 여러 모폴리노 올리고의 코인주입으로 줄일 수 있으며, 이는 선량에 의존하는 오프 타겟 RNA 상호작용을 줄이거나 제거하는 효과적인 전략이다.[39]
mRNA 구조 실험은 때때로 야생형 표현형을 배아에 복원하고 모폴리노의 특수성에 대한 증거를 제공할 수 있다.mRNA 구조에서, 모폴리노는 모플리노의 단백질을 암호화하는 mRNA와 함께 주입된다.그러나 구조 mRNA는 구조 mRNA가 모폴리노의 표적을 포함하지 않도록 5'-UTR(번역되지 않은 지역)을 수정했다.구조 mRNA의 코딩 부위는 관심 단백질을 암호화한다.구조 mRNA의 번역은 모폴리노가 쓰러뜨린 단백질의 생산을 대체한다.구조 mRNA는 모폴리노의 오프타깃 유전자 발현 변조에 의해 표현형 변화에 영향을 주지 않기 때문에, 이러한 야생형 표현형으로의 복귀는 모폴리노 특이성의 추가 증거다.[38]구조 RNA의 외경적 표현은 야생형 표현형의 회복을 불가능하게 만드는 경우도 있다.
배아에서 모폴리노스는 null 돌연변이로 실험해 예상치 못한 RNA 상호작용을 검사한 뒤 야생형 배아에서 사용하여 급성 녹다운 표현형을 밝힐 수 있다.녹다운 표현형은 돌연변이 표현형보다 더 극단적인 경우가 많다. 돌연변이에서는 유전자 보상에 의해 무효 유전자를 잃는 효과가 감춰질 수 있다.[40]
완전히 부자연스러운 등뼈 때문에 모폴리노는 세포단백질에 의해 인식되지 않는다.핵은 모폴리노스를 분해하지 않으며,[41] 혈청이나 세포에서 분해되지 않는다.[42]
모폴리노스의 최대 18%가 중추신경계 세포사멸과 제브라피쉬 배아의 소마이트 조직 등 비표적 표현형을 유발하는 것으로 나타났다.[43]이러한 효과의 대부분은 p53 매개 세포사멸의 활성화에 기인하며, 실험용 모폴리노와 함께 항 p53 모폴리노를 공동 주입하여 억제할 수 있다.더욱이, 모폴리노 녹다운의 p53 매개 세포충격 효과는 다른 항산화 구조 유형을 사용하여 페노코피화되었으며, p53 매개 세포충증은 대상 단백질의 손실에 따른 것이지 녹다운 올리고 유형의 결과가 아니라는 것을 보여준다.[44]대부분의 경우처럼 모폴리노가 비표적 효과와 연관되어 있다면 4-베이스 불일치 모폴리노는 이러한 효과를 유발하지 않는다.
모폴리노스의 사용에서 우려되는 원인은 "오프 타깃" 효과의 가능성이다.관측된 형태 표현형이 의도된 녹다운 때문인지 아니면 목표물이 벗어난 RNA와의 상호작용 때문인지 여부는, 관찰된 형태 표현형이 예상 대상의 녹다운에서 비롯된다는 것을 확인하기 위해 또 다른 실험을 실행하여 배아에서 종종 다루어질 수 있다.이것은 두번째,non-overlapping Morpholino으로 관찰된 표현형의 돌연변이 변형(비록 보상 일부 돌연변이 안에서 한 표현형을 가릴 것이다)과, null돌연변이 배경에 추가 pheno를 감지하기 위해 Morpholino을 테스트하여 비교하여 확인에 의해 같은 mRNA,[38]를 목표로 하는morphant에 표현형 recapitulating로 할 수 있다.typic 변화 또는 지배 음의 방법에 의한 변화.위에서 언급한 바와 같이, 구조 mRNA를 코인젝트하여 관찰된 표현형식의 구조는, 실현 가능할 때, 모폴리노의 특수성에 대한 신뢰할 수 있는 시험이다.[38][40]
배달
모폴리노가 효과를 발휘하려면 세포막을 지나 세포의 세포질로 전달되어야 한다.세포의 세포핵에 미세주입한 후 관찰된 모폴리노스의 핵 스플라이스 수정 활성에서 증명되었듯이 세포핵에 일단 들어간 모폴리노스는 세포핵과 핵 사이에 자유롭게 확산된다.배아, 배양 세포 또는 성인 동물로 전달하기 위해 다른 방법들이 사용된다.미세주사 기구는 보통 배아로 분만하는데 사용되며, 단세포 또는 소세포 단계에서 가장 일반적으로 수행되는 주입이 사용된다.[45] 배아 분만을 위한 대안적인 방법은 후기 배아 단계의 조직으로 올리고를 전달할 수 있는 전기로증식하는 것이다.[46]배양된 세포로 전달하기 위한 일반적인 기법으로는 Endo-Porter 펩타이드(내도솜에서 모폴리노가 방출되게 하는 원인),[21] 특수 전달 시스템(더 이상 상용화되지 않고, 모폴리노-DNA 헤테로듀플렉스와 에톡실화 폴리에틸리메닌 전달 시약을 사용함),[20][47] 전기화 또는 스크래치 로딩이 있다.[48]
수정되지 않은 모폴리노 올리고(Duchenne 근위축증을[49] 가진 근육세포 또는 풍선 혈관내피세포가[50] 스트레스를 받는 혈관내피세포로 흡수하는 것을 포함)를 유용한 몇 가지 시스템이 있지만, 성인조직으로의 전달은 보통 어렵다.조직 내 세포간 공간을 통해 효과적으로 스며들지만, 비주입 PMO는 IV 투여 후 건강한 조직 내 세포솔과 핵 공간에 제한적으로 분포한다.반면 독성은 펩티드 conjugates,[51][52]의 그들은 vivo에 효과적인oligo 배달을 위해 이 관찰된 유독성으로를 일으키고 아래의 복용량에 사용되어 왔다 적당한 양과 연관된다 성인 유기체에 많은 세포로 계통적 배달 cell-penetrating 펩타이드와 Morpholino oligos의 공유 결합 같은 관계를 사용해서, 이루어질 수 있다.ity.[7][53]모르폴리노 끝에 붙어 있는 옥타-과니디늄 덴드리머는 변형된 올리고(비보-모르폴리노라고 부른다)를 혈액에서 시토솔로 전달할 수 있다.[22][54]펩타이드 결합제, 비보-모르폴리노스와 같은 분만 가능한 모폴리노스는 바이러스 및 유전 질환의 치료제로서 가능성을 보여준다.[55]
참고 항목
참조
- ^ Heasman J (March 2002). "Morpholino oligos: making sense of antisense?". Developmental Biology. 243 (2): 209–14. doi:10.1006/dbio.2001.0565. PMID 11884031.
- ^ a b Draper BW, Morcos PA, Kimmel CB (July 2001). "Inhibition of zebrafish fgf8 pre-mRNA splicing with morpholino oligos: a quantifiable method for gene knockdown". Genesis. 30 (3): 154–6. doi:10.1002/gene.1053. PMID 11477696.
- ^ a b Kloosterman WP, Lagendijk AK, Ketting RF, Moulton JD, Plasterk RH (August 2007). "Targeted inhibition of miRNA maturation with morpholinos reveals a role for miR-375 in pancreatic islet development". PLOS Biology. 5 (8): e203. doi:10.1371/journal.pbio.0050203. PMC 1925136. PMID 17676975.
- ^ Moulton JD (2016). "Guide for Morpholino Users: Toward Therapeutics" (PDF). J Drug Discov Develop and Deliv. 3 (2): 1023.
- ^ Moulton HM, Moulton JD, eds. (2017). Morpholino Oligomers. Methods in Molecular Biology. Vol. 1565. Humana Press (Springer). p. 284. doi:10.1007/978-1-4939-6817-6. ISBN 978-1-4939-6815-2. S2CID 28338321.
- ^ Geller BL (April 2005). "Antibacterial antisense". Current Opinion in Molecular Therapeutics. 7 (2): 109–13. PMID 15844617.
- ^ a b Deas TS, Bennett CJ, Jones SA, Tilgner M, Ren P, Behr MJ, Stein DA, Iversen PL, Kramer LD, Bernard KA, Shi PY (July 2007). "In vitro resistance selection and in vivo efficacy of morpholino oligomers against West Nile virus". Antimicrobial Agents and Chemotherapy. 51 (7): 2470–82. doi:10.1128/AAC.00069-07. PMC 1913242. PMID 17485503.
- ^ McClorey G, Fall AM, Moulton HM, Iversen PL, Rasko JE, Ryan M, Fletcher S, Wilton SD (October 2006). "Induced dystrophin exon skipping in human muscle explants". Neuromuscular Disorders. 16 (9–10): 583–90. doi:10.1016/j.nmd.2006.05.017. PMID 16919955. S2CID 21338534.
- ^ "Press Announcements - FDA grants accelerated approval to first drug for Duchenne muscular dystrophy". Food and Drug Administration. 2019-09-10.
- ^ Commissioner, Office of the (2019-12-12). "FDA grants accelerated approval to first targeted treatment for rare Duchenne muscular dystrophy mutation". FDA. Retrieved 2019-12-14.
- ^ Roshmi, R. R.; Yokota, T. (October 2019). "Viltolarsen for the treatment of Duchenne muscular dystrophy". Drugs of Today. 55 (10): 627–639. doi:10.1358/dot.2019.55.10.3045038. ISSN 1699-3993. PMID 31720560. S2CID 207935659.
- ^ Shirley, Matt (May 2021). "Casimersen: First Approval". Drugs. 81 (7): 875–879. doi:10.1007/s40265-021-01512-2. ISSN 1179-1950. PMID 33861387. S2CID 233248050.
- ^ Summerton JE (2017). "Invention and Early History of Morpholinos: From Pipe Dream to Practical Products". Morpholino Oligomers. Methods in Molecular Biology. Vol. 1565. Humana Press (Springer). pp. 1–15. doi:10.1007/978-1-4939-6817-6_1. ISBN 978-1-4939-6817-6. PMID 28364229.
- ^ a b Summerton J, Weller D (June 1997). "Morpholino antisense oligomers: design, preparation, and properties". Antisense & Nucleic Acid Drug Development. 7 (3): 187–95. doi:10.1089/oli.1.1997.7.187. PMID 9212909. S2CID 19372403.
- ^ Summerton J (December 1999). "Morpholino antisense oligomers: the case for an RNase H-independent structural type". Biochimica et Biophysica Acta (BBA) - Gene Structure and Expression. 1489 (1): 141–58. doi:10.1016/S0167-4781(99)00150-5. PMID 10807004.
- ^ Nasevicius A, Ekker SC (October 2000). "Effective targeted gene 'knockdown' in zebrafish". Nature Genetics. 26 (2): 216–20. doi:10.1038/79951. PMID 11017081. S2CID 21451111.
- ^ Heasman J, Kofron M, Wylie C (June 2000). "Beta-catenin signaling activity dissected in the early Xenopus embryo: a novel antisense approach". Developmental Biology. 222 (1): 124–34. doi:10.1006/dbio.2000.9720. PMID 10885751.
- ^ Howard EW, Newman LA, Oleksyn DW, Angerer RC, Angerer LM (February 2001). "SpKrl: a direct target of beta-catenin regulation required for endoderm differentiation in sea urchin embryos". Development. 128 (3): 365–75. doi:10.1242/dev.128.3.365. PMID 11152635.
- ^ Kos R, Reedy MV, Johnson RL, Erickson CA (April 2001). "The winged-helix transcription factor FoxD3 is important for establishing the neural crest lineage and repressing melanogenesis in avian embryos". Development. 128 (8): 1467–79. doi:10.1242/dev.128.8.1467. PMID 11262245.
- ^ a b Morcos PA (July 2001). "Achieving efficient delivery of morpholino oligos in cultured cells". Genesis. 30 (3): 94–102. doi:10.1002/gene.1039. PMID 11477682.
- ^ a b Summerton JE (November 2005). "Endo-Porter: a novel reagent for safe, effective delivery of substances into cells". Annals of the New York Academy of Sciences. 1058 (1): 62–75. Bibcode:2005NYASA1058...62S. doi:10.1196/annals.1359.012. PMID 16394126. S2CID 28590429.
- ^ a b Morcos PA, Li Y, Jiang S (December 2008). "Vivo-Morpholinos: a non-peptide transporter delivers Morpholinos into a wide array of mouse tissues". BioTechniques. 45 (6): 613–4, 616, 618 passim. doi:10.2144/000113005. PMID 19238792.
- ^ "New molecule knocks out superbugs' immunity to antibiotics". newatlas.com. 2017-01-20. Retrieved 2017-01-25.
- ^ Sully EK, Geller BL, Li L, Moody CM, Bailey SM, Moore AL, Wong M, Nordmann P, Daly SM, Sturge CR, Greenberg DE (March 2017). "Peptide-conjugated phosphorodiamidate morpholino oligomer (PPMO) restores carbapenem susceptibility to NDM-1-positive pathogens in vitro and in vivo". The Journal of Antimicrobial Chemotherapy. 72 (3): 782–790. doi:10.1093/jac/dkw476. PMC 5890718. PMID 27999041.
- ^ Bruno IG, Jin W, Cote GJ (October 2004). "Correction of aberrant FGFR1 alternative RNA splicing through targeting of intronic regulatory elements". Human Molecular Genetics. 13 (20): 2409–20. doi:10.1093/hmg/ddh272. PMID 15333583.
- ^ Vetrini F, Tammaro R, Bondanza S, Surace EM, Auricchio A, De Luca M, Ballabio A, Marigo V (May 2006). "Aberrant splicing in the ocular albinism type 1 gene (OA1/GPR143) is corrected in vitro by morpholino antisense oligonucleotides". Human Mutation. 27 (5): 420–6. doi:10.1002/humu.20303. PMID 16550551. S2CID 21092974.
- ^ Morcos PA (June 2007). "Achieving targeted and quantifiable alteration of mRNA splicing with Morpholino oligos". Biochemical and Biophysical Research Communications. 358 (2): 521–7. doi:10.1016/j.bbrc.2007.04.172. PMID 17493584.
- ^ König H, Matter N, Bader R, Thiele W, Müller F (November 2007). "Splicing segregation: the minor spliceosome acts outside the nucleus and controls cell proliferation". Cell. 131 (4): 718–29. doi:10.1016/j.cell.2007.09.043. PMID 18022366.
- ^ Kloosterman WP, Wienholds E, Ketting RF, Plasterk RH (2004). "Substrate requirements for let-7 function in the developing zebrafish embryo". Nucleic Acids Research. 32 (21): 6284–91. doi:10.1093/nar/gkh968. PMC 535676. PMID 15585662.
- ^ Flynt AS, Li N, Thatcher EJ, Solnica-Krezel L, Patton JG (February 2007). "Zebrafish miR-214 modulates Hedgehog signaling to specify muscle cell fate". Nature Genetics. 39 (2): 259–63. doi:10.1038/ng1953. PMC 3982799. PMID 17220889.
- ^ Lagendijk AK, Moulton JD, Bakkers J (June 2012). "Revealing details: whole mount microRNA in situ hybridization protocol for zebrafish embryos and adult tissues". Biology Open. 1 (6): 566–9. doi:10.1242/bio.2012810. PMC 3509442. PMID 23213449.
- ^ Yen L, Svendsen J, Lee JS, Gray JT, Magnier M, Baba T, D'Amato RJ, Mulligan RC (September 2004). "Exogenous control of mammalian gene expression through modulation of RNA self-cleavage". Nature. 431 (7007): 471–6. Bibcode:2004Natur.431..471Y. doi:10.1038/nature02844. PMID 15386015. S2CID 4425795.
- ^ Matter N, König H (February 2005). "Targeted 'knockdown' of spliceosome function in mammalian cells". Nucleic Acids Research. 33 (4): e41. doi:10.1093/nar/gni041. PMC 549580. PMID 15731334.
- ^ Howard MT, Gesteland RF, Atkins JF (October 2004). "Efficient stimulation of site-specific ribosome frameshifting by antisense oligonucleotides". RNA. 10 (10): 1653–61. doi:10.1261/rna.7810204. PMC 1370650. PMID 15383681.
- ^ Penn AC, Balik A, Greger IH (January 2013). "Steric antisense inhibition of AMPA receptor Q/R editing reveals tight coupling to intronic editing sites and splicing". Nucleic Acids Research. 41 (2): 1113–23. doi:10.1093/nar/gks1044. PMC 3553965. PMID 23172291.
- ^ Vorlová S, Rocco G, Lefave CV, Jodelka FM, Hess K, Hastings ML, Henke E, Cartegni L (September 2011). "Induction of antagonistic soluble decoy receptor tyrosine kinases by intronic polyA activation". Molecular Cell. 43 (6): 927–39. doi:10.1016/j.molcel.2011.08.009. PMC 3781938. PMID 21925381.
- ^ Arthur PK, Claussen M, Koch S, Tarbashevich K, Jahn O, Pieler T (July 2009). "Participation of Xenopus Elr-type proteins in vegetal mRNA localization during oogenesis". The Journal of Biological Chemistry. 284 (30): 19982–92. doi:10.1074/jbc.M109.009928. PMC 2740424. PMID 19458392.
- ^ a b c d Bill BR, Petzold AM, Clark KJ, Schimmenti LA, Ekker SC (March 2009). "A primer for morpholino use in zebrafish". Zebrafish. 6 (1): 69–77. doi:10.1089/zeb.2008.0555. PMC 2776066. PMID 19374550.
- ^ Kamachi Y, Okuda Y, Kondoh H (January 2008). "Quantitative assessment of the knockdown efficiency of morpholino antisense oligonucleotides in zebrafish embryos using a luciferase assay". Genesis. 46 (1): 1–7. doi:10.1002/dvg.20361. PMID 18196596.
- ^ a b Stainier DY, Raz E, Lawson ND, Ekker SC, Burdine RD, Eisen JS, Ingham PW, Schulte-Merker S, Yelon D, Weinstein BM, Mullins MC, Wilson SW, Ramakrishnan L, Amacher SL, Neuhauss SC, Meng A, Mochizuki N, Panula P, Moens CB (October 2017). "Guidelines for morpholino use in zebrafish". PLOS Genetics. 13 (10): e1007000. doi:10.1371/journal.pgen.1007000. PMC 5648102. PMID 29049395.
- ^ Hudziak RM, Barofsky E, Barofsky DF, Weller DL, Huang SB, Weller DD (1996). "Resistance of morpholino phosphorodiamidate oligomers to enzymatic degradation". Antisense & Nucleic Acid Drug Development. 6 (4): 267–72. doi:10.1089/oli.1.1996.6.267. PMID 9012862.
- ^ Youngblood DS, Hatlevig SA, Hassinger JN, Iversen PL, Moulton HM (2007). "Stability of cell-penetrating peptide-morpholino oligomer conjugates in human serum and in cells". Bioconjugate Chemistry. 18 (1): 50–60. doi:10.1021/bc060138s. PMID 17226957.
- ^ Ekker SC, Larson JD (July 2001). "Morphant technology in model developmental systems". Genesis. 30 (3): 89–93. doi:10.1002/gene.1038. PMID 11477681.
- ^ Robu ME, Larson JD, Nasevicius A, Beiraghi S, Brenner C, Farber SA, Ekker SC (May 2007). "p53 activation by knockdown technologies". PLOS Genetics. 3 (5): e78. doi:10.1371/journal.pgen.0030078. PMC 1877875. PMID 17530925.
- ^ Rosen JN, Sweeney MF, Mably JD (March 2009). "Microinjection of zebrafish embryos to analyze gene function". Journal of Visualized Experiments. 9 (25). doi:10.3791/1115. PMC 2762901. PMID 19274045.
- ^ Cerda GA, Thomas JE, Allende ML, Karlstrom RO, Palma V (July 2006). "Electroporation of DNA, RNA, and morpholinos into zebrafish embryos". Methods. 39 (3): 207–11. doi:10.1016/j.ymeth.2005.12.009. hdl:10533/178089. PMID 16837210.
- ^ Jubin R (2004). "Optimizing electroporation conditions for intracellular delivery of Morpholino antisense oligonucleotides directed against the hepatitis C virus internal ribosome entry site". Antisense Therapeutics. Methods Mol. Med. Vol. 106. pp. 309–22. doi:10.1385/1-59259-854-4:309. ISBN 978-1-59259-854-0. PMID 15375324.
- ^ Partridge M, Vincent A, Matthews P, Puma J, Stein D, Summerton J (1996). "A simple method for delivering morpholino antisense oligos into the cytoplasm of cells". Antisense & Nucleic Acid Drug Development. 6 (3): 169–75. doi:10.1089/oli.1.1996.6.169. PMID 8915501. S2CID 8161222.
- ^ Fletcher S, Honeyman K, Fall AM, Harding PL, Johnsen RD, Wilton SD (February 2006). "Dystrophin expression in the mdx mouse after localised and systemic administration of a morpholino antisense oligonucleotide". The Journal of Gene Medicine. 8 (2): 207–16. doi:10.1002/jgm.838. PMID 16285002. S2CID 42463260.
- ^ Kipshidze NN, Kim HS, Iversen P, Yazdi HA, Bhargava B, New G, Mehran R, Tio F, Haudenschild C, Dangas G, Stone GW, Iyer S, Roubin GS, Leon MB, Moses JW (May 2002). "Intramural coronary delivery of advanced antisense oligonucleotides reduces neointimal formation in the porcine stent restenosis model". Journal of the American College of Cardiology. 39 (10): 1686–91. doi:10.1016/S0735-1097(02)01830-2. PMID 12020498.
- ^ Abes S, Moulton HM, Clair P, Prevot P, Youngblood DS, Wu RP, Iversen PL, Lebleu B (December 2006). "Vectorization of morpholino oligomers by the (R-Ahx-R)4 peptide allows efficient splicing correction in the absence of endosomolytic agents". Journal of Controlled Release. 116 (3): 304–13. doi:10.1016/j.jconrel.2006.09.011. PMID 17097177.
- ^ Burrer R, Neuman BW, Ting JP, Stein DA, Moulton HM, Iversen PL, Kuhn P, Buchmeier MJ (June 2007). "Antiviral effects of antisense morpholino oligomers in murine coronavirus infection models". Journal of Virology. 81 (11): 5637–48. doi:10.1128/JVI.02360-06. PMC 1900280. PMID 17344287.
- ^ Amantana A, Moulton HM, Cate ML, Reddy MT, Whitehead T, Hassinger JN, Youngblood DS, Iversen PL (2007). "Pharmacokinetics, biodistribution, stability and toxicity of a cell-penetrating peptide-morpholino oligomer conjugate". Bioconjugate Chemistry. 18 (4): 1325–31. doi:10.1021/bc070060v. PMID 17583927.
- ^ Li YF, Morcos PA (July 2008). "Design and synthesis of dendritic molecular transporter that achieves efficient in vivo delivery of morpholino antisense oligo". Bioconjugate Chemistry. 19 (7): 1464–70. doi:10.1021/bc8001437. PMID 18564870.
- ^ Moulton JD, Jiang S (March 2009). "Gene knockdowns in adult animals: PPMOs and vivo-morpholinos". Molecules. 14 (3): 1304–23. doi:10.3390/molecules14031304. PMC 6253989. PMID 19325525.
추가 읽기
- 와일리-리스, 주식회사 특수 이슈: 창세기 30권의 모폴리노 유전자 녹다운, 이슈 3 페이지 89-200(2001년 7월)이는 다양한 동물 및 조직 배양 시스템에서 모폴리노 유전자 기능의 녹다운을 이용한 일련의 동료 검토 짧은 논문들로 구성된 제네시스 특집호다.
- "펩타이드 핵산, 모폴리노스와 관련 항산화 생체분자." eds.잰슨 & 기간 (Springer, 2007)
- Moulton J (2007). "Using Morpholinos to Control Gene Expression (Unit 4.30)". In Beaucage S (ed.). Current Protocols in Nucleic Acid Chemistry. New Jersey: John Wiley & Sons, Inc. ISBN 978-0-471-24662-6.