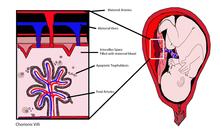
무세포 태아 DNA
Cell-free fetal DNA무세포 태아 DNA(cffDNA)는 모체의 혈액에서 자유롭게 순환하는 태아 DNA이다.모체의 혈액은 정맥시술로 채취한다.cffDNA 분석은 산모 고령의 임산부에게 자주 주문되는 비침습적 태아 진단 방법입니다.출산 후 2시간이 지나면 산모의 혈액에서 cffDNA가 검출되지 않는다.
배경
cffDNA는 태반 영양아세포에서 [1][2]유래한다.태아 DNA는 태반 미립자가 모체 [3]혈액순환에 빠지면 조각난다.
cffDNA fragment의 길이는 약 200 bp입니다.모체 DNA [4]조각보다 상당히 작습니다.크기 차이는 cffDNA를 모성 DNA [5][6]조각과 구별할 수 있게 한다.
모체 혈액에 있는 무세포 DNA의 약 11-13.4%는 태아에서 유래한 것이다.임신부마다 [7]그 양은 천차만별이다.cffDNA는 임신 5주에서 7주 후에 나타난다.임신 [8]진행에 따라 cffDNA의 양이 증가한다.산모 혈액의 cffDNA 양은 출산 후 급격히 감소한다.출산 후 2시간이 지나면 산모의 [9]혈액에서 cffDNA가 검출되지 않는다.
cffDNA의 분석은 현재 기술보다 태아 상태의 조기 진단을 제공할 수 있다.cffDNA는 모체 혈액에서 발견되기 때문에, 샘플링은 자발적 [10][11][12][13][14]낙태의 위험을 수반하지 않습니다. cffDNA 분석은 양수천자 [15]및 융모막채취와 같은 다른 기술과 동일한 윤리적, 실용적인 문제를 가지고 있습니다.
cffDNA 표본 추출의 단점으로는 모체 혈액 내 cffDNA의 낮은 농도, 개인 간 cffDNA 양의 변화, 모체 [16]혈액 내 cffDNA에 비해 모체 세포 프리 DNA의 높은 농도가 있다.
새로운 증거는 자연 임신에 비해 체외수정 임신에서 cffDNA 테스트 실패율이 높고 태아 분율(모체 혈액 샘플에서 태아 대 산모 DNA의 비율)이 낮으며,[17] 삼소체 18, 13 및 SCA에 대한 PPV가 감소한다는 것을 보여준다.
실험실 방법
유전자 결함에 대한 무세포 태아의 DNA 검사를 위한 많은 실험실 방법들이 개발되어 왔다.주요 접근방식은 (1) 대량 병렬 산탄총 시퀀스 처리(MPSS), (2) 표적 대량 병렬 시퀀스 처리(t-MPs), (3) 단일 뉴클레오티드 다형성(SNP) 기반 [18][19][20]접근법이다.
산모 말초 혈액 샘플은 임신 [21]약 10주 후에 정맥 절개로 채취된다.
cffDNA 분리
혈장은 실험실 원심분리기를 사용하여 모체 혈액 샘플에서 분리된다.그런 다음 cffDNA를 분리하여 [22]정제한다.이를 위한 표준화된 프로토콜은 과학 문헌의 평가를 통해 작성되었습니다.cffDNA 추출에서 가장 높은 수율은 "Q"로 구했다.IAamp DSP 바이러스 키트"[23]를 참조하십시오.
모체 혈액 샘플에 포름알데히드를 첨가하면 cffDNA의 생산량이 증가한다.포름알데히드는 온전한 세포를 안정시키고, 따라서 모체 DNA의 추가적인 방출을 억제합니다.포름알데히드를 첨가하면 모체 혈액 샘플에서 회수되는 cffDNA의 비율은 0.32%에서 40%,[24] 평균 7.7%로 변화한다.포름알데히드를 첨가하지 않으면 회수된 cffDNA의 평균 비율은 20.2%로 측정되었다.하지만 다른 수치는 5퍼센트에서 96퍼센트 [25][26]사이이다.
cffDNA의 회복은 DNA 조각의 길이와 관련이 있을 수 있다.태아의 DNA를 증가시키는 또 다른 방법은 DNA 조각의 물리적 길이에 기초한다.작은 조각들은 모체 혈액 [citation needed]샘플에서 총 무세포 DNA의 70%를 차지할 수 있다.
cffDNA 분석
실시간 PCR에서는 형광 프로브를 사용하여 앰피콘의 축적을 감시합니다.리포터 형광 신호는 생성되는 앰피콘 수에 비례합니다.가장 적절한 실시간 PCR 프로토콜은 검출될 특정 돌연변이 또는 유전자형에 따라 설계됩니다.포인트 돌연변이는 대립 유전자 특이적 프로브를 사용하여 질적 실시간 PCR로 분석된다.삽입 및 결실은 정량적 실시간 PCR을 사용한 용량 측정에 의해 분석됩니다.
cffDNA는 중합효소 연쇄반응(PCR)[27][28]을 통해 부계 유전 DNA 서열을 발견함으로써 검출될 수 있다.
정량적 실시간 PCR
임신 511명의 cffDNA에서 성별 결정 영역 Y 유전자(SRY)와 Y 염색체 짧은 연속 반복 "DYS14"를 정량적 실시간 PCR(RT-qPCR)을 사용하여 분석하였다.임신 7주 이상에 산모의 혈액을 채취한 임신 403건 중 401건에서 양쪽 DNA가 발견됐다.[29]
네스트 PCR
중첩 중합효소 연쇄반응(nested PCR)을 사용하여 모체 혈장으로부터 cffDNA에서 Y 염색체 특이 신호를 검출하여 성별을 판정하였다.내포 PCR에서 55명의 남성 태아 중 53명이 검출되었습니다.여성 태아를 가진 25명 중 3명의 혈장에서 나온 cffDNA는 Y 염색체 특이 신호를 포함했다.이 실험에서 내포된 PCR의 민감도는 96%였다.특이성은 88%[30]였다.
디지털 PCR
마이크로 유체 장치를 통해 모체 혈장 내 cffDNA 세그먼트를 실시간 PCR 이상의 정확도로 정량화할 수 있습니다.점 돌연변이, 헤테로 접합성 손실 및 이배체를 단일 PCR [31][32][33]단계에서 검출할 수 있다.디지털 PCR은 산모의 혈장과 태아의 DNA를 다중 [31]방식으로 구별할 수 있다.
샷건 시퀀싱
Solexa 또는 Illumina와 같은 도구를 사용한 높은 처리량 산탄총 시퀀싱은 산모 혈청 샘플당 약 500만 개의 시퀀스 태그를 생성합니다.임신 14주째에 검사했을 때 확인되는 삼출술과 같은 무배체 임신.모성 [13]혈청에서 cffDNA의 염기서열을 이용하여 부모 하플로타입 분석에 의한 태아 전체 게놈 매핑을 완료하였다.임신한 여성은 2-플렉스 대규모 병렬 모체 혈장 DNA 염기서열을 사용하여 연구되었고 트리소미는 [34]3보다 큰 z-점수로 진단되었다.이 순서는 민감도 100%, 특이도 97.9%, 긍정적 예측치 96.6%, 부정적 예측치 100%를 부여했다.
질량 분석
매트릭스 지원 레이저 탈리/이온화 비행시간 질량분석(MALDI-TOF MS)과 PCR 후 단일 염기 확장에 의해 단일 염기 특이성 및 단일 DNA 분자 [35]감도로 cffDNA 검출이 가능하다.DNA는 PCR에 의해 증폭된다.다음으로 염기확장반응(세 번째 프라이머 포함)에 의한 선형증폭은 돌연변이 부위에서 상류로 소둔되도록 설계된다.확장프라이머에 1개 또는 2개의 염기를 첨가하여 야생형 DNA 및 돌연변이 DNA로부터 2개의 확장생성물을 생성한다.단일 염기 특이성은 TaqMan 가수분해 프로브를 사용하는 하이브리드화 기반 기술에 비해 이점을 제공합니다.기술을 평가할 때, 16개의 산모 혈장 [35]샘플에서 태아 성별을 결정하기 위해 cffDNA를 찾았을 때 잘못된 양성 또는 음성이 발견되지 않았다.MALDI-TOF 질량 분석법을 사용하여 91개 수컷 태아의 성별을 정확하게 검출했다.이 기술은 99%[36] 이상의 정확도, 민감도, 특수성을 가지고 있었다.
후생학적 변형
산모와 태아의 DNA 사이의 유전자 활성화 차이는 이용될 수 있다.후생유전학적 변형(DNA 염기서열을 바꾸지 않고 유전자 기능을 바꾸는 유전적 변형)은 [37][38]cffDNA 검출에 사용될 수 있다.과메틸화 RASSF1A 프로모터는 cffDNA의 [39]존재를 확인하는 데 사용되는 범용 태아 마커입니다.모체 혈장에서 cffDNA를 추출한 후 메틸화 민감성 및 둔감성 제한 효소로 소화시키는 기술이 설명되었다.그리고 RASSF1A, SRY, DYS14의 실시간 PCR 분석을 수행하였다.[39]이 시술에서는 90개의 산모 혈액 샘플 중 79개의 RASSF1A가 검출되었습니다.
mRNA
태반에서 발현된 유전자의 mRNA 전사물은 모체 [40]혈장에서 검출된다.이 절차에서는 플라즈마가 원심분리되어 수성층이 나타납니다.이 층이 이동되고 거기에서 RNA가 추출됩니다.RT-PCR은 선택된 RNA 발현을 검출하는 데 사용됩니다. 예를 들어 인간 태반 락토겐(hPL)과 베타-hCG mRNA는 모체 혈장에서 안정적이며 검출될 수 있습니다.(Ng 등 2002년)이것은 모체 [16]혈장에서 cffDNA의 존재를 확인하는 데 도움을 줄 수 있다.
적용들
산전 성감별
모체 혈장 샘플에서 cffDNA를 분석하면 산전 성 감별이 가능하다.산전 성감별의 적용 분야는 다음과 같다.
- 질병 테스트:태아의 성별이 남성인지 여성인지에 따라 특정 임신, 특히 엄마가 [41]그 장애의 유전적 운반체일 때 특정 X-연계 열성 유전 장애의 위험을 결정할 수 있다.
- 육아에 있어서 성에 의존적인 부분을 위한 준비.
- 이식 전 유전자 진단 후 선호하는 성별의 배아만을 선택하여 성선택을 하거나 시험결과와 개인의 취향에 따라 성별선택적 낙태를 하여 착상 후 방법을 통해 성선택을 할 수 있다.
임신 초기 성별 판정에 신뢰할 수 없는 산부인과 초음파 검사나 유산 위험이 적은 양수천자에 비해 cffDNA 분석을 위한 모체 혈장 채취는 위험이 [42]없다.cffDNA 분석의 주요 표적은 Y 염색체와 DY14 [43][44]배열에서 성별 결정 영역 Y 단백질(SRY)을 담당하는 유전자이다.
선천성 부신 과형성
선천성 부신 과형성증에서 부신 피질은 적절한 코르티코스테로이드 합성이 부족하여 부신 안드로겐 과다를 초래하고 여성 [45]태아에게 영향을 미친다.여성 [46]태아에서 생식기의 외부 남성화가 있다.위험한 태아의 산모들은 뇌하수체 [47]안드로겐 분비를 억제하기 위해 임신 6주에 덱사메타손을 투여받는다.
모체 혈장 시료에서 얻은 cffDNA 분석에 Y염색체에서만 발견되는 유전자 마커가 없다면 여성 태아를 암시하는 것이다.그러나 분석 자체의 실패를 나타낼 수도 있습니다(잘못된 음수 결과).cffDNA 검출에는 부성유전자 다형성 및 성별 비의존성 마커를 사용할 수 있다.이 [48]어플리케이션에서는 이들 마커의 높은 수준의 헤테로 접합성이 존재해야 합니다.
친자 확인
산전 DNA 친자 검사는 상업적으로 이용 가능하다.그 테스트는 임신 [citation needed]9주 후에 시행될 수 있다.
단일 유전자 장애
아버지 유전 DNA를 분석하여 사전 진단된 상염색체 우성 및 열성 단일 유전자 장애에는 낭포성 섬유증, 베타 시상혈증, 겸상세포 빈혈, 척추근위축증 [27][43]및 근위축증이 포함된다.상염색체 열성 돌연변이, 모계 유전 상염색체 우성 돌연변이 또는 DNA 배열의 복제, 팽창 또는 삽입을 포함하는 대규모 염기서열 돌연변이에 의한 단일 유전자 장애의 태아 진단은 더 어렵다.[49]
cffDNA에서, 단일 유전자 장애와 관련된 200~300 bp 길이의 단편은 [citation needed]발견하기가 더 어렵다.
예를 들어 상염색체 우성 조건인 연골형성은 FGFR3 유전자 포인트 [50]돌연변이에 의해 발생한다.연골형성증이 있는 태아를 임신한 두 임신에서 모체 혈장 샘플의 cffDNA에서 부계 유전된 G1138A 돌연변이와 다른 [50]모체 혈장 샘플의 G1138A de novo 돌연변이가 발견되었다.
모체 혈장 샘플에서 cffDNA의 qRT-PCR을 사용한 헌팅턴 안무의 유전학 연구에서 CAG 반복이 정상 수준(17, 20, 24)[51]에서 검출되었다.
cffDNA는 또한 단일 유전자 [15]장애를 진단하는데 사용될 수 있다.cffDNA를 사용하는 실험실 과정의 발달은 [52][32]태아에서 트리소미 21(다운증후군)과 같은 배수의 태아 진단을 가능하게 할 수 있다.
태아와 신생아의 용혈성 질환
태아와 산모의 RhD 항원이 맞지 않는 것은 [53]신생아의 용혈성 질환의 주요 원인이다.백인 여성의 약 15퍼센트, 흑인 아프리카 여성의 3퍼센트에서 5퍼센트 그리고 아시아 여성의 3퍼센트 미만이 RhD 음성이다.[54]
이 질환은 신생아에게 치명적일 수 있고 근육내 면역글로불린(Anti-D)이나 정맥내 면역글로불린을 포함한 치료가 위험에 [55]처한 산모들에게 투여될 수 있기 때문에 정확한 태아 진단이 중요하다.
임신 9~13주 사이에 모체 혈장에서 얻은 cffDNA에서 RHD(유전자) 유전자 엑손 5와 7을 검출하는 PCR은 [53]신생 제대혈청에서 RhD 측정과 비교하여 높은 특이성, 민감도 및 진단 정확도(>90%)를 제공한다.exon 7과 [56]10을 대상으로 유사한 결과를 얻었다.태아 RhD 결정에서 액체 디지털 PCR은 일상적인 실시간 PCR 기법과 [57]유사했다.
산모 혈청의 cffDNA에서 태아 RhD 상태를 정기적으로 측정하면 Anti-D의 불필요한 사용을 25% [58]이상 줄이면서 위험 임신을 조기에 관리할 수 있습니다.
무배수성
- 성염색체
모성 혈청 cffDNA를 높은 처리량 시퀀싱으로 분석하면 터너증후군, 클라인펠터증후군, 트리플X증후군 등 일반적인 태아 성염색체 부배수를 검출할 수 있지만 시술의 양성 예측치는 [59]낮다.
- 트리소미 21
21번 염색체의 태아 삼분지가 다운증후군의 원인이다.이 삼차절제술은 [60]MPSS(Massive Parallel Shotgon Sequencing)를 통해 모체의 혈액에서 cffDNA를 분석함으로써 검출될 수 있다.또 다른 기술은 선택된 영역의 디지털 분석(DANSR)[60]입니다.이러한 테스트에서는 약 99%의 민감도와 99.9% 이상의 특이성이 나타난다.따라서, 그것들은 진단 절차로 간주될 수 없지만, 임신 초기 선별 검사나 [60][61]그 상태의 초음파 마커와 같은 양성 모성 선별 검사를 확인하는 데 사용될 수 있다.
- 트리소미 13 및 18
MPSS를 사용하여 모체 혈장으로부터 cffDNA를 분석하여 트리소미 13 또는 18을 찾을 수 있습니다[62].
민감도와 특이성을 제한하는 요인에는 모체 혈장의 cffDNA 수준이 포함된다. 모체 염색체는 모자이크성을 [63]가질 수 있다.
SERPINEB2 mRNA, 클래드 B, 염색체 18로부터의 저메틸화 SERPINB5, 태반특이적 4(PLAC4), 고메틸화 홀로카르복실화효소합성효소([64]HLCS) 및 MRNA 12로부터의 c21orf105를 포함한 다수의 태아핵산 분자를 검출할 수 있다.완전 삼출술에서 모체 혈장의 mRNA 대립 유전자는 일반적인 1:1 비율이 아니라 사실 2:1입니다.후생유전자 마커에 의해 결정되는 대립 유전율은 완전한 삼분지 검출에도 사용될 수 있다.태아 특이 핵산 분자에 한정하지 않고 태아 비배수 검출을 위한 대규모 병렬 배열 및 디지털 PCR을 사용할 수 있으며, MPSS는 96~100%, 다운증후군 검출을 위한 특이도는 94~100%로 추정된다.임신 [65]10주가 되면 시행이 가능합니다.미국의 한 연구는 다운증후군을 [66]감지하기 위해 cffDNA를 사용할 때 거짓 양성률을 0.3%, 양성 예측값을 80%로 추정했다.
프리클램피아
전립선증은 보통 [67]임신 20주 후에 고혈압과 단백뇨를 동반하는 임신의 복잡한 질환이다.그것은 근막의 세포세포성 침윤이 원활하지 않은 것과 관련이 있다.임신 20주에서 34주 사이의 발병은 "조기"[68]로 간주됩니다.임신 전 합병증에 의한 모체 혈장 샘플은 정상 [69][70][71]임신에 비해 상당히 높은 수준의 cffDNA를 가지고 있다.이것은 조기 발병 전 [68]전립선암증에도 해당된다.
장래의 전망
cffDNA로부터 전체 게놈 배열을 생성하기 위해 신세대 염기서열을 사용할 수 있다.이것은 윤리적 [72]문제를 일으킨다.그러나 특정 유전자 변형과 질병 상태 사이의 명확한 연관성이 [73][74]발견됨에 따라 이 절차의 효용성은 증가할 수 있다.
「 」를 참조해 주세요.
레퍼런스
- ^ Alberry M, Maddocks D, Jones M, Abdel Hadi M, Abdel-Fattah S, Avent N, Soothill PW (May 2007). "Free fetal DNA in maternal plasma in anembryonic pregnancies: confirmation that the origin is the trophoblast". Prenatal Diagnosis. Wiley-Blackwell. 27 (5): 415–8. doi:10.1002/pd.1700. PMID 17286310. S2CID 39693586.
- ^ Gupta AK, Holzgreve W, Huppertz B, Malek A, Schneider H, Hahn S (November 2004). "Detection of fetal DNA and RNA in placenta-derived syncytiotrophoblast microparticles generated in vitro". Clinical Chemistry. American Association for Clinical Chemistry (AACC). 50 (11): 2187–90. doi:10.1373/clinchem.2004.040196. PMID 15502097.
- ^ Smets EM, Visser A, Go AT, van Vugt JM, Oudejans CB (February 2006). "Novel biomarkers in preeclampsia". Clinica Chimica Acta; International Journal of Clinical Chemistry. Elsevier BV. 364 (1–2): 22–32. doi:10.1016/j.cca.2005.06.011. PMID 16139262.
- ^ Chan KC, Zhang J, Hui AB, Wong N, Lau TK, Leung TN, Lo KW, Huang DW, Lo YM (January 2004). "Size distributions of maternal and fetal DNA in maternal plasma". Clinical Chemistry. American Association for Clinical Chemistry (AACC). 50 (1): 88–92. doi:10.1373/clinchem.2003.024893. PMID 14709639.
- ^ Li Y, Zimmermann B, Rusterholz C, Kang A, Holzgreve W, Hahn S (June 2004). "Size separation of circulatory DNA in maternal plasma permits ready detection of fetal DNA polymorphisms" (PDF). Clinical Chemistry. American Association for Clinical Chemistry (AACC). 50 (6): 1002–11. doi:10.1373/clinchem.2003.029835. PMID 15073090.
- ^ Li Y, Di Naro E, Vitucci A, Zimmermann B, Holzgreve W, Hahn S (February 2005). "Detection of paternally inherited fetal point mutations for beta-thalassemia using size-fractionated cell-free DNA in maternal plasma". JAMA. American Medical Association (AMA). 293 (7): 843–9. doi:10.1001/jama.293.7.843. PMID 15713774.
- ^ Wang E, Batey A, Struble C, Musci T, Song K, Oliphant A (July 2013). "Gestational age and maternal weight effects on fetal cell-free DNA in maternal plasma". Prenatal Diagnosis. 33 (7): 662–6. doi:10.1002/pd.4119. PMID 23553731. S2CID 31630351.
- ^ Lo YM, Tein MS, Lau TK, Haines CJ, Leung TN, Poon PM, Wainscoat JS, Johnson PJ, Chang AM, Hjelm NM (April 1998). "Quantitative analysis of fetal DNA in maternal plasma and serum: implications for noninvasive prenatal diagnosis". American Journal of Human Genetics. Elsevier BV. 62 (4): 768–75. doi:10.1086/301800. PMC 1377040. PMID 9529358.
- ^ Lo YM, Zhang J, Leung TN, Lau TK, Chang AM, Hjelm NM (January 1999). "Rapid clearance of fetal DNA from maternal plasma". American Journal of Human Genetics. Elsevier BV. 64 (1): 218–24. doi:10.1086/302205. PMC 1377720. PMID 9915961.
- ^ Lo YM, Hjelm NM, Fidler C, Sargent IL, Murphy MF, Chamberlain PF, Poon PM, Redman CW, Wainscoat JS (December 1998). "Prenatal diagnosis of fetal RhD status by molecular analysis of maternal plasma". The New England Journal of Medicine. New England Journal of Medicine (NEJM/MMS). 339 (24): 1734–8. doi:10.1056/nejm199812103392402. PMID 9845707.
- ^ Allyse M, Sayres LC, King JS, Norton ME, Cho MK (November 2012). "Cell-free fetal DNA testing for fetal aneuploidy and beyond: clinical integration challenges in the US context". Human Reproduction. Oxford University Press (OUP). 27 (11): 3123–31. doi:10.1093/humrep/des286. PMC 3472618. PMID 22863603.
- ^ Mujezinovic F, Alfirevic Z (September 2007). "Procedure-related complications of amniocentesis and chorionic villous sampling: a systematic review". Obstetrics and Gynecology. Ovid Technologies (Wolters Kluwer Health). 110 (3): 687–94. doi:10.1097/01.aog.0000278820.54029.e3. PMID 17766619. S2CID 25548568.
- ^ a b Lo YM (August 2008). "Fetal nucleic acids in maternal plasma". Annals of the New York Academy of Sciences. Wiley-Blackwell. 1137 (1): 140–3. Bibcode:2008NYASA1137..140L. doi:10.1196/annals.1448.004. PMID 18837938. S2CID 3445205.
- ^ "Reliable Accurate Prenatal non-Invasive Diagnosis". The NHS RAPID project.
- ^ a b Hahn S, Chitty LS (April 2008). "Noninvasive prenatal diagnosis: current practice and future perspectives". Current Opinion in Obstetrics & Gynecology. 20 (2): 146–51. doi:10.1097/GCO.0b013e3282f73349. PMID 18388814. S2CID 7222299.
- ^ a b Wright CF, Burton H (22 October 2008). "The use of cell-free fetal nucleic acids in maternal blood for non-invasive prenatal diagnosis". Human Reproduction Update. Oxford University Press (OUP). 15 (1): 139–51. doi:10.1093/humupd/dmn047. PMID 18945714.
- ^ Lee TJ, Rolnik DL, Menezes MA, McLennan AC, da Silva Costa F (April 2018). "Cell-free fetal DNA testing in singleton IVF conceptions". Human Reproduction. 33 (4): 572–578. doi:10.1093/humrep/dey033. PMID 29462319.
- ^ Dar P, Shani H, Evans MI (June 2016). "Cell-free DNA: Comparison of Technologies". Clinics in Laboratory Medicine. 36 (2): 199–211. doi:10.1016/j.cll.2016.01.015. PMID 27235906.
- ^ Grace MR, Hardisty E, Dotters-Katz SK, Vora NL, Kuller JA (August 2016). "Cell-Free DNA Screening: Complexities and Challenges of Clinical Implementation". Obstetrical & Gynecological Survey. 71 (8): 477–87. doi:10.1097/OGX.0000000000000342. PMC 5548289. PMID 27526871.
- ^ Allen S, Young E, Bowns B (April 2017). "Noninvasive prenatal diagnosis for single gene disorders". Current Opinion in Obstetrics & Gynecology. 29 (2): 73–79. doi:10.1097/GCO.0000000000000347. PMID 28134670. S2CID 33474139.
- ^ Guibert J, Benachi A, Grebille AG, Ernault P, Zorn JR, Costa JM (August 2003). "Kinetics of SRY gene appearance in maternal serum: detection by real time PCR in early pregnancy after assisted reproductive technique". Human Reproduction. 18 (8): 1733–6. doi:10.1093/humrep/deg320. PMID 12871892.
- ^ Chiu RW, Poon LL, Lau TK, Leung TN, Wong EM, Lo YM (September 2001). "Effects of blood-processing protocols on fetal and total DNA quantification in maternal plasma". Clinical Chemistry. 47 (9): 1607–13. doi:10.1093/clinchem/47.9.1607. PMID 11514393.
- ^ Legler TJ, Liu Z, Mavrou A, Finning K, Hromadnikova I, Galbiati S, Meaney C, Hultén MA, Crea F, Olsson ML, Maddocks DG, Huang D, Fisher SA, Sprenger-Haussels M, Soussan AA, van der Schoot CE (September 2007). "Workshop report on the extraction of foetal DNA from maternal plasma". Prenatal Diagnosis. Wiley-Blackwell. 27 (9): 824–9. doi:10.1002/pd.1783. PMID 17604339. S2CID 38860225.
- ^ Dhallan R, Au WC, Mattagajasingh S, Emche S, Bayliss P, Damewood M, Cronin M, Chou V, Mohr M (March 2004). "Methods to increase the percentage of free fetal DNA recovered from the maternal circulation". JAMA. American Medical Association (AMA). 291 (9): 1114–9. doi:10.1001/jama.291.9.1114. PMID 14996781.
- ^ Benachi A, Yamgnane A, Olivi M, Dumez Y, Gautier E, Costa JM (January 2005). "Impact of formaldehyde on the in vitro proportion of fetal DNA in maternal plasma and serum". Clinical Chemistry. American Association for Clinical Chemistry (AACC). 51 (1): 242–4. doi:10.1373/clinchem.2004.038125. PMID 15514098.
- ^ Chinnapapagari SK, Holzgreve W, Lapaire O, Zimmermann B, Hahn S (March 2005). "Treatment of maternal blood samples with formaldehyde does not alter the proportion of circulatory fetal nucleic acids (DNA and mRNA) in maternal plasma". Clinical Chemistry. American Association for Clinical Chemistry (AACC). 51 (3): 652–5. doi:10.1373/clinchem.2004.042119. PMID 15738521.
- ^ a b Traeger-Synodinos J (2006). "Real-time PCR for prenatal and preimplantation genetic diagnosis of monogenic diseases". Molecular Aspects of Medicine. Elsevier BV. 27 (2–3): 176–91. doi:10.1016/j.mam.2005.12.004. PMID 16430951.
- ^ Boon EM, Schlecht HB, Martin P, Daniels G, Vossen RH, den Dunnen JT, Bakker B, Elles R (October 2007). "Y chromosome detection by Real Time PCR and pyrophosphorolysis-activated polymerisation using free fetal DNA isolated from maternal plasma". Prenatal Diagnosis. Wiley-Blackwell. 27 (10): 932–7. doi:10.1002/pd.1804. PMID 17600849. S2CID 24498216.
- ^ Hill M, Pařízek A, Cibula D, Kancheva R, Jirásek JE, Jirkovská M, Velíková M, Kubátová J, Klímková M, Pašková A, Zižka Z, Kancheva L, Kazihnitková H, Zamrazilová L, Stárka L (October 2010). "Steroid metabolome in fetal and maternal body fluids in human late pregnancy". The Journal of Steroid Biochemistry and Molecular Biology. Elsevier BV. 122 (4): 114–32. doi:10.1016/j.jsbmb.2010.05.007. PMID 20580824. S2CID 25820012.
- ^ Al-Yatama MK, Mustafa AS, Ali S, Abraham S, Khan Z, Khaja N (May 2001). "Detection of Y chromosome-specific DNA in the plasma and urine of pregnant women using nested polymerase chain reaction". Prenatal Diagnosis. Wiley-Blackwell. 21 (5): 399–402. doi:10.1002/pd.69. PMID 11360283. S2CID 20169086.
- ^ a b Zimmermann BG, Grill S, Holzgreve W, Zhong XY, Jackson LG, Hahn S (December 2008). "Digital PCR: a powerful new tool for noninvasive prenatal diagnosis?". Prenatal Diagnosis. Wiley-Blackwell. 28 (12): 1087–93. doi:10.1002/pd.2150. PMID 19003785. S2CID 2909830.
- ^ a b Lo YM, Lun FM, Chan KC, Tsui NB, Chong KC, Lau TK, Leung TY, Zee BC, Cantor CR, Chiu RW (August 2007). "Digital PCR for the molecular detection of fetal chromosomal aneuploidy". Proceedings of the National Academy of Sciences of the United States of America. Proceedings of the National Academy of Sciences. 104 (32): 13116–21. doi:10.1073/pnas.0705765104. PMC 1934923. PMID 17664418.
- ^ Quake S (July 2007). "At the interface of physics and biology". BioTechniques. 43 (1): 19. PMID 17695250.
- ^ Chiu RW, Lo YM (November 2010). "Pregnancy-associated microRNAs in maternal plasma: a channel for fetal-maternal communication?". Clinical Chemistry. American Association for Clinical Chemistry (AACC). 56 (11): 1656–7. doi:10.1373/clinchem.2010.153684. PMID 20837782.
- ^ a b Ding C (2008). "MALDI-TOF Mass Spectrometry for Analyzing Cell-Free Fetal DNA in Maternal Plasma". Prenatal Diagnosis. Methods in Molecular Biology. Vol. 444. Totowa, NJ: Humana Press. pp. 253–67. doi:10.1007/978-1-59745-066-9_20. ISBN 978-1-58829-803-4. PMID 18425487.
- ^ Akolekar R, Farkas DH, VanAgtmael AL, Bombard AT, Nicolaides KH (October 2010). "Fetal sex determination using circulating cell-free fetal DNA (ccffDNA) at 11 to 13 weeks of gestation". Prenatal Diagnosis. Wiley-Blackwell. 30 (10): 918–23. doi:10.1002/pd.2582. PMID 20721878. S2CID 20744999.
- ^ Tong YK, Chiu RW, Chan KC, Leung TY, Lo YM (September 2012). "Technical concerns about immunoprecipitation of methylated fetal DNA for noninvasive trisomy 21 diagnosis". Nature Medicine. Springer Nature. 18 (9): 1327–8, author reply 1328–9. doi:10.1038/nm.2915. PMID 22961155. S2CID 31316176.
- ^ Papageorgiou EA, Karagrigoriou A, Tsaliki E, Velissariou V, Carter NP, Patsalis PC (April 2011). "Fetal-specific DNA methylation ratio permits noninvasive prenatal diagnosis of trisomy 21". Nature Medicine. Springer Nature. 17 (4): 510–3. doi:10.1038/nm.2312. PMC 3977039. PMID 21378977.
- ^ a b White HE, Dent CL, Hall VJ, Crolla JA, Chitty LS (14 September 2012). Oudejans C (ed.). "Evaluation of a novel assay for detection of the fetal marker RASSF1A: facilitating improved diagnostic reliability of noninvasive prenatal diagnosis". PLOS ONE. Public Library of Science (PLoS). 7 (9): e45073. Bibcode:2012PLoSO...745073W. doi:10.1371/journal.pone.0045073. PMC 3443218. PMID 23024794.
- ^ Ng EK, Tsui NB, Lam NY, Chiu RW, Yu SC, Wong SC, Lo ES, Rainer TH, Johnson PJ, Lo YM (August 2002). "Presence of filterable and nonfilterable mRNA in the plasma of cancer patients and healthy individuals". Clinical Chemistry. 48 (8): 1212–7. doi:10.1093/clinchem/48.8.1212. PMID 12142376.
- ^ Baird PA, Anderson TW, Newcombe HB, Lowry RB (May 1988). "Genetic disorders in children and young adults: a population study". American Journal of Human Genetics. 42 (5): 677–93. PMC 1715177. PMID 3358420.
- ^ Scheffer PG, van der Schoot CE, Page-Christiaens GC, Bossers B, van Erp F, de Haas M (January 2010). "Reliability of fetal sex determination using maternal plasma". Obstetrics and Gynecology. Ovid Technologies (Wolters Kluwer Health). 115 (1): 117–26. doi:10.1097/aog.0b013e3181c3c938. PMID 20027043. S2CID 26126381.
- ^ a b Bustamante-Aragones A, Gonzalez-Gonzalez C, de Alba MR, Ainse E, Ramos C (March 2010). "Noninvasive prenatal diagnosis using ccffDNA in maternal blood: state of the art". Expert Review of Molecular Diagnostics. Informa UK Limited. 10 (2): 197–205. doi:10.1586/erm.09.86. PMID 20214538. S2CID 207219250.
- ^ Zimmermann B, El-Sheikhah A, Nicolaides K, Holzgreve W, Hahn S (September 2005). "Optimized real-time quantitative PCR measurement of male fetal DNA in maternal plasma". Clinical Chemistry. American Association for Clinical Chemistry (AACC). 51 (9): 1598–604. doi:10.1373/clinchem.2005.051235. PMID 16020496.
- ^ Finning KM, Chitty LS (April 2008). "Non-invasive fetal sex determination: impact on clinical practice". Seminars in Fetal & Neonatal Medicine. Elsevier BV. 13 (2): 69–75. doi:10.1016/j.siny.2007.12.007. PMID 18243829.
- ^ Markey CM, Wadia PR, Rubin BS, Sonnenschein C, Soto AM (June 2005). "Long-term effects of fetal exposure to low doses of the xenoestrogen bisphenol-A in the female mouse genital tract". Biology of Reproduction. Oxford University Press (OUP). 72 (6): 1344–51. doi:10.1095/biolreprod.104.036301. PMID 15689538.
- ^ Sayres LC, Cho MK (July 2011). "Cell-free fetal nucleic acid testing: a review of the technology and its applications". Obstetrical & Gynecological Survey. Ovid Technologies (Wolters Kluwer Health). 66 (7): 431–42. doi:10.1097/ogx.0b013e31822dfbe2. PMID 21944155. S2CID 17018886.
- ^ Hill M, Barrett AN, White H, Chitty LS (October 2012). "Uses of cell free fetal DNA in maternal circulation". Best Practice & Research. Clinical Obstetrics & Gynaecology. Elsevier BV. 26 (5): 639–54. doi:10.1016/j.bpobgyn.2012.03.004. PMID 22542961.
- ^ Norbury G, Norbury CJ (April 2008). "Non-invasive prenatal diagnosis of single gene disorders: how close are we?". Seminars in Fetal & Neonatal Medicine. Elsevier BV. 13 (2): 76–83. doi:10.1016/j.siny.2007.12.008. PMID 18234572.
- ^ a b Li Y, Page-Christiaens GC, Gille JJ, Holzgreve W, Hahn S (January 2007). "Non-invasive prenatal detection of achondroplasia in size-fractionated cell-free DNA by MALDI-TOF MS assay". Prenatal Diagnosis. Wiley-Blackwell. 27 (1): 11–7. doi:10.1002/pd.1608. PMID 17154237. S2CID 5808436.
- ^ [1] de Die-Smulders CE, de Wert GM, Liebaers I, Tibben A, Evers-Kiebooms G (2013). "Reproductive options for prospective parents in families with Huntington's disease: clinical, psychological and ethical reflections". Human Reproduction Update. 19 (3): 304–15. doi:10.1093/humupd/dms058. PMID 23377865.
- ^ Fan HC, Blumenfeld YJ, Chitkara U, Hudgins L, Quake SR (October 2008). "Noninvasive diagnosis of fetal aneuploidy by shotgun sequencing DNA from maternal blood". Proceedings of the National Academy of Sciences of the United States of America. Proceedings of the National Academy of Sciences. 105 (42): 16266–71. Bibcode:2008PNAS..10516266F. doi:10.1073/pnas.0808319105. PMC 2562413. PMID 18838674.
- ^ a b Cardo L, García BP, Alvarez FV (August 2010). "Non-invasive fetal RHD genotyping in the first trimester of pregnancy". Clinical Chemistry and Laboratory Medicine. Walter de Gruyter GmbH. 48 (8): 1121–6. doi:10.1515/cclm.2010.234. PMID 20482298. S2CID 31027958.
- ^ Chinen PA, Nardozza LM, Martinhago CD, Camano L, Daher S, Pares DB, Minett T, Araujo Júnior E, Moron AF (November 2010). "Noninvasive determination of fetal rh blood group, D antigen status by cell-free DNA analysis in maternal plasma: experience in a Brazilian population". American Journal of Perinatology. Georg Thieme Verlag KG. 27 (10): 759–62. doi:10.1055/s-0030-1253560. PMID 20408112.
- ^ Okwundu CI, Afolabi BB (January 2013). "Intramuscular versus intravenous anti-D for preventing Rhesus alloimmunization during pregnancy". The Cochrane Database of Systematic Reviews (1): CD007885. doi:10.1002/14651858.CD007885.pub2. PMID 23440818.
- ^ Aykut A, Onay H, Sagol S, Gunduz C, Ozkinay F, Cogulu O (December 2013). "Determination of fetal rhesus d status by maternal plasma DNA analysis". Balkan Journal of Medical Genetics. Walter de Gruyter GmbH. 16 (2): 33–8. doi:10.2478/bjmg-2013-0029. PMC 4001413. PMID 24778561.
- ^ Svobodová I, Pazourková E, Hořínek A, Novotná M, Calda P, Korabečná M (2015). "Performance of Droplet Digital PCR in Non-Invasive Fetal RHD Genotyping - Comparison with a Routine Real-Time PCR Based Approach". PLOS ONE. 10 (11): e0142572. Bibcode:2015PLoSO..1042572S. doi:10.1371/journal.pone.0142572. PMC 4642940. PMID 26562517.
- ^ Papasavva T, Martin P, Legler TJ, Liasides M, Anastasiou G, Christofides A, Christodoulou T, Demetriou S, Kerimis P, Kontos C, Leontiades G, Papapetrou D, Patroclos T, Phylaktou M, Zottis N, Karitzie E, Pavlou E, Kountouris P, Veldhuisen B, van der Schoot E, Kleanthous M (April 2016). "Prevalence of RhD status and clinical application of non-invasive prenatal determination of fetal RHD in maternal plasma: a 5 year experience in Cyprus". BMC Research Notes. Springer Nature. 9 (1): 198. doi:10.1186/s13104-016-2002-x. PMC 4818414. PMID 27036548.
- ^ Zhang B, Lu BY, Yu B, Zheng FX, Zhou Q, Chen YP, Zhang XQ (April 2017). "Noninvasive prenatal screening for fetal common sex chromosome aneuploidies from maternal blood". The Journal of International Medical Research. SAGE Publications. 45 (2): 621–630. doi:10.1177/0300060517695008. PMC 5536640. PMID 28357876.
- ^ a b c Kazemi M, Salehi M, Kheirollahi M (10 August 2016). "Down Syndrome: Current Status, Challenges and Future Perspectives". International Journal of Molecular and Cellular Medicine. 5 (3): 125–133. PMC 5125364. PMID 27942498.
- ^ Mersy E, Smits LJ, van Winden LA, de Die-Smulders CE, Paulussen AD, Macville MV, Coumans AB, Frints SG (2013). "Noninvasive detection of fetal trisomy 21: systematic review and report of quality and outcomes of diagnostic accuracy studies performed between 1997 and 2012". Human Reproduction Update. 19 (4): 318–29. doi:10.1093/humupd/dmt001. PMID 23396607.
- ^ Clark-Ganheart CA, Iqbal SN, Brown DL, Black S, Fries MH (May 2014). "Understanding the Limitations of Circulating Cell Free Fetal DNA: An Example of Two Unique Cases". Journal of Clinical Gynecology and Obstetrics. 3 (2): 38–70. doi:10.14740/jcgo229w. PMC 4185925. PMID 25298847.
- ^ Wataganara T, LeShane ES, Farina A, Messerlian GM, Lee T, Canick JA, Bianchi DW (February 2003). "Maternal serum cell-free fetal DNA levels are increased in cases of trisomy 13 but not trisomy 18". Human Genetics. 112 (2): 204–8. doi:10.1007/s00439-002-0853-9. PMID 12522563. S2CID 9721963.
- ^ Chiu RW, Lo YM (April 2011). "Non-invasive prenatal diagnosis by fetal nucleic acid analysis in maternal plasma: the coming of age". Seminars in Fetal & Neonatal Medicine. Elsevier BV. 16 (2): 88–93. doi:10.1016/j.siny.2010.10.003. PMID 21075065.
- ^ 모체 혈액 중 무세포 태아 핵산을 이용한 태아 비침습 태아 배수의 비침습적 태아 진단: 옥스퍼드 건강플랜의 임상 정책(2013년 5월 01일 발효)
- ^ 비앙키 DW, 파커 RL, 웬트워스 JMadankumar R, Saffer C, 다스 AF, 크레이그 JA, Chudova 경위, 디버스 PL, 존스 KW, 올리버 K, Rava RP, Sehnert AJ(2월 2014년)."대 표준 태아의 aneuploidy 검사 DNA염기 서열 결정 법".뉴 잉글랜드 의학 저널.370(9):799–808. doi:10.1056/NEJMoa1311037.PMID 24571752.S2CID 13278444..뉴 잉글랜드 저널 오브 메디신에서 최근의 조사에 따르면 낮은 위험 인구의 NIPT를 사용하는 것의 가능성을 입증했다.
- ^ Henderson JT, Thompson JH, Burda BU, Cantor A (April 2017). "Preeclampsia Screening: Evidence Report and Systematic Review for the US Preventive Services Task Force". JAMA. American Medical Association (AMA). 317 (16): 1668–1683. doi:10.1001/jama.2016.18315. PMID 28444285. S2CID 205077025.
- ^ a b Seval MM, Karabulut HG, Tükün A, Koç A (2015). "Cell free fetal DNA in the plasma of pregnant women with preeclampsia". Clinical and Experimental Obstetrics & Gynecology. 42 (6): 787–91. doi:10.12891/ceog1982.2015. PMID 26753487. S2CID 20971322.
- ^ Lo YM, Lau TK, Zhang J, Leung TN, Chang AM, Hjelm NM, Elmes RS, Bianchi DW (October 1999). "Increased fetal DNA concentrations in the plasma of pregnant women carrying fetuses with trisomy 21". Clinical Chemistry. 45 (10): 1747–51. doi:10.1093/clinchem/45.10.1747. PMID 10508120.
- ^ Leung TN, Zhang J, Lau TK, Chan LY, Lo YM (January 2001). "Increased maternal plasma fetal DNA concentrations in women who eventually develop preeclampsia". Clinical Chemistry. 47 (1): 137–9. doi:10.1093/clinchem/47.1.137. PMID 11148193.
- ^ Zhong XY, Holzgreve W, Hahn S (2002). "The levels of circulatory cell free fetal DNA in maternal plasma are elevated prior to the onset of preeclampsia". Hypertension in Pregnancy. Informa UK Limited. 21 (1): 77–83. doi:10.1081/prg-120002911. PMID 12044339. S2CID 72519129.
- ^ Yurkiewicz IR, Korf BR, Lehmann LS (January 2014). "Prenatal whole-genome sequencing--is the quest to know a fetus's future ethical?". The New England Journal of Medicine. 370 (3): 195–7. doi:10.1056/NEJMp1215536. PMID 24428465. S2CID 205109276.
- ^ Wellcome Trust Case Control Consortium (June 2007). "Genome-wide association study of 14,000 cases of seven common diseases and 3,000 shared controls". Nature. 447 (7145): 661–78. Bibcode:2007Natur.447..661B. doi:10.1038/nature05911. PMC 2719288. PMID 17554300.
- ^ Mailman MD, Feolo M, Jin Y, Kimura M, Tryka K, Bagoutdinov R, et al. (October 2007). "The NCBI dbGaP database of genotypes and phenotypes". Nature Genetics. 39 (10): 1181–6. doi:10.1038/ng1007-1181. PMC 2031016. PMID 17898773.