21-하이드록실라제
21-Hydroxylase| 스테로이드 21-하이드록실라제 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| 식별자 | |||||||||
| EC no. | 1.14.14.16 | ||||||||
| CAS no. | 9029-68-9 | ||||||||
| Alt. 이름들 | "사이토크롬 P450, 패밀리 21, 아과 A, 폴리펩티드 2", CYP21A2, CYP21, CYP21B,[1] P45021A2, 시토크롬 P450c21,[2][3][4] 스테로이드 21-모노옥시게나제,[5] 21-하이드록실라제, 21α-하이드록실라제,[6][7] 21β-하이드록실라제[8][9] | ||||||||
| 데이터베이스 | |||||||||
| 인텐즈 | InTEnz 뷰 | ||||||||
| 브렌다 | 브렌다 항목 | ||||||||
| ExPASY | 나이스자임뷰 | ||||||||
| KEGG | KEGG입력 | ||||||||
| 메타사이클 | 대사 경로 | ||||||||
| 프리암 | 옆모습 | ||||||||
| PDB 구조물 | RCSB PDB PDBe PDBsum | ||||||||
| 유전자 온톨로지 | 아미고 / 퀵고 | ||||||||
| |||||||||
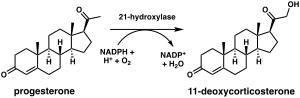
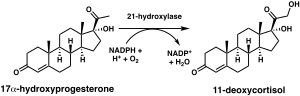
스테로이드 21-하이드록실라제는 인간에서 CYP21A2 유전자에 의해 암호화되는 단백질입니다. 단백질은 분자의 C21 위치에서 스테로이드를 하이드록실화하는 효소입니다.[10][11] 효소에 대한 명명 규칙은 작용하는 기질과 수행되는 화학적 과정을 기반으로 합니다. 생화학적으로 이 효소는 혈압 조절, 나트륨 항상성, 혈당 조절에 중요한 부신 호르몬인 알도스테론과 코르티솔의 생합성에 관여합니다. 효소는 프로게스테론과 17α-하이드록시프로게스테론을 각각 11-디옥시코르티코스테론과 11-디옥시코르티솔로 전환시키며,[12][13] 이는 궁극적으로 인간에서 알도스테론과 코르티솔 생성으로 이어지는 대사 경로 내에서 효소의 결핍은 선천적인 부신 비대증을 유발할 수 있습니다.
스테로이드 21-하이드록실라제는 철을 포함하는 헴 보조인자를 사용하여 기질을 산화시키는 모노옥시게나제 효소의 시토크롬 P450 계열의 구성체입니다.
인간에서 효소는 부신피질 세포의 소포체 막에 국한되어 있으며,[14][15] 서열 유사성이 높은 CYP21A1P 유사유전자 근처에 위치한 CYP21A2 유전자에 의해 암호화됩니다. 이런 유사성은 분자 수준에서 유전자 분석을 어렵게 하고, DNA의 유전자간 교환으로 인해 유전자의 기능 상실 돌연변이로 이어지는 경우도 있습니다.
유전자
| CYP21A2 | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| 식별자 | |||||||||||||||||||||||||||||||
| 별칭 | CYP21A2, CA21H, CAH1, CPS1, CYP21, CYP21B, P450c21B, cytochrome P450 family 21 subfamily A member 2 | ||||||||||||||||||||||||||||||
| 외부 ID | OMIM : 613815 MGI : 88591 호몰로진 : 68063 유전자카드 : CYP21A2 | ||||||||||||||||||||||||||||||
| EC 번호 | 1.14.14.16,1.14.14.16 | ||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| 위키데이터 | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||

인간의 스테로이드 21-하이드록실라제는 비기능성 유사유전자 CYP21A1P의 하나 또는 여러 사본과 함께 동반될 수 있는 CYP21A2 유전자에 의해 암호화되며,[20][21] 이 유사유전자는 실제 기능성 유전자와 외인성 정보 동일성의 98%를 공유합니다.[22][23]
유사유전자는 유전체에서 흔히 볼 수 있으며 복제 과정에서 인공물로 시작됩니다. 종종 "정크 DNA"로 생각되지만, 연구에 따르면 이러한 결함 있는 사본을 유지하는 것이 유익한 역할을 할 수 있으며 종종 부모 유전자의 조절을 제공합니다.[24]
마우스 게놈에서 Cyp21a2는 유사유전자이고 Cyp21a1은 기능유전자입니다.[25] 닭과 메추리에는 Cyp21 유전자 하나만 있는데, Cenpa와 함께 보체 성분 C4와 TNX 유전자 사이에 위치합니다.[26]
인간의 CYP21A2는 보체 성분 4 유전자 C4A 및 C4B, 테나신 X 유전자 TNXB 및 STK19에 가까운 주요 조직적합성 복합체 III(MHC class III)[27]의 염색체 6에 위치합니다.[28] MHC class III는 인간 게놈에서 가장 유전자 밀도가 높은 영역으로 2023년 현재 알려지지 않은 기능 또는 구조를 가진 많은 유전자를 포함합니다.[29][27]
CYP21A2는 인간 유전체에서 가장 복잡한 유전자 클러스터인 RCCX 클러스터(STK19 세린/트레오닌 키나제 19의 옛 이름),[30][31] C4, CYP21 및 TNX 유전자의 이름으로 구성된 약어) 내에 위치합니다.[32][33] 염색체에서 RCCX 세그먼트의 수는 1개에서 4개 사이로 다양하며,[30] 단일 모듈의 경우 약 15%, 이중 모듈(STK19-C4A-CYP21A1P-TNXA-STK19B-CYP21A2-TNXB)[31][34]의 경우 75%, 유럽인의 경우 3개 모듈의 경우 10%의 유병률을 보입니다.[35] RCCX 유닛의 4차 모듈 구조는 매우 희귀합니다.[36][30][35] 단모듈 구조에서 모든 유전자는 기능적, 즉 단백질 코딩이지만 모듈 수가 2개 이상인 경우 항상 활성 사본을 갖는 C4 유전자를 제외하고 나머지 기능적 유전자는 비코딩 유사 유전자로 하나의 사본만 존재합니다.[30][35]
CYP21A2 유전자와 CYP21A1P pseudogene 간의 상동성이 높고 RCCX locus의 복잡성으로 인해 CYP21A2에 대한 분자 진단을 수행하기가 어렵습니다. 유사 유전자는 기능 유전자와 동일하거나 유사한 단일 뉴클레오티드 다형성(SNP)을 가질 수 있어 구별이 어렵습니다. 유사유전자는 기능적 유전자와 재조합할 수도 있고, 양쪽의 특징을 가진 하이브리드 유전자를 만듭니다. 이로 인해 CYP21A2에서 SNP를 검사할 때 위양성 또는 위음성 결과가 나타날 수 있습니다.[37]
전체 유전체 염기서열 분석 기술은 DNA를 작은 조각으로 부수고 염기서열을 분석한 다음 중첩된 부분에 따라 다시 조립하는 것에 의존합니다. 그러나 CYP21A2와 유사 유전자의 높은 상동성과 가변성 때문에 단편은 유전자의 어느 사본에도 명확하게 매핑될 수 없습니다. 이로 인해 결합체에 오류가 발생하거나 공백이 발생하거나 유전자에 존재하는 일부 변이체가 누락될 수 있습니다.[38][37]
중합효소 연쇄반응(PCR) 분자진단은 선택적 프라이머를 사용하여 특정 질병이나 상태를 진단하거나 감지하는 것과 관련된 DNA 서열의 특정 세그먼트를 증폭합니다. 프라이머가 세심하게 설계되지 않으면 CYP21A2 및 CYP21A1P 유사유전자 모두에 결합하거나 RCCX 클러스터의 다른 세그먼트에 결합하여 위양성 또는 위음성 결과를 초래할 수 있습니다. 따라서 CYP21A2에 대한 PCR은 유전자와 유사 유전자, 그리고 서로 다른 RCCX 모듈을 구별할 수 있는 유전자좌 특이적 프라이머를 사용해야 합니다. 더욱이, PCR은 CYP21A2의 경우 빈번하게 발생하는 큰 유전자 전환, 결손 또는 복제와 같은 복잡한 변이체를 검출하지 못할 수 있습니다.[39][40][38]
DNA 샘플에서 특정 DNA 서열을 검출하고 정량화하는 방법인 서던 블롯팅도 CYP21A2를 분석하는 데 한계가 있습니다. 이 방법은 시간이 많이 걸리고 양질의 DNA가 많이 필요하기 때문에 일상적인 진단 환경에서는 적용이 덜합니다. 이 방법에는 방사성 생물학적 위험이 수반되어 안전 문제가 있고 노동 집약적입니다. 서던 블롯팅은 키메라의 접합 부위를 감지할 수 없습니다. CYP21A2 유전자는 불일치 및 재배열되기 쉬우며, 카피 수 변이, 큰 유전자 변환, 작은 삽입/삭제 및 단일 뉴클레오티드(SNP) 변이를 포함하는 다양한 유형의 복잡한 변이를 생성합니다. 서던 블롯팅은 이러한 모든 유형의 변종을 동시에 감지할 수 없습니다. 그 외에도, 서던 블롯팅은 부모의 유전자 분석이 필요한데, 이는 항상 실현 가능하거나 실용적이지는 않습니다.[38][41]
따라서 CYP21A2 유전자를 정확하게 분석하기 위해서는 더 긴 DNA 조각을 염기서열 분석하고 유전자 구조와 변이에 대한 더 많은 정보를 포착할 수 있는 표적형 롱-리드 염기서열 분석 등 보다 전문적이고 민감한 방법이 필요합니다. 그러나 이 방법은 널리 사용할 수 없거나 임상적으로 사용할 수 있는 가격이 저렴하지 않습니다.[42][43][44]
단백질
스테로이드 21-하이드록실라제는 모노옥시게나제 효소의 시토크롬 P450 계열의 구성체이며, 단백질은 분자량이 55,000인 494개의 아미노산 잔기를 가지고 있습니다. 이 효소는 연구된 다른 P-450 효소와 최대 28% 상동성입니다.[45]
구조적으로 단백질은 4개의 α-나선 다발의 진화적으로 보존된 코어를 포함합니다(이러한 유전적 보존의 중요성은 이 단백질 구조의 이러한 측면의 기능적 중요성을 입증하는 데 있습니다). 또한 2개의 추가 알파 나선, 2세트의 β-시트 및 헴 보조인자 결합 루프가 있습니다.[46] 인간 효소의 각 소단위체는 총 13개의 α-나선과 9개의 β-가닥으로 구성되어 삼각형 프리즘과 같은 3차 구조로 접힙니다.[12]
활성 부위를 정의하는 철(III) 헴 그룹은 각 서브유닛의 중앙에 존재합니다. 인간 효소는 한 번에 하나의 기질을 결합합니다.[12] 대조적으로, 잘 특성화된 소 효소는 두 가지 기질을 결합할 수 있습니다.[47] 인간과 소의 효소는 80%의 아미노산 서열 동일성을 공유하지만 특히 루프 영역에서 구조적으로 다르며 2차 구조 요소에서도 분명합니다.[12]
종.
스테로이드 21-하이드록실라제의 변형은 모든 척추동물에서 발견될 수 있습니다.[48]
Cyp21은 기저 화음과 척추동물 사이의 종분화 이전에 화음에서 처음 나타났습니다.[49] 5억년 이상 전에 발생한 초기 턱이 없는 어종인 바다 램프리는 Cyp21의 진화와 출현에 대한 귀중한 통찰력을 제공합니다. Sea lamprey는 포유류에서 관찰되는 바와 같이 11-데옥시코르티솔을 코르티솔로 전환시키는 11β-하이드록실라제 효소가 부족합니다. 대신, 그들은 미네랄 코르티코이드 특성을 가진 그들의 주요 글루코코르티코이드 호르몬으로서 CYP21에 의해 촉매되는 반응의 산물인 11-디옥시코르티솔에 의존합니다. 이것은 적어도 5억 년 전 초기 척추동물 진화 과정에서 나타난 복잡하고 매우 특이한 코르티코스테로이드 신호 전달 경로의 존재를 시사합니다.[50]
어류, 양서류, 파충류, 조류, 포유류 등의 척추동물에서 Cyp21은 글루코코르티코이드와 미네랄코르티코이드의 생합성에 참여하므로 Cyp21은 척추동물의 스트레스 반응, 전해질 균형, 혈압, 면역체계 및 대사 조절에 필수적입니다.[51]
Cyp21은 포유류들 사이에서 비교적 보존되어 있으며, 그 구조, 발현, 조절에 있어서 약간의 변화를 보이고 있습니다.[51] 붉은털 원숭이와 오랑우탄은 Cyp21의 두 개의 사본을 가지고 있는 반면, 침팬지는 세 개의 사본을 가지고 있지만, 유사유전자(CYP21A1P)는 영장류 중에서 인간에게만 존재합니다.[52]
조직 및 세포하 분포
스테로이드 21-하이드록실라제는 부신 피질 내 소포체 막의 마이크로솜에 국한되어 있습니다.[10] 세 가지 마이크로솜 스테로이드 생성 시토크롬 P450 효소 중 하나이며, 다른 하나는 스테로이드 17-하이드록실라제 및 아로마타제입니다.[53]
간에서 가장 풍부한 발현으로 여러 조직에서 발현되는 시토크롬 P450 상과의 다른 효소와 달리 성인 인간의 경우 스테로이드 11β-하이드록실라제 및 알도스테론 합성효소와 함께 스테로이드 21-하이드록실라제가 거의 독점적으로 부신에서 발현됩니다.[54][55]
2023년 현재,[update] 인간 세포에서 암호화된 단백질의 주요 세포내 위치는 알려져 있지 않으며, 세포 분석을 기다리고 있습니다.[56]
기능.

효소인 스테로이드 21-하이드록실라제는 C21 위치에서 스테로이드를 하이드록실화합니다.[13]스테로이드는 자연적으로 발생하고 합성적으로 생성되는 유기 화합물의 그룹으로, 스테로이드는 모두 4환의 1차 구조를 공유합니다. 효소는 스테로이드 생체분자의 C21 위치에 하이드록시기(-OH)가 첨가되는 화학반응을 촉매합니다. 이 위치는 D 링의 곁사슬에 있습니다.
이 효소는 모노옥시게나제 효소의 시토크롬 P450 슈퍼패밀리의 일원입니다. 시토크롬 P450 효소는 약물 대사와 콜레스테롤, 스테로이드 및 기타 지질의 합성에 관여하는 많은 반응을 촉매합니다.
스테로이드 21-하이드록실라제는 코르티솔과 알도스테론의 생합성에 필수적입니다.[57][58]
메카니즘


스테로이드 21-하이드록실라제는 기질 특이성과 비교적 높은 촉매 효율로 유명한 사이토크롬 P450 효소입니다.[48]
다른 시토크롬 P450 효소와 마찬가지로 스테로이드 21-하이드록실라제는 시토크롬 P450 촉매 사이클에 참여하고 NADPH-P450 환원효소와 일전자 전달에 관여합니다. 스테로이드 21-하이드록실라제는 프로게스테론과 17-하이드록시프로게스테론의 하이드록실화에 매우 특이적입니다. 이것은 광범위한 기질을 가지고 있는 진화적으로 그리고 기능적으로 관련된 P450 효소 17-하이드록실라제와 현저한 대조를 이룹니다.[59]
스테로이드 21-하이드록실라제가 프로게스테론, 17α-하이드록시프로게스테론 및 21-데옥시코르티손의[60] C21 위치에 하이드록실(-OH)의 첨가를 촉매하는 화학 반응은 1952년에 처음 기술되었습니다.[61]
효모에서 발현된 인간 효소에 대한 연구는 처음에 17-하이드록시프로게스테론을 스테로이드 21-하이드록실라제에 대한 선호되는 기질로 분류했지만,[59][62][63] 정제된 인간 효소에 대한 나중의 분석에서는 17-하이드록시프로게스테론보다 프로게스테론에 대한 더 낮은M K 및 더 큰 촉매 효율을 발견했습니다.[12]
인간에서 프로게스테론의 전환을 위한 스테로이드 21-하이드록실라제의 촉매 효율은 37 °C에서 약 1.3 x 107 Ms입니다−1−1. 이것은 현재까지 보고된 것 중 가장 촉매적으로 효율적인 P450 효소이며 밀접하게 관련된 소 스테로이드 21-하이드록실라제 효소보다 촉매적으로 더 효율적입니다.[14] C-H 결합을 파괴하여 1차 탄소 라디칼을 생성하는 것이 하이드록실화의 속도 제한 단계라고 생각됩니다.[12]
임상적 의의
선천성 부신 비대증
CYP21A2 유전자의 유전적 변이는 효소의 발달에 장애를 일으켜 21-하이드록실라제 결핍으로 인한 선천성 부신 비대증(CAH)을 유발합니다. 기능 유전자와 유사 유전자를 포함하는 유전자 전환 사건은 스테로이드 21-하이드록실라제 결핍의 많은 경우를 설명합니다.[64] CAH는 상염색체 열성 질환입니다. CAH에는 환자에게 여전히 존재하는 효소 기능의 양에 따라 고전적 형태와 비고전적 형태로 정의되는 여러 형태가 있습니다.
고전적인 형태는 전 세계적으로 약 10000명 중 1명에서 20000명 중 1명에서 발생하며, 염분 낭비([58][65]소변을 통해 나트륨이 과도하게 배출되어 저나트륨혈증과 탈수를 유발함)와 단순 바이러스화 형태를 모두 포함합니다. 효소 활성의 완전한 손실은 소금 낭비 형태를 유발합니다. 스테로이드 21-하이드록실라아제의 구조의 변이는 선천성 부신 비대증의 임상적 중증도와 관련이 있습니다. 코르티솔과 알도스테론 결핍은 스테로이드가 나트륨 항상성을 조절하는 역할을 하기 때문에 생명을 위협하는 나트륨 손실과 관련이 있습니다. 단순 바이러스성 CAH 환자(~1-2% 효소 기능)[58]는 적절한 나트륨 항상성을 유지하지만, 소아기의 가속화된 성장 및 여성 신생아의 모호한 생식기를 포함하여 소금 낭비 형태가 공유하는 다른 증상을 나타냅니다.
비고전적 형태는 효소 기능의 약 20%~50%를 유지하는 가장 가벼운 상태입니다.[58] 이 형태는 경증 및 임상적으로 조용한 코르티솔 장애와 관련이 있지만,[65] 사춘기 이후 안드로겐의 과잉과 관련이 있습니다.[66]
비고전적 선천성 부신 비대증
21-하이드록실라제 결핍(NCCAH)에 의한 비고전적 선천성 부신 비대증은 더 온화하고 늦게 발병하는 선천성 부신 비대증입니다. 다른 민족 집단에서의 유병률은 1000분의 1에서 50분의 1까지 다양합니다.[58] 해당 질환에 걸린 사람 중에는 관련 징후와 증상이 없는 사람도 있고, 고안드로겐증 증상을 경험하는 사람도 있습니다.[58][65][66]
NCCAH를 가진 여성들은 태어날 때 보통 정상적인 여성 생식기를 가지고 있습니다. 나중에 이 병의 징후와 증상은 여드름, 다모증, 남성형 대머리, 불규칙한 월경, 불임을 포함할 수 있습니다.[58][65][25]
남성은 일반적으로 무증상이기 때문에 NCCAH를 가진 남성에 대한 연구는 여성에 대한 연구에 비해 덜 발표되었습니다.[25][58] 그러나 남성은 여드름과[67][68] 조기 대머리를 보일 수 있습니다.[69][70]
증상은 대개 사춘기 이후에 진단되지만, 어린이는 조기 부신 마비를 보일 수 있습니다.[71]
다른 조건에 대한 연구
CYP21A2 유전자의 유전자 변이가 어떻게 병원성 질환으로 이어질 수 있는지에 대한 연구가 진행 중입니다. 이 유전자의 변이는 상염색체 우성 후극 백내장을 유발하는 것으로 보고되었으며, 이는 스테로이드 21-하이드록실라제가 눈의 수정체에서 알도스테론과 코르티솔의 부신외 생합성에 관여할 수 있음을 시사합니다.[72]
역사
1950년대와 1960년대에 여러 단계를 포함하는 복잡한 경로를 통해 콜레스테롤을 프로게스테론으로 전환하는 것을 포함하는 스테로이드 생성 경로가 확인되었고, 그 중에서 시토크롬 P450 효소에 의해 매개되는 위치 21(21-하이드록실화)에서의 하이드록실화 반응을 포함하는 특정 효소 단계를 나타내는 코티솔 합성 경로.[73] 그런 다음 사이토크롬 P450 효소가 기술되었으며 스테로이드 21-하이드록실화는 사이토크롬 P450과 관련이 있었습니다.[74][73]
1980년대와 1990년대에 부분 길이의 소 Cyp21 cDNA 클론이 인간 CYP21A2와 관련된 것으로 확인되었습니다.[75][73] 연구원들은 선천성 부신 비대증(CAH)과 관련된 CYP21A2 유전자의 돌연변이를 발견했습니다.[73]
1990년대부터 특정 돌연변이는 CAH의 다른 형태/심각도 수준과 상관관계가 있었습니다. 진단 정확도 향상을 위해 유전자형/표현형 상관관계를 조사했습니다.[73]
참고 항목
참고문헌
- ^ "UniProt". www.uniprot.org.
- ^ Marino S, Perez Garrido N, Ramírez P, Pujana M, Dratler G, Belgorosky A, Marino R (2020). "Molecular analysis of the CYP21A2 gene in dried blood spot samples". Medicina. 80 (3): 197–202. PMID 32442933.
- ^ Kaewkot A, Boonkaewwan C, Noosud J, Kayan A (November 2017). "Expression level of the cytochrome P450c21 (CYP21) protein correlating to drip loss in pigs". Animal Science Journal. 88 (11): 1855–1859. doi:10.1111/asj.12863. PMID 28677294.
- ^ Mizrachi D, Wang Z, Sharma KK, Gupta MK, Xu K, Dwyer CR, Auchus RJ (May 2011). "Why human cytochrome P450c21 is a progesterone 21-hydroxylase". Biochemistry. 50 (19): 3968–74. doi:10.1021/bi102078e. PMC 3165045. PMID 21446712.
- ^ "Information on EC 1.14.14.16 - steroid 21-monooxygenase - BRENDA Enzyme Database". www.brenda-enzymes.org.
- ^ Mukangwa M, Takizawa K, Aoki Y, Hamano S, Tetsuka M (February 2020). "Expression of genes encoding mineralocorticoid biosynthetic enzymes and the mineralocorticoid receptor, and levels of mineralocorticoids in the bovine follicle and corpus luteum". The Journal of Reproduction and Development. 66 (1): 75–81. doi:10.1262/jrd.2019-127. PMC 7040213. PMID 31839646.
- ^ Sarafoglou K, Lorentz CP, Otten N, Oetting WS, Grebe SK (July 2012). "Molecular testing in congenital adrenal hyperplasia due to 21α-hydroxylase deficiency in the era of newborn screening". Clinical Genetics. 82 (1): 64–70. doi:10.1111/j.1399-0004.2011.01694.x. PMID 21534945. S2CID 7197547.
- ^ Bergamaschi R, Livieri C, Uggetti C, Candeloro E, Egitto MG, Pichiecchio A, Cosi V, Bastianello S (March 2006). "Brain white matter impairment in congenital adrenal hyperplasia". Archives of Neurology. 63 (3): 413–6. doi:10.1001/archneur.63.3.413. PMID 16540460.
- ^ Marcol W, Kalina-Faska B, Wackermann-Ramos A, Koehler B (2000). "Congenital adrenal hyperplasia conditioned by 21beta-hydroxylase deficiency - clinical considerations". Endokrynologia, Diabetologia I Choroby Przemiany Materii Wieku Rozwojowego (in Polish). 6 (1): 67–9. PMID 14640134.
- ^ a b
 이 기사는 다음과 같은 퍼블릭 도메인 자료를 포함합니다.
이 기사는 다음과 같은 퍼블릭 도메인 자료를 포함합니다. - ^ Ryan KJ, Engel LL (March 1957). "Hydroxylation of steroids at carbon 21" (PDF). The Journal of Biological Chemistry. 225 (1): 103–14. doi:10.1016/S0021-9258(18)64913-0. PMID 13416221.
- ^ a b c d e f Pallan PS, Wang C, Lei L, Yoshimoto FK, Auchus RJ, Waterman MR, Guengerich FP, Egli M (May 2015). "Human Cytochrome P450 21A2, the Major Steroid 21-Hydroxylase: structure of the enzyme progesterone substrate complex and rate-limiting c-h bond cleavage". The Journal of Biological Chemistry. 290 (21): 13128–43. doi:10.1074/jbc.M115.646307. PMC 4505568. PMID 25855791.
- ^ a b Neunzig J, Milhim M, Schiffer L, Khatri Y, Zapp J, Sánchez-Guijo A, et al. (March 2017). "The steroid metabolite 16(β)-OH-androstenedione generated by CYP21A2 serves as a substrate for CYP19A1". The Journal of Steroid Biochemistry and Molecular Biology. 167: 182–191. doi:10.1016/j.jsbmb.2017.01.002. PMID 28065637. S2CID 36860068.
- ^ a b Guengerich FP, Waterman MR, Egli M (August 2016). "Recent Structural Insights into Cytochrome P450 Function". Trends in Pharmacological Sciences. 37 (8): 625–40. doi:10.1016/j.tips.2016.05.006. PMC 4961565. PMID 27267697.
- ^ Sushko TA, Gilep AA, Usanov SA (June 2012). "Mechanism of intermolecular interactions of microsomal cytochrome P450s CYP17 and CYP21 involved in steroid hormone biosynthesis". Biochemistry. Biokhimiia. 77 (6): 585–92. doi:10.1134/S0006297912060041. PMID 22817457. S2CID 18927484.
- ^ a b c ENSG00000231852, ENSG00000206338, ENSG00000233151, ENSG00000232414, ENSG00000235134 GRCh38: Ensembl release 89: ENSG00000198457, ENSG00000231852, ENSG00000206338, ENSG00000233151, ENSG00000232414, ENSG00000235134 - Ensembl, May 2017
- ^ a b c GRCm38: 앙상블 릴리즈 89: ENSMUSG00000024365 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^
 이 기사는 다음과 같은 퍼블릭 도메인 자료를 포함합니다.
이 기사는 다음과 같은 퍼블릭 도메인 자료를 포함합니다. - ^ Baumgartner-Parzer S, Witsch-Baumgartner M, Hoeppner W (October 2020). "EMQN best practice guidelines for molecular genetic testing and reporting of 21-hydroxylase deficiency". European Journal of Human Genetics. 28 (10): 1341–1367. doi:10.1038/s41431-020-0653-5. PMC 7609334. PMID 32616876. S2CID 220295067.
- ^ Higashi Y, Yoshioka H, Yamane M, Gotoh O, Fujii-Kuriyama Y (May 1986). "Complete nucleotide sequence of two steroid 21-hydroxylase genes tandemly arranged in human chromosome: a pseudogene and a genuine gene". Proceedings of the National Academy of Sciences of the United States of America. 83 (9): 2841–5. Bibcode:1986PNAS...83.2841H. doi:10.1073/pnas.83.9.2841. PMC 323402. PMID 3486422.
- ^ Concolino P, Rizza R, Costella A, Carrozza C, Zuppi C, Capoluongo E (June 2017). "CYP21A2 intronic variants causing 21-hydroxylase deficiency". Metabolism: Clinical and Experimental. 71: 46–51. doi:10.1016/j.metabol.2017.03.003. PMID 28521877.
- ^ Witek, Jennifer; Mohiuddin, Shamim S. (2023), "Biochemistry, Pseudogenes", StatPearls, Treasure Island (FL): StatPearls Publishing, PMID 31751022, retrieved 2023-11-27
- ^ a b c Parker KL, Chaplin DD, Wong M, Seidman JG, Smith JA, Schimmer BP (December 1985). "Expression of murine 21-hydroxylase in mouse adrenal glands and in transfected Y1 adrenocortical tumor cells". Proceedings of the National Academy of Sciences of the United States of America. 82 (23): 7860–4. Bibcode:1985PNAS...82.7860P. doi:10.1073/pnas.82.23.7860. PMC 390869. PMID 2999780.
- ^ Shiina T, Shimizu S, Hosomichi K, Kohara S, Watanabe S, Hanzawa K, et al. (June 2004). "Comparative genomic analysis of two avian (quail and chicken) MHC regions". Journal of Immunology. 172 (11): 6751–63. doi:10.4049/jimmunol.172.11.6751. PMID 15153492.
- ^ a b Yu CY (1999). "Molecular genetics of the human MHC complement gene cluster". Experimental and Clinical Immunogenetics. 15 (4): 213–230. doi:10.1159/000019075. PMID 10072631. S2CID 25061446.
- ^ White PC, Grossberger D, Onufer BJ, Chaplin DD, New MI, Dupont B, Strominger JL (February 1985). "Two genes encoding steroid 21-hydroxylase are located near the genes encoding the fourth component of complement in man". Proceedings of the National Academy of Sciences of the United States of America. 82 (4): 1089–1093. Bibcode:1985PNAS...82.1089W. doi:10.1073/pnas.82.4.1089. PMC 397199. PMID 2983330.
- ^ Xie T, Rowen L, Aguado B, Ahearn ME, Madan A, Qin S, et al. (December 2003). "Analysis of the gene-dense major histocompatibility complex class III region and its comparison to mouse". Genome Research. 13 (12): 2621–2636. doi:10.1101/gr.1736803. PMC 403804. PMID 14656967.
- ^ a b c d Bánlaki Z, Doleschall M, Rajczy K, Fust G, Szilágyi A (October 2012). "Fine-tuned characterization of RCCX copy number variants and their relationship with extended MHC haplotypes". Genes and Immunity. 13 (7): 530–535. doi:10.1038/gene.2012.29. PMID 22785613. S2CID 36582994.
- ^ a b Carrozza C, Foca L, De Paolis E, Concolino P (2021). "Genes and Pseudogenes: Complexity of the RCCX Locus and Disease". Frontiers in Endocrinology. 12: 709758. doi:10.3389/fendo.2021.709758. PMC 8362596. PMID 34394006.
- ^ Sweeten TL, Odell DW, Odell JD, Torres AR (January 2008). "C4B null alleles are not associated with genetic polymorphisms in the adjacent gene CYP21A2 in autism". BMC Medical Genetics. 9: 1. doi:10.1186/1471-2350-9-1. PMC 2265260. PMID 18179706.
- ^ Milner CM, Campbell RD (August 2001). "Genetic organization of the human MHC class III region". Frontiers in Bioscience. 6: D914–D926. doi:10.2741/milner. PMID 11487476.
- ^ Kim JH, Kim GH, Yoo HW, Choi JH (June 2023). "Molecular basis and genetic testing strategies for diagnosing 21-hydroxylase deficiency, including CAH-X syndrome". Annals of Pediatric Endocrinology & Metabolism. 28 (2): 77–86. doi:10.6065/apem.2346108.054. PMC 10329939. PMID 37401054.
- ^ a b c Bánlaki Z, Szabó JA, Szilágyi Á, Patócs A, Prohászka Z, Füst G, Doleschall M (2013). "Intraspecific evolution of human RCCX copy number variation traced by haplotypes of the CYP21A2 gene". Genome Biol Evol. 5 (1): 98–112. doi:10.1093/gbe/evs121. PMC 3595039. PMID 23241443.
- ^ Tsai LP, Lee HH (September 2012). "Analysis of CYP21A1P and the duplicated CYP21A2 genes". Gene. 506 (1): 261–262. doi:10.1016/j.gene.2012.06.045. PMID 22771554.
- ^ a b Arriba M, Ezquieta B (2022). "Molecular Diagnosis of Steroid 21-Hydroxylase Deficiency: A Practical Approach". Front Endocrinol. 13: 834549. doi:10.3389/fendo.2022.834549. PMC 9001848. PMID 35422767.
- ^ a b c Karaoğlan M, Nacarkahya G, Aytaç EH, Keskin M (November 2021). "Challenges of CYP21A2 genotyping in children with 21-hydroxylase deficiency: determination of genotype-phenotype correlation using next generation sequencing in Southeastern Anatolia". J Endocrinol Invest. 44 (11): 2395–2405. doi:10.1007/s40618-021-01546-z. PMID 33677812. S2CID 232133292.
- ^ Xu Z, Chen W, Merke DP, McDonnell NB (November 2013). "Comprehensive mutation analysis of the CYP21A2 gene: an efficient multistep approach to the molecular diagnosis of congenital adrenal hyperplasia". J Mol Diagn. 15 (6): 745–53. doi:10.1016/j.jmoldx.2013.06.001. PMC 5803549. PMID 24071710.
- ^ "Polymerase Chain Reaction (PCR) Fact Sheet". Genome.gov.
- ^ "Southern blotting — Knowledge Hub". GeNotes.
- ^ Guo X, Zhang Y, Yu Y, Zhang L, Ullah K, Ji M, Jin B, Shu J (2023). "Corrigendum: Getting pregnant with congenital adrenal hyperplasia: assisted reproduction and pregnancy complications. A systematic review and meta-analysis". Front Endocrinol. 14: 1269711. doi:10.3389/fendo.2023.1269711. PMC 10575760. PMID 37842302.
- ^ Adachi E, Nakagawa R, Tsuji-Hosokawa A, Gau M, Kirino S, Yogi A, Nakatani H, Takasawa K, Yamaguchi T, Kosho T, Murakami M, Tajima T, Hasegawa T, Yamada T, Morio T, Ohara O, Kashimada K (October 2023). "A MinION-Based Long-Read Sequencing Application with One-Step PCR for the Genetic Diagnosis of 21-Hydroxylase Deficiency". J Clin Endocrinol Metab. doi:10.1210/clinem/dgad577. PMID 37804107. S2CID 263742489.
- ^ Zhang, X.; Gao, Y.; Lu, L.; Cao, Y.; Zhang, W.; Sun, B.; Wu, X.; Tong, A.; Chen, S.; Wang, X.; Mao, J.; Nie, M. (2023). "Targeted long-read sequencing for comprehensive detection of CYP21A2 mutations in patients with 21-hydroxylase deficiency". Journal of Endocrinological Investigation. doi:10.1007/s40618-023-02197-y. PMID 37815751. S2CID 263800944.
- ^ "Steroid 21-hydroxylase DrugBank Online". go.drugbank.com. Retrieved 2023-11-27.
- ^ Werck-Reichhart D, Feyereisen R (2000). "Cytochromes P450: a success story". Genome Biology. 1 (6): REVIEWS3003. doi:10.1186/gb-2000-1-6-reviews3003. PMC 138896. PMID 11178272.
- ^ Zhao B, Lei L, Kagawa N, Sundaramoorthy M, Banerjee S, Nagy LD, Guengerich FP, Waterman MR (March 2012). "Three-dimensional structure of steroid 21-hydroxylase (cytochrome P450 21A2) with two substrates reveals locations of disease-associated variants". The Journal of Biological Chemistry. 287 (13): 10613–22. doi:10.1074/jbc.M111.323501. PMC 3323056. PMID 22262854.
- ^ a b Graham SE, Peterson JA (2002). "Sequence alignments, variabilities, and vagaries". Cytochrome P450 Part C. Methods in Enzymology. Vol. 357. Academic Press. pp. 15–28. doi:10.1016/s0076-6879(02)57661-8. ISBN 9780121822606. PMID 12424893.
- ^ Baker ME, Nelson DR, Studer RA (July 2015). "Origin of the response to adrenal and sex steroids: Roles of promiscuity and co-evolution of enzymes and steroid receptors". J Steroid Biochem Mol Biol. 151: 12–24. doi:10.1016/j.jsbmb.2014.10.020. PMID 25445914. S2CID 21649057.
- ^ Barany A, Shaughnessy CA, McCormick SD (March 2021). "Corticosteroid control of Na+/K+-ATPase in the intestine of the sea lamprey (Petromyzon marinus)". General and Comparative Endocrinology. 307: 113756. doi:10.1016/j.ygcen.2021.113756. PMID 33741310. S2CID 232296805.
- ^ a b Cameron PU, Tabarias HA, Pulendran B, Robinson W, Dawkins RL (1990). "Conservation of the central MHC genome: PFGE mapping and RFLP analysis of complement, HSP70, and TNF genes in the goat". Immunogenetics. 31 (4): 253–64. doi:10.1007/BF00204897. PMID 1970334. S2CID 22716959.
- ^ Kawashima A, Satta Y (2014). "Substrate-dependent evolution of cytochrome P450: rapid turnover of the detoxification-type and conservation of the biosynthesis-type". PLOS ONE. 9 (6): e100059. Bibcode:2014PLoSO...9j0059K. doi:10.1371/journal.pone.0100059. PMC 4076195. PMID 24977709.
- ^ Auchus RJ, Miller WL (2015). "P450 Enzymes in Steroid Processing". Cytochrome P450: Structure, Mechanism, and Biochemistry (Fourth ed.). Springer International Publishing. pp. 851–879. doi:10.1007/978-3-319-12108-6_12. ISBN 978-3-319-12107-9.
- ^ Korzekwa, Ken (2014). "Enzyme Kinetics of Oxidative Metabolism: Cytochromes P450". Enzyme Kinetics in Drug Metabolism. Methods in Molecular Biology (Clifton, N.J.). Vol. 1113. pp. 149–166. doi:10.1007/978-1-62703-758-7_8. ISBN 978-1-62703-757-0. ISSN 1940-6029. PMID 24523112.
- ^ "Tissue expression of CYP21A2". The Human Protein Atlas.
- ^ "CYP21A2 Subcellular RNA expression". The Human Protein Atlas.
- ^ Araújo RS, Mendonca BB, Barbosa AS, Lin CJ, Marcondes JA, Billerbeck AE, Bachega TA (October 2007). "Microconversion between CYP21A2 and CYP21A1P promoter regions causes the nonclassical form of 21-hydroxylase deficiency". The Journal of Clinical Endocrinology and Metabolism. 92 (10): 4028–34. doi:10.1210/jc.2006-2163. PMID 17666484.
- ^ a b c d e f g h Speiser PW, Arlt W, Auchus RJ, Baskin LS, Conway GS, Merke DP, et al. (November 2018). "Congenital Adrenal Hyperplasia Due to Steroid 21-Hydroxylase Deficiency: An Endocrine Society Clinical Practice Guideline". The Journal of Clinical Endocrinology and Metabolism. 103 (11): 4043–4088. doi:10.1210/jc.2018-01865. PMC 6456929. PMID 30272171.
- ^ a b Auchus RJ, Sampath Kumar A, Andrew Boswell C, Gupta MK, Bruce K, Rath NP, Covey DF (January 2003). "The enantiomer of progesterone (ent-progesterone) is a competitive inhibitor of human cytochromes P450c17 and P450c21". Archives of Biochemistry and Biophysics. 409 (1): 134–44. doi:10.1016/s0003-9861(02)00491-5. PMID 12464252.
- ^ Rosenfeld G, Ungar F, Dorfman RI, Pincus G (1955). "Irradiation and adrenal steroidogenesis: steroid transformations by irradiated isolated perfused calf adrenals". Endocrinology. 56 (1): 24–9. doi:10.1210/endo-56-1-24. PMID 13220521.
- ^ Dorfman RI, Hayano M (March 1952). "The action of adrenal homogenates on progesterone, 17-hydroxyprogesterone and 21-desoxycortisone". Archives of Biochemistry and Biophysics. 36 (1): 237–9. doi:10.1016/0003-9861(52)90397-4. PMID 14934270.
- ^ Lorence MC, Trant JM, Mason JI, Bhasker CR, Fujii-Kuriyama Y, Estabrook RW, Waterman MR (August 1989). "Expression of a full-length cDNA encoding bovine adrenal cytochrome P450C21". Archives of Biochemistry and Biophysics. 273 (1): 79–88. doi:10.1016/0003-9861(89)90164-1. PMID 2502949.
- ^ Wu DA, Hu MC, Chung BC (April 1991). "Expression and functional study of wild-type and mutant human cytochrome P450c21 in Saccharomyces cerevisiae". DNA and Cell Biology. 10 (3): 201–9. doi:10.1089/dna.1991.10.201. PMID 1707279.
- ^ "NCBI: CYP21A2 cytochrome P450 family 21 subfamily A member 2". National Center for Biotechnology Information. Retrieved 30 November 2020.
This gene encodes a member of the cytochrome P450 superfamily of enzymes. The cytochrome P450 proteins are monooxygenases which catalyze many reactions involved in drug metabolism and synthesis of cholesterol, steroids and other lipids. This protein localizes to the endoplasmic reticulum and hydroxylates steroids at the 21 position. Its activity is required for the synthesis of steroid hormones including cortisol and aldosterone. Mutations in this gene cause congenital adrenal hyperplasia. A related pseudogene is located near this gene; gene conversion events involving the functional gene and the pseudogene are thought to account for many cases of steroid 21-hydroxylase deficiency. Two transcript variants encoding different isoforms have been found for this gene.
 이 문서는 공용 도메인에 있는 이 소스의 텍스트를 통합합니다.
이 문서는 공용 도메인에 있는 이 소스의 텍스트를 통합합니다. - ^ a b c d Merke DP, Auchus RJ (September 2020). "Congenital Adrenal Hyperplasia Due to 21-Hydroxylase Deficiency". The New England Journal of Medicine. 383 (13): 1248–1261. doi:10.1056/NEJMra1909786. PMID 32966723. S2CID 221884108.
- ^ a b Miller WL, Auchus RJ (February 2011). "The molecular biology, biochemistry, and physiology of human steroidogenesis and its disorders". Endocrine Reviews. 32 (1): 81–151. doi:10.1210/er.2010-0013. PMC 3365799. PMID 21051590.
- ^ Sharquie KE, Noaimi AA, Saleh BO, Anbar ZN (December 2009). "The frequency of 21-alpha hydroxylase enzyme deficiency and related sex hormones in Iraqi healthy male subjects versus patients with acne vulgaris". Saudi Medical Journal. 30 (12): 1547–50. PMID 19936418.
- ^ Falhammar H, Nordenström A (September 2015). "Nonclassic congenital adrenal hyperplasia due to 21-hydroxylase deficiency: clinical presentation, diagnosis, treatment, and outcome". Endocrine. 50 (1): 32–50. doi:10.1007/s12020-015-0656-0. PMID 26082286. S2CID 23469344.
- ^ New MI (November 2006). "Extensive clinical experience: nonclassical 21-hydroxylase deficiency". The Journal of Clinical Endocrinology and Metabolism. 91 (11): 4205–14. doi:10.1210/jc.2006-1645. PMID 16912124.
Loss of scalp hair in females and males is embarrassing, requiring treatment with 5α-reductase inhibitors
- ^ Feingold KR, Anawalt B, Boyce A, Chrousos G, de Herder WW, Dungan K, Grossman A, Hershman JM, Hofland J, Kaltsas G, Koch C, Kopp P, Korbonits M, McLachlan R, Morley JE, New M, Purnell J, Singer F, Stratakis CA, Trence DL, Wilson DP, Yau M, Gujral J, New MI (April 2019). Congenital Adrenal Hyperplasia: Diagnosis and Emergency Treatment. MDText.com. PMID 25905311.
- ^ Witchel SF, Azziz R (2010). "Nonclassic congenital adrenal hyperplasia". International Journal of Pediatric Endocrinology. 2010: 625105. doi:10.1155/2010/625105. PMC 2910408. PMID 20671993.
- ^ Berry V, Pontikos N, Ionides A, Kalitzeos A, Quinlan RA, Michaelides M (April 2022). "Pathogenic variants in the CYP21A2 gene cause isolated autosomal dominant congenital posterior polar cataracts". Ophthalmic Genet. 43 (2): 218–223. doi:10.1080/13816810.2021.1998556. PMID 34748434. S2CID 243861798.
- ^ a b c d e Miller WL, White PC (January 2023). "History of Adrenal Research: From Ancient Anatomy to Contemporary Molecular Biology". Endocr Rev. 44 (1): 70–116. doi:10.1210/endrev/bnac019. PMC 9835964. PMID 35947694.
- ^ Yamazaki, Hiroshi, ed. (2014). Fifty Years of Cytochrome P450 Research. doi:10.1007/978-4-431-54992-5. ISBN 978-4-431-54991-8. S2CID 27237884.
- ^ Miller WL (2020). "Tenascin-X-Discovery and Early Research". Front Immunol. 11: 612497. doi:10.3389/fimmu.2020.612497. PMC 7829301. PMID 33505400.
외부 링크
- 21-하이드록실라제 결핍 선천성 부신 비대증에 대한 Gene Reviews/NCBI/NIH/UW 항목
- 21-하이드록실라제 결핍 선천성 부신 비대증에 대한 OMIM 진입
- 프로게스테론으로부터 데옥시코르티코스테론의 합성 21-하이드록실라제 (이미지) 웨이백 머신에서 보관된 2021-04-26
- 미국 국립 의학 도서관의 스테로이드+21-하이드록실라제 (MeSH)
- UCSC Genome Browser(UCSC 게놈 브라우저)에서 인간 CPS1 유전자 위치 및 CPS1 유전자 세부 정보 페이지.
- 인간 CYP21A2 유전체 위치 및 CYP21A2 유전자 상세 페이지는 UCSC 유전체 브라우저에서 확인할 수 있습니다.
- PDBe-KB의 UniProt: P08686(스테로이드 21-하이드록실라제)용 PDB에서 사용할 수 있는 모든 구조 정보 개요.
이 기사는 공공 영역에 있는 미국 국립 의학 도서관의 텍스트를 통합합니다.