라노스테롤합성효소
Lanosterol synthase| 라노스테롤합성효소 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 식별자 | |||||||||
| EC 번호 | 5.4.99.7 | ||||||||
| CAS 번호 | 9032-71-7 | ||||||||
| 데이터베이스 | |||||||||
| 인텐츠 | IntEnz 뷰 | ||||||||
| 브렌다 | 브렌다 엔트리 | ||||||||
| ExPASy | NiceZyme 뷰 | ||||||||
| 케그 | KEGG 엔트리 | ||||||||
| 메타사이크 | 대사 경로 | ||||||||
| 프라이머리 | 프로필 | ||||||||
| PDB 구조 | RCSB PDB PDBe PDBum | ||||||||
| 진 온톨로지 | AmiGO / QuickGO | ||||||||
| |||||||||
| LSS | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| 식별자 | |||||||||||||||||||||||||
| 에일리어스 | LSS, OSC, CTRCT44, 라노스테롤합성효소(2,3-옥시도스퀄렌-라노스테롤시클라아제), 라노스테롤합성효소, HYPT14, APMR4 | ||||||||||||||||||||||||
| 외부 ID | OMIM: 600909 MGI: 1336155 HomoloGene: 37408 GeneCard: LSS | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| 맞춤법 | |||||||||||||||||||||||||
| 종. | 인간 | 마우스 | |||||||||||||||||||||||
| 엔트레즈 | |||||||||||||||||||||||||
| 앙상블 | |||||||||||||||||||||||||
| 유니프로트 | |||||||||||||||||||||||||
| RefSeq(mRNA) | |||||||||||||||||||||||||
| RefSeq(단백질) | |||||||||||||||||||||||||
| 장소(UCSC) | Chr 21: 46.19 ~46.23 Mb | Chr 10: 76.37 ~76.39 Mb | |||||||||||||||||||||||
| PubMed 검색 | [3] | [4] | |||||||||||||||||||||||
| 위키데이터 | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
라노스테롤 합성효소(EC 5.4.99.7)는 (S)-2,3-옥시도스칼렌을 프로토스테롤 양이온으로 변환하고 최종적으로 라노스테롤로 [5]변환하는 산화도스칼렌 사이클라아제(OSC) 효소이다.라노스테롤은 콜레스테롤 [6][7]생합성의 핵심 네 고리 중간체이다.인간에서 라노스테롤 합성효소는 LSS [8][9]유전자에 의해 암호화된다.
진핵생물에서 라노스테롤 합성효소는 소포체의 [10]세포측과 관련된 일체형 단조 단백질이다.몇몇 증거는 효소가 그것을 생산하는 [11]몇 안 되는 원핵생물에서 용해성, 비막 결합 단백질이라는 것을 암시한다.
콜레스테롤 생합성에 있어 효소의 역할로 인해 기존 스타틴을 [12]보완하기 위해 잠재적 콜레스테롤 감소 약물로 라노스테롤 합성효소 억제제에 관심이 있다.
메커니즘
비록 그 메커니즘에 대한 일부 데이터가 자살 억제제, 돌연변이 유발 연구, 그리고 호몰로지 모델링의 사용으로 얻어졌지만, 그 효소가 어떻게 라노스테롤의 [12]형성을 촉매하는지는 아직 완전히 이해되지 않았다.
초기 에폭시드 양성자화 및 링 개방
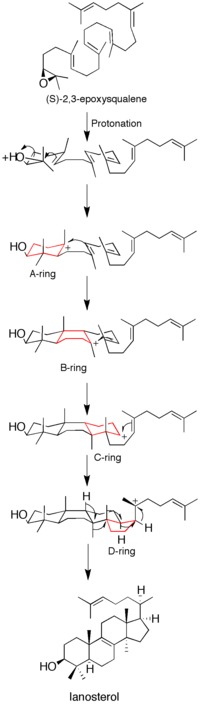
단백질의 X선 결정 구조를 획득하기 전에 부위 지향 돌연변이 유발을 사용하여 효소의 촉매 활성에 중요한 잔류물을 확인하였다.효소 기능에 아스파라긴산 잔기(D455)와 히스티딘 잔기(H146, H234) 2개가 필수인 것으로 파악되었다.코리 등아스파라긴산이 기질의 에폭시드 고리를 양성자화함으로써 분자 내 공격에 대한 감수성을 증가시켜 H146이 수소 [13]결합을 통해 아스파라긴산의 양성자 공여 능력을 강화시킬 수 있다는 가설을 세웠다.효소의 X선 결정 구조를 획득한 후, 기질의 에폭시드에 대한 양성자 공여체로서의 D455의 역할이 확인되었지만, D455는 이전에 제안된 히스티딘의 [12]2개의 시스테인 잔기(C456 및 C533)로부터의 수소 결합에 의해 안정화될 가능성이 더 높은 것으로 확인되었다.
링 형성 캐스케이드
에폭시드 양성자는 기질을 활성화하여 일련의 링 형성 반응을 일으킵니다.총 4개의 고리(A~D)가 형성되어 콜레스테롤 [12]골격을 생성한다.과거에도 네 개의 고리가 모두 결합되어 형성된다는 생각이 제기되었지만, (S)-2,3-옥시도스칼렌 아날로그를 사용한 역학 연구에 따르면 제품 형성은 이산 카르보케이션 중간체를 통해 달성된다(그림 1 참조).라노스테롤 합성효소 돌연변이로부터 단환식 및 이환식 생성물의 분리는 결합 메커니즘의 [14][15]가설을 더욱 약화시켰다.단,[16] 에폭시드 고리의 개구부와 A 고리의 형성이 일치하고 있는 것을 알 수 있습니다.
구조.
라노스테롤 합성효소는 2개의 연결된 (α/α) 배럴 도메인과 3개의 작은 β 구조로 구성된 2개의 도메인 단량체[10] 단백질이다.효소 활성 부위는 단백질의 중심에 있으며, 제한된 통로에 의해 차단됩니다.(S)-2,3-에폭시스퀄렌 기질이 채널을 통과하려면 단백질 배좌의 변화가 필요하다.진핵생물에서 소수성 표면(전체 효소 표면적의 6%)은 ER막 결합 영역이다(그림 [12]2 참조).
이 효소는 Gln-Trp 모티브를 포함하는 5개의 지문 영역을 포함하며, 매우 유사한 박테리아 효소 스쿠알렌-호펜 사이클라아제에도 [12]존재한다.이러한 지문 영역의 잔류물은 [17]효소에 의해 촉매되는 고발기성 환화 반응 동안 효소 안정성에 기여하는 것으로 생각되는 쌓인 곁사슬을 포함한다.
기능.
라노스테롤 생성 촉매 작용
라노스테롤 합성효소는 (S)-2,3-에폭시스퀄렌을 콜레스테롤 [6][7]생합성의 핵심 4고리 중간체인 라노스테롤로 변환하는 것을 촉매한다.따라서 에스트로겐, 안드로겐, 프로게스토겐, 글루코코르티코이드, 미네랄코르티코이드 및 신경스테로이드의 전구체를 제공한다.진핵생물에서 효소는 소포체막의 [10]세포 쪽에 결합되어 있다.콜레스테롤 합성은 대부분 진핵생물과 관련이 있지만, 라노스테롤 합성효소를 발현하는 원핵생물은 거의 발견되지 않았다; 그것은 Methyloccus [11]capsulatus에서 가용성 단백질로 발견되었다.
에폭시아노스테롤 생성 촉매 작용
라노스테롤 합성효소는 또한 2,3;22,23-디옥시시스퀄렌을 24(S),25-에폭시아노스테롤로 [18]환화시키고, 나중에 24(S),25-에폭시콜레스테롤로 [19]전환한다.이 제2기질에 대한 효소 친화력이 모노에폭시(S)-2,3-에폭시스칼렌보다 크므로 2,3;22,23-디옥시스칼렌을 24(S)로 부분억제 변환했을 때 라노스테롤 [20]합성보다 25-에폭시슬라노스테롤이 바람직하다.이것은 질병 예방과 치료와 관련이 있다.
임상적 의의
콜레스테롤 강하제로서의 효소 억제제
혈중 콜레스테롤을 낮추고 아테롬성 경화증을 치료하기 위한 약물로 라노스테롤 합성효소 억제제에 대한 관심이 높아지고 있다.현재 널리 사용되는 스타틴 약물은 HMG-CoA 환원효소 [6]활성을 억제함으로써 LDL(저밀도 리포단백질) 콜레스테롤을 낮추는 데 사용된다.이 효소는 (S)-2,3-에폭시스퀄렌 및 콜레스테롤의 훨씬 상류에서 전구체 형성을 촉매하기 때문에 스타틴은 다른 생합성 경로에 필요한 중간체 양(예를 들어 이소프레노이드, 코엔자임 Q의 합성)에 부정적인 영향을 미칠 수 있다.따라서, HMG-CoA 환원효소보다 콜레스테롤 생합성과 더 밀접하게 관련된 라노스테롤 합성효소는 매력적인 약물 [21]대상이다.
라노스테롤 합성효소 억제제는 이중 조절 메커니즘에 의해 LDL과 VLDL 콜레스테롤을 낮추는 것으로 생각됩니다.라노스테롤 합성효소가 부분적으로 억제된 연구는 라노스테롤 형성의 직접적인 감소와 HMG-CoA 환원효소 활성의 감소를 모두 보여주었다.부분 라노스테롤 합성효소 억제 중 라노스테롤 위에 우선적으로 형성되는 옥시스테롤 24(S), 25-에폭시아노스테롤은 HMG-CoA 환원효소 활성의 [22]저해를 일으키는 것으로 생각된다.
진화
산화수질환원효소(OSCs, 라노스테롤환원효소가 속한 클래스)는 호파노이드 형성과 관련된 박테리아 스쿠알렌-호펜환원효소(SHC)에서 진화한 것으로 생각된다.다양한 유기체의 OSC의 아미노산 배열로 구성된 계통수는 하나의 공통 조상을 나타내며, 합성 경로는 단 [23]한 번만 진화하였다.호주 필바라크라톤에서 27억 년 된 셰일즈에서 콜레스탄을 포함한 스테란이 발견된 것은 OSC와 복잡한 스테로이드 기구를 가진 진핵생물들이 지구 [24]역사 초기에 존재했음을 시사한다.
레퍼런스
- ^ a b c ENSG00000281289 GRCh38: 앙상블 릴리즈 89: ENSG00000160285, ENSG00000281289: Ensembl, 2017년 5월
- ^ a b c GRCm38: 앙상블 릴리즈 89: ENSMUSG000033105 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Dean PD, Ortiz de Montellano PR, Bloch K, Corey EJ (Jun 1967). "A soluble 2,3-oxidosqualene sterol cyclase". The Journal of Biological Chemistry. 242 (12): 3014–5. doi:10.1016/S0021-9258(18)99606-7. PMID 6027261.
- ^ a b c Huff MW, Telford DE (Jul 2005). "Lord of the rings--the mechanism for oxidosqualene:lanosterol cyclase becomes crystal clear". Trends in Pharmacological Sciences. 26 (7): 335–340. doi:10.1016/j.tips.2005.05.004. PMID 15951028.
- ^ a b Yamamoto S, Lin K, Bloch K (May 1969). "Some properties of the microsomal 2,3-oxidosqualene sterol cyclase". Proceedings of the National Academy of Sciences of the United States of America. 63 (1): 110–7. Bibcode:1969PNAS...63..110Y. doi:10.1073/pnas.63.1.110. PMC 534008. PMID 5257956.
- ^ Baker CH, Matsuda SP, Liu DR, Corey EJ (Aug 1995). "Molecular cloning of the human gene encoding lanosterol synthase from a liver cDNA library". Biochemical and Biophysical Research Communications. 213 (1): 154–160. doi:10.1006/bbrc.1995.2110. PMID 7639730.
- ^ Young, Michele; Chen, Haiming; Lalioti, Maria D.; Antonarakis, Stylianos E. (May 1996). "The human lanosterol synthase gene maps to chromosome 21q22.3". Human Genetics. 97 (5): 620–624. doi:10.1007/BF02281872. PMID 8655142. S2CID 21051816.
- ^ a b c Ruf A, Müller F, D'Arcy B, Stihle M, Kusznir E, Handschin C, Morand OH, Thoma R (Mar 2004). "The monotopic membrane protein human oxidosqualene cyclase is active as monomer". Biochemical and Biophysical Research Communications. 315 (2): 247–254. doi:10.1016/j.bbrc.2004.01.052. PMID 14766201.
- ^ a b Lamb DC, Jackson CJ, Warrilow AG, Manning NJ, Kelly DE, Kelly SL (Aug 2007). "Lanosterol biosynthesis in the prokaryote Methylococcus capsulatus: insight into the evolution of sterol biosynthesis". Molecular Biology and Evolution. 24 (8): 1714–1721. doi:10.1093/molbev/msm090. PMID 17567593.
- ^ a b c d e f Thoma R, Schulz-Gasch T, D'Arcy B, Benz J, Aebi J, Dehmlow H, Hennig M, Stihle M, Ruf A (Nov 2004). "Insight into steroid scaffold formation from the structure of human oxidosqualene cyclase". Nature. 432 (7013): 118–122. Bibcode:2004Natur.432..118T. doi:10.1038/nature02993. PMID 15525992. S2CID 364281.
- ^ Corey EJ, Cheng CH, Baker CH, Matsuda SP, Li D, Song X (February 1997). "Studies on the Substrate Binding Segments and Catalytic Action of Lanosterol Synthase. Affinity Labeling with Carbocations Derived from Mechanism-Based Analogs of 2, 3-Oxidosqualene and Site-Directed Mutagenesis Probes". J. Am. Chem. Soc. 119 (6): 1289–96. doi:10.1021/ja963228o.
- ^ Wu TK, Wang TT, Chang CH, Liu YT, Shie WS (Nov 2008). "Importance of Saccharomyces cerevisiae oxidosqualene-lanosterol cyclase tyrosine 707 residue for chair-boat bicyclic ring formation and deprotonation reactions". Organic Letters. 10 (21): 4959–62. doi:10.1021/ol802036c. PMID 18842050.
- ^ Joubert BM, Hua L, Matsuda SP (Feb 2000). "Steric bulk at position 454 in Saccharomyces cerevisiae lanosterol synthase influences B-ring formation but not deprotonation". Organic Letters. 2 (3): 339–41. doi:10.1021/ol9912940. PMID 10814317.
- ^ Corey EJ, Cheng CH, Baker CH, Matsuda SP, Li D, Song X (February 1997). "Methodology for the Preparation of Pure Recombinant S. cerevisiae Lanosterol Synthase Using a Baculovirus Expression System. Evidence That Oxirane Cleavage and A-Ring Formation Are Concerted in the Biosynthesis of Lanosterol from 2,3-Oxidosqualene". J. Am. Chem. Soc. 119 (6): 1277–88. doi:10.1021/ja963227w.
- ^ Wendt KU, Poralla K, Schulz GE (Sep 1997). "Structure and function of a squalene cyclase". Science. 277 (5333): 1811–15. doi:10.1126/science.277.5333.1811. PMID 9295270.
- ^ Corey EJ, Gross SK (Aug 1967). "Formation of sterols by the action of 2,3-oxidosqualene-sterol cyclase on the factitious substrates 2,3:22,23-dioxidosqualene and 2,3-oxido-22,23-dihydrosqualene". Journal of the American Chemical Society. 89 (17): 4561–2. doi:10.1021/ja00993a079. PMID 6046552.
- ^ Nelson JA, Steckbeck SR, Spencer TA (Feb 1981). "Biosynthesis of 24,25-epoxycholesterol from squalene 2,3;22,23-dioxide". The Journal of Biological Chemistry. 256 (3): 1067–8. doi:10.1016/S0021-9258(19)69921-7. PMID 7451488.
- ^ Boutaud O, Dolis D, Schuber F (Oct 1992). "Preferential cyclization of 2,3(S):22(S),23-dioxidosqualene by mammalian 2,3-oxidosqualene-lanosterol cyclase". Biochemical and Biophysical Research Communications. 188 (2): 898–904. doi:10.1016/0006-291X(92)91140-L. PMID 1445330.
- ^ Telford DE, Lipson SM, Barrett PH, Sutherland BG, Edwards JY, Aebi JD, Dehmlow H, Morand OH, Huff MW (Dec 2005). "A novel inhibitor of oxidosqualene:lanosterol cyclase inhibits very low-density lipoprotein apolipoprotein B100 (apoB100) production and enhances low-density lipoprotein apoB100 catabolism through marked reduction in hepatic cholesterol content". Arteriosclerosis, Thrombosis, and Vascular Biology. 25 (12): 2608–14. doi:10.1161/01.ATV.0000189158.28455.94. PMID 16210564.
- ^ Panini SR, Gupta A, Sexton RC, Parish EJ, Rudney H (Oct 1987). "Regulation of sterol biosynthesis and of 3-hydroxy-3-methylglutaryl-coenzyme A reductase activity in cultured cells by progesterone". The Journal of Biological Chemistry. 262 (30): 14435–40. doi:10.1016/S0021-9258(18)47813-1. PMID 3667583.
- ^ Pearson A, Budin M, Brocks JJ (Dec 2003). "Phylogenetic and biochemical evidence for sterol synthesis in the bacterium Gemmata obscuriglobus". Proceedings of the National Academy of Sciences of the United States of America. 100 (26): 15352–7. Bibcode:2003PNAS..10015352P. doi:10.1073/pnas.2536559100. PMC 307571. PMID 14660793.
- ^ Brocks JJ, Logan GA, Buick R, Summons RE (Aug 1999). "Archean molecular fossils and the early rise of eukaryotes". Science. 285 (5430): 1033–6. CiteSeerX 10.1.1.516.9123. doi:10.1126/science.285.5430.1033. PMID 10446042.
추가 정보
- Roessler E, Mittaz L, Du Y, Scott HS, Chang J, Rossier C, Guipponi M, Matsuda SP, Muenke M, Antonarakis SE (Nov 1999). "Structure of the human Lanosterol synthase gene and its analysis as a candidate for holoprosencephaly (HPE1)". Human Genetics. 105 (5): 489–95. doi:10.1007/s004390051135. PMID 10598817.
- Ma J, Dempsey AA, Stamatiou D, Marshall KW, Liew CC (Mar 2007). "Identifying leukocyte gene expression patterns associated with plasma lipid levels in human subjects". Atherosclerosis. 191 (1): 63–72. doi:10.1016/j.atherosclerosis.2006.05.032. PMID 16806233.
- Beyea MM, Heslop CL, Sawyez CG, Edwards JY, Markle JG, Hegele RA, Huff MW (Feb 2007). "Selective up-regulation of LXR-regulated genes ABCA1, ABCG1, and APOE in macrophages through increased endogenous synthesis of 24(S),25-epoxycholesterol". The Journal of Biological Chemistry. 282 (8): 5207–16. doi:10.1074/jbc.M611063200. PMID 17186944.
- Dang H, Liu Y, Pang W, Li C, Wang N, Shyy JY, Zhu Y (Mar 2009). "Suppression of 2,3-oxidosqualene cyclase by high fat diet contributes to liver X receptor-alpha-mediated improvement of hepatic lipid profile". The Journal of Biological Chemistry. 284 (10): 6218–26. doi:10.1074/jbc.M803702200. PMC 2649084. PMID 19119143.
- Kimura K, Wakamatsu A, Suzuki Y, Ota T, Nishikawa T, Yamashita R, Yamamoto J, Sekine M, Tsuritani K, Wakaguri H, Ishii S, Sugiyama T, Saito K, Isono Y, Irie R, Kushida N, Yoneyama T, Otsuka R, Kanda K, Yokoi T, Kondo H, Wagatsuma M, Murakawa K, Ishida S, Ishibashi T, Takahashi-Fujii A, Tanase T, Nagai K, Kikuchi H, Nakai K, Isogai T, Sugano S (Jan 2006). "Diversification of transcriptional modulation: large-scale identification and characterization of putative alternative promoters of human genes". Genome Research. 16 (1): 55–65. doi:10.1101/gr.4039406. PMC 1356129. PMID 16344560.
- Sung CK, Shibuya M, Sankawa U, Ebizuka Y (Oct 1995). "Molecular cloning of cDNA encoding human lanosterol synthase". Biological & Pharmaceutical Bulletin. 18 (10): 1459–61. doi:10.1248/bpb.18.1459. PMID 8593458.
- Young M, Chen H, Lalioti MD, Antonarakis SE (May 1996). "The human lanosterol synthase gene maps to chromosome 21q22.3". Human Genetics. 97 (5): 620–4. doi:10.1007/BF02281872. PMID 8655142. S2CID 21051816.
- Peffley DM, Gayen AK, Morand OH (Aug 1998). "Down-regulation of 3-hydroxy-3-methylglutaryl coenzyme A reductase mRNA levels and synthesis in syrian hamster C100 cells by the oxidosqualene cyclase inhibitor [4'-(6-allyl-ethyl-amino-hexyloxy)-2'-fluoro-phenyl]-(4-bromophenyl)-me thanone (Ro 48-8071): comparison to simvastatin". Biochemical Pharmacology. 56 (4): 439–49. doi:10.1016/S0006-2952(98)00083-5. PMID 9763219.
- Lu Y, Dollé ME, Imholz S, van 't Slot R, Verschuren WM, Wijmenga C, Feskens EJ, Boer JM (Dec 2008). "Multiple genetic variants along candidate pathways influence plasma high-density lipoprotein cholesterol concentrations". Journal of Lipid Research. 49 (12): 2582–9. doi:10.1194/jlr.M800232-JLR200. PMID 18660489.
- Cheng J, Kapranov P, Drenkow J, Dike S, Brubaker S, Patel S, Long J, Stern D, Tammana H, Helt G, Sementchenko V, Piccolboni A, Bekiranov S, Bailey DK, Ganesh M, Ghosh S, Bell I, Gerhard DS, Gingeras TR (May 2005). "Transcriptional maps of 10 human chromosomes at 5-nucleotide resolution". Science. 308 (5725): 1149–54. Bibcode:2005Sci...308.1149C. doi:10.1126/science.1108625. PMID 15790807. S2CID 13047538.
- Pyrah IT, Kalinowski A, Jackson D, Davies W, Davis S, Aldridge A, Greaves P (2001). "Toxicologic lesions associated with two related inhibitors of oxidosqualene cyclase in the dog and mouse". Toxicologic Pathology. 29 (2): 174–9. doi:10.1080/019262301317052440. PMID 11421484. S2CID 38721319.
- Bonaldo MF, Lennon G, Soares MB (Sep 1996). "Normalization and subtraction: two approaches to facilitate gene discovery". Genome Research. 6 (9): 791–806. doi:10.1101/gr.6.9.791. PMID 8889548.
- Ruf A, Müller F, D'Arcy B, Stihle M, Kusznir E, Handschin C, Morand OH, Thoma R (Mar 2004). "The monotopic membrane protein human oxidosqualene cyclase is active as monomer". Biochemical and Biophysical Research Communications. 315 (2): 247–54. doi:10.1016/j.bbrc.2004.01.052. PMID 14766201.
- Mark M, Muller P, Maier R, Eisele B (Jan 1996). "Effects of a novel 2,3-oxidosqualene cyclase inhibitor on the regulation of cholesterol biosynthesis in HepG2 cells". Journal of Lipid Research. 37 (1): 148–58. doi:10.1016/S0022-2275(20)37643-4. PMID 8820110.