프로콜라겐프롤린디옥시게나아제
Procollagen-proline dioxygenase| 프로콜라겐프롤린디옥시게나아제 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
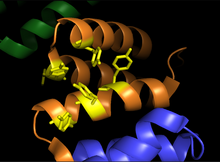
 프로콜라겐-프롤린 디옥시게나아제 알파 서브유닛.이미지는 기판 결합 영역(주황색)과 티로신 잔류물의 결합 홈(노란색)을 보여줍니다. | |||||||||
| 식별자 | |||||||||
| EC 번호 | 1.14.11.2 | ||||||||
| CAS 번호 | 9028-06-2 | ||||||||
| 데이터베이스 | |||||||||
| 인텐츠 | IntEnz 뷰 | ||||||||
| 브렌다 | 브렌다 엔트리 | ||||||||
| ExPASy | NiceZyme 뷰 | ||||||||
| 케그 | KEGG 엔트리 | ||||||||
| 메타사이크 | 대사 경로 | ||||||||
| 프라이머리 | 프로필 | ||||||||
| PDB 구조 | RCSB PDB PDBe PDBum | ||||||||
| 진 온톨로지 | AmiGO / QuickGO | ||||||||
| |||||||||
일반적으로 프롤릴 하이드록실라아제라고 알려진 프로콜라겐-프롤린 디옥실라아제는 알파-케토글루타르산 의존성 하이드록실라아제라고 알려진 효소 클래스의 구성원이다.이들 효소는 α-케토글루타르산,[1][2] Fe2+ 및 아스코르브산염이 필요한 메커니즘을 통해 유기 기질에 산소의 결합을 촉매한다.이 특정 효소는 인간 [3]프로테옴에서 가장 일반적인 번역 후 변형을 나타내는 화합물인 (2S, 4R)-4-히드록시프롤린의 형성을 촉매한다.
효소 메커니즘
프로콜라겐-프롤린 디옥시게나아제는 다음과 같은 반응을 촉매한다.
L-프롤린+α-케토글루타르산+O2 → (2S, 4R)-4-히드록시프롤린+숙신산+CO2
반응 메커니즘은 다른 다이옥시게나아제들의 메커니즘과 유사하며, 두 가지 뚜렷한 [3]단계에서 발생한다.우선 반응성이 높은 Fe(IV)=O종을 생성한다.분자산소는 축방향 위치에서 단방향으로 결합되어 다이옥시겐 단위를 생성한다.C2에 대한 친핵성 공격은 쌍산소 단위에서 이중 결합을 상실하고 2-옥소글루타르산염의 철 및 알파 카본에 결합하는 사면체 중간체를 생성한다.CO의 후속2 제거는 Fe(IV)=O종의 형성과 일치한다.두 번째 단계는 프롤린 기질의 C-4에서 프로R 수소 원자를 추상화한 후 히드록시프롤린을 생성하는 라디칼 조합을 [4]포함한다.
반응기구의 결과로 2-옥소글루타르산염 1분자가 탈탄산화되어 숙신산염이 된다.이 숙신산염은 각 반응 후에 가수분해되어 다른 2-옥소글루타르산염으로 대체되며, 2-옥소글루타르산염의 존재 하에서 효소2+ 결합 Fe가 Fe로 빠르게3+ 전환되어 [5]효소의 불활성화를 초래한다는 결론을 얻었다.Fe를 Fe로2+ 환원하는3+ 보조인자로 [6]아스코르브산염을 이용한다.
효소구조
프롤릴 하이드록실화효소는 2개의 고유한 서브유닛을 [7]가진 4분자체이다.α 서브유닛은 59kDa이며 펩타이드 결합과 촉매 [8]활성 모두를 담당한다.펩타이드 결합 도메인은 α 서브유닛의 [9]잔류물 140~215에 걸쳐 있으며, 프롤린이 풍부한 기질에 양호한 상호작용을 하는 여러 티로신 잔류물로 둘러싸인 오목한 표면으로 구성되어 있다.활성 부위는 히스티딘 잔기 2개와 아스파르트산 잔기 1개에 결합된 Fe2+로 구성되며, 대부분의 2-옥소글루타르산 의존성 디옥시게나아제들이 공유하는 특성이다.55kDa β 서브유닛은 효소가 소포체 [10]내에 위치하여 유지되는 역할을 한다.이 서브유닛은 단백질 이황화물 [11]이성질화효소로 알려진 효소와 동일하다.
생물학적 기능
프롤릴 하이드록실화효소는 히드록시프롤린의 형성을 촉매한다.수정은 [12]인체의 주요 결합 조직인 콜라겐의 안정성에 큰 영향을 미칩니다.구체적으로는 히드록실화는 헬리컬 콜라겐의 녹는 온도(Tm)를 16°C 증가시켜 체온에서 단백질이 안정적으로 유지되도록 하는 비히드록실화 [13]콜라겐과 비교한다.인간 내 콜라겐(전체 단백질의 약 1/3)이 풍부하고 콜라겐에서 이러한 변형이 많이 발생하기 때문에 히드록시프롤린은 양적으로 인간 [14]내 가장 풍부한 번역 후 변형이 된다.
이 효소는 X-Pro-Gly 모티브(Pro는 프롤린)에 포함된 프롤린에 특이하게 작용합니다.이러한 모티브 특이적 행동 때문에, 효소는 또한 이와 같은 동일한 서열을 포함하는 다른 단백질에 작용합니다.이러한 단백질에는 C1q,[15] 엘라스틴,[16] PrP,[17] Argonaute [18]2, 및 [19]코노톡신 등이 포함된다.
질병 관련성
프롤릴 하이드록실화효소는 [5]기능하기 위해 보조인자로 아스코르브산염이 필요하기 때문에, 그 부재는 효소의 활성을 저해한다.그 결과 수산화 감소는 괴혈병으로 알려진 질병으로 이어진다.괴혈병 환자는 콜라겐의 안정성이 떨어지기 때문에 자반, 자반, 잇몸 출혈을 일으키는 혈관 약화 등의 증상이 나타난다.
저산소 유도인자(HIF)는 세포가 [21]산소의 감소에 생리적으로 반응할 수 있도록 하는 진화적으로 보존된 전사인자이다[20].HIF에 특이적으로 작용하는 프롤릴 하이드록실화효소의 클래스가 확인되었다.[22] HIF의 하이드록실화는 단백질을 [22]분해 대상으로 할 수 있게 한다.HIF 프롤릴-히드록실화효소는 뇌졸중,[23][24] 신장병,[25] 허혈,[26] 빈혈 및 기타 중요한 질병을 치료하기 위한 다양한 억제제에 의해 표적이 되었다.
대체 이름
- 프로토콜라겐수산화효소
- 프롤릴수산화효소
- 프롤릴 4-히드록실화효소
- 프로토콜라겐프롤릴히드록실화효소
레퍼런스
- ^ Smith TG, Talbot NP (April 2010). "Prolyl hydroxylases and therapeutics". Antioxidants & Redox Signaling. 12 (4): 431–3. doi:10.1089/ars.2009.2901. PMID 19761407.
- ^ Hutton JJ, Trappel AL, Udenfriend S (July 1966). "Requirements for alpha-ketoglutarate, ferrous ion and ascorbate by collagen proline hydroxylase". Biochemical and Biophysical Research Communications. 24 (2): 179–84. doi:10.1016/0006-291x(66)90716-9. PMID 5965224.
- ^ a b Gorres KL, Raines RT (April 2010). "Prolyl 4-hydroxylase". Critical Reviews in Biochemistry and Molecular Biology. 45 (2): 106–24. doi:10.3109/10409231003627991. PMC 2841224. PMID 20199358.
- ^ Fujita Y, Gottlieb A, Peterkofsky B, Udenfriend S, Witkop B (1964). "The Preparation of cis- and trans-4-H3-L-Prolines and Their Use in Studying the Mechanism of Enzymatic Hydroxylation in Chick Embryos". Journal of the American Chemical Society. 86 (21): 4709–4716. doi:10.1021/ja01075a036.
- ^ a b de Jong L, Albracht SP, Kemp A (June 1982). "Prolyl 4-hydroxylase activity in relation to the oxidation state of enzyme-bound iron. The role of ascorbate in peptidyl proline hydroxylation". Biochimica et Biophysica Acta. 704 (2): 326–32. doi:10.1016/0167-4838(82)90162-5. PMID 6285984.
- ^ De Jong L, Kemp A (May 1984). "Stoicheiometry and kinetics of the prolyl 4-hydroxylase partial reaction". Biochimica et Biophysica Acta (BBA) - Protein Structure and Molecular Enzymology. 787 (1): 105–11. doi:10.1016/0167-4838(84)90113-4. PMID 6326839.
- ^ Berg RA, Prockop DJ (February 1973). "Affinity column purification of protocollagen proline hydroxylase from chick embryos and further characterization of the enzyme". The Journal of Biological Chemistry. 248 (4): 1175–82. doi:10.1016/S0021-9258(19)44278-6. PMID 4346946.
- ^ Helaakoski T, Vuori K, Myllylä R, Kivirikko KI, Pihlajaniemi T (June 1989). "Molecular cloning of the alpha-subunit of human prolyl 4-hydroxylase: the complete cDNA-derived amino acid sequence and evidence for alternative splicing of RNA transcripts". Proceedings of the National Academy of Sciences of the United States of America. 86 (12): 4392–6. Bibcode:1989PNAS...86.4392H. doi:10.1073/pnas.86.12.4392. PMC 287275. PMID 2543975.
- ^ Pekkala M, Hieta R, Bergmann U, Kivirikko KI, Wierenga RK, Myllyharju J (December 2004). "The peptide-substrate-binding domain of collagen prolyl 4-hydroxylases is a tetratricopeptide repeat domain with functional aromatic residues". The Journal of Biological Chemistry. 279 (50): 52255–61. doi:10.1074/jbc.M410007200. PMID 15456751.
- ^ Vuori K, Pihlajaniemi T, Myllylä R, Kivirikko KI (November 1992). "Site-directed mutagenesis of human protein disulphide isomerase: effect on the assembly, activity and endoplasmic reticulum retention of human prolyl 4-hydroxylase in Spodoptera frugiperda insect cells". The EMBO Journal. 11 (11): 4213–7. doi:10.1002/j.1460-2075.1992.tb05515.x. PMC 556932. PMID 1327760.
- ^ Pihlajaniemi T, Helaakoski T, Tasanen K, Myllylä R, Huhtala ML, Koivu J, Kivirikko KI (March 1987). "Molecular cloning of the beta-subunit of human prolyl 4-hydroxylase. This subunit and protein disulphide isomerase are products of the same gene". The EMBO Journal. 6 (3): 643–9. doi:10.1002/j.1460-2075.1987.tb04803.x. PMC 553446. PMID 3034602.
- ^ Shoulders MD, Raines RT (2009). "Collagen structure and stability". Annual Review of Biochemistry. 78: 929–58. doi:10.1146/annurev.biochem.77.032207.120833. PMC 2846778. PMID 19344236.
- ^ Berg RA, Prockop DJ (May 1973). "The thermal transition of a non-hydroxylated form of collagen. Evidence for a role for hydroxyproline in stabilizing the triple-helix of collagen". Biochemical and Biophysical Research Communications. 52 (1): 115–20. doi:10.1016/0006-291x(73)90961-3. PMID 4712181.
- ^ Gorres, Kelly L.; Raines, Ronald T. (April 2010). "Prolyl 4-hydroxylase". Critical Reviews in Biochemistry and Molecular Biology. 45 (2): 106–124. doi:10.3109/10409231003627991. PMC 2841224. PMID 20199358.
- ^ Müller W, Hanauske-Abel H, Loos M (October 1978). "Biosynthesis of the first component of complement by human and guinea pig peritoneal macrophages: evidence for an independent production of the C1 subunits". Journal of Immunology. 121 (4): 1578–84. PMID 701808.
- ^ Rosenbloom J, Cywinski A (June 1976). "Inhibition of proline hydroxylation does not inhibit secretion of tropoelastin by chick aorta cells". FEBS Letters. 65 (2): 246–50. doi:10.1016/0014-5793(76)80490-5. PMID 6335. S2CID 34210226.
- ^ Gill AC, Ritchie MA, Hunt LG, Steane SE, Davies KG, Bocking SP, Rhie AG, Bennett AD, Hope J (October 2000). "Post-translational hydroxylation at the N-terminus of the prion protein reveals presence of PPII structure in vivo". The EMBO Journal. 19 (20): 5324–31. doi:10.1093/emboj/19.20.5324. PMC 314005. PMID 11032800.
- ^ Qi HH, Ongusaha PP, Myllyharju J, Cheng D, Pakkanen O, Shi Y, Lee SW, Peng J, Shi Y (September 2008). "Prolyl 4-hydroxylation regulates Argonaute 2 stability". Nature. 455 (7211): 421–4. Bibcode:2008Natur.455..421Q. doi:10.1038/nature07186. PMC 2661850. PMID 18690212.
- ^ Daly NL, Craik DJ (February 2009). "Structural studies of conotoxins". IUBMB Life. 61 (2): 144–50. doi:10.1002/iub.158. PMID 19165896. S2CID 8678009.
- ^ Bacon NC, Wappner P, O'Rourke JF, Bartlett SM, Shilo B, Pugh CW, Ratcliffe PJ (August 1998). "Regulation of the Drosophila bHLH-PAS protein Sima by hypoxia: functional evidence for homology with mammalian HIF-1 alpha". Biochemical and Biophysical Research Communications. 249 (3): 811–6. doi:10.1006/bbrc.1998.9234. PMID 9731218.
- ^ Smith TG, Robbins PA, Ratcliffe PJ (May 2008). "The human side of hypoxia-inducible factor". British Journal of Haematology. 141 (3): 325–34. doi:10.1111/j.1365-2141.2008.07029.x. PMC 2408651. PMID 18410568.
- ^ a b Bruick RK, McKnight SL (November 2001). "A conserved family of prolyl-4-hydroxylases that modify HIF". Science. 294 (5545): 1337–40. Bibcode:2001Sci...294.1337B. doi:10.1126/science.1066373. PMID 11598268. S2CID 9695199.
- ^ Karuppagounder SS, Ratan RR (July 2012). "Hypoxia-inducible factor prolyl hydroxylase inhibition: robust new target or another big bust for stroke therapeutics?". Journal of Cerebral Blood Flow and Metabolism. 32 (7): 1347–61. doi:10.1038/jcbfm.2012.28. PMC 3390817. PMID 22415525.
- ^ Warnecke C, Griethe W, Weidemann A, Jürgensen JS, Willam C, Bachmann S, Ivashchenko Y, Wagner I, Frei U, Wiesener M, Eckardt KU (June 2003). "Activation of the hypoxia-inducible factor-pathway and stimulation of angiogenesis by application of prolyl hydroxylase inhibitors". FASEB Journal. 17 (9): 1186–8. doi:10.1096/fj.02-1062fje. PMID 12709400. S2CID 45194703.
- ^ Selvaraju V, Parinandi NL, Adluri RS, Goldman JW, Hussain N, Sanchez JA, Maulik N (June 2014). "Molecular mechanisms of action and therapeutic uses of pharmacological inhibitors of HIF-prolyl 4-hydroxylases for treatment of ischemic diseases". Antioxidants & Redox Signaling. 20 (16): 2631–65. doi:10.1089/ars.2013.5186. PMC 4026215. PMID 23992027.
- ^ Muchnik E, Kaplan J (May 2011). "HIF prolyl hydroxylase inhibitors for anemia". Expert Opinion on Investigational Drugs. 20 (5): 645–56. doi:10.1517/13543784.2011.566861. PMID 21406036. S2CID 21973130.
외부 링크
- 미국 국립 의학 도서관 의학 주제 제목(MeSH)의 프로콜라겐+디옥시게나아제
- PROSITE에서의 Fe(2+) 2-옥소글루타르산디옥시게나아제 도메인