티오라아제
Thiolase| 티오라아제, N말단 도메인 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 식별자 | |||||||||
| 기호. | 티오라아제_n | ||||||||
| 팜 | PF00108 | ||||||||
| 인터프로 | IPR002155 | ||||||||
| 프로 사이트 | PDOC00092 | ||||||||
| SCOP2 | 1pxt/SCOPe/SUPFAM | ||||||||
| CDD | cd00751 | ||||||||
| |||||||||
| 티오라아제, C말단 도메인 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 식별자 | |||||||||
| 기호. | 티오라아제_c | ||||||||
| 팜 | PF02803 | ||||||||
| 인터프로 | IPR002155 | ||||||||
| 프로 사이트 | PDOC00092 | ||||||||
| SCOP2 | 1pxt/SCOPe/SUPFAM | ||||||||
| |||||||||
아세틸-코엔자임 A 아세틸전달효소(ACAT)로도 알려진 티오라아제는 메발론산 경로에서 아세틸-CoA의 두 단위를 아세틸-CoA로 변환하는 효소이다.
티오라아제는 지방산 분해의 베타 산화 경로와 다양한 생합성 경로를 [1]포함한 많은 중요한 생화학 경로에서 중요한 역할을 하는 유비쿼터스 효소이다.티오라아제군의 구성원은 분해 티오라아제(EC 2.3.1.16)와 생합성 티오라아제(EC 2.3.1.9)의 두 가지 큰 범주로 나눌 수 있다.진핵생물 및 원핵생물 모두에서 아세토아세틸-CoA 티올라아제(EC:2.3.1.9)와 3-케토아실-CoA 티올라아제(EC:2.3.1.16). 3-케토아실-CoA 티올라아제(3-케토아세틸-CoA 티올라아제)의 두 가지 다른 유형이 발견된다.아세토아세틸-CoA 티오라아제(티오라아제 II라고도 함)는 아세토아세틸-CoA의 티오 분해에 특이하며, 베타-히드록시낙산 합성 또는 스테로이드 생물 생성과 같은 생합성 경로에 관여한다.
탄소-탄소 결합의 형성은 지방산과 폴리케티드가 만들어지는 생합성 경로의 핵심 단계이다.티오라아제 슈퍼패밀리 효소는 티오에스테르 의존성 클라이젠 응축[2] 반응 [3]메커니즘을 통해 탄소-탄소 결합 형성을 촉매한다.
기능.
티오라아제들은 진화적으로 관련된 효소들의 한 종류이다.진핵생물 및 원핵생물 모두에서 아세토아세틸-CoA 티오라아제(EC 2.3.1.9)와 3-케토아실-CoA 티오라아제(EC 2.3.1.16)의 두 가지 다른 타입의 티오라아제가[4][5][6] 발견되며, 3-케토아실-CoA 티오라아제는 광범위한 사슬을 가지고 있다.아세토아세틸-CoA 티오라아제(티오라아제 II라고도 함)는 아세토아세틸-CoA의 티오분해 작용에 특이적이며 폴리 베타-히드록시낙산 합성 또는 스테로이드 생물 생성과 같은 생합성 경로에 관여한다.
진핵생물에서 3-케토아실-CoA 티올라아제에는 미토콘드리아에 위치한 것과 페르옥시좀에 위치한 두 가지 형태가 있다.
티오라아제 활성에 중요한 두 개의 보존된 시스테인 잔기가 있다.효소의 N 말단 부분에 위치한 첫 번째 부분은 아실 효소 중간체 형성에 관여하고, 두 번째 부분은 응축 반응에서 탈양성자와 관련된 활성 부위 염기이다.
아이소자임
| EC 번호 | 이름. | 대행명 | 아이소자임 | 세포하 분포 |
|---|---|---|---|---|
| EC 2.3.1.9 | 아세틸CoAC-아세틸전달효소 | 티오라아제 II 아세토아세틸CoA티올라아제 | ACAT1 | 미토콘드리아 |
| ACAT2 | 세포질의 | |||
| EC 2.3.1.16 | 아세틸CoAC-아실전달효소 | 티오라아제 I; 3-케토아실-CoA 티오라아제 β-케토티오라아제 | ACAA1 | 과산화염색체 |
| ACAA2 | 미토콘드리아 | |||
| 하드 | 미토콘드리아 | |||
| EC 2.3.1.154 | 프로피오닐CoAC2-트리메틸트리데카노일전달효소 | 3-옥소프리스타노일-CoA티올라아제 | ||
| EC 2.3.1.174 | 3-옥소아디필CoA티올라아제 | β-케토아디필-CoA티올라아제 | ||
| EC 2.3.1.176 | 프로파노일CoAC-아실전달효소 | 페르옥시좀티오라아제2 | SCP2 | 과산화염색체/황산염색체 |
포유류의 비특이적 지질전달단백질(nsL-TP)은 14Kd 단백질(SCP-2)과 더 큰 58Kd 단백질(SCP-x)의 두 가지 다른 형태로 존재하는 것으로 보이는 단백질이다.전자는 세포질 또는 미토콘드리아에서 발견되며 지질 운반에 관여한다. 후자는 페르옥시좀에서 발견된다.SCP-x의 C 말단부는 SCP-2와 동일하지만 N 말단부는 [6]티오라아제와의 진화적 관계이다.
메커니즘
티오에스터는 산소 에스테르보다 반응성이 높고 지방산 [7]대사의 일반적인 중간체이다.이들 티오에스터는 지방산을 조효소 A(CoA) 또는 아실 캐리어 단백질(ACP)의 판테틴 부분의 유리 SH기와 결합함으로써 만들어진다.
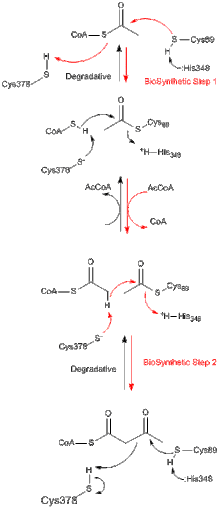
모든 티오라아제는 생합성 또는 생체내 분해에 관계없이 아세틸-CoA 및 단축된 아실-CoA 종을 형성하기 위해 3-케토아실-CoA의 분해를 우선적으로 촉매하지만 (분해의 음의 깁스 에너지 변화를 반영함) 역클라이젠 응축 반응을 촉매할 수도 있다.티올라아제).Z. ramigera의 생합성 티올라아제에 대한 연구로부터 티올라아제 반응이 두 단계로 일어나 탁구 [8]동역학을 따른다는 것이 잘 입증되었다.분해반응 및 생합성반응의 첫 번째 단계에서 친핵성 Cys89(또는 그 상당량)는 아실-CoA(또는 3-케토아실-CoA) 기질을 공격하여 공유가의 아실-엔자임 [9]중간체를 형성한다.두 번째 단계에서 아실-효소 중간체에 CoA(분해 반응) 또는 아세틸-CoA(생합성 반응)를 첨가하면 [10]효소에서 생성물이 방출된다.아세틸기의 친핵성 시스테인으로의 이동 및 친핵성 시스테인으로부터의 이동 중에 발생하는 각 사면체 반응 중간체는 A.[11] 후미가투스로부터의 생합성 티올라아제 X선 결정 구조에서 각각 관찰되었다.
구조.
티오라아제 슈퍼패밀리의 대부분의 효소는 이합체이다.단, 단량체는 관찰되지 않았다.테트라머는 티오라아제 서브패밀리에서만 관찰되며, 이 경우 이합체는 이합체화되어 테트라머가 된다.Zo Gloea ramigera의 4중합체 티올라아제 결정구조는 2.0Ω 분해능으로 측정되었다.이 구조에는 놀랍고 참신한 '케이지 같은' 4중합 모티브가 포함되어 있어 서로에 대한 두 개의 타이트 이합체의 힌지 모션을 어느 정도 허용합니다.효소 사량체는 Cys89에서 아세틸화되며 활성 부위 포켓 [12]각각에 CoA 분자가 결합되어 있습니다.
생물학적 기능
진핵세포, 특히 포유동물 세포에서 티오라아제는 기질 특이성뿐만 아니라 그들의 대사 기능과 관련된 세포 내 국재화에 다양성을 보인다.예를 들어 과산화좀과 미토콘드리아에서 지방산β산화, 미토콘드리아에서 [13]케톤체 대사, 과산화좀과 세포질에서 [14]메발론산 경로의 초기 단계에 기여한다.생화학적 조사와 더불어 유전자 장애의 분석은 [15]그 기능의 기초를 명확히 했다.유전자 연구는 또한 효모 사카로미세스 세레비시아에 [16]있는 티올라아제들의 생리학적 기능을 밝히기 시작했다.티오라아제는 지방산, 스테로이드 및 폴리케티드 합성과 같은 주요 효소 경로에서 중심적으로 중요하다.예를 들어, 구조 생물학에 대한 자세한 이해는 이러한 효소의 유전적 결함으로 인한 질병에 대한 더 나은 이해와 새로운 항생제 [17]개발에 있어 큰 의학적 관련성이 있다.생물학적 및 의학적으로 관련된 천연물의 합성을 위해 폴리케티드 합성효소의 복잡한 촉매적 다양성을 활용하는 것 또한 이 슈퍼패밀리의 [18]효소 연구의 중요한 미래 관점이다.
질병 관련성
β-케토티오라아제 결핍증으로 알려진 미토콘드리아 [19]아세토아세틸-CoA 티오라아제 결핍증은 이소류신 이화작용과 케톤체 대사를 수반하는 선천적 대사 오류이다.이 장애의 주요 임상적 징후는 간헐적 케토산증이지만, 명백히 양성인 것으로 보이는 장기적인 임상 결과는 잘 입증되지 않았다.미토콘드리아 아세토아세틸-CoA 티오라아제 결핍증은 뇨중유기산 분석으로 쉽게 진단되며 배양피부섬유아세포 또는 혈중백혈구의 [20]효소 분석으로 확인할 수 있다.
β-케토티오라아제 결핍증에는 다양한 징후가 있다.대부분의 영향을 받는 환자들은 생후 5개월에서 24개월 사이에 심각한 케토산증 증세를 보인다.증상은 단백질 섭취, 감염 또는 발열로 인해 발생할 수 있습니다.증상은 구토에서 탈수증, 케토산증 [21]등으로 진행된다.호중구감소증 및 혈소판감소증이 있을 수 있으며, 이는 고암몬혈증을 완화할 수 있다.혈당은 일반적으로 정상이지만 급성 [22]증례에서는 낮거나 높을 수 있습니다.첫 번째 급성 발작 이전이라도 발달 지연이 발생할 수 있으며, 뇌 MRI에서 기저핵의 양쪽 선조체 괴사가 관찰되었습니다.
레퍼런스
- ^ Thompson S, Mayerl F, Peoples OP, Masamune S, Sinskey AJ, Walsh CT (July 1989). "Mechanistic studies on beta-ketoacyl thiolase from Zoogloea ramigera: identification of the active-site nucleophile as Cys89, its mutation to Ser89, and kinetic and thermodynamic characterization of wild-type and mutant enzymes". Biochemistry. 28 (14): 5735–42. doi:10.1021/bi00440a006. PMID 2775734.
- ^ Heath RJ, Rock CO (October 2002). "The Claisen condensation in biology". Nat Prod Rep. 19 (5): 581–96. doi:10.1039/b110221b. PMID 12430724.
- ^ Haapalainen AM, Meriläinen G, Wierenga RK (January 2006). "The thiolase superfamily: condensing enzymes with diverse reaction specificities". Trends Biochem. Sci. 31 (1): 64–71. doi:10.1016/j.tibs.2005.11.011. PMID 16356722.
- ^ Baker ME, Billheimer JT, Strauss JF (November 1991). "Similarity between the amino-terminal portion of mammalian 58-kD sterol carrier protein (SCPx) and Escherichia coli acetyl-CoA acyltransferase: evidence for a gene fusion in SCPx". DNA Cell Biol. 10 (9): 695–8. doi:10.1089/dna.1991.10.695. PMID 1755959.
- ^ Yang SY, Yang XY, Healy-Louie G, Schulz H, Elzinga M (June 1990). "Nucleotide sequence of the fadA gene. Primary structure of 3-ketoacyl-coenzyme A thiolase from Escherichia coli and the structural organization of the fadAB operon". J. Biol. Chem. 265 (18): 10424–9. PMID 2191949.
- ^ a b Igual JC, González-Bosch C, Dopazo J, Pérez-Ortín JE (August 1992). "Phylogenetic analysis of the thiolase family. Implications for the evolutionary origin of peroxisomes". J. Mol. Evol. 35 (2): 147–55. doi:10.1007/BF00183226. PMID 1354266. S2CID 39746646.
- ^ Enzymatic reaction mechanisms. San Francisco: W. H. Freeman. 1979. ISBN 978-0-7167-0070-8.
- ^ Masamune, Satoru; Walsh, Christopher T.; Gamboni, Remo; Thompson, Stuart; Davis, Jeffrey T.; Williams, Simon F.; Peoples, Oliver P.; Sinskey, Anthony J.; Walsh, Christopher T. (1989). "Bio-Claisen condensation catalyzed by thiolase from Zoogloea ramigera. Active site cysteine residues". J. Am. Chem. Soc. 111 (5): 1879, 1991. doi:10.1021/ja00187a053.
- ^ Gilbert HF, Lennox BJ, Mossman CD, Carle WC (July 1981). "The relation of acyl transfer to the overall reaction of thiolase I from porcine heart". J. Biol. Chem. 256 (14): 7371–7. PMID 6114098.
- ^ Mathieu M, Modis Y, Zeelen JP, et al. (October 1997). "The 1.8 A crystal structure of the dimeric peroxisomal 3-ketoacyl-CoA thiolase of Saccharomyces cerevisiae: implications for substrate binding and reaction mechanism". J. Mol. Biol. 273 (3): 714–28. doi:10.1006/jmbi.1997.1331. PMID 9402066.
- ^ Marshall, Andrew C.; Bond, Charles S.; Bruning, John B. (January 25, 2018). "Structure of Aspergillus fumigatus Cytosolic Thiolase: Trapped Tetrahedral Reaction Intermediates and Activation by Monovalent Cations". ACS Catalysis. 8 (3): 1973–1989. doi:10.1021/acscatal.7b02873. hdl:2440/113865.
- ^ Modis Y, Wierenga RK (October 1999). "A biosynthetic thiolase in complex with a reaction intermediate: the crystal structure provides new insights into the catalytic mechanism". Structure. 7 (10): 1279–90. doi:10.1016/S0969-2126(00)80061-1. PMID 10545327.
- ^ Middleton B (April 1973). "The oxoacyl-coenzyme A thiolases of animal tissues". Biochem. J. 132 (4): 717–30. doi:10.1042/bj1320717. PMC 1177647. PMID 4721607.
- ^ Hovik R, Brodal B, Bartlett K, Osmundsen H (June 1991). "Metabolism of acetyl-CoA by isolated peroxisomal fractions: formation of acetate and acetoacetyl-CoA". J. Lipid Res. 32 (6): 993–9. PMID 1682408.
- ^ Middleton B, Bartlett K (March 1983). "The synthesis and characterisation of 2-methylacetoacetyl coenzyme A and its use in the identification of the site of the defect in 2-methylacetoacetic and 2-methyl-3-hydroxybutyric aciduria". Clin. Chim. Acta. 128 (2–3): 291–305. doi:10.1016/0009-8981(83)90329-7. PMID 6133656.
- ^ Kanayama N, Ueda M, Atomi H, Tanaka A (February 1998). "Genetic evaluation of physiological functions of thiolase isoenzymes in the n-alkalane-assimilating yeast Candida tropicalis". J. Bacteriol. 180 (3): 690–8. doi:10.1128/JB.180.3.690-698.1998. PMC 106940. PMID 9457876.
- ^ Price AC, Choi KH, Heath RJ, Li Z, White SW, Rock CO (March 2001). "Inhibition of beta-ketoacyl-acyl carrier protein synthases by thiolactomycin and cerulenin. Structure and mechanism". J. Biol. Chem. 276 (9): 6551–9. doi:10.1074/jbc.M007101200. PMID 11050088.
- ^ Keatinge-Clay AT, Maltby DA, Medzihradszky KF, Khosla C, Stroud RM (September 2004). "An antibiotic factory caught in action". Nat. Struct. Mol. Biol. 11 (9): 888–93. doi:10.1038/nsmb808. PMID 15286722. S2CID 12394083.
- ^ Daum RS, Lamm PH, Mamer OA, Scriver CR (December 1971). "A "new" disorder of isoleucine catabolism". Lancet. 2 (7737): 1289–90. doi:10.1016/S0140-6736(71)90605-2. PMID 4143539.
- ^ Mitchell GA, Fukao T (2001). "Inborn errors of ketone body metabolism". In Scriver CR, Beaudet AL, Sly WS, Valle D (eds.). The metabolic & molecular bases of inherited disease. New York: McGraw-Hill. pp. 2326–2356. ISBN 978-0-07-913035-8.
- ^ Hillman RE, Keating JP (February 1974). "Beta-ketothiolase deficiency as a cause of the "ketotic hyperglycinemia syndrome"". Pediatrics. 53 (2): 221–5. PMID 4812006.
- ^ Robinson BH, Sherwood WG, Taylor J, Balfe JW, Mamer OA (August 1979). "Acetoacetyl CoA thiolase deficiency: a cause of severe ketoacidosis in infancy simulating salicylism". J. Pediatr. 95 (2): 228–33. doi:10.1016/S0022-3476(79)80658-7. PMID 36452.
외부 링크
- 미국 국립의학도서관의 아세틸-CoA+C-아세틸전달효소(MeSH)
- PDB for UniProt: P28790(3-케토아실-CoA 티올라아제)에서 PDBe-KB에서 사용 가능한 모든 구조 정보의 개요.
- PDB for UniProt: Q56WD9(3-케토아실-CoA 티올라아제 2, peroxisomal)에서 PDB에서 사용 가능한 모든 구조 정보의 개요는 PDBe-KB.




