아질산 메틸
Methyl nitrite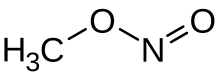 | |
| 이름 | |
|---|---|
| 선호 IUPAC 이름 아질산 메틸 | |
| 식별자 | |
3D 모델(JSmol) | |
| 켐스파이더 | |
| ECHA InfoCard | 100.009.882 |
펍켐 CID | |
| 유니 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| CH3NO2 | |
| 어금질량 | 61.040 g·migration−1 |
| 외관 | 황색가스[1] |
| 밀도 | 0.991 g/cm3[1] |
| 녹는점 | -16°C(3°F, 257K)[1] |
| 비등점 | -12°C(10°F, 261K)[1] |
| 열화학[2] | |
의 성 엔탈피 대형화 (ΔfH⦵298) | -66.1 kJ/mol |
| 위험 | |
| 안전 데이터 시트(SDS) | 외부 MSDS |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
아질산 메틸은 화학식 CHO노를
3 함유한 유기 화합물이다. 그것은 기체고, 가장 단순한 알킬 질산염이다.
구조
상온에서 아질산 메틸은 시스와 트랜스 컨포머의 혼합물로 존재한다. 시스 컨포머는 3.13 kJ mol로−1 트랜스폼보다 안정적이며, 45.3 kJ mol의−1 회전에 에너지 장벽이 있다.[3] cis와 트랜스 구조도 마이크로파 분광법에 의해 결정되었다(외부 링크 참조).
 |  |
| 아질산염 시스메틸 | 아질산 트랜스메틸 |
합성
아질산 메틸은 아질산 은색 아질산염과 요오드메탄의 반응에 의해 준비될 수 있다. 아그노(AgNO2)는 은이온, 아그(Ag+)와 아질산 이온(Nitrite Ion) NO2−. 아질산 이온에서 나오는 산소의 외로운 쌍 중 하나가 메틸 그룹(—CH3)을 공격하여 요오드화 이온을 용액으로 방출함으로써 용액에 존재한다.[4] 은 질산염과 달리 요오드화은은 물에 녹지 않는 특성이 강해 고체를 형성한다.[5] 질소는 산소보다 더 좋은 핵물질이며 대부분의 질소는 S2와N 같은 메커니즘을 통해 반응하며 주요 생산물은 니트로메탄일 것이다. 예를 들어, 요오드메탄과 반응하는 나트륨과 아질산칼륨은 대부분 니트로메탄(nitromethane)을 생성하며, 아질산메틸은 경제품으로 한다. 그러나 용액에 은이온이 존재하면 탄수화물 중간체의 형성에 안정화 효과가 있어 질산 메틸의 수율을 높인다. 어느 경우든 약간의 니트로메탄과 니틸아이트가 둘 다 형성된다.[4]
그림은 IR과 마이크로파 분광법에 의해 결정되는 아질산 메틸의 두 가스 위상 구조를 보여준다.
니트로메탄 없는 아질산 메틸은 요오드메탄과 이산화질소를 반응시켜 만들 수 있다.
이 화합물은 무연 휘발유의 연소에 의해 생성되며, 곤충의 감소의 원인이 될 수 있으며, 따라서 유럽에서는 집참새와 다른 새들의 감소를 야기할 수 있다.[6]
아질산 메틸은 또한 오래된 담배 연기에도 존재한다. 여기서 그것은 아마도 아산화질소(아산화질소의 자동산화 작용에 의해 형성된 것)와 메탄올으로 형성되어 있을 것이다.[7]
속성 및 사용
아질산 메틸은 산화제와 열에 민감한 폭발물이다. 금속 산화물이 있으면 그 민감도가 증가한다. 무기 염기로 폭발성 염분을 형성한다. 그것은 공기와 폭발성 혼합물을 형성한다. 그것은 로켓 추진제, 단로형 추진제로 사용된다.[8] 그것은 에틸 아질산염보다 더 심하게 폭발한다. 알킬 질산염은 냉장 보관 시에도 분해되어 용기가 폭발할 수 있다.[9]
아질산 메틸은 독성 질식 가스로서 강력한 청색제다. 노출은 메트헤모글로빈혈증을 유발할 수 있다.[10]
아질산 메틸은 화학 합성에 전구체로서, 예를 들어 페닐프로판올아민 생산 과정에서 중간체로 사용된다.[10]
참고 항목
참조
- ^ a b c d 헤인즈, 페이지 3.382
- ^ 헤인즈, 페이지 5.20
- ^ Van Der Veken, B. J.; Maas, R.; Guirgis, G. A.; Stidham, H. D.; Sheehan, T. G.; Durig, James R. (1990). "Infrared spectrum, ab initio calculations, barriers to internal rotation and structural parameters for methyl nitrite". Journal of Physical Chemistry. 94 (10): 4029–39. doi:10.1021/j100373a028.
- ^ a b Pavia, Donald L.; Lampman, Gary M.; Kriz, George S. (2004). Organic Chemistry. 2. Mason, Ohio: Thompson Custom Publishing. ISBN 978-0-03-014813-2. OCLC 236055357.
- ^ Darrell D. Ebbing; Steven D. Gammon (2005). General Chemistry (8th ed.). Boston: Houghton Mifflin. ISBN 978-0-618-39941-3.
- ^ Summers-Smith, J. Denis (September 2007). "Is unleaded petrol a factor in urban House Sparrow decline?". British Birds. 100: 558. ISSN 0007-0335.
- ^ Rodgman, Alan; Perfetti, Thomas A. (2016-04-19). The Chemical Components of Tobacco and Tobacco Smoke. ISBN 9781466515529.
- ^ 니트라이트 메틸. Cameochemicals.noaa.gov. 2019-03-10에 검색됨.
- ^ Bretherick, L. (2016-10-27). Bretherick's Handbook of Reactive Chemical Hazards. ISBN 9781483162508.
- ^ a b 메틸 니트라이트 – 국립 의학 라이브러리 HSDB 데이터베이스 Toxnet.nlm.nih.gov. 2019-03-10에 검색됨.
인용된 출처
- Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). CRC Press. ISBN 978-1439855119.
외부 링크
| 위키미디어 커먼스는 질산메틸과 관련된 미디어를 보유하고 있다. |



