루신의 검은 소금
Roussin's black salt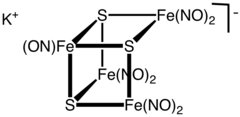 | |
| 이름 | |
|---|---|
| 기타 이름 헵타니트로실트리-μ3-thioetraferrate 칼륨 | |
| 식별자 | |
| |
3D 모델(JSmol) | |
펍켐 CID | |
| |
| |
| 특성. | |
| Fe4KN7O7S3 | |
| 어금질량 | 568.70 g·190−1 |
| 외관 | 블랙 솔리드 |
| 녹는점 | 198~200°C(388~392°F, 471~473K) |
| 관련 화합물 | |
관련 | 루신의 붉은 소금 |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
루신의 검은 소금은 KFeS43(NO)라는 공식을 가진 화학 화합물이다.7[1] [FeS43(NO)]7− 음이온, 금속 니트로실 화합물의 칼륨 염으로 구성된다. 1858년 자차리 루신(Zacharie Roussin)에 의해 처음 묘사된 이 성단은 그의 이름이 새겨진 붉은 소금과 함께 최초의 합성 철황 성단 중 하나이다.[2]
구조
성단 음이온은 C3v 대칭의 불완전한 큐방형 성단의 기하학적 구조를 가지고 있다. 단지의 어두운 색상은 여러 가지 전하 전달 상호작용에 기인한다.[3]
합성
루신의 흑염은 질산, 수산화칼륨, 황화칼륨, 철의 반응에 의해 생성된다.II) 수용액에 함유된 황산염.[4] 그것은 또한 약한 산성 조건에서 루신의 붉은 소금이 변환됨으로써 형성될 수 있다. 이 반응은 되돌릴 수 있고 루신의 붉은 소금은 반응 용액의 알칼리화에 따라 수정된다.
사용하다
루신의 검은 소금은 질소산화물 기증자다.[5] 또한, 루신의 블랙 솔트는 일부 식품 가공 애플리케이션에서 항균 활동을 보인다.[6]
참고 항목
참조
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 1094. ISBN 978-0-08-037941-8.
- ^ Butler, Anthony R. (July 1982). "The chemist Z. Roussin (1827-94)". Journal of Chemical Education. 59 (7): 549. Bibcode:1982JChEd..59..549B. doi:10.1021/ed059p549.
- ^ Jaworska, Maria; Stasicka, Zofia (March 2006). "Structure and UV–vis spectroscopy of roussin black salt [Fe4S3(NO)7]−". Journal of Molecular Structure. 785 (1–3): 68–75. Bibcode:2006JMoSt.785...68J. doi:10.1016/j.molstruc.2005.09.030.
- ^ Marchlewski, L.; Sachs, J. (1892). "Studien über ROUSINS Salz". Zeitschrift für anorganische Chemie. 2 (1): 175–181. doi:10.1002/zaac.18920020117.
- ^ Janczyk, Agnieszka; Wolnicka-Glubisz, Agnieszka; Chmura, Antonina; Elas, Martyna; Matuszak, Zenon; Stochel, Grazyna; Urbanska, Krystyna (February 2004). "NO-dependent phototoxicity of Roussin's black salt against cancer cells". Nitric Oxide. 10 (1): 42–50. doi:10.1016/j.niox.2004.01.009. PMID 15050534.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. pp. 1094–1095. ISBN 978-0-08-037941-8.



