C2 도메인
C2 domain| C2 도메인 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
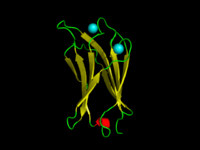 C.absonum α-toxin(PDB 1OLP)의 C2 도메인.β-strands은 노란색, α-helic은 빨간색, 루프는 녹색으로 표시된다.Calcium 이온은 청록색이다. | |||||||||
| 식별자 | |||||||||
| 기호 | C2 | ||||||||
| Pfam | PF00168 | ||||||||
| 인터프로 | IPR000008 | ||||||||
| 스마트 | C2 | ||||||||
| 프로사이트 | PDOC00380 | ||||||||
| SCOP2 | 1qas / SCOPe / SUPFAM | ||||||||
| OPM 슈퍼 패밀리 | 45 | ||||||||
| OPM단백질 | 원ugk | ||||||||
| CDD | cd00030 | ||||||||
| |||||||||
| 인광산화 3-키나아제 C2 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
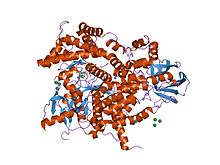 인산염 3-키나아제의 구조.[1] | |||||||||||
| 식별자 | |||||||||||
| 기호 | PI3K_C2 | ||||||||||
| Pfam | PF00792 | ||||||||||
| 인터프로 | IPR002420 | ||||||||||
| 스마트 | PI3K_C2 | ||||||||||
| 프로사이트 | PDOC50004 | ||||||||||
| SCOP2 | 1e8x / SCOPe / SUPFAM | ||||||||||
| CDD | cd08380 | ||||||||||
| |||||||||||
C2 영역은 세포막으로 단백질을 표적으로 하는 데 관여하는 단백질 구조 영역이다.전형적 버전(PKC-C2)은 8 β-강도로 구성된 베타 샌드위치를 가지고 있는데, 이 베타 샌드위치는 영역의 첫 번째와 마지막 루프가 형성한 캐비티에서 결합하는 2-3개의 칼슘 이온을 멤브레인 결합면에 배치한다.다른 많은 C2 도메인 가족들은 칼슘 결합 활동을 하지 않는다.[2][3]
다른 도메인과의 연결
C2 영역은 효소 영역과 결합하여 자주 발견된다. 예를 들어, PTEN의 C2 영역은 인산염 영역을 플라즈마 막과 접촉시켜 기질인 인산염(3,4,5)-트리스포산염(PIP)3을 막에서 제거하지 않고도 인산염(phosphatylinosital)을 제거할 수 있다. 이 영역은 정력적으로 비용이 많이 든다.PTEN은 단백질 티로신인산효소 도메인과 C2 도메인으로 구성된다.이 도메인 쌍은 곰팡이, 식물, 동물의 다양한 단백질에서 발견되는 유전적인 단위인 슈퍼도메인을 구성한다.[4]또 이노시톨 링의 3-히드로옥실 그룹에 인산염화효소를 인산염화시키는 효소인 인산염리노시톨 3-키나아제(PI3-키나아제)도 C2 도메인을 사용하여 막에 결합한다(예: 1e8W PDB 엔트).
진화
C2 도메인은 현재 eukaryotes와 알파-톡신의 일부인 prokaryote Clostridium perfringens에서만 알려져 있다.[5]17개 이상의 C2 도메인이 확인되었다.[2][3]대부분의 C2 계열은 마지막 진핵 공통 조상 이전의 초기 다변화를 나타내는 기저 진핵 종으로 거슬러 올라갈 수 있다.PKC-C2 도메인 제품군만 보존된 칼슘 결합 잔류물을 포함하고 있어, 일반적인 칼슘 의존적 멤브레인 상호작용은 PKC-C2 도메인에서 제한된 파생 특성임을 시사한다.[2]
칼슘 및 지질 선택성
C2 도메인은 인산염, 인산염 등 세포막의 주요 구성요소에 대해 광범위한 지질 선택성을 보인다는 점에서 대상 멤브레인 도메인 사이에서 독특하다.이 C2 도메인은 약 116개의 아미노산 잔류물이며 단백질 키나제 C의 C1 도메인(포볼 에스테르와 디아실글리세롤을 결합하는 것)의 두 복사본(PDOC00379 참조)과 단백질 키나제 촉매 도메인(PDOC00100 참조) 사이에 위치한다.C2-영역에 대한 유의미한 동질감을[6] 가진 지역들은 많은 단백질에서 발견되었다.C2 영역은 칼슘 의존성 인지질 결합과[7] 세포하 국소화와 같은 멤브레인 타겟팅 공정에 관여하는 것으로 생각된다.대부분의 C2 도메인은 Ca 의존적인2+ 방식으로 멤브레인(인산염색체)과 상호작용하지만, 일부 C2 도메인은 Ca에2+ 구속되지 않고 멤브레인과 상호작용할 수 있다.마찬가지로, C2 영역은 지질에 대해 서로 다른 특수성을 가지도록 진화되었다.시냅토타그민 C2A와 같은 많은 C2 도메인은 음이온성 인지질(인산화물을 포함하는 PS 또는 PIP2)에 바인딩된다.그러나 cPLA2-α C2 도메인과 같은 다른 C2 도메인은 zwitterionic 지질(예: PC)에 바인딩된다.Ca와2+ 지질 결합의 이러한 다양성과 선택성은 C2 도메인이 다른 기능을 가지도록 진화되었음을 시사한다.[8]
3D 구조
이 도메인은 보존된 4줄 모티브를 중심으로 8줄 베타 샌드위치를 형성하며, C2 키로 지정된다.[9]칼슘은 C2키 모티브의 N-와 C-단자 루프가 형성한 컵 모양의 우울증에 결합한다.여러 C2 영역의 구조 해석에 따르면 그것들은 8개의 좌초된 대타렐 베타 샌드위치의 끝에 3개의 Ca-binding2+ 루프가 위치한 유사한 3차 구조로 구성된다.
C2영역을 포함하는 인간 단백질
ABR; BAIAP3; BCR; C2CD2; C2CD3; CADPS; CADPS2; CAPN5; CAPN6; CC2D1A; CC2D1B; CPNE1; CPNE2; CPNE3; CPNE4; CPNE5; CPNE6; CPNE7; CPNE8; CPNE9; DAB2IP; DOC2A; DOC2B; DYSF; ESYT1; ESYT3; FAM62A; FAM62B; FAM62C; FER1L3; FER1L5; HECW1; HECW2; ITCH; ITSN1; ITSN2; MCTP1; MCTP2; MTAC2D1; NEDD4; NEDD4L; NEDL1; OTOF; PCLO; PIK3C2A; PIK3C2B; PIK3C2G; PLA2G4A; PLA2G4B; PLA2G4D; PLA2G4E; PLA2G4F; PLCB1; PLCB2; PLCB3; PLCB4; PLCD1; PLCD3; PLCD4; PLCE1; PLCG1; PLCG2; PLCH1; PLCH2; PLCL1; PLCL2; PLCZ1; PRF1; PRKCA; PRKCB1; PRKCE; PRKCG; PRKCH; RAB11FIP1; RAB11FIP2; RAB11FIP5; RASA1; RASA2; RASA3; RASA4; RASAL1; RASAL2; RGS3; RIMS1; RIMS2; RIMS3; RIMS4; RPGRIP1; RPGRIP1L; RPH3A; SGA72M; SMURF1; SMURF2; SYNGAP1; SYT1; SYT10; SYT11; SYT12; SYT13; SYT14; SYT14L; SYT15; SYT16; SYT17; SYT2; SYT3; SYT4; SYT5; SYT6;SYT7; SYT8; SYTL9; SYTL1; SYTL2; SYTL3; SYTL4; SYTL5; TallIP; UNC13A; UNC13B; UNC13C; WWC2; WWP1; PTEN
참조
- ^ Walker EH, Pacold ME, Perisic O, Stephens L, Hawkins PT, Wymann MP, Williams RL (October 2000). "Structural determinants of phosphoinositide 3-kinase inhibition by wortmannin, LY294002, quercetin, myricetin, and staurosporine". Molecular Cell. 6 (4): 909–19. doi:10.1016/S1097-2765(05)00089-4. PMID 11090628.
- ^ a b c Zhang D, Aravind L (December 2010). "Identification of novel families and classification of the C2 domain superfamily elucidate the origin and evolution of membrane targeting activities in eukaryotes". Gene. 469 (1–2): 18–30. doi:10.1016/j.gene.2010.08.006. PMC 2965036. PMID 20713135.
- ^ a b Zhang D, Aravind L (October 2012). "Novel transglutaminase-like peptidase and C2 domains elucidate the structure, biogenesis and evolution of the ciliary compartment". Cell Cycle. 11 (20): 3861–75. doi:10.4161/cc.22068. PMC 3495828. PMID 22983010.
- ^ Haynie DT, Xue B (May 2015). "Superdomains in the protein structure hierarchy: The case of PTP-C2". Protein Science. 24 (5): 874–82. doi:10.1002/pro.2664. PMC 4420535. PMID 25694109.
- ^ Naylor, Claire E.; Eaton, Julian T.; Howells, Angela; Justin, Neil; Moss, David S.; Titball, Richard W.; Basak, Ajit K. (August 1998). "Structure of the key toxin in gas gangrene". Nature Structural & Molecular Biology. 5 (8): 738–746. doi:10.1038/1447. ISSN 1545-9993. PMID 9699639. S2CID 21000585.
- ^ Brose N, Hofmann K, Hata Y, Südhof TC (October 1995). "Mammalian homologues of Caenorhabditis elegans unc-13 gene define novel family of C2-domain proteins". The Journal of Biological Chemistry. 270 (42): 25273–80. doi:10.1074/jbc.270.42.25273. PMID 7559667.
- ^ Davletov BA, Südhof TC (December 1993). "A single C2 domain from synaptotagmin I is sufficient for high affinity Ca2+/phospholipid binding". The Journal of Biological Chemistry. 268 (35): 26386–90. PMID 8253763.
- ^ Nalefski EA, Wisner MA, Chen JZ, Sprang SR, Fukuda M, Mikoshiba K, Falke JJ (March 2001). "C2 domains from different Ca2+ signaling pathways display functional and mechanistic diversity". Biochemistry. 40 (10): 3089–100. doi:10.1021/bi001968a. PMC 3862187. PMID 11258923.
- ^ Sutton RB, Davletov BA, Berghuis AM, Südhof TC, Sprang SR (March 1995). "Structure of the first C2 domain of synaptotagmin I: a novel Ca2+/phospholipid-binding fold". Cell. 80 (6): 929–38. doi:10.1016/0092-8674(95)90296-1. PMID 7697723. S2CID 18981505.
외부 링크
- Pfam의 Phosphoinositide 3-kinase C2 계열
- IMT-2000 3GPP-막군 내 단백질 UMICH 방향-47 - 막군 내 C2 영역 방향(OPM)


