인광암반
Phospholamban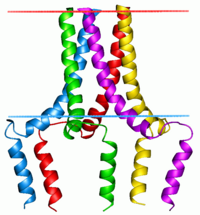 인광암반 펜타머 | |||||||||
| 식별자 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 기호 | 인광암반 | ||||||||
| Pfam | PF04272 | ||||||||
| 인터프로 | IPR005984 | ||||||||
| SCOP2 | 1fjk / SCOPe / SUPFAM | ||||||||
| TCDB | 1.A.50 | ||||||||
| OPM 슈퍼 패밀리 | 62 | ||||||||
| OPM단백질 | 1zll | ||||||||
| 멤브라노메 | 383 | ||||||||
| |||||||||
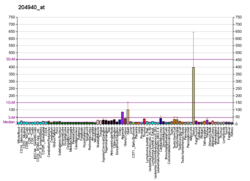
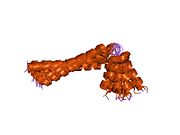
PLN 또는 PLB라고도 알려진 인광암반은 인간에서 PLN 유전자에 의해 인코딩되는 마이크로펩타이드 단백질이다.[3]인광암은 심장 근육 세포의 칼슘(Ca2+) 펌프를 조절하는 52-아미노산 일체형 막 단백질이다.[4]
함수
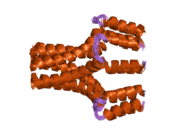
이 단백질은 펜타머로 발견되며 심장근육에서 cAMP 의존성 단백질 키나아제(PKA)의 주요 기질이다.비인산성 상태에서 인광암은 시토솔에서 사코플라스믹 레티큘럼으로 칼슘을 운반하는 심장근육 사코플라스믹 레티코스2+([5]SERCA2)의 억제제다.PKA에 의한 인산염화(Phosphylated, PKA에 의한) - SR의 Ca-ATPase2+ 불능화로 인해 Ca가2+ 사코플라즘 망막에 더 빨리 흡수되어 베타아곤학자에 의해 심장에서 도출된 후루시텔리틱 반응에 기여한다.[6]단백질은 심장 이완 기능의 주요 조절기다.이 유전자의 돌연변이는 유전자가 난치성 울혈성 심부전으로 확장된 심근증의 원인이다.[7]
PKA에 의해 인광암반이 인광화되면 SERCA2를 억제하는 능력이 상실된다.[8]따라서 베타 아드레날린 작용제 에피네프린(공감 자극에 의해 분비됨)과 같은 PKA의 활성제는 심장 근세포 이완 속도를 높일 수 있다.또한 SERCA2가 더 활성화되기 때문에 다음 작용 전위는 칼슘의 방출량을 증가시켜 수축(양성 비등방성 효과)이 증가하게 된다.PKA가 비활성화된 경우와 같이 인광암반이 인광화되지 않은 경우 SERCA와 상호 작용하여 억제할 수 있다.인광암의 전반적인 효과는 수축성과 근육 이완 속도를 감소시켜 각각 뇌졸중 볼륨과 심장 박동수를 감소시키는 것이다.[9]
임상적 유의성
인광암의 유전자 결핍은 극도의 역학적 심장을 가진 동물을 낳는데, 명백한 부정적인 결과는 거의 없다.[10]
이 유전자의 돌연변이는 유전자가 난치성 울혈성 심부전으로 확장된 심근증의 원인이다.[11][12]
디스커버리
인골람반은 1974년 아놀드 마틴 캣츠와 동료들에 의해 발견되었다.[13]
상호작용
PLN은 SLN[14][15] 및 SERCA1과 상호작용하는 것으로 나타났다.[15][16][17]
참조
- ^ a b c GRCh38: 앙상블 릴리스 89: ENSG00000198523 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Fujii J, Zarain-Herzberg A, Willard HF, Tada M, MacLennan DH (June 1991). "Structure of the rabbit phospholamban gene, cloning of the human cDNA, and assignment of the gene to human chromosome 6". The Journal of Biological Chemistry. 266 (18): 11669–75. doi:10.1016/S0021-9258(18)99009-5. PMID 1828805.
- ^ Rodriguez P, Kranias EG (December 2005). "Phospholamban: a key determinant of cardiac function and dysfunction". Archives des Maladies du Coeur et des Vaisseaux. 98 (12): 1239–43. PMID 16435604.
- ^ "InterPro".
- ^ Hagemann D, Xiao RP (February 2002). "Dual site phospholamban phosphorylation and its physiological relevance in the heart". Trends in Cardiovascular Medicine. 12 (2): 51–6. doi:10.1016/S1050-1738(01)00145-1. PMID 11852250.
- ^ "Entrez Gene: PLN phospholamban".
- ^ Medical Physiology. Philadelphia: Saunders. 2004. ISBN 0-8089-2333-1.
- ^ Brittsan AG, Kranias EG (December 2000). "Phospholamban and cardiac contractile function". Journal of Molecular and Cellular Cardiology. 32 (12): 2131–9. doi:10.1006/jmcc.2000.1270. PMID 11112989.
- ^ Luo W, Grupp IL, Harrer J, Ponniah S, Grupp G, Duffy JJ, Doetschman T, Kranias EG (September 1994). "Targeted ablation of the phospholamban gene is associated with markedly enhanced myocardial contractility and loss of beta-agonist stimulation". Circulation Research. 75 (3): 401–9. doi:10.1161/01.res.75.3.401. PMID 8062415.
- ^ Schmitt JP, Kamisago M, Asahi M, Li GH, Ahmad F, Mende U, Kranias EG, MacLennan DH, Seidman JG, Seidman CE (February 2003). "Dilated cardiomyopathy and heart failure caused by a mutation in phospholamban". Science. 299 (5611): 1410–3. doi:10.1126/science.1081578. PMID 12610310. S2CID 12253445.
- ^ Eijgenraam TR, Boukens BJ, Boogerd CJ, Schouten EM, van de Kolk CW, Stege NM, te Rijdt WP, Hoorntje ET, van der Zwaag PA, van Rooij E, van Tintelen JP, van den Berg MP, van der Meer P, van der Velden J, Silljé HH, de Boer RA (17 June 2020). "The phospholamban p.(Arg14del) pathogenic variant leads to cardiomyopathy with heart failure and is unreponsive to standard heart failure therapy". Scientific Reports. 10 (1): 9819. Bibcode:2020NatSR..10.9819E. doi:10.1038/s41598-020-66656-9. PMC 7300032. PMID 32555305.
- ^ Tada M, Kirchberger MA, Repke DI, Katz AM (October 1974). "The stimulation of calcium transport in cardiac sarcoplasmic reticulum by adenosine 3':5'-monophosphate-dependent protein kinase". The Journal of Biological Chemistry. 249 (19): 6174–80. doi:10.1016/S0021-9258(19)42237-0. PMID 4371608.
- ^ Asahi M, Sugita Y, Kurzydlowski K, De Leon S, Tada M, Toyoshima C, MacLennan DH (April 2003). "Sarcolipin regulates sarco(endo)plasmic reticulum Ca2+-ATPase (SERCA) by binding to transmembrane helices alone or in association with phospholamban". Proceedings of the National Academy of Sciences of the United States of America. 100 (9): 5040–5. Bibcode:2003PNAS..100.5040A. doi:10.1073/pnas.0330962100. PMC 154294. PMID 12692302.
- ^ a b Asahi M, Kurzydlowski K, Tada M, MacLennan DH (July 2002). "Sarcolipin inhibits polymerization of phospholamban to induce superinhibition of sarco(endo)plasmic reticulum Ca2+-ATPases (SERCAs)". The Journal of Biological Chemistry. 277 (30): 26725–8. doi:10.1074/jbc.C200269200. PMID 12032137.
- ^ Asahi M, Kimura Y, Kurzydlowski K, Tada M, MacLennan DH (November 1999). "Transmembrane helix M6 in sarco(endo)plasmic reticulum Ca(2+)-ATPase forms a functional interaction site with phospholamban. Evidence for physical interactions at other sites". The Journal of Biological Chemistry. 274 (46): 32855–62. doi:10.1074/jbc.274.46.32855. PMID 10551848.
- ^ Asahi M, Green NM, Kurzydlowski K, Tada M, MacLennan DH (August 2001). "Phospholamban domain IB forms an interaction site with the loop between transmembrane helices M6 and M7 of sarco(endo)plasmic reticulum Ca2+ ATPases". Proceedings of the National Academy of Sciences of the United States of America. 98 (18): 10061–6. Bibcode:2001PNAS...9810061A. doi:10.1073/pnas.181348298. PMC 56915. PMID 11526231.
이 기사는 공공영역에 있는 미국 국립 의학 도서관의 텍스트를 통합하고 있다.
외부 링크
- PDBe-KB는 인간 심장 인광반 PDB에서 사용할 수 있는 모든 구조 정보에 대한 개요를 제공한다.