Humanized 항체
Humanized antibody인간화된 항체는 [1][2]인간에서 자연적으로 생성된 항체 변종과의 유사성을 증가시키기 위해 단백질 서열이 변형된 비인간 종으로부터의 항체이다."인간화" 과정은 보통 사람에게 투여하기 위해 개발된 모노클로널 항체(예를 들어 항암제로 개발된 항체)에 적용된다.인간화는 특정 항체를 개발하는 과정이 비인간 면역 체계에서 생성될 때 필요할 수 있다.이러한 방식으로 생성된 항체의 단백질 배열은 사람에게 자연적으로 발생하는 상동 항체와 부분적으로 구별되므로, 따라서 인간 환자에게 투여할 때 잠재적으로 면역 유발성이 있다(인간 항쥐 항체 참조.인간화된 항체의 국제 비특허 명칭은 오말리주맵과 같이 -zumab으로 끝난다(단일클로널 항체의 명명법 참조).
인간화된 항체는 키메라 항체와 구별된다.후자는 또한 그들의 단백질 배열이 인간의 항체와 더 비슷하게 만들어졌지만, 더 많은 비인간 단백질을 가지고 있다.
모노클로널 항체를 개발하는 다른 방법들이 있다.이 목록은 인간에게 사용하기 위해 개발된 많은 모노클로널을 포함한다.
인간화 과정에서 재조합 DNA 사용
인간화 과정은 재조합 DNA를 사용하여 모노클로널 항체의 생산을 할 수 있다는 점을 이용하여 포유류의 세포 배양에서 발현할 수 있는 구조를 만들[3] 수 있다.즉, 항체를 생성할 수 있는 유전자 세그먼트를 분리하여 생물반응기에서 배양할 수 있는 세포로 복제함으로써 복제된 유전자의 DNA에서 생성된 항체 단백질을 대량으로 채취할 수 있다.재조합 DNA를 포함하는 단계는 발현된 항체의 단백질 서열을 바꾸기 위해 쉽게 이용될 수 있는 개입 지점을 제공한다.따라서 인간화 과정에서 달성되는 항체 구조의 변화는 모두 DNA 수준의 기술을 통해 영향을 받는다.인간 치료를 위해 의도된 항체를 도출하는 모든 방법은 인간화 단계(예: 파지 표시)를 필요로 하는 것은 아니지만, 기본적으로 모든 방법은 항체 분자 부분의 "삽입" 또는 "교환"을 유사하게 허용하는 기술에 의존한다.
키메라 항체와의 구별
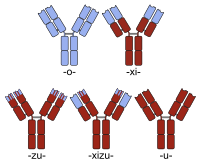
인간화는 보통 쥐-인간 항체 키메라 생성과 구별되는 것으로 보인다.따라서, 항체 키메라 생성은 보통 (마우스 항체의 일정한 영역을 인간의 것으로 대체함으로써) 보다 인간적인 항체를 얻기 위해 수행되지만, 이러한 유형의 단순한 키메라들은 보통 인간화된 것으로 언급되지 않는다.오히려 인간화된 항체의 단백질 배열은 항체가 표적 항원에 결합하는 능력을 담당하는 일부 상보성 결정 영역(CDR) 세그먼트의 비인간적 기원이지만 본질적으로 인간 변이의 단백질 배열과 동일하다.
키메라 항체명은 -xi- 줄기를 포함한다.인간 치료를 위해 승인된 키메라 항체의 예로는 abcximab(ReoPro), basiliximab(Simulect), cetuximab(Erbitux), infliximab(Remicade) 및 rituximab(MabThera)이 있다.또한 현재 임상 시험에서 키메릭스의 몇 가지 예가 있다(예: bavituximab, 추가 예는 정렬 가능 목록 참조).
키메라 중간체를 통한 인간화
인간화 과정에는 첫 단계로 쥐-인간 키메라 생성도 포함될 수 있다.이 경우 마우스 변수 영역은 인간 상수 영역에 스플라이스됩니다.키메라는 분자의 가변 영역에서 아미노산 배열을 선택적으로 변화시킴으로써 더욱 인간화될 수 있다.
변경 과정은 항체가 원래 개발된 특이성을 유지하기 위해 "선택적"이어야 한다.즉, 가변영역의 CDR 부분은 항체가 의도한 표적에 결합하는 능력에 필수적이기 때문에 이러한 부분의 아미노산은 개발 목적을 저해할 위험 없이 변경될 수 없다.CDR 세그먼트와는 별도로 사람과는 다른 가변 영역의 부분은 적절한 개별 아미노산을 교환함으로써 보정할 수 있다.이것은 돌연변이 유발을 통해 DNA 수준에서 달성된다.
인간화된 키메라 명명에는 두 명칭(-xi- + -zu-)의 스템이 포함된다.오텔릭시즈맵은 류마티스 관절염과 [4]당뇨병을 치료하기 위해 현재 임상시험 중인 인간화된 키메라 중 하나이다.
인간 항체 "scafold"에 관련 CDR을 삽입하여 인간화
키메라 중간체를 생성하지 않고도 인간화된 항체를 생성할 수 있다.인간화된 항체의 "직접" 생성은 인간 항체 "scafold"(일명 "수용체")에 적절한 CDR 코드 세그먼트(일명 "기증자"라 함)를 삽입함으로써 달성될 수 있다.위에서 설명한 바와 같이, 이것은 포유동물 세포에서 적절한[3] 벡터와 발현을 사용하는 재조합 DNA 방법을 통해 달성된다.즉, 항체가 마우스(또는 다른 비인간)에서 원하는 특성을 가지도록 개발된 후, 해당 항체를 코드하는 DNA를 분리하여 벡터로 복제하고 배열할 수 있다.다음으로 항체 CDR에 대응하는 DNA 배열을 결정할 수 있다.원하는 CDR의 정확한 배열을 알게 되면 이들 배열을 인간 항체 [5][6]변이를 위한 DNA를 포함하는 구조에 적절히 삽입하는 전략을 고안할 수 있다.이 전략은 CDR 시퀀스의 판독치에 기초한 선형 DNA 단편 합성을 사용할 수도 있다.이 과정은 결합 부위의 구조를 손상시키지 않고 어떤 항체의 아미노산이 뮤린 배열에서 인간 배열로 바뀔 수 있는지를 결정하기 위해 컴퓨터 모델링 소프트웨어를 필요로 한다.미국에서는 이 소프트웨어가 1980년대와 [7]1990년대에 캘리포니아 마운틴 뷰의 Protein Design Labs, Inc.에 의해 개발, 특허 취득 및 시연되었습니다.
알렘투주맵은 인간화에 키메라 중간체가 포함되지 않은 항체의 초기 사례이다.이 경우 Campath-1이라는 이름의 모노클로널이 마우스 시스템을 사용하여 CD52를 결합하기 위해 개발되었습니다.그런 다음 Campath-1의 초가변 루프(CDR을 포함하고 그에 따라 CD52와 결합하는 능력을 부여함)를 추출하여 인간 항체 [1]프레임워크에 삽입했다.Alemtuzumab은 B세포 만성 림프구[8] 백혈병 치료에 대해 승인되었으며, 현재 다발성 [9]경화증을 포함한 다양한 다른 질환에 대해 임상시험 중이다.
마우스 이외의 소스로부터의 파생
인간 치료를 위한 항체를 발견하는 과정에서 쥐나 다른 비인간 포유류의 사용을 완전히 피하는 기술이 있다.그러한 시스템의 예로는 다양한 "표시" 방법(주로 파지 표시)과 인간의 면역 반응 동안 발생하는 높은 B 세포 수준을 이용하는 방법이 있다.
표시 방법
이것들은 특정 항체 생산의 선택적 원리를 사용하지만 미생물(파지 디스플레이와 같은) 또는 세포 없는 추출물(리보솜 디스플레이와 같은)을 이용한다.이러한 시스템은 말초 혈액에서 분리된 인간의 RNA로부터 전적으로 파생될 수 있는 항체 유전자 "라이브러리"의 생성에 의존한다.이러한 시스템의 직접적인 산물은 항체 단편이며, 일반적으로 Fab 또는 scFv입니다.
즉, 표시 방법을 사용하여 생성된 항체 조각은 완전한 인간 배열이지만 완전한 항체는 아니라는 것이다.따라서 인간화와 본질적으로 동일한 과정이 완전한 항체 내에 파생된 친화력을 통합하고 발현하기 위해 사용된다.
아달리맵(Humira)은 파지 디스플레이를 [10][11]통해 만들어진 인체 치료용으로 승인된 항체의 한 예이다.
인간 환자 또는 백신 접종자의 항체
모노클로널 항체의 발견에 있어서 인간의 면역 반응을 이용하는 것이 가능하다.간단히 말해서, 인간의 면역 반응은 쥐나 다른 비인간 포유동물과 같은 방식으로 작용한다.따라서, 감염병, 암 또는 백신 접종과 같은 면역 체계에 대한 도전을 경험하는 사람들은 그러한 도전을 지향하는 모노클로널 항체의 잠재적 원천이다.이 접근법은 수동 면역의 원리를 이용하는 항바이러스 치료법의 개발에 특히 적합한 것으로 보인다.이 접근법의 변형은 원칙적으로[12] 입증되었으며 일부는 상업적인 [13]개발로 발전하고 있습니다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b Riechmann L, Clark M, Waldmann H, Winter G (1988). "Reshaping human antibodies for therapy". Nature. 332 (6162): 323–7. Bibcode:1988Natur.332..323R. doi:10.1038/332323a0. PMID 3127726. S2CID 4335569.
- ^ 여왕 C, 슈나이더 WPSelick HE, 페인 PW, Landolfi 씨, 던컨 제이에프, Avdalovic에는 NM, 레빗 M, Junghans RP, Waldmann TA(12월 1989년)."는 인터류킨 2수용체 바인딩 된 인간화된 항체".Proc Natl로 Sci USA86(24):10029–33.Bibcode:1989PNAS...8610029Q.doi:10.1073/pnas.86.24.10029.PMC298637.PMID 2513570.(용어"항체 humanized"의 사용의 이것은 초기 예이다.).
- ^ a b Norderhaug L, Olafsen T, Michaelsen TE, Sandlie I (May 1997). "Versatile vectors for transient and stable expression of recombinant antibody molecules in mammalian cells". J Immunol Methods. 204 (1): 77–87. doi:10.1016/S0022-1759(97)00034-3. PMID 9202712.
- ^ otelixizumab의 임상 시험 페이지 목록
- ^ Kashmiri SV, De Pascalis R, Gonzales NR, Schlom J (May 2005). "SDR grafting—a new approach to antibody humanization". Methods. 36 (1): 25–34. doi:10.1016/j.ymeth.2005.01.003. PMID 15848072.
- ^ Hou S, Li B, Wang L, Qian W, Zhang D, Hong X, Wang H, Guo Y (July 2008). "Humanization of an anti-CD34 monoclonal antibody by complementarity-determining region grafting based on computer-assisted molecular modeling". J Biochem. 144 (1): 115–20. doi:10.1093/jb/mvn052. PMID 18424812.
- ^ Fletcher, L. PDL의 mAb 기술은 적절한 타이밍을 찾아냅니다.NAT Biotechnol 19, 395-396(2001).https://doi.org/10.1038/88010
- ^ Alemtuzumab의 DrugBank 엔트리
- ^ alemtuzumab 임상시험 페이지
- ^ Kempeni J. (Nov 1999). "Preliminary results of early clinical trials with the fully human anti-TNFalpha monoclonal antibody D2E7". Ann Rheum Dis. 58 (Suppl 1): I70–2. doi:10.1136/ard.58.2008.i70. PMC 1766582. PMID 10577977.
- ^ Rau R (Nov 2002). "Adalimumab (a fully human anti-tumour necrosis factor alpha monoclonal antibody) in the treatment of active rheumatoid arthritis: the initial results of five trials". Ann Rheum Dis. 61 (Suppl 2): 70–3. doi:10.1136/ard.61.suppl_2.ii70. PMC 1766697. PMID 12379628.
- ^ Stacy JE, Kausmally L, Simonsen B, Nordgard SH, Alsøe L, Michaelsen TE, Brekke OH (Dec 2003). "Direct isolation of recombinant human antibodies against group B Neisseria meningitidis from scFv expression libraries". J Immunol Methods. 283 (1–2): 247–59. doi:10.1016/j.jim.2003.09.015. PMID 14659916.
- ^ http://www.theraclone-sciences.com/pdf/Theraclone_ISTAR.pdf 2016-03-03 Wayback Machine에서 보관 사람 환자를 모노클로널 항체 소스로 사용하는 방법 예시


