리바로사반
Rivaroxaban | |
 | |
| 임상 데이터 | |
|---|---|
| 상호 | 자렐토, 기타 |
| 기타 이름 | 베이 59-7939 |
| AHFS/Drugs.com | 모노그래프 |
| Medline Plus | a611049 |
| 라이선스 데이터 |
|
| 임신 카테고리 |
|
| 루트 행정부. | 입으로 |
| ATC 코드 | |
| 법적 상태 | |
| 법적 상태 | |
| 약동학 데이터 | |
| 바이오 어베이러빌리티 | 80~100%, Cmax = 2~4시간 (10mg 경구)[4] |
| 대사 | CYP3A4, CYP2J2 및 CYP 비의존 메커니즘[4] |
| 반감기 제거 | 20~45세의[4][5] 건강한 피험자에게 5~9시간 |
| 배설물 | 간에서 대사되는 2/3와 변경되지 않은 1/3 제거[4] |
| 식별자 | |
| |
| CAS 번호 | |
| PubChem CID | |
| IUPHAR/BPS | |
| 드러그뱅크 | |
| 켐스파이더 | |
| 유니 | |
| 케그 | |
| 체비 | |
| 첸블 | |
| PDB배위자 | |
| CompTox 대시보드 (EPA ) | |
| ECHA 정보 카드 | 100.210.589 |
| 화학 및 물리 데이터 | |
| 공식 | C19H18클론N3O5S |
| 몰 질량 | 435.88g/표준−1 |
| 3D 모델(JSmol) | |
| |
| |
| | |
자렐토라는 상표명으로 판매되는 리바로사반은 [6]혈전을 치료하고 예방하는 데 사용되는 항응고제(혈액 희석제)입니다.특히 심정맥 혈전증 및 폐색전증 치료 및 심방세동 및 고관절 또는 무릎 [6]수술 후 혈전 예방에 사용됩니다.입으로 [6]먹는 거예요.
일반적인 부작용은 [6]출혈을 포함한다.다른 심각한 부작용으로는 척추혈종과 무지외반증이 [6]있을 수 있다.임신과 모유 수유에 사용하는 것이 [1]안전한지는 확실하지 않다.와파린에 비해 다른 [7]약물과의 상호작용이 적다.이것은 응고 단백질 인자 [6]Xa의 활성을 차단함으로써 작용한다.
Rivaroxaban은 2007년에 특허를 받았으며 [8]2011년에 미국에서 의료용으로 승인되었습니다.미국에서는 [9][10]2024년까지 제네릭 의약품으로 판매되지 않을 예정이다.그것은 세계보건기구의 필수 [11]의약품 목록에 있다.2019년 미국에서 가장 흔하게 처방되는 의약품으로 8백만 건 이상의 [12][13]처방전이 있었다.
의료 용도
비판막 심방 세동을 가진 사람들에게서, 그것은 허혈성 뇌졸중과 색전 [14][15]현상을 예방하는 데 와파린만큼 효과가 있는 것으로 보인다.리바록사반은 와파린보다 심각하고 치명적인 출혈 발생률이 낮지만, 리바록사반은 위장관 [16]출혈율이 높다.
2012년 7월, 영국 국립 보건 및 임상 우수 연구소는 정맥 혈전 색전증을 [17]예방하고 치료하기 위해 리바로사반을 추천했습니다.
금지 사항
출혈 관리가 어렵기 때문에 리바록사반은 수술 최소 24시간 전에 중단한 후 적절한 지혈이 [18]확립되는 즉시 다시 시작해야 합니다.
리바록사반의 [2][19]혈장 농도가 현저히 높아지기 때문에 리바록사반을 강력한 복합 CYP3A4/P-글리코프로틴 억제제로 알려진 약물과 함께 투여하는 것은 권장되지 않는다.
부작용
가장 심각한 부작용은 심한 [20][21][22]내출혈을 포함한 출혈이다.리바록사반은 와파린보다 심각하고 치명적인 출혈 발생률이 낮지만 위장관 [16]출혈율이 높다.
2015년 현재[update] 시판 후 평가에서 간 독성이 나타났으며,[23][24] 이 위험을 정량화하기 위한 추가 연구가 필요하다.2015년, 리바로사반은 FDA의 부작용 보고 시스템(AERS)[25]에 대해 정기적으로 모니터링되는 의약품 중 심각한 부상의 보고된 환자 중 가장 많은 수를 차지했다.
반전제
2014년 10월 Portola Pharmacuticals는 부작용이 거의 없는 Factor Xa 억제제에 대한 해독제로서 Andexanet alfa에 대한 임상 1, II상을 완료하고 3상 [26][27]시험을 시작했습니다.안덱사넷 알파는 2018년 5월 미국 식품의약국에 의해 안덱사라는 [28][29]상표명으로 승인되었다.
작용 메커니즘
리바록사반은 프로트롬비나아제 [30]복합체에서 유리 및 결합 인자 Xa를 모두 억제한다.선택적 직접인자 Xa 억제제로서 2.5~[31]4시간 작용 개시이다.Xa 인자의 억제는 혈액 응고 캐스케이드의 내인성 및 외인성 경로를 방해하여 트롬빈 형성과 트롬비의 발달을 모두 억제한다.리바록사반은 트롬빈(활성화 인자 II)을 억제하지 않으며 혈소판에 미치는 영향은 아직 [4]입증되지 않았다.예측 가능한 항응고 및 선량 조정과 정기적인 응고 [4]모니터링을 가능하게 하므로 식이 제한은 [32]필요하지 않습니다.
또한 비분열화 헤파린(UFH), 저분자량 헤파린(LMWH), 폰다파리눅스는 순환 항트롬빈(AT III)에 결합함으로써 Xa 인자의 활성을 간접적으로 억제하고 주입해야 하며, 반면 경구 활성 와파린, 펜프로코몬 및 아세노쿠마롤은 비타민 KVKA 길항제이다.(인자 [33]X 포함)
리바록사반은 광범위한 환자 스펙트럼(나이, 성별, 체중, 인종)에 걸쳐 예측 가능한 약동학을 가지고 있으며, 8배 선량 범위(5-40mg)[34]에 걸쳐 동일한 선량 반응을 보인다.경구 생체 가용성은 용량에 [2]따라 달라진다.10mg 미만의 리바록사반 선량은 [35]식품 섭취 여부와 무관하게 높은 생체 가용성을 나타냈기 때문에 식품과 함께 또는 식품 없이 섭취할 수 있다.리바록사반을 15mg 또는 20mg의 경구 용량으로 투여할 경우 약물 흡수를 돕고 적절한 생물학적 가용성(≥ 80%)[35]을 달성하기 위해 식품과 함께 섭취해야 한다.
화학
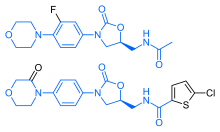
리바록사반은 항생제 라인졸리드와 현저한 구조적 유사성을 가지고 있다: 두 약물은 동일한 옥사졸리디논 유래 코어 구조를 [36]공유한다.따라서 리바록사반은 가능한 항균 효과와 장기 라인졸리드 [37]사용의 알려진 합병증인 미토콘드리아 독성의 가능성에 대해 연구되었다.연구 결과 리바로크사반과 그 대사물 모두 그램 양성 [citation needed]박테리아에 대한 항생제 효과가 없는 것으로 밝혀졌다.미토콘드리아 독성에 대해서는 2008년 이전에 발표된 시험관내 연구에서 위험이 낮은 [36]것으로 나타났다.
역사
Rivaroxaban은 처음에 [38]Bayer에 의해 개발되었다.미국에서는 Jansen Pharmacuticals(Johnson & [38]Johnson의 일부)가 판매하고 있습니다.구강으로 [39]섭취되는 최초의 직접 인자 Xa 억제제였다.
사회와 문화
경제학
미국 최대 약국 혜택 [32]관리업체인 익스프레스 스크립트 홀딩사에 따르면 와파린 대신 리바로사반을 사용하는 것은 70배나 더 많은 비용이 든다.2016년 현재, 바이엘은 그 약이 130개국에서 허가되었고 2300만 명 이상의 환자들이 [40]치료를 받았다고 주장했다.
승인.
2008년 9월, 캐나다 보건부는 선택적인 전체 고관절 치환 또는 전체 무릎 치환 [41]수술을 받은 사람들의 정맥 혈전 색전증(VTE)을 예방하기 위해 리바로사반의 시판 허가를 내주었다.
같은 달 유럽위원회는 또한 고관절과 무릎 [42][3]치환술을 받는 성인의 정맥 혈전 색전증을 예방하기 위해 리바로사반의 시판 허가를 내주었다.
2011년 7월 1일 미국 식품의약국(US FDA)은 고관절 및 무릎 치환 [43]수술을 받고 있는 성인의 폐색전증(PE)으로 이어질 수 있는 심부정맥혈전증(DVT) 예방을 위해 리바로사반을 승인했다.
2011년 11월 4일, 미국 FDA는 비판막 심방세동 [44]환자의 뇌졸중 예방을 위해 리바록사반을 승인했다.
법적 대응
2019년 3월 25일 미국에서 리바록사반 관련 25,000건 이상의 소송이 7억 7,500만 달러에 합의되어 피해자들에게 지급되었다.원고들은 의사와 환자들이 적절한 정보를 [45]제공받았더라면 그들의 부상을 막을 수 있었을 것이라고 주장하며 마약 제조사들이 출혈 위험에 대해 경고하지 않았다고 비난했다.
조사.
Duke Clinical Research Institute의 연구원들은 리바록사반을 [46]평가하는 데 사용되는 임상 데이터를 보류하고 있다는 혐의를 받고 있다.듀크는 ROCKET AF [47]실험으로 알려진 임상 실험에서 리바록사반을 테스트했다.2011년 뉴잉글랜드 저널 오브[48] 메디신에 발표되고 당시 [49][48]FDA 국장이었던 Robert Califf에 의해 주도된 이 임상 실험은 리바록사반이 [48]심방세동 환자의 허혈성 뇌졸중 가능성을 줄이는데 와파린보다 더 효과적이라는 것을 발견했다.때 제약 후원자들 바이엘이나 존슨 &, 존슨 씨는 INRatio 혈액 모니터링 기기를 활용하는 properly,[46][47]는 공작 팀에 의한 후속적인 분석을 통해서 2월 2016년에 출판된 기능을 발휘하지 못하고 있다는 것 연구의 타당성에 의문을 제기하는 2014년에 있어서 이t.에 효능과 안전성에 어떤 중대한 효과 있다는 것을 발견했다라고 불렸다그는 재판.[50]
임상시험에서 소수 인종에 대한 불충분한 표현이 지적되었다.와파린과 비교했을 때, 효능과 안전성은 여러 인종 [48]집단에서 유사한 것으로 밝혀졌다.
레퍼런스
- ^ a b "Rivaroxaban Use During Pregnancy". Drugs.com. Retrieved March 3, 2019.
- ^ a b c "Xarelto- rivaroxaban tablet, film coated Xarelto- rivaroxaban tablet, film coated Xarelto- rivaroxaban kit". DailyMed. Retrieved November 13, 2020.
- ^ a b "Xarelto EPAR". European Medicines Agency (EMA). Retrieved November 13, 2020.
- ^ a b c d e f "Xarelto: Summary of Product Characteristics". Bayer Schering Pharma AG. 2008. Retrieved February 11, 2009.
- ^ Abdulsattar Y, Bhambri R, Nogid A (May 2009). "Rivaroxaban (xarelto) for the prevention of thromboembolic disease: an inside look at the oral direct factor xa inhibitor". P & T. 34 (5): 238–44. PMC 2697099. PMID 19561868.
- ^ a b c d e f "Rivaroxaban Monograph for Professionals". Drugs.com. American Society of Health-System Pharmacists. Retrieved March 3, 2019.
- ^ Kiser K (2017). Oral Anticoagulation Therapy: Cases and Clinical Correlation. Springer. p. 11. ISBN 9783319546438.
- ^ "Generic Xarelto Availability". Drugs.com. Retrieved May 9, 2017.
- ^ "Orange Book: Approved Drug Products with Therapeutic Equivalence Evaluations". www.accessdata.fda.gov. Retrieved April 24, 2019.
- ^ "Bayer, J&J Win Ruling That Upholds Patent for Xarelto Drug". April 22, 2019. Retrieved April 24, 2019.
- ^ World Health Organization (2021). World Health Organization model list of essential medicines: 22nd list (2021). Geneva: World Health Organization. hdl:10665/345533. WHO/MHP/HPS/EML/2021.02.
- ^ "The Top 300 of 2019". ClinCalc. Retrieved October 16, 2021.
- ^ "Rivaroxaban - Drug Usage Statistics". ClinCalc. Retrieved October 16, 2021.
- ^ Lowenstern A, Al-Khatib SM, Sharan L, Chatterjee R, Allen LaPointe NM, Shah B, et al. (December 2018). "Interventions for Preventing Thromboembolic Events in Patients With Atrial Fibrillation: A Systematic Review". Annals of Internal Medicine. 169 (11): 774–787. doi:10.7326/M18-1523. PMC 6825839. PMID 30383133.
- ^ Gómez-Outes A, Terleira-Fernández AI, Calvo-Rojas G, Suárez-Gea ML, Vargas-Castrillón E (2013). "Dabigatran, Rivaroxaban, or Apixaban versus Warfarin in Patients with Nonvalvular Atrial Fibrillation: A Systematic Review and Meta-Analysis of Subgroups". Thrombosis. 2013: 640723. doi:10.1155/2013/640723. PMC 3885278. PMID 24455237.
- ^ a b Brown DG, Wilkerson EC, Love WE (March 2015). "A review of traditional and novel oral anticoagulant and antiplatelet therapy for dermatologists and dermatologic surgeons". Journal of the American Academy of Dermatology. 72 (3): 524–34. doi:10.1016/j.jaad.2014.10.027. PMID 25486915.
- ^ "Overview Rivaroxaban for the treatment of deep vein thrombosis and prevention of recurrent deep vein thrombosis and pulmonary embolism Guidance NICE". www.nice.org.uk. Retrieved January 1, 2020.
- ^ Sunkara T, Ofori E, Zarubin V, Caughey ME, Gaduputi V, Reddy M (2016). "Perioperative Management of Direct Oral Anticoagulants (DOACs): A Systemic Review". Health Services Insights. 9 (Suppl 1): 25–36. doi:10.4137/HSI.S40701. PMC 5156547. PMID 28008269.
- ^ Mueck W, Kubitza D, Becka M (September 2013). "Co-administration of rivaroxaban with drugs that share its elimination pathways: pharmacokinetic effects in healthy subjects". British Journal of Clinical Pharmacology. 76 (3): 455–66. doi:10.1111/bcp.12075. PMC 3769672. PMID 23305158.
- ^ "Medication Guide – Xarelto" (PDF). U.S. Food and Drug Administration. Retrieved September 1, 2014.
- ^ "Xarelto Side Effects". WebMD. Retrieved September 1, 2014.
- ^ "Xarelto Side Effects Center". RxList. Retrieved September 1, 2014.
- ^ Raschi E, Poluzzi E, Koci A, Salvo F, Pariente A, Biselli M, et al. (August 2015). "Liver injury with novel oral anticoagulants: assessing post-marketing reports in the US Food and Drug Administration adverse event reporting system". British Journal of Clinical Pharmacology. 80 (2): 285–93. doi:10.1111/bcp.12611. PMC 4541976. PMID 25689417.
- ^ Russmann S, Niedrig DF, Budmiger M, Schmidt C, Stieger B, Hürlimann S, Kullak-Ublick GA (August 2014). "Rivaroxaban postmarketing risk of liver injury" (PDF). Journal of Hepatology. 61 (2): 293–300. doi:10.1016/j.jhep.2014.03.026. PMID 24681117.
- ^ Schroeder C. "ISMP Ranks Xarelto Most Dangerous Drug in the United States". DrugNews. DrugNews. Retrieved August 10, 2016.
- ^ Schroeder C. "Possible Antidote Could Help Blood Thinner Patients In Bleeding Emergencies". DrugNews. Retrieved August 20, 2015.
- ^ Mo Y, Yam FK (February 2015). "Recent advances in the development of specific antidotes for target-specific oral anticoagulants". Pharmacotherapy. 35 (2): 198–207. doi:10.1002/phar.1532. PMID 25644580. S2CID 22593448.
- ^ "Accelerated Approval for AndexXa" (PDF). FDA. Retrieved August 1, 2018.
- ^ "U.S. FDA Approves Portola Pharmaceuticals' Andexxa®, First and Only Antidote for the Reversal of Factor Xa Inhibitors". Portola Pharmaceuticals Inc. GlobeNewswire News Room. Retrieved August 1, 2018.
- ^ Roehrig S, Straub A, Pohlmann J, Lampe T, Pernerstorfer J, Schlemmer KH, et al. (September 2005). "Discovery of the novel antithrombotic agent 5-chloro-N-({(5S)-2-oxo-3- [4-(3-oxomorpholin-4-yl)phenyl]-1,3-oxazolidin-5-yl}methyl)thiophene- 2-carboxamide (BAY 59-7939): an oral, direct factor Xa inhibitor". Journal of Medicinal Chemistry. 48 (19): 5900–8. doi:10.1021/jm050101d. PMID 16161994.
- ^ Ansell J (January 2019). "Outpatient Oral Anticoagulant Therapy". Consultative Hemostasis and Thrombosis (Fourth ed.). Elsevier. pp. 747–777. doi:10.1016/B978-0-323-46202-0.00037-6. ISBN 978-0-323-46202-0.
- ^ a b Berkrot B (December 23, 2015). "New blood thinner 'antidote' to help doctors move past warfarin". Reuters.
- ^ Turpie AG (January 2008). "New oral anticoagulants in atrial fibrillation". European Heart Journal. 29 (2): 155–65. doi:10.1093/eurheartj/ehm575. PMID 18096568.
- ^ Eriksson BI, Borris LC, Dahl OE, Haas S, Huisman MV, Kakkar AK, et al. (November 2006). "A once-daily, oral, direct Factor Xa inhibitor, rivaroxaban (BAY 59-7939), for thromboprophylaxis after total hip replacement". Circulation. 114 (22): 2374–2381. doi:10.1161/CIRCULATIONAHA.106.642074. PMID 17116766.
- ^ a b Stampfuss J, Kubitza D, Becka M, Mueck W (July 2013). "The effect of food on the absorption and pharmacokinetics of rivaroxaban". International Journal of Clinical Pharmacology and Therapeutics. 51 (7): 549–561. doi:10.5414/CP201812. PMID 23458226.
- ^ a b European Medicines Agency (2008). "CHP Assessment Report for Xarelto (EMEA/543519/2008)" (PDF). Retrieved June 11, 2009.[영구 데드링크]
- ^ Singh AK, Noronha V, Gupta A, Singh D, Singh P, Singh A, Singh A. (2020). "Rivaroxaban: Drug review". Cancer Res Stat Treat. 3: 264–269. doi:10.4103/CRST.CRST_122_19.
{{cite journal}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ a b "Xarelto FDA Approval History". September 7, 2020.
- ^ Fassiadis N (December 2009). "Rivaroxaban, the first oral, direct factor Xa inhibitor". Expert Opinion on Pharmacotherapy. 10 (18): 2945–2946. doi:10.1517/14656560903413559. PMID 19925048. S2CID 23498967.
- ^ "Bayer comments on article in The British Medical Journal (BMJ) regarding Xarelto" (PDF). Bayer AG Communications, Government Relations & Corporate Brand. September 29, 2016.
- ^ "Bayer's Xarelto Approved in Canada" (Press release). Bayer. September 16, 2008. Retrieved January 31, 2010.
- ^ "Bayer's Novel Anticoagulant Xarelto now also approved in the EU" (Press release). Bayer. February 10, 2008. Retrieved January 31, 2010.
- ^ "FDA Approves Xarelto® (rivaroxaban tablets) to Help Prevent Deep Vein Thrombosis in Patients Undergoing Knee or Hip Replacement Surgery" (Press release). Janssen Pharmaceutica. July 1, 2011. Archived from the original on November 5, 2011. Retrieved July 1, 2011.
- ^ "FDA approves Xarelto to prevent stroke in people with common type of abnormal heart rhythm". US Food and Drug Association. November 4, 2011. Retrieved April 27, 2016.
- ^ "Bayer, Johnson & Johnson settle more than 25,000 lawsuits over blood thinner Xarelto for $775 million". washingtonpost.com. Retrieved April 7, 2019.
- ^ a b Thomas K (March 1, 2016). "Document Claims Drug Makers Deceived a Top Medical Journal". The New York Times. Retrieved May 3, 2016.
- ^ a b Patel V. "Duke clinical trial under scrutiny in drug case". The Chronicle. Duke Student Publishing Company.
- ^ a b c d Patel MR, Mahaffey KW, Garg J, Pan G, Singer DE, Hacke W, et al. (September 2011). "Rivaroxaban versus warfarin in nonvalvular atrial fibrillation". The New England Journal of Medicine. 365 (10): 883–91. doi:10.1056/NEJMoa1009638. PMC 3860773. PMID 21830957.
- ^ "Meet Robert M. Califf, M.D., Commissioner of Food and Drugs". U.S. Food and Drug Administration. U.S. Food and Drug Administration. Retrieved May 3, 2016.
- ^ Patel MR, Hellkamp AS, Fox KA (February 2016). "Point-of-Care Warfarin Monitoring in the ROCKET AF Trial" (PDF). The New England Journal of Medicine. 374 (8): 785–8. doi:10.1056/NEJMc1515842. hdl:20.500.11820/69b742f0-5b6d-4f54-93a5-98a1da909653. PMID 26839968.
외부 링크
- "Rivaroxaban". Drug Information Portal. U.S. National Library of Medicine.