아민
Amine| 프라이머리 아민(1°) | 2차(2°) 아민 | 제3의 아민 |
|---|---|---|
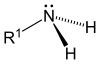 |  | 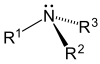 |
유기화학에서 아민(/ˈmiːn, æminn/,[1][2] 영국도 /eeɪminn/)[3]은 단일 쌍의 염기성 질소 원자를 포함하는 화합물 및 관능기이다.아민은 공식적으로 암모니아(NH3)의 유도체로, 하나 이상의 수소 원자가 알킬기 또는 아릴기와[4] 같은 치환기에 의해 치환되었다(이것들은 각각 알킬아민 및 아릴아민이라고 불릴 수 있다). 두 가지 유형의 치환기가 하나의 질소 원자에 결합되어 있는 아민은 알킬아민이라고 불릴아민이라고 불릴 수 있다.중요한 아민에는 아미노산, 바이오제닉아민, 트리메틸아민 및 아닐린이 포함됩니다. 범주를 참조하십시오.아민 목록을 위한 아민입니다.암모니아의 무기 유도체는 모노클로라민(NClH2)[5]과 같은 아민이라고도 불린다.
치환기 [6]-NH는2 아미노기라고 불린다.
카보닐기에 질소 원자가 붙어 있어 R-CO-NRrR, 구조를 가진 화합물은 아미드라고 불리며 아민과 다른 화학적 특성을 가지고 있다.
아민의 분류
아민은 질소의 성질과 치환기 수에 따라 분류될 수 있다.지방족 아민은 H 및 알킬 치환기만을 포함한다.방향족에는 질소 원자가 방향족 고리에 연결되어 있습니다.
아민은 알킬과 아릴 모두 질소에 인접한 탄소 원자의 수(암모니아 분자의 수소 원자가 탄화수소기로[7] 대체되는 수)[6]에 따라 세 가지 하위 범주(표 참조)로 분류됩니다.
- 1차 (1°) 아민: 1차 아민은 암모니아에서 3개의 수소 원자 중 하나가 알킬기 또는 방향족으로 대체될 때 발생합니다.중요한 1차 알킬아민은 메틸아민, 대부분의 아미노산 및 완충제 트리스를 포함하고, 1차 방향족에는 아닐린을 포함한다.
- 2차(2°) 아민—2차 아민은 1개의 수소와 함께 질소에 결합된 2개의 유기 치환기(알킬, 아릴 또는 둘 다)를 가지고 있다.디메틸아민이 중요한 대표주자로, 방향족으로는 디페닐아민이 있다.
- 제3의 아민(3°): 3차 아민 중 질소는 3가지 유기 치환기를 가지고 있다.예를 들어 특유의 비린내가 나는 트리메틸아민과 EDTA가 있다.
네 번째 서브카테고리는 질소에 부착된 치환기의 연결성에 의해 결정된다.
- 사이클릭아민: 사이클릭아민은 2차 아민 또는 3차 아민 중 하나입니다.고리형 아민의 예로는 3원환 아지리딘 및 6원환 피페리딘이 있다.N-메틸피페리딘 및 N-페닐피페리딘은 고리형 제3아민의 예이다.
또한 질소에는 4개의 유기 치환기가 있을 수 있다.이 종들은 아민이 아니라 4차 암모늄 양이온으로 질소 중심이 충전되어 있다.4차 암모늄 소금은 많은 종류의 음이온과 함께 존재한다.
명명 규칙
아민은 여러 가지 방법으로 이름이 붙여진다.일반적으로 화합물에는 접두사 "amino-" 또는 접미사 "-amine"이 붙습니다.접두사 "N-"는 질소 원자의 치환을 나타냅니다.여러 아미노기를 가진 유기 화합물은 디아민, 트리아민, 테트라아민 등으로 불린다.
일반적인 아민의 계통명:
| 하위 아민은 접미사 -amine으로 명명됩니다. | 높은 아민은 기능성 기로서 아미노를 접두사로 가지고 있다.그러나 IUPAC는 이 [citation needed]규약을 권장하지 않지만, 예를 들어 N-펜탄-2-아민 등의 알칸아민 형태를 선호한다. |
물리 속성
수소 결합은 1차 및 2차 아민의 특성에 큰 영향을 미칩니다.예를 들어, 메틸과 에틸아민은 표준 조건의 기체이며, 이에 상응하는 메틸과 에틸알코올은 액체입니다.아민은 암모니아 특유의 냄새를 가지고 있고, 액체 아민은 독특한 "생선 같은" 냄새와 악취가 납니다.
질소 원자는 H와 결합하여+ 암모늄 이온3+ RNH를 형성할 수 있는 단일 전자 쌍을 특징으로 합니다.이 글에서 유일한 전자쌍은 N의 위 또는 옆에 있는 두 개의 점으로 표현된다.단순 아민의 수용성은 이러한 단일 전자 쌍과 관련된 수소 결합에 의해 강화된다.일반적으로 암모늄 화합물의 염은 물에서 1차 암모늄(RNH+
3) > 2차 암모늄(RNH
2+
2) > 3차 암모늄(RNH3+) 순으로 용해된다.작은 지방족 아민은 많은 용매에서 유의한 용해성을 보이는 반면, 큰 치환기를 가진 아민은 친유성이다.아닐린과 같은 방향족들은 벤젠 고리에 단쌍의 전자를 결합하기 때문에 수소 결합에 관여하는 경향이 감소한다.끓는점이 높고 물속에서의 용해도는 낮다.
분광학적 식별
일반적으로 아민 관능기의 존재는 질량 분석, NMR 및 IR 스펙트럼 분석 등의 기술을 조합하여 추론한다.1DO로2 검체를 처리하면 아민에 대한 H NMR 신호가 사라집니다.적외선 스펙트럼에서 1차 아민은 2개의 N-H 밴드를 나타내고 2차 아민은 1개만 나타냅니다.[6]
구조.
알킬아민류
 | ⇌ |  |
| 아민 공간 구성의 반전:아민은 바람에 뒤집힌 우산처럼 휙휙 날아간다.점 쌍은 질소 원자 위에 있는 유일한 전자 쌍을 나타냅니다. | ||
알킬아민은 특징적으로 사면체 질소 중심을 특징으로 한다.C-N-C 및 C-N-H 각도는 이상적인 각도인 109°에 근접한다.C-N 거리는 C-C 거리보다 약간 짧습니다.스테레오 센터의 질소 반전 에너지 장벽은 트리알킬아민의 경우 약 7kcal/mol입니다.그 상호 변환은 열린 우산이 강풍으로 반전되는 것과 비교되어 왔다.
NHRR' 및 NRRrR'형 아민은 키랄이다. 질소 중심에는 단일 쌍을 계수하는 4개의 치환기가 있다.반전 장벽이 낮기 때문에 광학적 순도로 NHRR'형 아민을 얻을 수 없다.키랄 3차 아민은 N-치환 아지리딘 등의 고리구조에서 R, R' 및 R'기가 구속되어 있을 경우에만 NRR δR δR δ를 분해할 수 있다(4차 암모늄염은 분해 가능하다.
방향족
방향족("Anilines")에서 질소는 종종 아릴 치환기와 단일 쌍의 결합으로 인해 거의 평면적이다.따라서 C-N 거리가 더 짧습니다.아닐린에서는 C-N 거리는 C-C [8]거리와 동일합니다.
기본성
암모니아처럼 아민은 [9]염기이다.알칼리 금속 하이드록시드에 비해 아민은 약하다(공역산 K 값의a 예는 표 참조).
| 알킬아민[10] 또는 아닐린[11] | 의a pK 양성자화아민 | Kb[검증 필요] |
|---|---|---|
| 메틸아민(MeNH2) | 10.62 | 4.17 E-04 |
| 디메틸아민(MeNH2) | 10.64 | 4.37 E-04 |
| 트리메틸아민(MeN3) | 9.76 | 5.75 E-05 |
| 에틸아민(EtNH2) | 10.63 | 4.27 E-04 |
| 아닐린(PhNH2) | 4.62 | 4.17 E-10 |
| 4-메톡시아닐린(4-MeOCHNH642) | 5.36 | 2.29 E-09 |
| N, N-디메틸아닐린(PhNMe2) | 5.07 | 1.17 E-09 |
| 3-니트로아닐린(3-NO-CHNH2642) | 2.46 | 2.88 E-12 |
| 4-니트로아닐린(4-NO-CHNH2642) | 1.00 | 1.00 E-13 |
| 4-트리플루오로메틸아닐린(CFCHNH3642) | 2.75 | 5.62 E-12 |
아민의 염기성은 다음에 따라 달라집니다.
- 치환기의 전기적 특성(알킬기는 염기성을 높이고 아릴기는 염기성을 감소시킨다)
- 양성자화된 아민의 용매화 정도. 질소에 대한 그룹의 입체적 장애를 포함합니다.
전자 효과
유도 효과 때문에, 아민의 염기성은 아민에 대한 알킬기 수와 함께 증가할 것으로 예상될 수 있다.유도 효과의 추세에 반하는 용매화 효과 때문에 상관관계가 복잡하다.용매화 효과도 방향족(애닐린)의 염기성을 지배한다.아닐린의 경우, 질소에 있는 유일한 전자 쌍은 고리 안으로 비국재화되어 염기성이 감소합니다.방향족 고리상의 치환기 및 아미노기에 대한 치환기의 위치도 표와 같이 염기성에 영향을 미친다.
용해 효과
용매화는 아민의 염기성에 큰 영향을 미친다.N-H 그룹은 특히 암모늄 이온에서 물과 강하게 상호작용합니다.그 결과 용매화에 의해 암모니아 염기성이 10 향상된다11.아민의 고유 염기성, 즉 용해가 중요하지 않은 상황은 기체 단계에서 평가되었습니다.기상에서 아민은 유기 치환기의 전자방출 효과로부터 예측되는 염기성을 나타낸다.따라서 3차 아민은 2차 아민보다 염기성이 높고, 1차 아민보다 염기성이 높고, 마지막으로 암모니아는 염기성이 가장 낮다.pKb(물의 염기성) 순서가 이 순서를 따르지 않습니다.마찬가지로 아닐린은 기체상에서는 암모니아보다 염기성이 높지만 수용액에서는 [12]1만 배나 적다.
DMSO, DMF 및 아세토니트릴과 같은 비프로톤 극성 용제에서는 용매화 에너지가 물이나 메탄올과 같은 원형 극성 용제만큼 높지 않습니다.이러한 이유로 이러한 비프로톤 용제의 아민 염기는 거의 전적으로 전자 효과에 의해 제어됩니다.
합성
알코올로부터
산업적으로 유의한 알킬 아민은 알코올에 [5]의한 알킬화에 의해 암모니아로부터 제조됩니다.
- ROH + NH3 → RNH2 + HO2
알킬과 할로겐화 아릴로부터
아민과 알코올의 반응과는 달리, 아민과 암모니아와 할로겐화 알킬의 반응은 실험실에서 합성에 사용됩니다.
- RX + 2 R'NH2 → RR'NH + [RR]NH2]X
요오드화알킬과 브롬화알킬에 더 유용한 반응에서는 알킬화 정도를 제어하기 어려워 1차, 2차, 3차 아민 혼합물과 4차 암모늄염을 [5]얻을 수 있다.
산업 규모에서는 거의 사용되지 않지만, 델레핀 반응을 통해 선택성이 향상될 수 있습니다.가브리엘 합성에서도 선택성이 보장되며, 가브리엘 합성에서는 유기할라이드가 프탈이미드 칼륨과 반응한다.
할로겐화 아릴은 아민에 대한 반응성이 훨씬 낮으며 그 때문에 제어하기 더 쉽다.아릴아민을 만드는 인기 있는 방법은 부크발트-하르트비히 반응이다.
알켄에서
이치환된 알케인은 강한 산의 존재 하에서 HCN과 반응하여 포름아미드를 생성하며, 포름아미드는 탈카르보닐화될 수 있습니다.이 방법인 리터 반응은 산업적으로 tert-옥틸아민과 [5]같은 제3의 아민을 생산하기 위해 사용된다.
알케인의 하이드로아미네이션도 널리 행해지고 있다.이 반응은 제올라이트 기반의 고체산에 [5]의해 촉매된다.
환원 경로
수소화 과정을 통해 불포화 N함유 관능기는 니켈 촉매의 존재 하에서 수소를 이용한 아민으로 환원된다.적절한 그룹에는 아질화물, 아지드, 옥심, 아미드 및 니트로가 포함됩니다.아질산염의 경우 산성 또는 알칼리성 조건에 민감하여 -CN기의 가수분해를 일으킬 수 있다.LiAlH는4 실험실 규모에서 이러한 동일한 그룹의 감소를 위해 더 일반적으로 사용된다.
많은 아민은 환원아미노화를 통해 알데하이드와 케톤에서 생성되며, 환원아미노화는 촉매적으로 또는 화학적으로 진행될 수 있다.
아닐린(CHNH652) 및 그 유도체는 니트로아로마틱스의 환원에 의해 제조된다.산업에서는 수소가 선호되는 환원제인 반면, 실험실에서는 주석과 철이 종종 사용된다.
특수한 방법
아민의 제조에는 많은 방법이 존재하며, 이 방법들 중 많은 것들이 다소 전문적이다.
| 반응명 | 기판 | 댓글 |
|---|---|---|
| 스타딩거 환원 | 유기 아지드화물 | 이 반응은 리튬 수소화 알루미늄과 같은 환원제에서도 발생합니다. |
| 슈미트 반응 | 카르본산 | |
| 아자바일리스힐만 반응 | 이민 | 알릴아민합성 |
| 자작나무 감소 | 이민 | 그리냐르 반응과 같은 [13]불안정한 이민 중간체를 포획하는 반응에 유용합니다. |
| 호프만 분해 | 아미드 | 이 반응은 1차 아민의 준비에만 유효합니다.다른 아민과 오염되지 않은 1차 아민의 산출량이 좋습니다. |
| 호프만 소거 | 제4급 암모늄염 | 튼튼한 베이스로 시술 시 |
| 루카르트 반응 | 케톤 및 알데히드 | 포름산 및 암모니아에 의한 환원 아미노화(이민 중간체 경유) |
| 호프만-뢰플러 반응 | 할로아민 | |
| 에슈바일러-클라크 반응 | 아민 | 포름산 및 포름알데히드를 통한 이미네 중간체를 통한 환원 아미노화 |
반응
알킬화, 아실화, 술폰화 등
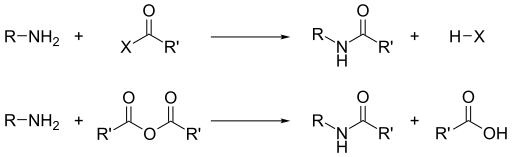
염기성 외에도 아민의 주요 반응성은 친핵성이다.[14]대부분의 1차 아민은 금속 이온이 배위 복합체를 만드는 데 좋은 리간드입니다.아민은 할로겐화 알킬에 의해 알킬화된다.아실 염화물과 산 무수물은 1차 및 2차 아민과 반응하여 아미드를 형성한다.
마찬가지로 염화술포닐도 술폰아미드를 얻을 수 있다.힌스버그 반응으로 알려진 이 변형은 아민의 존재에 대한 화학적 테스트입니다.
아민은 염기성이기 때문에 산을 중화시켜 대응하는 암모늄염3+ RNH를 형성한다.카르본산과 1차 및 2차 아민에서 생성되면 이들 소금은 열적으로 탈수되어 대응하는 아미드를 형성한다.
아민은 삼산화황 또는 그 공급원으로 처리할 때 황산화된다.
- RNH2 + SO3 → RNSOH23
산염기 반응
알킬아민은 pH=7 부근에서 양성자화되어 알킬암모늄 유도체를 생성한다.
디아조타이제이션
아민들은 아질산과 함께 디아조늄 염을 만든다.알킬 디아조늄 소금은 너무 불안정하기 때문에 별로 중요하지 않다.가장 중요한 구성 요소는 아닐린("페닐아민")과 같은 방향족 유도체입니다(A = 아릴 또는 나프틸).
아닐린과 나프틸아민은 보다 안정적인 디아조늄 소금을 형성하며, 이는 결정 [15]형태로 분리될 수 있다.디아조늄염은 N기를2 음이온으로 치환하는 것을 포함한 다양한 유용한 변형을 겪는다.예를 들어, 시안화 제철소는 다음과 같은 질화물을 생성합니다.
아릴디아조늄은 페놀과 같은 전자가 풍부한 방향족 화합물과 결합하여 아조 화합물을 형성합니다.이러한 반응은 [16]염료 생산에 널리 적용된다.
Imines로의 변환
이민 형성은 중요한 반응이다.1차 아민은 케톤과 알데히드와 반응하여 이민을 형성합니다.포름알데히드(R' = H)의 경우, 이러한 생성물은 일반적으로 순환 삼량체로 존재한다.
- RNH2 + R'2C → O'C 2= R'C → HO2
이러한 imin의 감소는 2차 아민을 생성한다.
- R'2C=H+H2→R'2CH–NHR
마찬가지로 2차 아민은 케톤 및 알데히드와 반응하여 에나민을 형성합니다.
- RNH2 + R'(RchCH2)C=O → RchCH=C(NR)2R' + HO2
개요
아민의 반응 개요는 다음과 같습니다.
| 반응명 | 반응 생성물 | 댓글 |
|---|---|---|
| 아민 알킬화 | 아민류 | 치환 정도가 증가 |
| 쇼텐-바우만 반응 | 아미드 | 시약 : 아실염화물, 산무수물 |
| 힌스버그 반응 | 술폰아미드류 | 시약: 염화술포닐 |
| 아민-카르보닐 응축 | 아이민스 | |
| 유기 산화 | 니트로소 화합물 | 시약: 페르옥시모노황산 |
| 유기 산화 | 디아조늄염 | 시약 : 아질산 |
| 아연케 반응 | 아연케알데히드 | 시약: 피리지늄염, 1차 및 2차 아민 포함 |
| 감압 열화 | 제3아민 | 4차 암모늄 양이온 저감 |
| 호프만-마티우스 전위 | 아릴 치환 아닐린 | |
| 폰 브라운 반응 | 유기시아나미드 | 브롬화 시안(Cyanogen)을 사용한 분할(테리 아민만 해당) |
| 호프만 소거 | 알켄 | 덜 저해된 탄소의 β 제거로 진행됨 |
| 코프 반응 | 알켄 | 호프만 제거와 유사 |
| 카르빌아민 반응 | 이소니트릴 | 프라이머리 아민만 |
| 호프만 겨자유 시험 | 이소티오시아네이트 | CS와2 HgCl이2 사용됩니다.티오시아네이트는 겨자 냄새가 난다. |
생물학적 활동
아민은 생물학 어디에나 있다.아미노산의 분해는 트리메틸아민 냄새가 나는 부패한 생선의 경우에서 유명한 아민을 방출합니다.에피네프린, 노르에피네프린, 도파민, 세로토닌, 히스타민을 포함한 많은 신경전달물질은 아민이다.양성자화 아미노기(–NH+
3)는 단백질, 특히 아미노산 리신에서 [17]가장 일반적으로 양전하를 띤 부분이다.음이온성 폴리머 DNA는 전형적으로 다양한 아민이 풍부한 [18]단백질에 결합되어 있다.또한 리신에 대전된 1차 암모늄은 단백질의 [19]3차원 구조에 대한 주요 영향 중 하나인 폴리펩타이드 중 다른 아미노산의 카르복실기와 염교를 형성한다.
아민 도포
염료
아조염료 제조의 원료로 1차 방향족이 사용된다.아질산과 반응하여 디아조늄염을 형성하고, 디아조늄염은 결합반응을 거쳐 아조화합물을 형성할 수 있다.아조 컴포넌트는 색상이 높기 때문에 다음과 같은 염색 산업에서 널리 사용됩니다.
약품
약물과 약물 후보자의 약 42%는 아민 작용기를 [20]포함하고 있다.
- 클로페닐라민은 감기, 꽃가루 알레르기, 가려움증, 벌레 물림, 침 등으로 인한 알레르기 질환을 완화시키는 데 도움이 되는 항히스타민제입니다.
- 클로르프로마진은 잠을 유도하지 않고 진정시키는 진정제이다.그것은 불안, 흥분, 불안, 심지어 정신 장애를 완화시키는 데 사용된다.
- 염산아민으로서 에페드린과 페닐레프린이 충혈제거제로 사용된다.
- 암페타민, 필로폰, 메카티논은 미국 DEA에 의해 통제 물질로 등록된 정신 자극제 아민이다.
- 항정신병 약물인 티오리다진은 다른 [21]아미드에 대한 효과 때문에 부분적으로 항정신병 효과를 보이는 것으로 여겨지는 아미드이다.
- 아미트리프틸린, 이미프라민, 로페프라민 및 클로미프라민은 삼환식 항우울제 및 제3아민이다.
- 노르티프틸린, 데시플라민 및 아목사핀은 삼환식 항우울제 및 2차 아민이다.(삼환식은 측쇄상의 최종 아미노기의 성질에 따라 분류됩니다.)
- 치환된 트립타민과 페네틸아민은 다양한 사이키델릭 약물의 주요 기본 구조이다.
- 모르핀, 코데인, 헤로인과 같은 아편 진통제는 제3의 아민이다.
가스 처리
천연가스 및 정제공정에서 이산화탄소(CO2) 및 황화수소(HS2)를 제거하기 위해 수성 모노에탄올아민(MEA), 디글리콜아민(DGA), 디에탄올아민(DEA), 디에탄올아민(DEA) 및 메틸디에탄올아민(MDEA)이 산업적으로 널리 사용된다.또한 연소 가스와 연도 가스에서 CO를 제거하는2 데 사용될 수 있으며 온실 가스의 감소 가능성이 있을 수 있습니다.관련된 과정은 [22]감미라고 알려져 있다.
에폭시 수지 경화제
에폭시 수지 경화제로 [23][24]아민이 많이 사용된다.디메틸에틸아민, 시클로헥실아민 및 4,4 - 디아미노디시클로헥실메탄 [5]등의 다양한 디아민을 포함한다.테트라에틸렌펜타민, 트리에틸렌테트라민 등의 다기능 아민도 이 [25]용량으로 널리 사용된다.이 반응은 에폭시 수지의 옥시란 고리의 가장 바깥쪽 탄소를 공격하는 아민 질소의 단일 전자 쌍에 의해 진행됩니다.이는 에폭시드의 링 변형을 완화하며 [citation needed]반응의 원동력이 됩니다.
안전.
에틸아민과 같은 저분자량의 단순 아민은 LD가 10050~1000mg/kg일 때만 약독성이 있다.그것들은 피부 자극제이며,[5] 특히 어떤 것들은 피부를 통해 쉽게 흡수되기 때문에 더욱 그렇다.아민은 광범위한 종류의 화합물이며, 그 클래스의 더 복잡한 구성원들은 스트리치닌과 헤로인처럼 매우 생체 활성적일 수 있습니다.
「 」를 참조해 주세요.
레퍼런스
- ^ "amine". The American Heritage Dictionary of the English Language (5th ed.). HarperCollins.
- ^ "Amine definition and meaning". Collins English Dictionary. Archived from the original on 23 February 2015. Retrieved 28 March 2017.
- ^ "amine – definition of amine in English". Oxford Dictionaries. Archived from the original on 23 February 2015. Retrieved 28 March 2017.
- ^ McMurry, John E. (1992), Organic Chemistry (3rd ed.), Belmont: Wadsworth, ISBN 0-534-16218-5
- ^ a b c d e f g Eller, Karsten; Henkes, Erhard; Rossbacher, Roland; Höke, Hartmut (2000). "Amines, Aliphatic". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a02_001.
- ^ a b c Smith, Janice Gorzynski (2011). "Chapter 25 Amines". Organic chemistry (3rd ed.). New York, NY: McGraw-Hill. pp. 949–993. ISBN 978-0-07-337562-5. Archived from the original (Book) on 28 June 2018. Retrieved 26 June 2018.
- ^ "3.11 Basic properties of amines". Chemistry LibreTexts. 28 September 2015. Archived from the original on 23 May 2021. Retrieved 23 May 2021.
- ^ G. M. Wöjcik "Anilines의 구조적 화학"(Patai의 기능성 그룹 화학), S. Patai, Ed. 2007, Wiley-VCH, Weinheim.doi: 10.1002/9780470682531.pat0385
- ^ J. W. Smith (1968). S. Patai (ed.). "Basicity and complex formation". Patai's Chemistry of Functional Groups: 161–204. doi:10.1002/9780470771082.ch4. ISBN 9780470771082.
- ^ Hall, H. K. (1957). "Correlation of the Base Strengths of Amines". Journal of the American Chemical Society. 79 (20): 5441–5444. doi:10.1021/ja01577a030.
- ^ Kaljurand, I.; Kütt, A.; Sooväli, L.; Rodima, T.; Mäemets, V.; Leito, I.; Koppel, I. A. (2005). "Extension of the Self-Consistent Spectrophotometric Basicity Scale in Acetonitrile to a Full Span of 28 pKa Units: Unification of Different Basicity Scales". The Journal of Organic Chemistry. 70 (3): 1019–1028. doi:10.1021/jo048252w. PMID 15675863.
- ^ Smith, Michael B.; March, Jerry (2007), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th ed.), New York: Wiley-Interscience, ISBN 978-0-471-72091-1
- ^ Weiberth, Franz J.; Hall, Stan S. (1986). "Tandem alkylation-reduction of nitriles. Synthesis of branched primary amines". Journal of Organic Chemistry. 51 (26): 5338–5341. doi:10.1021/jo00376a053.
- ^ March, Jerry (1992), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (4th ed.), New York: Wiley, ISBN 0-471-60180-2
- ^ A. N. Nesmajanow (1943). "β-Naphthylmercuric chloride". Organic Syntheses.; Collective Volume, vol. 2, p. 432
- ^ Hunger, Klaus; Mischke, Peter; Rieper, Wolfgang; Raue, Roderich; Kunde, Klaus; Engel, Aloys (2000). "Azo Dyes". Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a03_245. ISBN 3527306730.
- ^ Andrade, Miguel A.; O'Donoghue, Seán I.; Rost, Burkhard (1998). "Adaptation of protein surfaces to subcellular location". Journal of Molecular Biology. 276 (2): 517–25. CiteSeerX 10.1.1.32.3499. doi:10.1006/jmbi.1997.1498. PMID 9512720.
- ^ Nelson, D. L.; Cox, M. M. (2000). Lehninger, Principles of Biochemistry (3rd ed.). New York: Worth Publishing. ISBN 1-57259-153-6.
- ^ Dill, Ken A. (1990). "Dominant forces in protein folding". Biochemistry. 29 (31): 7133–55. doi:10.1021/bi00483a001. PMID 2207096.
- ^ Roughley, Stephen D.; Jordan, Allan M. (2011). "The Medicinal Chemist's Toolbox: An Analysis of Reactions Used in the Pursuit of Drug Candidates". Journal of Medicinal Chemistry. 54 (10): 3451–3479. doi:10.1021/jm200187y. PMID 21504168.
- ^ 미국 의료 시스템 약사 협회; AHFS 약물 정보 2010.Bethesda, MD (2010), 페이지 2510
- ^ Hammer, Georg; Lübcke, Torsten; Kettner, Roland; Davis, Robert N.; Recknagel, Herta; Commichau, Axel; Neumann, Hans-Joachim; Paczynska-Lahme, Barbara (2000). "Natural Gas". Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a17_073. ISBN 3527306730.
- ^ "amine curing agent: Topics by Science.gov". science.gov. Retrieved 1 March 2022.
- ^ Howarth, Graham (1 January 1995). "The use of water‐based epoxies for anti‐corrosive primers". Pigment & Resin Technology. 24 (6): 3–6. doi:10.1108/eb043156. ISSN 0369-9420.
- ^ Eller K, Henkes E, Rossbacher R, Höke H (2005). "Amines, Aliphatic". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a02_001. ISBN 3527306730.
추가 정보
- "Amines Introduction to Chemistry". courses.lumenlearning.com. Retrieved 22 July 2021.
- Flick, Ernest W. (1993). Epoxy resins, curing agents, compounds, and modifiers : an industrial guide. Park Ridge, NJ. ISBN 978-0-8155-1708-5. OCLC 915134542.

![Amine reaction with carboxylic acids {\displaystyle {\underbrace {\ce {H-\!\!{\overset {\displaystyle R1 \atop |}{\underset {| \atop \displaystyle R2}{N}}}\!\!\!\!:}} _{\text{amine}}+\underbrace {\ce {R3-{\overset {\displaystyle O \atop \|}{C}}-OH}} _{\text{carboxylic acid}}->}\ \underbrace {\ce {{H-{\overset {\displaystyle R1 \atop |}{\underset {| \atop \displaystyle R2}{N+}}}-H}+R3-COO^{-}}} _{{\text{substituted-ammonium}} \atop {\text{carboxylate salt}}}{\ce {->[{\text{heat}}][{\text{dehydration}}]}}{\underbrace {\ce {{\overset {\displaystyle R1 \atop |}{\underset {| \atop \displaystyle R2}{N}}}\!\!-{\overset {\displaystyle O \atop \|}{C}}-R3}} _{\text{amide}}+\underbrace {\ce {H2O}} _{\text{water}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0fe12f730885534fda8c9f8c41b2bd6ba4371fcc)




