염교(단백질 및 초분자)
Salt bridge (protein and supramolecular)화학에서 소금 브릿지는 수소 결합과 이온 결합의 두 가지 비공유 상호작용의 조합입니다(그림 1).이온 쌍은 화학, 생물학적 시스템, 다양한 물질 및 이온 쌍 크로마토그래피와 같은 많은 응용 분야에서 가장 중요한 비공유력 중 하나입니다.그것은 단백질의 장내적으로 불리한 접힌 형태에 대한 안정성에 가장 일반적으로 관찰되는 기여이다.비공유 상호작용은 상대적으로 약한 상호작용으로 알려져 있지만, 작은 안정화 상호작용이 합산하여 [1]컨포머의 전반적인 안정성에 중요한 기여를 할 수 있다.염교는 단백질에서 발견될 뿐만 아니라 초분자 화학에서도 발견될 수 있다.각각의 열역학은 실험 절차를 통해 염교의 자유 에너지 기여도를 주의 전체 자유 에너지로 접근하기 위해 탐구됩니다.
화학접합 시 염교
물에서 염교나 이온쌍의 형성은 대부분 엔트로피에 의해 이루어지며,[2] 일반적으로 결합 시 상호작용하는 이온의 용융으로 인해 불리한 δH 기여가 동반된다.수소 결합은 예를 들어 양성자화된 암모늄 이온과 이온 쌍의 안정성에 기여하고 음이온과 함께 카르본산염, 인산염 등의 경우 탈양성자에 의해 형성되며, 결합 상수는 pH에 의존합니다.이온 쌍을 위한 엔트로픽 구동력(H 결합 기여도가 유의하지 않은 경우)도 용매로서 메탄올에서 발견됩니다.비극성 용제에서는 매우 높은 연관 상수를 가진 접촉 이온 쌍이 형성되며,[3][4] 기체 단계에서는 예를 들어 알칼리 할로겐화물의 연관 에너지가 최대 200 kJ/[5]mol에 도달합니다.Bjerrum 또는 Fuoss 방정식은 이온 쌍 연관성을 이온 전하 zA 및 zB와 매체의 유전 상수 δ의 함수로 설명한다. 안정성 δG 대 zAzB의 해당 그래프는 200개 이상의 이온 쌍에 대해 다양한 [6]이온에 대한 예상 선형 상관 관계를 보여준다.무기이온과 유기이온은 [7][8]이온의 성질(크기, 분극성 등)과는 거의 무관하게 음이온과 양이온의 1:1 조합에 대해 5~6kJ/mol 정도의 염교결합 δG 값으로 나타난다.δG 값은 첨가물이며 전하의 거의 선형 함수이며, 예를 들어 이중 하전된 인산 음이온과 단일 하전된 암모늄 양이온의 상호작용은 약 2x5 = 10 kJ/mol을 차지한다.δG 값은 Debye-Hückel 방정식에서 설명한 바와 같이 0 이온 강도 1에서 δG = 8 kJ/mol을 관측할 때 용액의 이온 강도 I에 따라 달라진다.음이온 전하 z의 함수로서의 알칼리 이온 쌍의 안정성은 보다 상세한 [9]방정식으로 설명할 수 있다.
단백질에서 발견되는 염교
소금 브릿지는 아스파라긴산 또는 글루탐산의 음이온성 카르본산−(RCOO)과 리신의 양이온성 암모늄3+(RNH) 또는 아르기닌의 구아니디늄(RNHC2(NH)2+에서 가장 자주 발생한다(그림 2).[1]이들은a 가장 흔하지만 pK를 방해하는 외부 요인에 따라 히스티딘, 티로신, 세린과 같은 이온성 측쇄를 가진 다른 잔류물들도 참여할 수 있다.염교에 관여하는 잔류물 사이의 거리도 중요한 것으로 지적되고 있다.필요한 거리는 4Ω(오후 400) 미만입니다.이 거리보다 큰 아미노산은 염교를 [11]형성할 자격이 없다.단백질 전체에서 발견되는 수많은 아미노산 이온화 곁사슬 때문에 단백질이 배치되는 pH는 안정성에 매우 중요합니다.
단백질의 염교 안정성을 정량화하는 방법
단백질의 접힌 상태에 대한 전반적인 안정성에 대한 소금 브릿지의 기여도는 돌연변이 유발 연구 및 핵자기 공명 [12]기술로부터 수집된 열역학 데이터를 통해 평가할 수 있다.높은 pH에서의 침전을 방지하기 위해 특이적으로 변이된 의사야생형 단백질을 사용하여 접힌 단백질 상태의 전체 자유 에너지에 대한 염교의 기여도를 점변환, 변경 및 결과적으로 염교를 파괴함으로써 결정할 수 있다.예를 들어 잔류물 70의 아스파라긴산(Asp)과 잔류물 31의 히스티딘(His) 사이의 T4 리소자임에서 소금 브릿지가 존재하는 것으로 확인되었다(그림 3).아스파라긴(Asn)을 사용한 사이트 지향 돌연변이 유발(그림 4)이 3개의 새로운 돌연변이를 얻었다.Asp70Asn His31(머턴트1), Asp70His31Asn(머턴트2), Asp70Asn His31Asn(더블머턴트2).
일단 돌연변이가 확립되면 소금 브릿지와 관련된 자유 에너지를 계산하기 위해 두 가지 방법을 사용할 수 있습니다.한 가지 방법은 야생형 단백질의 녹는 온도와 세 가지 돌연변이 단백질의 녹는 온도를 관찰하는 것이다.변성은 원형 이색성의 변화를 통해 감시할 수 있다.용융 온도가 낮아지면 안정성이 저하됩니다.이는 Becktel과 Shellman에 의해 설명된 방법을 통해 정량화되며, 두 방법 간의 자유 에너지 차이는 [13]δTΩS를 통해 계산됩니다.이 계산에는 몇 가지 문제가 있으며 매우 정확한 [citation needed]데이터에서만 사용할 수 있습니다.T4 리조자임 예에서 의사 야생형의 δS는 pH 5.5에서 이전에 보고되었으므로 이 pH에서 11°C의 중간점 온도차에 360 cal/(mol·K)의 보고된 δS(1.5kJ/(mOL·K)의 에너지 변화를 곱한 것이다.이 값은 Salt Bridge에 의해 단백질의 안정성에 기여하는 자유 에너지의 양에 해당한다.
두 번째 방법은 핵자기공명분광법을 이용하여 염교의 자유 에너지를 계산한다.카르본산염 또는 암모늄기에 인접한 카본의 양성자에 대응하는 화학적 시프트를 기록하면서 적정한다.적정곡선의 중간점은 pKa, 즉 양성자화된 pH: 탈양성자 분자의 비율이 1:1인 pH에 해당한다.T4 리소자임 예에 이어 히스티딘31의 C2 양성자 변화를 관찰함으로써 적정곡선을 구한다(그림5).그림 5는 야생형과 Asp70이 Asn인 돌연변이 사이의 적정곡선 변화를 나타낸다.형성된 염교는 탈양성자화된 Asp70과 양성자화된 His31 사이에 있다.이 교호작용에 의해 His31의a pK에서 볼 수 있는 이동이 발생합니다.염교가 없는 전개 야생형 단백질에서 His31은 적당한 이온 강도의 HO 버퍼에서2 pK가a 6.8인 것으로 보고되었다.그림 5는 와일드타입 9.05의 pK를a 나타내고 있습니다.이러한a pK의 차이는 His31과 Asp70의 상호작용에 의해 지원됩니다.염교를 유지하기 위해 His31은 양성자를 최대한 오래 유지하려고 할 것이다.돌연변이 D70N과 같이 소금 브릿지가 교란되면 pK는a 전개상태에서 His31에 훨씬 가까운 6.9의 값으로 되돌아간다.
pK의a 차이는 염교의 자유 에너지 기여도를 반영하여 정량화할 수 있다.Gibbs 자유 에너지 사용 : δG = -RT ln(Keq) (R은 유니버설 가스 상수, T는 켈빈 단위, K는eq 평형 상태에서의 반응의 평형 상수)His31의 탈양성자는 산 해리 상수 Ka: His31-H+ his His31 + H로+ 알려진 특수eq K와의 산 평형 반응이다.그런a 다음 pK는 pKa = -log(K)에a 의해 K와a 관련된다.돌연변이와 야생형의 자유 에너지 차이의 계산은 이제 자유 에너지 방정식a, pK의 정의, 관측된a pK 값 및 자연 로그와 로그 사이의 관계를 사용하여 수행할 수 있습니다.T4 리조자임 사례에서, 이 접근법은 전체 자유 [12]에너지에 약 3kcal/mol의 계산된 기여도를 산출했다.His31의 돌연변이 후 pK의a 변화를 감시함으로써 염분 브릿지의 다른 참가자(T4 리조자임 예시의 Asp70 등)에게도 같은 접근방식을 취할 수 있다.
적절한 실험을 선택할 때 주의해야 할 점은 단백질 내의 염교 위치와 관련이 있습니다.환경은 상호작용에서 [14]큰 역할을 합니다.높은 이온 강도에서는 정전 상호작용이 수반되기 때문에 소금 브릿지를 완전히 마스킹할 수 있습니다.T4 리조임의 His31-Asp70 소금 브릿지는 단백질 안에 묻혔다.엔트로피는 일반적으로 이동 능력을 가진 잔류물이 정전 상호작용과 수소 결합에 의해 수축되는 표면 염교에서 더 큰 역할을 한다.이것은 상호작용의 [15]기여가 거의 지워질 정도로 엔트로피를 감소시키는 것으로 나타났다.표면염교는 매설염교와 마찬가지로 이중 돌연변이 주기 및 NMR [16]적정법을 사용하여 연구할 수 있다.매설염교가 다른 모든 것과 마찬가지로 안정성에 기여하는 경우가 존재하지만, 매설염교는 예외가 존재하며, 매설염교는 불안정 [11]효과를 나타낼 수 있다.또한 특정 조건 하에서 표면염교는 안정화 [14][16]효과를 나타낼 수 있다.안정화 또는 불안정화 효과는 사례별로 평가해야 하며 포괄적 진술은 거의 할 수 없습니다.
초분자 화학
초분자 화학은 고분자 간의 비공유 상호작용에 관련된 분야이다.염교는 음이온 감지, 분자 캡슐 합성, 이중 나선형 폴리머를 포함한 다양하고 창의적인 방법으로 이 분야의 화학자들에 의해 사용되어 왔다.
음이온 착화
초분자 화학의 주요 기여는 [17][18][19][20][21][22]음이온의 인식과 감지이다.이온 쌍은 음이온 복합체의 가장 중요한 원동력이지만, 할로겐화물 계열 내의 선택성은 대부분 수소 결합 기여에 의해 달성되었다.
분자 캡슐
분자 캡슐은 게스트 분자를 포착하고 유지하기 위해 설계된 화학 비계입니다(분자 캡슐화 참조).Szumna와 동료들은 키랄 [23]내부를 가진 새로운 분자 캡슐을 개발했다.이 캡슐은 플라스틱 부활절 달걀처럼 두 부분으로 구성되어 있습니다(그림 6).두 반쪽 사이의 소금 브릿지 상호작용으로 인해 용액에서 자체 조립됩니다(그림 7).60°C까지 가열해도 안정적입니다.
이중 나선 폴리머
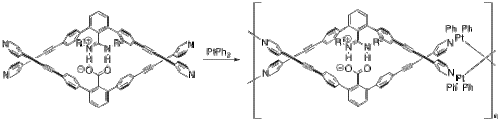
야시마와 동료들은 DNA와 매우 유사한 [24]이중 나선 구조를 채택한 여러 개의 폴리머를 만들기 위해 염교를 사용해 왔다.한 예로, 그들은 이중 나선형 금속 [25]중합체를 만들기 위해 백금을 사용했다.단량체와 플래티넘부터.II) 비페닐(그림8)은 일련의 배위자 교환 반응을 통해 금속 중합체 자가 조립된다.단량체의 두 반쪽은 탈양성자 카르본산염과 양성자 니트로겐 사이의 소금 브릿지를 통해 함께 고정됩니다.
레퍼런스
- ^ a b Dougherty, Dennis A. (2006). Modern Physical Organic Chemistry. Sausalito, CA: University Science Books. ISBN 978-1-891389-31-3.
- ^ Marcus Y, Hefter G (November 2006). "Ion pairing". Chemical Reviews. 106 (11): 4585–621. doi:10.1021/cr040087x. PMID 17091929.
- ^ Isaacs N (1996). Physical Organic Chemistry (2nd ed.). England: Longmans. ISBN 978-0582218635.[페이지 필요]
- ^ 자연 및 합성 고분자에서의 이온 상호작용(A).Ciferri와 A.Perico, Eds), 2012 John Wiley & Sons, Inc., 35 ff ISBN 978-0-470-52927-0.
- ^ Chase MW (1998). NIST-JANAF Thermochemical Tables. J. Phys. Chem. Ref. Data. Vol. Monograph 9 (Fourth ed.). pp. 1–1951.
- ^ Schneider HJ, Yatsimirsky AK, eds. (2000). Principles and methods in supramolecular chemistry. Chichester: Wiley. ISBN 978-0-471-97253-2.[페이지 필요]
- ^ Biedermann F, Schneider HJ (May 2016). "Experimental Binding Energies in Supramolecular Complexes". Chemical Reviews. 116 (9): 5216–300. doi:10.1021/acs.chemrev.5b00583. PMID 27136957.
- ^ Schneider HJ (2009). "Binding mechanisms in supramolecular complexes". Angewandte Chemie. 48 (22): 3924–77. doi:10.1002/anie.200802947. PMID 19415701.
- ^ Daniele PG, Foti C, Gianguzza A, Prenesti E, Sammartano S (2008). "Weak alkali and alkaline earth metal complexes of low molecular weight ligands in aqueous solution". Coordination Chemistry Reviews. 252 (10–11): 1093–1107. doi:10.1016/j.ccr.2007.08.005.
- ^ Al-Haggar M, Madej-Pilarczyk A, Kozlowski L, Bujnicki JM, Yahia S, Abdel-Hadi D, Shams A, Ahmad N, Hamed S, Puzianowska-Kuznicka M (November 2012). "A novel homozygous p.Arg527Leu LMNA mutation in two unrelated Egyptian families causes overlapping mandibuloacral dysplasia and progeria syndrome". European Journal of Human Genetics. 20 (11): 1134–40. doi:10.1038/ejhg.2012.77. PMC 3476705. PMID 22549407.
- ^ a b Kumar S, Nussinov R (July 2002). "Close-range electrostatic interactions in proteins". ChemBioChem. 3 (7): 604–17. doi:10.1002/1439-7633(20020703)3:7<604::AID-CBIC604>3.0.CO;2-X. PMID 12324994.
- ^ a b Anderson DE, Becktel WJ, Dahlquist FW (March 1990). "pH-induced denaturation of proteins: a single salt bridge contributes 3-5 kcal/mol to the free energy of folding of T4 lysozyme". Biochemistry. 29 (9): 2403–8. doi:10.1021/bi00461a025. PMID 2337607.
- ^ Becktel WJ, Schellman JA (November 1987). "Protein stability curves". Biopolymers. 26 (11): 1859–77. doi:10.1002/bip.360261104. PMID 3689874.
- ^ a b Horovitz A, Serrano L, Avron B, Bycroft M, Fersht AR (December 1990). "Strength and co-operativity of contributions of surface salt bridges to protein stability". Journal of Molecular Biology. 216 (4): 1031–44. doi:10.1016/S0022-2836(99)80018-7. PMID 2266554.
- ^ Sun DP, Sauer U, Nicholson H, Matthews BW (July 1991). "Contributions of engineered surface salt bridges to the stability of T4 lysozyme determined by directed mutagenesis". Biochemistry. 30 (29): 7142–53. doi:10.1021/bi00243a015. PMID 1854726.
- ^ a b Strop P, Mayo SL (February 2000). "Contribution of surface salt bridges to protein stability" (PDF). Biochemistry. 39 (6): 1251–5. doi:10.1021/bi992257j. PMID 10684603.
- ^ Bianchi A, Bowman-James K, García-España E, eds. (1997). Supramolecular chemistry of anions. New York: Wiley-VCH. ISBN 9780471186229.
- ^ Bowman-James K, Bianchi A, García-Espana E, eds. (2012). Anion coordination chemistry. Weinheim: Wiley-VCH. ISBN 978-3527323708.
- ^ Sessler JL, Gale PA, Cho WS, eds. (2006). Anion receptor chemistry. Cambridge: Royal Society of Chemistry. ISBN 978-0854049745.
- ^ Gale PA, Dehaen W, eds. (2010). Anion Recognition in Supramolecular Chemistry. Springer Science. Bibcode:2010arsc.book.....G. ISBN 978-3642264702.
- ^ Busschaert N, Caltagirone C, Van Rossom W, Gale PA (May 2015). "Applications of supramolecular anion recognition". Chemical Reviews. 115 (15): 8038–155. doi:10.1021/acs.chemrev.5b00099. PMID 25996028.
- ^ Evans NH, Beer PD (October 2014). "Advances in anion supramolecular chemistry: From recognition to chemical applications" (PDF). Angewandte Chemie International Edition. 53 (44): 11716–54. doi:10.1002/anie.201309937. PMID 25204549.
- ^ Kuberski B, Szumna A (April 2009). "A self-assembled chiral capsule with polar interior". Chemical Communications (15): 1959–61. doi:10.1039/b820990a. PMID 19333456.
- ^ Liu J, Lam JW, Tang BZ (November 2009). "Acetylenic polymers: syntheses, structures, and functions". Chemical Reviews. 109 (11): 5799–867. doi:10.1021/cr900149d. PMID 19678641.
- ^ Ikeda M, Tanaka Y, Hasegawa T, Furusho Y, Yashima E (May 2006). "Construction of double-stranded metallosupramolecular polymers with a controlled helicity by combination of salt bridges and metal coordination". Journal of the American Chemical Society. 128 (21): 6806–7. doi:10.1021/ja0619096. PMID 16719458.