혈관내피증식인자
Vascular endothelial growth factor| 혈관내피증식인자 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 식별자 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 에일리어스 | 혈관내피증식인자 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| 외부 ID | Gene Cards : [ 1 ] | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| 위키 데이터 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
혈관내피성장인자(VEGF)는 원래 혈관투과성인자(VPF)[1]로 알려진 많은 세포에 의해 생성되는 신호 단백질로 혈관의 형성을 자극한다.구체적으로 말하면, VEGF는 성장 인자의 하위 계열이며, 혈소판 유래 성장 인자 계열인 시스틴-노트 성장 인자이다.그것들은 혈관형성(배아 순환계의 신생)과 혈관형성(기존 혈관구조에서 혈관의 성장)에 모두 관여하는 중요한 신호 단백질이다.
저산소 상태 [2]등 혈액순환이 원활하지 않을 때 조직에 대한 산소 공급을 복구하는 시스템의 일부입니다.VEGF의 혈청 농도는 기관지 천식과 [3]당뇨병에서 높다.VEGF의 정상 기능은 배아 발달 과정에서 새로운 혈관을 만들고, 부상 후 새로운 혈관을 만들고, 운동 후 근육을 만들고, 막힌 혈관을 우회하는 것이다.그것은 질병의 원인이 될 수 있다.고형암은 충분한 혈액공급 없이는 제한된 크기 이상으로 자랄 수 없다; VEGF를 발현할 수 있는 암은 성장하고 전이될 수 있다.VEGF의 과잉 발현은 눈의 망막과 신체의 다른 부분에 혈관 질환을 일으킬 수 있다.아프리베셉트, 베바시주맙, 라니비주맙, 페갑타닙과 같은 약물은 VEGF를 억제하고 이러한 질병을 통제하거나 늦출 수 있습니다.
역사
1970년, 유다 포크맨 외 연구진은 종양에 의해 혈관신생을 일으키는 인자를 종양 혈관신생인자라고 [4]기술했다.1983년 Senger 등은 기니피그와 [1]햄스터의 종양에 의해 분비되는 혈관 투과성 인자를 확인했다.1989년 페라라와 헨젤은 소뇌하수체 모낭세포의 동일한 인자를 정제, 복제 및 [5]VEGF라고 명명했다.유사한 VEGF 대체 스플라이싱이 [6]Tischer 등에 의해 1991년에 발견되었다.1996년과 1997년 사이에 Christinger와 De Vos는 VEGF의 결정 구조를 얻었는데, 처음에는 분해능이 2.5 o이고, 나중에는 1.9 [7][8][9]o이었다.
Fms 유사 티로신 키나제-1(flt-1)은 1992년 [10]페라라 등에 의해 VEGF 수용체로 확인되었다.키나제 삽입 도메인 수용체(KDR)는 1992년 Terman 등에 의해서도 [11]VEGF 수용체로 확인되었다.1998년에는 뉴로실린 1과 뉴로실린 2가 VEGF [12]수용체로 작용하는 것으로 나타났다.
분류
포유동물에서 VEGF 패밀리는 VEGF-A, 태반성장인자(PGF), VEGF-B, VEGF-C 및 VEGF-D의 5개 멤버를 포함한다.후자의 멤버는 VEGF-A 이후에 검출되었습니다.이들이 검출되기 전에는 VEGF-A는 VEGF로 알려져 있었습니다.바이러스(VEGF-E)와 일부 뱀의 독(VEGF-F)에 의해 암호화된 다수의 VEGF 관련 단백질도 발견되었다.
| 유형 | 기능. |
|---|---|
| VEGF-A | |
| VEGF-B | 배아 혈관신생(구체적으로는 심근조직)[16] |
| VEGF-C | 림프관 형성[17] |
| VEGF-D | 폐 세기관지[citation needed] 주변 림프혈관 발달에 필요 |
| PLGF | 혈관 형성에 중요하며 허혈, 염증, 상처 치유 및 [citation needed]암 발생 시 혈관 형성에 필요합니다. |
VEGF-A의 활성은 이름에서 알 수 있듯이 혈관 내피 세포에서 주로 연구되었지만, 다른 여러 세포 유형(예: 자극 단구/대식세포 이동, 뉴런, 암 세포, 신장 상피 세포)에 영향을 미친다.체외에서 VEGF-A는 내피세포 유사생성과 세포 이동을 촉진하는 것으로 나타났다.VEGF-A는 혈관확장제이며 미세혈관 투과성을 증가시키며, 원래는 혈관 투과성 인자로 불렸다.
Isoforms
단일 8-exon VEGFA 유전자의 mRNA 대체 스플라이싱에서 발생하는 VEGF-A에는 여러 개의 동소형식이 있다.이들은 말단 엑손(exon 8) 스플라이스 부위에 따라 언급되는 두 개의 그룹으로 분류된다. 근위 스플라이스 부위(VEGFxxx) 또는 원위 스플라이스 부위(VEGFbxxx)이다.또한 엑손6과 엑손7의 번갈아 스플라이싱은 이들의 헤파린결합 친화력과 아미노산수를 변화시킨다(인간의 경우121 VEGF121165, VEGF145165, VEGFb, VEGF189, VEGF, VEGF206, 이들 단백질의 설치류 오솔로그는 하나 적은 아미노산을 포함한다).말단(exon 8) 스플라이스 부위는 단백질이 혈관신생(혈관신생 중 발현되는 근위 스플라이스 부위)인지 항혈관신생(정상 조직에서 발현되는 원위 스플라이스 부위)인지를 결정하기 때문에 이러한 도메인은 VEGF 스플라이스 변종에 중요한 기능적 결과를 초래한다.또한 엑손6 및 엑손7의 포함 또는 제외는 세포표면상의 헤파란황산프로테오글리칸(HSPG) 및 뉴로실린공수용체와의 상호작용을 매개하여 VEGF 수용체(VEGFR)[18]를 결합 및 활성화하는 능력을 향상시킨다.최근 VEGF-C는 혈관신생 [19]효과를 발휘하지 않고 심실하부에서 신경생성을 유도하는 중요한 인자로 나타났다.
메커니즘
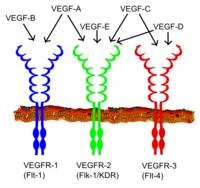
VEGF 패밀리의 모든 구성원은 세포 표면의 티로신 키나아제 수용체(VEGFR)에 결합함으로써 세포 반응을 자극하고, 서로 다른 부위, 시간 및 범위에도 불구하고 트랜스포스포릴화를 통해 이량화되고 활성화된다.VEGF 수용체는 7개의 면역글로불린 유사 도메인으로 이루어진 세포외 부분, 단일 막간 스패닝 영역 및 분할 티로신-키나아제 도메인을 포함하는 세포내 부분을 가진다.VEGF-A는 VEGFR-1(Flt-1) 및 VEGFR-2(KDR/Flk-1)[21]에 바인드 됩니다.VEGFR-2는 VEGF에 대한 기존의 거의 모든 셀룰러 응답을 매개하는 것으로 보입니다.VEGFR-1의 기능은 VEGFR-2 [22]시그널링을 변조하는 것으로 생각되지만 명확하게 정의되어 있지 않습니다.VEGFR-1의 또 다른 기능은 더미/디코이 수용체로서 작용하여 VEGF를 VEGFR-2 결합으로부터 격리하는 것일 수 있다(이는 배아의 혈관 형성 중에 특히 중요한 것으로 보인다).VEGF-A가 아닌 VEGF-C와 VEGF-D는 림프관 형성을 매개하는 제3수용체(VEGFR-3/Flt4)의 리간드이다.수용체(VEGFR3)는 표적 세포에 대한 리간드의 영구적인 작용과 기능을 매개하는 주요 리간드(VEGFC 및 VEGFD)의 결합 부위이다.혈관내피증식인자-C는 림프관형성(VEGFR3 경유)과 VEGFR2 경유 혈관형성을 자극할 수 있다.혈관내피증식인자-R3는 많은 종, 소, 버팔로, [23]영장류의 CL의 림프내피세포에서 검출되었다.
VEGFRs에 결합할 뿐만 아니라 VEGF는 뉴로일린과 VEGFRs로 이루어진 수용체 복합체에 결합한다.이 수용체 복합체는 내피 세포(혈관)[12][24]에서 VEGF 신호 전달 활성을 증가시켰다.뉴로일린(NRP)은 다방성 수용체이므로 다른 분자가 NRP/VEGFR 수용체 복합체의 신호 전달을 방해할 수 있다.예를 들어 클래스 3 세마포린은 NRP 결합을 위해 VEGF와165 경쟁하므로 VEGF 매개 혈관신생을 [25]조절할 수 있다.
표현
충분한 [21]산소를 공급받지 못하는 세포에서 VEGF-A 생산을 유도할 수 있다.세포에 산소가 부족하면 HIF, 저산소 유도인자, 전사인자를 생성한다.HIF는 다른 기능들(적혈구 조절 포함) 중에서 VEGF-A의 방출을 자극한다.그리고 나서 순환하는 VEGF-A는 내피세포의 VEGF 수용체에 결합하여 혈관신생을 [clarification needed]유도하는 티로신 키나제 경로를 유발한다.VEGF가 없는 상태에서 안지오포이에틴-2의 발현은 내피세포사 및 혈관 [26]퇴행으로 이어진다.반대로 생체 내에서 수행된 독일 연구는 30분 [27]동안 산소 섭취를 25% 줄인 후 VEGF 농도가 실제로 감소했다는 것을 발견했다.HIF1 alpha와 HIF1 beta는 지속적으로 생성되지만 HIF1 alpha는 높은2 O 불안정성이므로 유산소 조건에서는 분해된다.세포가 저산소가 되면 HIF1 알파가 지속되고 HIF1alpha/베타 복합체가 VEGF 방출을 자극합니다.마이크로베시클과 5-FU의 조합으로 편평상피세포암세포의 화학 감수성이 5-FU 또는 마이크로베시클의 단독 사용보다 향상되었다.또한 VEGF 유전자 발현의 하향 조절은 CD1 유전자 [28]발현 감소와 관련이 있었다.
임상적 의의
병중
중추신경계(CNS)의 외상 손상 후 VEGF-A 및 이에 대응하는 수용체가 빠르게 상향 조절된다.VEGF-A는 CNS 손상의 급성 및 아급성 단계에서 고도로 발현되지만, 단백질의 발현은 시간이 지남에 따라 감소한다.이 VEGF-A 발현 시간 범위는 부상 [25]후 내인성 재혈관계 용량에 해당합니다.이는 외상성 CNS 손상 후 혈관신생을 촉진하기 위한 대상으로 VEGF-A/VEGF를165 사용할 수 있음을 시사한다.그러나 CNS 상해 [25]모델에서 VEGF-A 치료의 효과에 대한 과학적 보고가 모순된다.
급성 허혈성 [29]뇌졸중 진단을 위한 바이오마커로 연관되지는 않았지만, 처음 48시간 동안 혈청에서 높은 VEGF 수치가 6개월과[30] 2년 [31]이상 뇌경색에서 예후 불량과 관련이 있는 경우.
VEGF-A는 유방암의 나쁜 예후와 관련이 있다.많은 연구들이 VEGF를 과도하게 발현하는 종양에서 전반적인 생존과 무병 생존이 감소했음을 보여준다.VEGF-A의 과발현은 전이 과정의 초기 단계일 수 있습니다.이것은 혈관 형성 스위치에 관여하는 단계입니다.VEGF-A는 생존율 저하와 상관관계가 있지만 종양의 진행에 있어 정확한 작용 메커니즘은 [citation needed]불분명하다.
VEGF-A는 또한 TNF-α에 반응하여 류마티스 관절염에서 방출되어 내피 투과성과 붓기를 증가시키고 혈관신생(모세혈관 [citation needed]형성)을 자극한다.
VEGF-A는 당뇨병 망막증에서도 중요하다.당뇨병이 있는 사람들의 망막의 미세 순환 문제는 망막 허혈증을 일으킬 수 있으며, 이것은 VEGF-A의 방출을 초래하고, 정상 발현된xxx VEGF 동형식에 대한 혈관신생성xxx VEGF 동형질의 균형에 변화를 일으킬 수 있다.그리고xxx 나서 VEGF는 망막과 눈의 다른 곳에 새로운 혈관을 생성하게 할 수 있으며, 시력을 위협할 수 있는 변화를 예고합니다.
VEGF-A는 산업화된 세계 노인들의 실명의 주요 원인인 습식 노화 관련 황반변성(AMD)의 질병 병리학에 중요한 역할을 한다.AMD의 혈관 병리학은 당뇨병 망막증과 어떤 유사점을 공유하지만 질병의 원인과 혈관 신생화의 전형적인 원천은 두 질병 간에 다르다.
VEGF-D 혈청 수치는 [32]혈관육종 환자에서 유의하게 증가한다.
방출된 VEGF-A는 여러 반응을 유도할 수 있다.그것은 세포의 생존, 이동 또는 분화를 일으킬 수 있다.따라서 VEGF는 암 치료의 잠재적 대상이다.최초의 항VEGF 약물인 bevacizumab은 2004년에 승인되었다.환자의 약 10-15%가 베바시주맙 치료의 혜택을 받는다. 그러나, 베바시주맙 효과의 바이오마커는 아직 알려져 있지 않다.
최근의 연구는 VEGF만이 혈관신생을 촉진하는 것은 아니라는 것을 보여준다.특히 FGF2와 HGF는 잠재적인 혈관신생인자이다.
폐 폐기종을 앓고 있는 환자들은 폐동맥의 VEGF 수치가 감소한 것으로 밝혀졌다.
또한 VEGF-D는 림프관절근종증에서 과잉 발현된 것으로 나타났으며 현재 이 희귀질환의 [33]치료에서 진단 바이오마커로 사용되고 있다.
신장에서는 사구체에서 VEGF-A의 발현 증가는 단백뇨와 [34]관련된 사구체 비대증을 직접적으로 일으킨다.
VEGF의 변경은 조기 전암페어증을 [35]예측할 수 있습니다.
난치성 협심증에 대한 유전자 치료는 혈관신생을 [36]촉진하기 위해 심외세포에서 VEGF의 발현을 확립한다.
「 」를 참조해 주세요.
- 혈관신생의 단백질분해효소
- 혈관신생의 강력한 억제제인 위다페린 A
레퍼런스
- ^ a b Senger, D.; Galli, S.; Dvorak, A.; Perruzzi, C.; Harvey, V.; Dvorak, H. (25 February 1983). "Tumor cells secrete a vascular permeability factor that promotes accumulation of ascites fluid". Science. 219 (4587): 983–985. Bibcode:1983Sci...219..983S. doi:10.1126/science.6823562. PMID 6823562.
- ^ Palmer, Biff F.; Clegg, Deborah J. (2014). "Oxygen sensing and metabolic homeostasis". Molecular and Cellular Endocrinology. 397 (1–2): 51–57. doi:10.1016/j.mce.2014.08.001. PMID 25132648. S2CID 5165215.
- ^ Cooper, Mark; Vranes, Dimitria; Youssef, Sherif; Stacker, Steven A.; Cox, Alison J.; Rizkalla, Bishoy; Casley, David J.; Bach, Leon A.; Kelly, Darren J.; Gilbert, Richard E. (November 1999). "Increased Renal Expression of Vascular Endothelial Growth Factor (VEGF) and Its Receptor VEGFR-2 in Experimental Diabetes". Diabetes. 48 (11): 2229–2239. doi:10.2337/diabetes.48.11.2229. PMID 10535459.
- ^ Folkman, J (1 February 1971). "Isolation of a tumor factor responsible for angiogenesis". Journal of Experimental Medicine. 133 (2): 275–288. doi:10.1084/jem.133.2.275. PMC 2138906. PMID 4332371.
- ^ Ferrara, N; Henzel, WJ (15 June 1989). "Pituitary follicular cells secrete a novel heparin-binding growth factor specific for vascular endothelial cells". Biochemical and Biophysical Research Communications. 161 (2): 851–858. doi:10.1016/0006-291x(89)92678-8. PMID 2735925.
- ^ Tischer, E; Mitchell, R; Hartman, T; Silva, M; Gospodarowicz, D; Fiddes, JC; Abraham, JA (25 June 1991). "The human gene for vascular endothelial growth factor. Multiple protein forms are encoded through alternative exon splicing". The Journal of Biological Chemistry. 266 (18): 11947–54. doi:10.1016/S0021-9258(18)99049-6. PMID 1711045.
- ^ Christinger, Hans W.; Muller, Yves A.; Berleau, Lea T.; Keyt, Bruce A.; Cunningham, Brian C.; Ferrara, Napoleone; de Vos, Abraham M. (November 1996). "Crystallization of the receptor binding domain of vascular endothelial growth factor". Proteins: Structure, Function, and Genetics. 26 (3): 353–357. doi:10.1002/(SICI)1097-0134(199611)26:3<353::AID-PROT9>3.0.CO;2-E. PMID 8953654.
- ^ Muller, Yves A.; Li, Bing; Christinger, Hans W.; Wells, James A.; Cunningham, Brian C.; Vos, Abraham M. de (8 July 1997). "Vascular endothelial growth factor: Crystal structure and functional mapping of the kinase domain receptor binding site". Proceedings of the National Academy of Sciences. 94 (14): 7192–7197. Bibcode:1997PNAS...94.7192M. doi:10.1073/pnas.94.14.7192. PMC 23789. PMID 9207067.
- ^ Muller, Yves A; Christinger, Hans W; Keyt, Bruce A; de Vos, Abraham M (October 1997). "The crystal structure of vascular endothelial growth factor (VEGF) refined to 1.93 Å resolution: multiple copy flexibility and receptor binding". Structure. 5 (10): 1325–1338. doi:10.1016/s0969-2126(97)00284-0. PMID 9351807.
- ^ Vries, C. de; Escobedo, J. A.; Ueno, H.; Houck, K.; Ferrara, N.; Williams, L. T. (21 February 1992). "The fms-like tyrosine kinase, a receptor for vascular endothelial growth factor". Science. 255 (5047): 989–991. Bibcode:1992Sci...255..989D. doi:10.1126/science.1312256. PMID 1312256.
- ^ Terman, Bruce I.; Dougher-Vermazen, Maureen; Carrion, Miguel E.; Dimitrov, Dragan; Armellino, Douglas C.; Gospodarowicz, Denis; Böhlen, Peter (30 September 1992). "Identification of the KDR tyrosine kinase as a receptor for vascular endothelial cell growth factor". Biochemical and Biophysical Research Communications. 187 (3): 1579–1586. doi:10.1016/0006-291x(92)90483-2. PMID 1417831.
- ^ a b Soker, Shay; Takashima, Seiji; Miao, Hua Quan; Neufeld, Gera; Klagsbrun, Michael (March 1998). "Neuropilin-1 Is Expressed by Endothelial and Tumor Cells as an Isoform-Specific Receptor for Vascular Endothelial Growth Factor". Cell. 92 (6): 735–745. doi:10.1016/s0092-8674(00)81402-6. PMID 9529250. S2CID 547080.
- ^ Bang, Seokyoung; Lee, Seung-Ryeol; Ko, Jihoon; Son, Kyungmin; Tahk, Dongha; Ahn, Jungho; Im, Changkyun; LiJeon, Noo (14 August 2017). "A Low Permeability Microfluidic Blood-Brain Barrier Platform with Direct Contact between Perfusable Vascular Network and Astrocytest". Scientific Reports. 7 (1): 8083. Bibcode:2017NatSR...7.8083B. doi:10.1038/s41598-017-07416-0. PMC 5556097. PMID 28808270.
- ^ Ivet Elias; Sylvie Franckhauser; Fatima Bosch (1 April 2013). "New insights into adipose tissue VEGF-A actions in the control of obesity and insulin resistance". Adipocyte. 2 (2): 109–112. doi:10.4161/adip.22880. Retrieved 4 February 2022 – via Taylor & Francis.
- ^ Cursiefen, Claus; Chen, Lu; Borges, Leonardo P.; Jackson, David; Cao, Jingtai; Radziejewski, Czeslaw; D’Amore, Patricia A.; Dana, M. Reza; Wiegand, Stanley J.; Streilein, J. Wayne (1 April 2004). "VEGF-A stimulates lymphangiogenesis and hemangiogenesis in inflammatory neovascularization via macrophage recruitment". Journal of Clinical Investigation. 113 (7): 1040–1050. doi:10.1172/JCI200420465. PMC 379325. PMID 15057311.
- ^ Claesson-Welsh, L. (20 August 2008). "VEGF-B Taken to Our Hearts: Specific Effect of VEGF-B in Myocardial Ischemia". Arteriosclerosis, Thrombosis, and Vascular Biology. 28 (9): 1575–1576. doi:10.1161/ATVBAHA.108.170878. PMID 18716319.
- ^ Mandriota, S. J.; Jussila, L.; Jeltsch, M.; Compagni, A.; Baetens, D.; Prevo, R.; Banerji, S.; Huarte, J.; Montesano, R.; Jackson, D. G.; Orci, L.; Alitalo, K.; Christofori, G.; Pepper, M. S. (15 February 2001). "Vascular endothelial growth factor-C-mediated lymphangiogenesis promotes tumour metastasis". The EMBO Journal. 20 (4): 672–682. doi:10.1093/emboj/20.4.672. PMC 145430. PMID 11179212. Retrieved 3 February 2022.
- ^ Cébe Suarez, S.; Pieren, M.; Cariolato, L.; Arn, S.; Hoffmann, U.; Bogucki, A.; Manlius, C.; Wood, J.; Ballmer-Hofer, K. (September 2006). "A VEGF-A splice variant defective for heparan sulfate and neuropilin-1 binding shows attenuated signaling through VEGFR-2". Cellular and Molecular Life Sciences. 63 (17): 2067–2077. doi:10.1007/s00018-006-6254-9. PMID 16909199. S2CID 28267679.
- ^ Shin, Y. J.; Choi, J. S.; et al. (2010). "Induction of vascular endothelial growth factor receptor-3 mRNA in glial cells following focal cerebral ischemia in rats". J Neuroimmunol. 229 (1–2): 81–90. doi:10.1016/j.jneuroim.2010.07.008. PMID 20692049. S2CID 21073290.
- ^ Häggström, Mikael (2014). "Medical gallery of Mikael Häggström 2014". WikiJournal of Medicine. 1 (2). doi:10.15347/wjm/2014.008.
- ^ a b Holmes, Katherine; Roberts, Owain Ll; Thomas, Angharad M.; Cross, Michael J. (2007). "Vascular endothelial growth factor receptor-2: Structure, function, intracellular signalling and therapeutic inhibition". Cellular Signalling. 19 (10): 2003–12. doi:10.1016/j.cellsig.2007.05.013. PMID 17658244.
- ^ Karkkainen, M.J.; Petrova, T.V. (2000). "Vascular endothelial growth factor receptors in the regulation of angiogenesis and lymphangiogenesis". Oncogene. 19 (49): 5598–5605. doi:10.1038/sj.onc.1203855. PMID 11114740.
- ^ Ali, Ibne; et al. (2013). "Expression and localization of locally produced growth factors regulating lymphangiogenesis during different stages of the estrous cycle in corpus luteum of buffalo" (Bubalus bubalis)". Theriogenology. 81 (3): 428–436. doi:10.1016/j.theriogenology.2013.10.017. PMID 24246422.
- ^ Herzog, Birger; Pellet-Many, Caroline; Britton, Gary; Hartzoulakis, Basil; Zachary, Ian C. (8 June 2011). "VEGF binding to NRP1 is essential for VEGF stimulation of endothelial cell migration, complex formation between NRP1 and VEGFR2, and signaling via FAK Tyr407 phosphorylation". Molecular Biology of the Cell. 22 (15): 2766–2776. doi:10.1091/mbc.E09-12-1061. PMC 3145551. PMID 21653826.
- ^ a b c Mecollari, Vasil; Nieuwenhuis, Bart; Verhaagen, Joost (27 October 2014). "A perspective on the role of class III semaphorin signaling in central nervous system trauma". Frontiers in Cellular Neuroscience. 8: 328. doi:10.3389/fncel.2014.00328. PMC 4209881. PMID 25386118.
- ^ Harmey, Judith (2004). VEGF and cancer. Georgetown, Tex: Landes Bioscience/Eurekah.com New York, N.Y. Kluwer Academic/Plenum Publishers. ISBN 978-0-306-47988-5.[페이지 필요]
- ^ Oltmanns, Kerstin M.; Gehring, Hartmut; Rudolf, Sebastian; Schultes, Bernd; Hackenberg, Claudia; Schweiger, Ulrich; Born, Jan; Fehm, Horst L.; Peters, Achim (1 March 2006). "Acute hypoxia decreases plasma VEGF concentration in healthy humans". American Journal of Physiology. Endocrinology and Metabolism. 290 (3): E434–E439. doi:10.1152/ajpendo.00508.2004. PMID 16219663. S2CID 32679788.
- ^ Abd El Latif, Ghada; Aboushady, Iman; Sabry, Dina (1 April 2019). "Decreased VEGF and Cyclin D1 Genes Expression Enhances Chemosensitivity of Human Squamous Cell Carcinoma Cells to 5-Fluorouracil and/or Mesenchymal Stem Cells-Derived Microvesicles". Egyptian Dental Journal. 65 (2): 1217–1228. doi:10.21608/EDJ.2019.72197.
- ^ Seidkhani-Nahal, Ali; Khosravi, Afra; Mirzaei, Asad; Basati, Gholam; Abbasi, Milad; Noori-Zadeh, Ali (5 September 2020). "Serum vascular endothelial growth factor (VEGF) levels in ischemic stroke patients: a systematic review and meta-analysis of case–control studies". Neurological Sciences. 42 (5): 1811–1820. doi:10.1007/s10072-020-04698-7. PMID 32888077. S2CID 221494935.
- ^ Escudero, Carlos; Acurio, Jesenia; López, Eduardo; Rodríguez, Andrés; Benavente, Antonia; Lara, Evelyn; Korzeniewski, Steven J. (2020). "Vascular endothelial growth factor and poor prognosis after ischaemic stroke". European Journal of Neurology. 28 (5): 1759–1764. doi:10.1111/ene.14641. PMID 33176035. S2CID 226310802.
- ^ Åberg, N. David; Wall, Alexander; Anger, Olof; Jood, Katarina; Andreasson, Ulf; Blennow, Kaj; Zetterberg, Henrik; Isgaard, Jörgen; Jern, Christina; Svensson, Johan (May 2020). "Circulating levels of vascular endothelial growth factor and post‐stroke long‐term functional outcome". Acta Neurologica Scandinavica. 141 (5): 405–414. doi:10.1111/ane.13219. PMID 31919840.
- ^ Amo, Y.; Masuzawa, M.; Hamada, Y.; Katsuoka, K. (2004). "Serum concentrations of vascular endothelial growth factor-D in angiosarcoma patients". British Journal of Dermatology. 150 (1): 160–1. doi:10.1111/j.1365-2133.2004.05751.x. PMID 14746640. S2CID 38291933.
- ^ Young, Lisa R.; Inoue, Yoshikazu; McCormack, Francis X. (10 January 2008). "Diagnostic Potential of Serum VEGF-D for Lymphangioleiomyomatosis". New England Journal of Medicine. 358 (2): 199–200. doi:10.1056/NEJMc0707517. PMC 3804557. PMID 18184970.
- ^ Liu, E.; Morimoto, M.; Kitajima, S.; Koike, T.; Yu, Y.; Shiiki, H.; Nagata, M.; Watanabe, T.; Fan, J. (2007). "Increased Expression of Vascular Endothelial Growth Factor in Kidney Leads to Progressive Impairment of Glomerular Functions". Journal of the American Society of Nephrology. 18 (7): 2094–104. doi:10.1681/ASN.2006010075. PMID 17554151.
- ^ Andraweera, P. H.; Dekker, G. A.; Roberts, C. T. (2012). "The vascular endothelial growth factor family in adverse pregnancy outcomes". Human Reproduction Update. 18 (4): 436–457. doi:10.1093/humupd/dms011. PMID 22495259.
- ^ "Gene therapy for refractory angina". Genome Context. 16 October 2019. Retrieved 16 October 2019.
추가 정보
- Bengoetxea H, Argandoña EG, Lafuente JV (2008). "Effects of Visual Experience on Vascular Endothelial Growth Factor Expression during the Postnatal Development of the Rat Visual Cortex". Cerebral Cortex. 18 (7): 1630–39. doi:10.1093/cercor/bhm190. PMC 2430152. PMID 17986606.
- Zan L, Wu H, Jiang J, Zhao S, Song Y, Teng G, Li H, Jia Y, Zhou M, Zhang X, Qi J, Wang J (2011). "Temporal profile of Src, SSeCKS, and angiogenic factors after focal cerebral ischemia: correlations with angiogenesis and cerebral edema". Neurochem. Int. 58 (8): 872–9. doi:10.1016/j.neuint.2011.02.014. PMC 3100427. PMID 21334414.
- Zan L, Zhang X, Xi Y, Wu H, Song Y, Teng G, Li H, Qi J, Wang J (2014). "Src regulates angiogenic factors and vascular permeability after focal cerebral ischemia-reperfusion". Neuroscience. 262: 118–28. doi:10.1016/j.neuroscience.2013.12.060. PMC 3943922. PMID 24412374.
- Wang J, Fu X, Jiang C, Yu L, Wang M, Han W, Liu L, Wang J (2014). "Bone marrow mononuclear cell transplantation promotes therapeutic angiogenesis via upregulation of the VEGF-VEGFR2 signaling pathway in a rat model of vascular dementia". Behav. Brain Res. 265: 171–80. doi:10.1016/j.bbr.2014.02.033. PMC 4000455. PMID 24589546.
- Ferrara N, Gerber HP (2002). "The role of vascular endothelial growth factor in angiogenesis". Acta Haematol. 106 (4): 148–56. doi:10.1159/000046610. PMID 11815711. S2CID 46785882.
- Orpana A, Salven P (2003). "Angiogenic and lymphangiogenic molecules in hematological malignancies". Leuk. Lymphoma. 43 (2): 219–24. doi:10.1080/10428190290005964. PMID 11999550. S2CID 21908151.
- Afuwape AO, Kiriakidis S, Paleolog EM (2003). "The role of the angiogenic molecule VEGF in the pathogenesis of rheumatoid arthritis". Histol. Histopathol. 17 (3): 961–72. PMID 12168808.
- de Bont ES, Neefjes VM, Rosati S, et al. (2003). "New vessel formation and aberrant VEGF/VEGFR signaling in acute leukemia: does it matter?". Leuk. Lymphoma. 43 (10): 1901–9. doi:10.1080/1042819021000015844. PMID 12481883. S2CID 45095413.
- Ria R, Roccaro AM, Merchionne F, et al. (2003). "Vascular endothelial growth factor and its receptors in multiple myeloma". Leukemia. 17 (10): 1961–6. doi:10.1038/sj.leu.2403076. PMID 14513045.
- Caldwell RB, Bartoli M, Behzadian MA, et al. (2004). "Vascular endothelial growth factor and diabetic retinopathy: pathophysiological mechanisms and treatment perspectives". Diabetes Metab. Res. Rev. 19 (6): 442–55. doi:10.1002/dmrr.415. PMID 14648803. S2CID 24931730.
- Patan, Sybill (2004). "Vasculogenesis and Angiogenesis". Angiogenesis in Brain Tumors. Cancer Treatment and Research. Vol. 117. pp. 3–32. doi:10.1007/978-1-4419-8871-3_1. ISBN 978-1-4613-4699-9. PMID 15015550.
- Machein, Marcia Regina; Plate, Karl Heinz (2004). "Role of VEGF in Developmental Angiogenesis and in Tumor Angiogenesis in the Brain". Angiogenesis in Brain Tumors. Cancer Treatment and Research. Vol. 117. pp. 191–218. doi:10.1007/978-1-4419-8871-3_13. ISBN 978-1-4613-4699-9. PMID 15015562.
- Eremina V, Quaggin SE (2004). "The role of VEGF-A in glomerular development and function". Curr. Opin. Nephrol. Hypertens. 13 (1): 9–15. doi:10.1097/00041552-200401000-00002. PMID 15090854. S2CID 24212588.
- Storkebaum E, Lambrechts D, Carmeliet P (2004). "VEGF: once regarded as a specific angiogenic factor, now implicated in neuroprotection". BioEssays. 26 (9): 943–54. doi:10.1002/bies.20092. PMID 15351965. S2CID 871954.
- Ribatti D (2005). "The crucial role of vascular permeability factor/vascular endothelial growth factor in angiogenesis: a historical review". Br. J. Haematol. 128 (3): 303–9. doi:10.1111/j.1365-2141.2004.05291.x. PMID 15667531.
- Loureiro RM, D'Amore PA (2005). "Transcriptional regulation of vascular endothelial growth factor in cancer". Cytokine Growth Factor Rev. 16 (1): 77–89. doi:10.1016/j.cytogfr.2005.01.005. PMID 15733833.
- Herbst RS, Onn A, Sandler A (2005). "Angiogenesis and lung cancer: prognostic and therapeutic implications". J. Clin. Oncol. 23 (14): 3243–56. doi:10.1200/JCO.2005.18.853. PMID 15886312.
- Pufe T, Kurz B, Petersen W, et al. (2006). "The influence of biomechanical parameters on the expression of VEGF and endostatin in the bone and joint system". Ann. Anat. 187 (5–6): 461–72. doi:10.1016/j.aanat.2005.06.008. PMID 16320826.
- Tong JP, Yao YF (2006). "Contribution of VEGF and PEDF to choroidal angiogenesis: a need for balanced expressions". Clin. Biochem. 39 (3): 267–76. doi:10.1016/j.clinbiochem.2005.11.013. PMID 16409998.
- Lambrechts D, Carmeliet P (2007). "VEGF at the neurovascular interface: therapeutic implications for motor neuron disease". Biochim. Biophys. Acta. 1762 (11–12): 1109–21. doi:10.1016/j.bbadis.2006.04.005. PMID 16784838.
- Matsumoto T, Mugishima H (2006). "Signal transduction via vascular endothelial growth factor (VEGF) receptors and their roles in atherogenesis". J. Atheroscler. Thromb. 13 (3): 130–5. doi:10.5551/jat.13.130. PMID 16835467.
- Bogaert E, Van Damme P, Van Den Bosch L, Robberecht W (2006). "Vascular endothelial growth factor in amyotrophic lateral sclerosis and other neurodegenerative diseases". Muscle Nerve. 34 (4): 391–405. doi:10.1002/mus.20609. PMID 16856151. S2CID 22086357.
- Mercurio AM, Lipscomb EA, Bachelder RE (2006). "Non-angiogenic functions of VEGF in breast cancer". Journal of Mammary Gland Biology and Neoplasia. 10 (4): 283–90. CiteSeerX 10.1.1.476.2778. doi:10.1007/s10911-006-9001-9. PMID 16924371. S2CID 16565983.
- Makinde T, Murphy RF, Agrawal DK (2007). "Immunomodulatory role of vascular endothelial growth factor and angiopoietin-1 in airway remodeling". Curr. Mol. Med. 6 (8): 831–41. doi:10.2174/156652406779010795. PMID 17168735.
- Rini BI, Rathmell WK (2007). "Biological aspects and binding strategies of vascular endothelial growth factor in renal cell carcinoma". Clin. Cancer Res. 13 (2 Pt 2): 741s–746s. doi:10.1158/1078-0432.CCR-06-2110. PMID 17255303.
- Jiang, Chao; Zuo, Fangfang; Wang, Yuejuan; Lu, Hong; Yang, Qingwu; Wang, Jian (1 January 2017). "Progesterone Changes VEGF and BDNF Expression and Promotes Neurogenesis After Ischemic Stroke". Molecular Neurobiology. 54 (1): 571–581. doi:10.1007/s12035-015-9651-y. PMC 4938789. PMID 26746666.
- Rodgers LS, Lalani S, Hardy KM, Xiang X, Broka D, Antin PB, Camenisch TD (2006). "Depolymerized hyaluronan induces vascular endothelial growth factor, a negative regulator of developmental epithelial-to-mesenchymal transformation". Circ. Res. 99 (6): 583–9. doi:10.1161/01.RES.0000242561.95978.43. PMID 16931798.
- Qaum, T; Xu, Q; Joussen, AM; et al. (2001). "VEGF-initiated blood-retinal barrier breakdown in early diabetes". Invest Ophthalmol Vis Sci. 42 (10): 2408–2413. PMID 11527957.
외부 링크
- 미국 국립의학도서관의 혈관+내피+성장+요인(MeSH)
- Proteopedia Vascular_내피_Growth_Factor – 대화형 3D 혈관 내피 성장인자 구조